Diagnosticar y manejar exitosamente las cardiopatías congénitas representa uno de los mayores triunfos de la medicina y la cirugía cardiovascular en el siglo xx . La publicación del libro «Congenital Malformations of the Heart», por la Dra. H. Taussig1, abrió las puertas a la comprensión de la cardiopatía congénita. Durante ese mismo periodo se produjeron los primeros hitos en el tratamiento de las cardiopatías congénitas: John H. Gibbon realizó la primera cirugía cardiaca abierta en un paciente con una comunicación interauricular (CIA); Robert Gross describió por primera vez la ligadura del ductus arterial; Clarence Craford, la resección de una coartación aórtica y la propia Taussig, junto con Blalock, publicó su experiencia con el shunt paliativo utilizado para enfermedades cardiacas cianóticas. El desarrollo y la incorporación de nuevas técnicas quirúrgicas, junto con un mejor cuidado médico de estos pacientes, han posibilitado una reducción significativa de la mortalidad desde un 20% en la década de los años setenta hasta el 5% actual. Como consecuencia, el número de adultos con cardiopatías congénitas ha crecido rápidamente, y se está acercando a 1 millón en América del Norte2, 3 y se estima que son unos 100.000 en España4. Aproximadamente el 60% de las cardiopatías congénitas se diagnostican en bebés menores de 1 año de edad, el 30% en niños y el 10% en adultos. Sin embargo, gracias al incremento de la supervivencia, hay más adultos que niños con lesiones congénitas, que requieren, en su mayoría, seguimiento y cuidados toda su vida. Además, muchos de estos pacientes necesitarán nuevas intervenciones durante el seguimiento, y siendo una población que ha requerido de múltiples operaciones previas, el campo del intervencionismo transcatéter adquiere un especial interés.
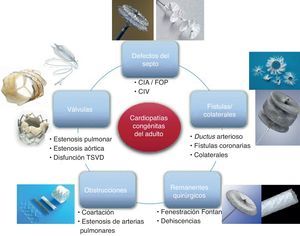
Durante las últimas dos décadas, el enfoque del diagnóstico y el tratamiento de adultos con cardiopatías congénitas se ha transformado totalmente. Durante muchos años el laboratorio de hemodinámica fue el lugar de diagnóstico, mientras que la sala de operaciones era el sitio de tratamiento. Ahora, el laboratorio de imagen (ecocardiografía, resonancia magnética [RM], tomografía computarizada [TC], etc.) es el sitio de diagnóstico, y el tratamiento primario invasivo se realiza con mayor frecuencia en el laboratorio de hemodinámica y cateterización cardiaca. El grupo de intervenciones que se realizan en el laboratorio de cateterización cardiaca se puede resumir en: a) enfermedad valvular; b) defectos del septo; c) obstrucciones vasculares; d) fístulas y colaterales, y e) lesiones residuales y dehiscencias de la cirugía. Grosso modo, el abordaje podría simplificarse en dos grupos de intervenciones: a) las que requieren la desobstrucción de un conducto vascular o una válvula, que se tratan con procedimientos de dilatación utilizando balones, stents o stents valvulados, y b) las que requieren ocluir una comunicación anómala entre dos cavidades cardiacas o conductos vasculares, que se tratan con dispositivos de cierre o coils (Figura 1).
Figura 1. Esquema de los diferentes tipos de procedimientos del intervencionismo en la cardiopatía congénita del adulto. Se agrupan las afecciones en defectos del septo, valvulopatías, obstrucciones, remanentes quirúrgicos y fístulas-colaterales. Cada grupo se acompaña con imágenes del dispositivo que se utiliza habitualmente para tratar la afección. CIA: comunicación interauricular; CIV: comunicación interventricular; FOP: foramen oval permeable; TSVD: tracto de salida del ventrículo derecho. Modificado con permiso de Palacios et al 5 .
Organización del laboratorio y el equipo de hemodinámicaEl intervencionismo pediátrico ha ido asumiendo procedimientos más y más complejos que requieren un abordaje multidisciplinario. Por una parte, es necesario el apoyo de un grupo de cardiólogos y cirujanos pediátricos que evalúen adecuadamente a los pacientes y discutan los casos antes de referir a los pacientes al laboratorio de hemodinámica. Por otra, es indispensable un grupo de especialistas en imagen con amplia experiencia en cardiopatías congénitas y que pueda realizar TC, RM y ecocardiografía tridimensional. La adecuada indicación clínica y un estudio de imagen de calidad facilitarán el abordaje de la intervención. Y por último, un grupo de intervencionismo, que idealmente debería de estar formado por un cardiólogo intervencionista pediátrico, un cardiólogo intervencionista de adultos y un cirujano cardiaco experto en cardiopatías congénitas, capaces de realizar procedimientos híbridos de forma conjunta.
Para poder asumir todo tipo de procedimientos con garantías, se recomienda disponer de una sala híbrida con un tamaño de unos 80 m2, que posibilite la presencia simultánea en la sala del equipo de anestesia (respirador, monitores, etc.), equipo de imagen (aparato de ecocardiografía), perfusionistas (aparato de circulación extracorpórea), equipo de electrofisiología (equipo de ablación y cartografía tridimensional), mesa de material quirúrgico y mesa de material de hemodinámica. El aparato de escopia biplanar presenta la ventaja de posibilitar adquisiciones perpendiculares simultáneas que facilitan el reconocimiento anatómico y la localización de los catéteres y la posterior reconstrucción tridimensional de las imágenes. Además, los nuevos equipos posibilitan una rotación de –135° a 135° manteniendo la zona de la cabeza del paciente accesible para los anestesistas y ecocardiografistas. La posibilidad de que la mesa de control pueda adoptar la posición de Trendelemburg y 20-30° de giro lateral facilitará un posible abordaje quirúrgico. En cuanto a la integración de toda la información disponible, la presencia de seis pantallas planas con eje rotacional posibilita la integración del polígrafo, la imagen de fluoroscopia anteroposterior y lateral, la ecografía, el ultrasonido intravascular y la TC/RM. Actualmente se dispone de software que permite integrar la imagen de TC sobre la fluoroscospia, los que facilita mucho la identificación de todas las estructuras. Por último, se debe disponer de amplias existencias de material en la sala, incluyendo todo tipo y tamaños de dispositivos, balones, stents (recubiertos), catéteres y guías. Siempre se ha de contar con material de rescate, ante posibles complicaciones: snares de diferentes tamaños y formas, stents recubiertos de tamaño adecuado, electrocatéteres, kits de punción pericárdica e incluso dispositivos de asistencia ventricular, si se considera necesario.
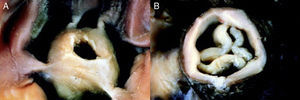
Enfermedad valvularValvuloplastia pulmonarLa estenosis pulmonar es un 7-12% de las enfermedades cardiacas congénitas. Hay tres morfologías valvulares: en forma de cúpula (las más frecuente y que se presenta de forma aislada), la displásica (el 20% de los casos, se asocia al síndrome de Noonan) y la unicúspide/bicúspide, que se observa como parte de la tetralogía de Fallot (Figura 2).
Figura 2. Imagen del aspecto macroscópico de una válvula pulmonar estenótica. A: válvula en cúpula. B: válvula displásica. Adaptado de Bruce et al 6 con permiso del editor.
La valvuloplastia pulmonar tiene una historia bien documentada, ya que se trata de una de las primeras intervenciones percutáneas con resultado exitoso. Está indicada en casos con válvulas en cúpula que presentan un gradiente > 30 mmHg en los pacientes sintomáticos y 50 mmHg en los asintomáticos (Tabla 1)7. En el Valvuloplasty and Angioplasty Congenital Anomalies Registry se incluyó a 533 pacientes tratados con valvuloplastia pulmonar, y en un seguimiento medio de 3 años, se observó que el 84% de los pacientes no requirieron nueva intervención. Un tamaño anular pequeño (típico en las válvulas displásicas), un gradiente residual elevado (> 30 mmHg) y un cociente diámetro del balón/anillo < 1,2 se demostraron predictores de resultado subóptimo8. La tasa de complicaciones resultó baja, a pesar de que la incidencia de cierto grado de insuficiencia pulmonar era habitual. Las insuficiencias de grado leve y moderado suelen tolerarse bien, pero se desconoce la repercusión clínica a largo plazo de las insuficiencias severas debido a la falta de seguimiento en las series publicadas.
Tabla 1. Indicaciones para la valvuloplastia pulmonar según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para valvuloplastia pulmonar | |
| Clase I | Válvula en cúpula con gradiente pico/medio por Doppler de 50/30 mmHg en pacientes sintomáticosVálvula en cúpula con gradiente pico/medio por Doppler de 60/40 mmHg en pacientes asintomáticos |
| Clase IIb | Válvula displásica con gradiente pico/medio por Doppler de 50/30 mmHg en pacientes sintomáticosVálvula displásica con gradiente pico/medio por Doppler de 60/40 mmHg en pacientes asintomáticos |
| Contraindicaciones para el cierre percutáneo | |
| Se recomienda cirugía en casos de insuficiencia pulmonar severa, anillo hipoplásico, estenosis supravalvular o subvalvular y en pacientes con displasia valvular severa | |
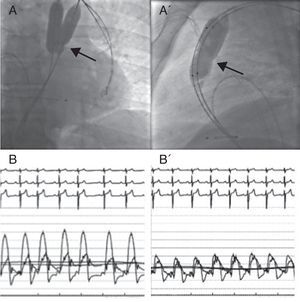
Cuando esta enfermedad se presenta en la edad adulta, los pacientes tienen síntomas más marcados que los pacientes más jóvenes; en ellos suele concurrir una obstrucción subvalvular debida a la hipertrofia producida por la obstrucción valvular crónica, las válvulas presentan mayor grado de calcificación y es muy frecuente una dilatación postestenótica importante de la arteria pulmonar (pues la mayoría de los casos son válvulas en cúpula). Para la valvulopastia se utiliza un diámetro de balón 1,25 veces el anillo pulmonar, por lo que en los adultos frecuentemente es necesario usar dos balones simultáneos9 (Figura 3). En caso de válvulas displásicas, se recomienda utilizar mayor diámetro del balón, que puede alcanzar 1,5 veces el tamaño del anillo. En pacientes pediátricos hay cierta experiencia positiva con balones de corte, pero actualmente no existen diámetros suficientemente amplios para adultos. No obstante, el desarrollo de balones de valvuloplastia como el AngioSculpt® (AngioScore Inc.; Fremont, California, Estados Unidos) podría suponer una alternativa idónea para las válvulas displásicas.
Figura 3. Valvuloplastia pulmonar en un adulto con la técnica de doble balón. A: imagen posteroanterior en fluoroscopia del inflado simultáneo de ambos balones a nivel de la válvula pulmonar. A’: imagen lateral del inflado simultáneo de ambos balones; la flecha señala la muesca del balón que se produce a nivel de la estenosis. B: curvas de presión simultáneas de la arteria pulmonar y el ventrículo derecho antes de la valvuloplastia; se observa un gradiente pico-pico de 60 mmHg. B’: curvas de presión simultáneas de la arteria pulmonar y el ventrículo derecho tras valvuloplastia; se observa una reducción significativa del gradiente pico-pico de 10 mmHg.
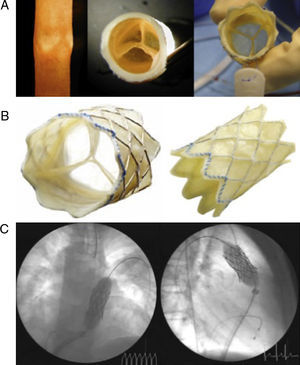
Prótesis pulmonar transcatéterTeniendo en cuenta el amplio número de pacientes adultos con cardiopatías congénitas por disfunción del tracto de salida del ventrículo derecho (TSVD), la posibilidad del reemplazo valvular por catéter supone un cambio drástico en el tratamiento de estos pacientes. Por ello, uno de los avances más importantes en el tratamiento de las cardiopatías del adulto es el desarrollo de la válvula Melody® (Medttronic Inc.; Minneapolis, Minnesota, Estados Unidos), y su aceptación para uso compasivo por la Food and Drug Administration (Figura 4). El dispositivo está construido con una válvula yugular bovina suturada en un stent Cheatham-Platinum que se monta sobre un balloon-in-balloon y su implantación requiere un catéter de 22 Fr. La implantación de la válvula no difiere mucho del implante de un stent en el TSVD, pero se ha de confirmar que no haya compresión de las estructuras vecinas (arterias coronarias) y tener en cuenta el tamaño, la forma y la distensibilidad del conducto (que en su mayoría están muy calcificados). En Estados Unidos se ha aprobado su uso en conductos circunferenciales que conectan el TVSD con la arteria pulmonar de 16-22 mm de diámetro con regurgitación o estenosis más que moderada. Sin embargo, la mayoría de las indicaciones de sustitución valvular pulmonar son para pacientes en que han dilatado el TSVD debido a la reparación de una tetralogía de Fallot con un parche transanular. Para poder extender el uso de la válvula a este grupo de pacientes, se propone implantar un stent en el TSVD antes del implante de la válvula10, 11, 12.
Figura 4. Válvula Melody. A: imagen de la vena yugular desde la que se extrae la válvula y de la válvula en eje corto que se utiliza para la construcción del stent valvulado. B: válvula suturada sobre el stent Cheatham-Platinum. C: inflado y expansión de la válvula realizado con estimulación ventricular rápida en un paciente con tetralogía de Fallot y resección transanular pulmonar.
Los resultados a medio plazo son buenos, con una competencia valvular adecuada y sin necesidad de reintervención a los 2 años en un 80-90% de los casos13, 14, 15, 16, 17 (Tabla 2). La mayoría de las reintervenciones se deben a una obstrucción del tracto producida, en gran parte, por rotura del stent. Parece que el implante sistemático de stents previo al implante de la válvula ha reducido esta complicación, y se espera con impaciencia los resultados a largo plazo.
Tabla 2. Resultados de las principales series de implante valvular transcatéter en posición pulmonar
| Grupo | Dispositivo | n | Implante (%) | Homoinjertos (%) | Gradiente antes (mmHg) | Gradiente después (mmHg) | Complicaciones (%) | Libre de reintervención (%) |
| Lurz et al 13 | Melody | 155 | 95 | 81 | 37±20 | 17±10 | 4,5 | 93 |
| McElhinney et al 14 | Melody | 136 | 91,1 | 76 | 37 (10-70) | 12 (0-37) | 6 | 93,5 |
| Vezmar et al 15 | Melody | 28 | 100 | 25 | 36±15 | 12±7 | 7 | 91 |
| Boone et al 16 | Edwards | 7 | 100 | 71,4 | 60,4±27,3 | 14,9±6,9 | 14,2 | 100 |
| Kenny et al 17 | Edwards | 36 | 97,1 | 80,5 | 26,8±18,4 | 11,7±8 | 19,4 | 97 |
Complicaciones: embolia del dispositivo, rotura del conducto, compresión coronaria, compresión o rotura de ramas pulmonares, complicaciones vasculares mayores y taquicardia ventricular; gradiente antes: gradiente entre el ventrículo derecho y la arteria pulmonar antes del implante; gradiente después: gradiente entre el ventrículo derecho y la arteria pulmonar tras el implante; homoinjertos: porcentaje de pacientes con implante sobre un homoinjerto; implante: porcentaje de pacientes cateterizados a los que se realizó el implante; libre de reintervención: porcentaje de pacientes que no requirieron una nueva intervención sobre el conducto durante el primer año de seguimiento.
Por otra parte, el desarrollo de válvulas Edwards de menor y mayor diámetro ha posibilitado el uso de esta válvula en posición pulmonar, y los resultados iniciales han sido positivos. Además, muchos de estos pacientes adultos presentan dilataciones aneurismáticas del TSVD, por lo que requieren dispositivos de mayor diámetro, y el desarrollo de la válvula de 29 mm ha facilitado su tratamiento.
Valvuloplastia aórticaLas malformaciones congénitas de la válvula aórtica son relativamente comunes, ya sea solas o junto con malformaciones cardiacas más complejas. El espectro de alteraciones morfológicas varía desde las válvulas unicúspides en cúpula, las más comunes válvulas bicúspides (presentes en un 1-2% de la población general) hasta las válvulas displásicas. En los adultos se observa una progresión de la enfermedad con engrosamiento y calcificación de las valvas, que se superpone a la enfermedad congénita subyacente, los que da como resultado la estenosis valvular y, menos frecuentemente, una insuficiencia valvular.
En las guías clínicas del American College of Cardiology/American Heart Association para la cardiopatía congénita del adulto, la valvuloplastia aórtica es una indicación IC para pacientes con válvula no calcificada y un gradiente pico transvalvular de 50 mmHg en los pacientes asintomáticos y 60 mmHg en los asintomáticos7 (Tabla 3).
Tabla 3. Indicaciones para la valvuloplastia aórtica según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para la valvuloplastia aórtica | |
| Clase I | Adultos jóvenes con válvulas no calcificadas y sin insuficiencia aórtica que:• Tienen síntomas y un gradiente pico-pico > 50 mmHg• Asintomáticos pero con cambios en el segmento ST o la onda T en el electrocardiograma y un gradiente pico-pico > 60 mmHg |
| Clase IIa | Adultos jóvenes asintomáticos y con un gradiente > 50 mmHg que quieran practicar deporte o mujeres que planean gestar |
| Clase IIb | Se puede considerar como puente a la cirugía para pacientes hemodinámicamente inestables o con alto riesgo quirúrgico o no operables por alta comorbilidad |
| Contraindicaciones para la valvuloplastia | |
| La valvuloplastia aórtica no se debe considerar una alternativa a la cirugía para pacientes adultos operables. Es desaconsejable realizarla a los que presentan un grado de insuficiencia aórtica más que moderado | |
Se recomienda utilizar un diámetro balón/anillo de 0,9-1. El acceso habitualmente es retrógrado, cruzando la válvula desde la aorta. Existen diferentes tipos de balones, pero se recomienda utilizar una longitud de balón > 40 mm y realizar el procedimiento con estimulación rápida ventricular mediante un electrocatéter situado en el ventrículo derecho. No obstante, muchos de los pacientes congénitos ya han sido cateterizados múltiples veces, y es posible que el acceso arterial en estos casos no sea adecuado. Para estos casos se debería considerar el acceso anterógrado a través de la vena y realizar una punción transeptal. Una vez cruzada la válvula aórtica con la guía, esta se captura con un lazo en la aorta descendente y se crea un loop arteriovenoso. La valvuloplastia se puede realizar con los balones habituales, pero los balones Inoue (Toray Inc.; Texas, Estados Unidos) que se utilizan para dilatación mitral presentan un buen perfil para este tipo de procedimientos.
En cuanto a los resultados, la tasa de reestenosis a los 5 años es superior al 50%18, por lo que muchos de estos pacientes requerirán una reintervención. Parece que la selección adecuada de pacientes es esencial para obtener buenos resultados y que aquellos de más edad, válvulas más calcificadas y con insuficiencia valvular previa obtienen los resultados más desfavorables. No obstante, el desarrollo de balones de mejor perfil y las técnicas de cierre percutáneo para el acceso arterial han reducido las complicaciones relacionadas con el procedimiento y son bastantes los centros que están recuperando esta técnica como puente al tratamiento definitivo, sea una sustitución valvular aórtica o el implante de una válvula transcatéter.
Implante de válvula aórtica transcatéterHasta el momento, la mayoría de los estudios realizados con las válvulas percutáneas, tanto la Edwards-SAPIEN (Edwards Lifesciences Inc., Irvine, California) como la CoreValve (Medtronic, Minneapolis, Minnesota), han incluido a pacientes no operables o generalmente añosos, con elevado riesgo quirúrgico19, 20. A pesar de que los resultados iniciales son prometedores, será necesario esperar unos años más hasta tener datos sobre el comportamiento de estas válvulas a largo plazo. En lo que se refiere a las cardiopatías congénitas del adulto, la experiencia es muy escasa y habitualmente en posición pulmonar17. No obstante, se han publicado resultados positivos de implantes sobre válvulas biológicas, y por ello se puede considerar una alternativa para pacientes operados múltiples veces y que presentan un riesgo quirúrgico elevado.
ObstruccionesCoartación aórticaLa coartación de aorta en el adulto se sitúa en la mayoría de los casos en el istmo, pero las lesiones complejas no son infrecuentes y la morfología puede ser muy variada (Figura 5). Sin tratamiento presenta una alta comorbilidad debido a hipertensión arterial, enfermedad coronaria precoz, insuficiencia cardiaca y accidentes cerebrovasculares21. El criterio tradicional para indicar tratamiento en la coartación es la presencia de un gradiente pico sistólico > 20 mmHg, aunque se debe considerar otros factores como la presencia de ramas colaterales, hipertrofia ventricular, hipertensión sistémica y otras comorbilidades7 (Tabla 4). Se acepta en general que la angioplastia con o sin stent parece el tratamiento de elección para pacientes con recoartación tras cirugía o stent previo. El abordaje percutáneo de la coartación nativa parece más controvertido, aunque los centros con experiencia abogan por el tratamiento endovascular. No hay comparaciones directas con la cirugía, pero el registro del Congenital Cardiovascular Interventional Study Consortium22 incluyó a 302 pacientes consecutivos a los que se implantó un stent en la aorta, y demostró una tasa de éxito inmediato del 96% y sólo un 1% de complicaciones mediante el abordaje endovascular (incluyendo una disección y tres aneurismas). Estos datos parecen superiores a los hallados en las series quirúrgicas, en las que la morbilidad es más elevada (e incluye sangrado, hemotórax, parálisis de los nervios laríngeo y frénico y formación de aneurismas).
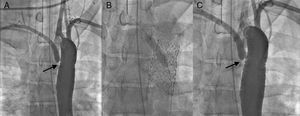
Figura 5. Coartación de aorta en un paciente con un origen anómalo de la arteria subclavia izquierda a nivel de la aorta torácica. A: tras el implante del stent en la coartación, se observa una reducción del diámetro del ostium de la arteria subclavia. B: se avanza una guía de 0,014” a través del stent y se realiza una angioplastia con un balón de 8 mm. C: resultado final, con una apertura de las celdas del stent hacia el ostium de la arteria subclavia y una mejora del pinzamiento arterial.
Tabla 4. Indicaciones para intervencionismo transcatéter de la coartación según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para intervencionismo transcatéter de la coartación | |
| Clase I | Gradiente pico-pico sistólico > 20 mmHgGradiente pico-pico < 20 mmHg pero con evidencia anatómica por imagen de coartación grave y presencia de colateralesEn las coartaciones cortas nativas, se recomienda el intervencionismo transcatéter frente a la cirugíaEn las recoartaciones con gradiente > 20 mmHg, se recomienda el intervencionismo transcatéter |
| Clase IIb | La implantación de stents en segmentos largos se considera una posible opción terapéutica, pero no existen datos sobre la eficacia y la seguridad a largo plazo |
Tampoco hay estudios que hayan comparado directamente el uso de stent frente a la angioplastia simple, pero la mayoría de los intervencionistas prefieren el uso de stents en los pacientes adultos, ya que permite una mayor reducción del gradiente y menores tasas de recoartación y de formación de aneurismas (ya que no es preciso producir el desgarro vascular necesario cuando se utiliza sólo el balón)23, 24. Hay un amplia gama de stets, que incluye Génesis, EV3, Cheatham-Platinum o el Atrium (este tiene la ventaja de que no hace falta montarlo sobre el balón). Para posicionarlos, algunos centros simplemente recurren a la estabilidad que puede aportar el baloon-in-baloon, aunque la mayoría recurre a su vez a la estimulación rápida ventricular. Tendremos que esperar a los estudios COAST, donde se utilizaron stents Cheatham-Platinum (su periodo de inclusión acabó hace más de 1 año), y el COAST II, que utilizará stents cubiertos, pues aportarán información esencial del uso de stents en esta patología.
Estenosis de las arterias pulmonaresLa estenosis de arterias pulmonares puede producirse en cualquier segmento del árbol vascular pulmonar y generalmente se da en el contexto de otras cardiopatías complejas (tetralogía de Fallot, síndrome de Williams, etc.). La intervención está indicada ante la presencia de síntomas y/o cuando se observa una reducción del calibre del vaso > 50% y/o un incremento de la presión del ventrículo derecho > 50 mmHg7. El gradiente a través de la lesión no parece útil en estos casos, ya que los cambios de presión producidos por la estenosis se mitigan con la redistribución del flujo pulmonar y podrían enmascarar el gradiente real a través de la lesión.
En cuanto al tratamiento transcatéter, tenemos los balones de alta presión, los balones de corte y la implantación de stents. Los balones de corte han presentado una tasa de éxito del 92% en vasos de pequeño calibre25, pero el seguimiento de estas series fue incompleto y desconocemos los resultados a largo plazo. El problema principal de utilizar en los adultos los balones de corte como con los stents liberadores de fármacos es la ausencia de dispositivos de más de 8 o 5 mm respectivamente, lo que limita su posible uso en muchos casos. El desarrollo de stents bioabsorbibles podría suponer una opción interesante en este campo.
Comunicaciones vasculares (colaterales, fístulas y ductus)Ductus arterioso persistenteEl ductus arterioso persistente puede clasificarse en cinco grupos según su anatomía (los grupos de Krichenko, el tipo A o de aspecto cónico es el más frecuente) y en tres según su repercusión hemodinámica (pequeños sin repercusión, moderados con sobrecarga de volumen del ventrículo izquierdo y grandes con incremento de las resistencias vasculares pulmonares) (Figura 6). El cierre del ductus está indicado en caso de sobrecarga del ventrículo izquierdo con dilatación, endarteritis previa e incluso en caso de ductus pequeño asintomático para prevenir la endarteritis7 (Tabla 5). En cuanto al cierre, el estudio previo con angiografía por TC es de gran ayuda para determinar el tamaño y la anatomía en adultos. En los de muy pequeño tamaño (< 2,5-3 mm), el cierre se puede realizar con coils, y en los de mayor tamaño, con el dispositivo Amplatzer® Duct Occluder I (St. Jude Medical; Minneapolis, Minnesota, Estados Unidos) se ha demostrado una tasa de éxito del 98% al año. El dispositivo Amplatzer® Duct Occluder II tiene la ventaja de requerir un catéter de menor diámetro para la liberación y disponer de dos discos simétricos, por lo que permite el implante tanto por el lado pulmonar como por el aórtico.
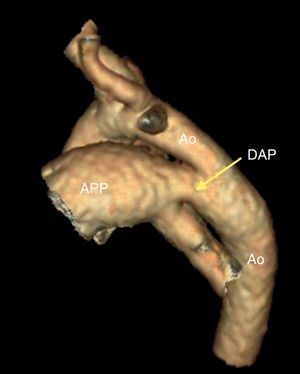
Figura 6. Angiografía por tomografía computarizada con reconstrucción tridimensional de un ductus arterioso. Ao: aorta; APP: arteria pulmonar principal; DAP: ductus arterioso permeable.
Tabla 5. Indicaciones para intervencionismo transcatéter del ductus arterioso persistente según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para intervencionismo transcatéter del ductus arterioso | |
| Clase I | Cuando hay dilatación de las cavidades izquierdasPresencia de hipertensión pulmonarShunt neto de izquierda a derechaEndarteritis previa |
| Clase IIa | El cierre de ductus pequeños y asintomáticos con dispositivos transcatéter parece razonable |
| Contraindicaciones para el intervencionismo en el ductus arterioso | |
| Se prefiere el abordaje quirúrgico en casos que presenten ductus de gran tamaño o con anatomía distorsionada no tratables mediante un dispositivo | |
| El cierre no está indicado en los pacientes con hipertensión pulmonar y shunt derecha-izquierda | |
Las fístulas coronarias son malformaciones congénitas en las que se establece una comunicación directa entre una arteria coronaria y otra cavidad cardiaca o pulmonar. La mayoría se origina en la coronaria derecha y drena generalmente en las cavidades derechas (seno coronario, aurícula o ventrículo)26. En las fístulas de tamaño importante o en las medianas que causan isquemia documentada, arritmias o dilatación ventricular, está indicado el cierre percutáneo previo estudio de la trayectoria de la fístula y habiendo confirmado el potencial de cierre completo por angiografía y angio-TC7 (Tabla 6). Con el cierre transcatéter se ha observado una oclusión completa hasta el 80% de los casos, con mínimas complicaciones durante el procedimiento. No obstante en el seguimiento a largo plazo se ha demostrado una tasa de eventos adversos del 15%, la mayoría por isquemia miocárdica27 y más frecuentes en drenajes al seno coronario. No se han realizado comparaciones directas entre el cierre quirúrgico y el transcatéter, pero los resultados parecen comparables.
Tabla 6. Indicaciones para intervencionismo transcatéter de las fístulas coronarias persistentes según las guías clínicas del American College of Cardiology/ American Heart Association 2008 7
| Indicaciones para intervencionismo transcatéter de las fístulas coronarias | |
| Clase I | Se debe cerrar las fístulas de gran tamaño independientemente de los síntomas y con previa confirmación de su trayectoria y la posibilidad de un cierre completoSe debe cerrar las de pequeño tamaño en caso de isquemia miocárdica documentada, arritmias o disfunción ventricular sistólica o diastólica no explicadas por otras causas o endarteritis |
| Contraindicaciones para el intervencionismo en las fístulas coronarias | |
| No se recomienda el cierre de fístulas pequeñas asintomáticas y sin repercusión hemodinámica | |
Las colaterales venosas sistemicopulmonares (frecuentes en los pacientes con corrección tipo Fontan debido al aumento de las resistencias pulmonares) y las malformaciones pulmonares-arteriovenosas pueden producir desaturación arterial y embolias paradójicas. En cambio, las colaterales sistemicopulmonares se producen en las cardiopatías asociadas a una hipoperfusión pulmonar (atresia pulmonar con comunicación interventricular [CIV], síndrome de Eisenmenger, etc.) y producen una sobrecarga de volumen en el ventrículo sistémico además de incrementar el riesgo de hemoptisis en estos pacientes.
Para el cierre de colaterales de pequeño calibre, los coils se han utilizado durante años con buenos resultados; además, se ha producido una mejora de estos dispositivos. Por una parte, por el desarrollo de coils con liberación controlada y, por otra, la creación de coils compatibles con la RM, técnica que se utiliza cada vez con más frecuencia para el estudio de la fisiología y la anatomía de las cardiopatías congénitas. En cambio, el cierre de vasos más grandes se realiza habitualmente con los dispositivos Amplatzer® Vascular Plug (St. Jude Medical); el Vascular Plug II, cuyo desarrollo ha facilitado mucho el cierre de colaterales más complejas y distales en el árbol vascular26 (Figura 7), y la reciente incorporación del Vascular Plug IV han permitido el uso de catéteres más pequeños (4 Fr) que se despliegan con más facilidad y precisión.
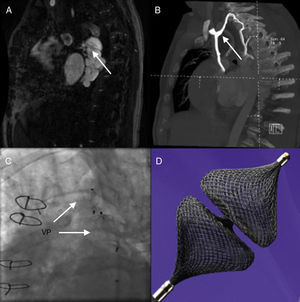
Figura 7. Cierre de colateral venovenosa en un paciente con hipoplasia de ventrículo izquierdo+cirugía de Fontan. A: en la imagen de la resonancia cardiaca se observa una gran colateral que se origina en la vena ácigos y drena en la vena pulmonar inferior derecha. B: reconstrucción tridimensional de la angiografía por tomografía computarizada que muestra la trayectoria completa de la colateral. C: imagen fluoroscópica del implante de dos dispositivos Vascular Plug II (St. Jude Medical) a nivel de la colateral descrita. D: dispositivo Vascular Plug IV (St. Jude Medical). VP: Vascular Plug.
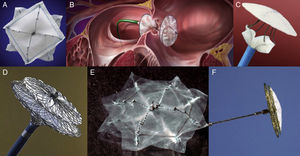
Defectos del septoForamen oval permeableEl foramen oval permeable no se considera una enfermedad congénita como tal, sino más bien una variante de la normalidad, presente en el 25% de la población. No obstante, se lo ha reconocido como mediador de diversas enfermedades, como la embolia paradójica, la desaturación ortostática observada en el síndrome platipnea-ortodesoxia, el síndrome de descompresión observado en los buceadores y la migraña, entre otros. Las guías clínicas del American College of Cardiology/American Heart Association recomiendan su cierre sólo en caso de que se observe un segundo episodio de embolia cerebral en paciente que ya está en tratamiento médico. El implante probablemente indiscriminado que se realizó hasta 2006 en Estados Unidos motivó que la Food and Drug Administration retirara la aprobación de uso a estos dispositivos, y desde entonces sólo están aprobados para uso compasivo o dentro de protocolos de investigación. Se trata de una cuestión que despierta controversia entre cardiólogos y neurólogos y que, a su vez, ha renovado el interés de la industria biomédica en el desarrollo de innumerables dispositivos desde bioabsorbibles a fácilmente recuperables (Figura 8).
Figura 8. Diferentes dispositivos para el cierre de la comunicación interauricular y el foramen oval permeable. A: CardioSEAL® (NMT Medical; Massachusetts, Estados Unidos). B: Helex® (Gore Inc.; Arkansas, Estados Unidos). C: STARFlex® Septal Occluder (NMT Medical). D: Amplatzer® Patent Foramen Ovale Occluder (St. Jude Medical). E: BioSTAR® Bioabsorbable Septal Occluder (NMT Medical). F: Figulla® Patent Foramen Ovale Occluder (Occlutech; Suecia).
Comunicación interauricularLos defectos del septo interauricular son un 22-30% de las cardiopatías congénitas en el adulto y son más prevalentes en mujeres (2:1). Representan una patología muy heterogénea y en muchas ocasiones más compleja de lo que aparentan. El cierre está indicado en los de tipo ostium secundum, en los que se observa una dilatación de cavidades derechas sin hipertensión pulmonar irreversible (Tabla 7). Los defectos tipo ostium primum, del seno coronario y del seno venoso se deben reparar quirúrgicamente. El dispositivo más utilizado mundialmente es el Amplatzer® Septal Occulder (St. Jude Medical) que dispone de una gama amplia de diferentes tamaños, un sistema de liberación sencillo y fácilmente recapturable y unas vainas de liberación que suelen requerir un tamaño inferior que con otros dispositivos. Como sucede con el foramen, hay una amplia gama de dispositivos, pero son pocos los que ofrecen la posibilidad de cerrar CIA > 24 mm. No obstante, presentan la ventaja de que no se han descrito casos de erosión, una rara complicación que se ha observado en los dispositivos Amplatzer® en menos de un 0,05-0,3% de los casos y parece relacionada con un excesivo tamaño del dispositivo o defectos con relación directa con la aorta o la aurícula izquierda. La tasa general de éxito con un cierre completo del defecto es superior al 95%. El cierre se puede realizar guiado por fluoroscopia o ecocardiografía transesofágica o intracardiaca, dependiendo de las características del defecto y la experiencia del operador.
Tabla 7. Indicaciones para el cierre percutáneo de comunicaciones interauriculares según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para el cierre percutáneo de CIA | |
| Clase I | Dilatación auricular y ventricular derecha con o sin síntomas relacionados |
| Clase IIa | Embolia paradójica o síndrome de platipnea-ortodesoxia |
| Clase IIb | Presencia de shunt neto izquierda-derecha con presión arterial pulmonar menor que dos tercios de la presión sistémica o resistencias vasculares pulmonares menores que dos tercios de las sistémicas y respuesta a los vasodilatadores pulmonares o un positivo en test de oclusión del defecto |
| Criterios para el cierre percutáneo | |
| CIA con diámetro mínimo > 5 y < 40 mm en el estudio ecocardiográfico | |
| Bordes adecuados (> 5 mm) desde el defecto hacia las estructuras vecinas incluyendo las venas cavas superior e inferior, el seno coronario, las válvulas auriculoventriculares y las venas pulmonares | |
| Contraindicaciones para el cierre percutáneo | |
| Todos los defectos septales que no sean tipo ostium secundum, incluidos los defectos de ostium primum, seno venoso y seno coronario | |
| Evítese en caso de septo muy aneurismático o con defectos multifenestrados en los que se observe escasez de tejido circundante | |
| Considérese otras opciones en caso de alergias al níquel o contraindicación para terapia antiplaquetaria | |
CIA: comunicación interauricular.
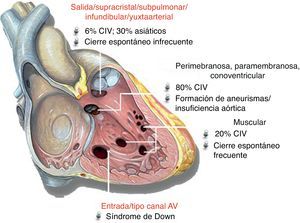
Las CIV presentan múltiples variantes anatómicas y son infrecuentes en la población adulta sin enfermedad congénita (Figura 9). Se considera susceptibles de cierre percutáneo los defectos musculares congénitos o adquiridos (postraumáticos o tras infarto), las CIV postoperatorias y las perimembranosas. El cierre trancatéter es una opción atractiva para pacientes con enfermedad cardiaca congénita que han requerido múltiples cirugías y tienen una CIV nativa o residual. El cierre está indicado en los pacientes con una sobrecarga hemodinámica significativa sin hipertensión pulmonar irreversible y en aquellos que han presentado endocarditis7 (Tabla 8). Hay discrepancias en lo que se refiere a las CIV perimembranosas. Pese a una tasa de éxito del 84%, se han descrito casos de bloqueo auriculoventricular en el 2-5% de los casos (ligeramente superior a las series quirúrgicas)28. Actualmente el dispositivo de cierre de CIV perimembranosas no tiene la aprobación de la Food and Drug Administration. No obstante, la nueva versión del dispositivo Amplatzer® para CIV perimembranosas se implantó por primera vez en humanos en 2011, y ya se han implantado unos 20, con excelentes resultados; en particular, no se ha descrito ningún caso de bloqueo auriculoventricular29. No obstante, será necesario un seguimiento a medio y largo plazo antes de concluir que con este nuevo dispositivo hay menor incidencia de bloqueo y se generalice su uso.
Figura 9. Representación de los diferentes tipos de comunicación interventricular. Tipos de comunicaciones interventriculares: en rojo, no tributarias de cierre percutáneo, y en negro, tributarias para cierre. AV: auriculoventricular; CIV: comunicación interventricular.
Tabla 8. Indicaciones para el cierre percutáneo de comunicaciones interventriculares según las guías clínicas del American College of Cardiology/American Heart Association 2008 7
| Indicaciones para el cierre percutáneo de CIV | |
| Clase I | QP/QS > 2 o signos de sobrecarga del ventrículo izquierdo |
| Clase I | Antecedente de endocarditis infecciosa |
| Clase IIa | QP/QS > 1,5 y cuando la presión arterial pulmonar sea menor que dos tercios de la presión sistémica o las resistencias vasculares pulmonares sean menores que dos tercios de las sistémicas o haya disfunción ventricular izquierda sistólica o diastólica |
| Criterios para el cierre percutáneo | |
| Sólo las CIV tipo IV o musculares son tributarias de cierre percutáneo (IIb), aunque hay amplia experiencia con CIV tipo II o perimembranosas | |
| Las CIV tras infarto rechazadas para cirugía o en caso de shunt residual tras cirugía | |
| Bordes adecuados (> 4 mm) desde el defecto hacia las estructuras vecinas incluyendo las válvulas aórtica, pulmonar, mitral y tricúspide | |
| Contraindicaciones para el cierre percutáneo | |
| Todos los defectos septales que no sean de tipo muscular, como los defectos tipo I o subpulmonares, los de tipo III o canal auriculoventricular. Hay dudas con los de tipo II o perimembranosos | |
| En el caso de las perimembranosas, se debe evitar las que presenten prolapso de la válvula aórtica o septo muy aneurismático | |
| Hay que considerar otras opciones en caso de alergias al níquel o contraindicación para terapia antiplaquetaria | |
CIV: comunicación interventricular.
Los pacientes con cardiopatía congénita compleja operada pueden presentar lesiones residuales (defectos que se deja intencionadamente buscando un beneficio) o complicadas (complicaciones no deseadas tras la cirugía) que requieren una segunda intervención. En la mayoría de los casos, al tratarse de pacientes que ya han sufrido múltiples intervenciones, el abordaje inicial suele ser con técnicas transcatéter. Muchos de estos casos requieren una inventiva especial para seleccionar la mejor estrategia y dispositivo.
Fenestración del FontanEn ocasiones los pacientes operados de Fontan requieren una fenestración entre el conducto intracardiaco/extracardiaco y la aurícula sistémica que permite descomprimir el circuito venopulmonar. Estas lesiones residuales a largo plazo pueden producir un significativo shunt derecha-izquierda, que conduce a hipoxia y favorece la embolia paradójica. En la mayoría de los casos, el cierre no difiere del de una CIA, pero en ocasiones se puede recurrir a stents recubiertos para excluir la fenestración30.
Obstrucción de conductosLos conductos extracardiacos, utilizados en su mayoría para conectar el ventrículo subpulmonar con la arteria pulmonar, pueden sufrir obstrucciones debidas a calcificación, proliferación tisular o compresión extrínseca. Esta reestenosis se produce mayormente en las zonas de anastomosis y pueden resolverse con angioplastia simple o implantación de stents.
Dehiscencias interauriculares del Mustard o SenningLas dehiscencias que se observan en el Mustard o en el Senning suelen ocasionar desaturación, y su cierre es muy similar al de las fenestraciones del Fontan, utilizando en su mayoría dispositivos de cierre de CIA o stents recubiertos. En caso de oclusión completa, se puede utilizar guías coronarias de oclusión crónica e incluso de radiofrecuencia para la repermeabilización.
ConclusionesEl intervencionismo en cardiopatía congénita del adulto es un campo que ha evolucionado espectacularmente las últimas tres décadas. El desarrollo continuo de nuevos dispositivos y la aparición de las válvulas percutáneas han supuesto un salto en la calidad de la asistencia a estos pacientes. Los avances tanto en la técnica como en la tecnología ahora permiten llevar a cabo nuevas intervenciones complejas con altas tasas de éxito y menor incidencia de complicaciones. La estrecha colaboración entre cardiólogos pediátricos, especialistas en imagen, cirujanos e intevencionistas es necesaria para obtener resultados óptimos en estos pacientes.
Conflicto de interesesNinguno.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Hospital de de la Santa Creu i Sant Pau, Sant Antoni Maria Claret 167, 08025 Barcelona, España. darzamendi@santpau.cat