Durante muchos años los patólogos han considerado que las placas vulnerables son aquellas que tienen una estructura que facilita su ruptura, es decir, un gran núcleo lipídico y una capa fibrosa adelgazada. Según este concepto biofísico, las placas se rompen en respuesta a las fuerzas de estrés. Sin embargo, en los últimos años, la ruptura de las placas se ha explicado desde un punto de vista más racional. Así, se sabe que la presencia de células inflamatorias, como los linfocitos T y los macrófagos, contribuye a la degradación de la matriz de la placa. Los linfocitos T activados se asocian a la producción de interferón gamma, que interfiere en la síntesis de colágeno de esta matriz, debilitando su estructura. Además, los linfocitos activados son capaces, a su vez, de activar a los macrófagos que se encuentran en el núcleo lipídico de la placa, los cuales producen en respuesta una serie de citocinas inflamatorias y proteasas que digieren la matriz proteica.
En este sentido es importante el estudio de Moreno et al 1, en el que se describe que las áreas ricas en macrófagos se encuentran fundamentalmente en pacientes que tienen eventos coronarios agudos. Comparando estas áreas en pacientes con angina crónica estable con aquellos que tienen síndromes coronarios agudos, se aprecia una menor concentración de macrófagos en las placas estables. Por lo tanto, los macrófagos son un marcador de actividad y de inestabilidad en la placa de ateroma.
Factores que determinan la inestabilidad de una placa: la inflamación
Las metaloproteinasas
La capa fibrosa de una placa de ateroma es la que confiere estabilidad a la placa y es una estructura dinámica. Existe un equilibrio entre la producción de tejido conectivo y su degradación, en el cual intervienen las metaloproteinasas. Las metaloproteinasas están afectadas directamente por los procesos inflamatorios, que derivan el equilibrio hacia la degradación con respecto a la producción de colágeno. Estudios realizados tanto en modelos animales como en humanos han demostrado la presencia de niveles elevados de metaloproteinasas, particularmente la 3 (estromelisina) y la 9 (gelatinasa B), en aquellos macrófagos que están en las placas inestables.
La gelatinasa B está directamente ligada a la aparición de eventos en una placa, sobre todo fisuras. La expresan de forma constitutiva los macrófagos y los monocitos, que se encuentran dentro de las lesiones ateromatosas. Su actividad está regulada por la presencia de citocinas inflamatorias, como el factor de necrosis tumoral alfa (TNF-α) y la interleucina 1 (IL-1). Hoy día sabemos que la reducción de los lípidos plasmáticos y el tratamiento con antioxidantes afectan favorablemente la actividad de la placa.
La neopterina
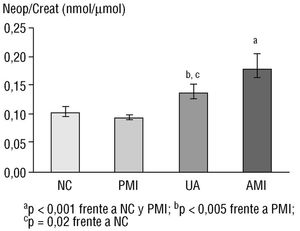
En los últimos 2 años, en el Saint George's Hospital, hemos estado estudiando otro marcador de inflamación producido por los monocitos-macrófagos, la neopterina. Esta molécula participa en la oxidación de los lípidos y actúa como cofactor en distintos procesos enzimáticos. Recientemente describimos que sus niveles estaban aumentados en el suero de pacientes que presentaban angina inestable e infarto de miocardio en relación con los individuos sin enfermedad coronaria o con aquellos que tenían una enfermedad coronaria estable 2 (fig. 1). Posteriormente, describimos que los niveles de neopterina se asociaban de forma independiente con la presencia de las lesiones complejas que se relacionan con los eventos coronarios agudos 3.
Fig. 1. Niveles séricos de neopterina en individuos control (NC), pacientes con enfermedad coronaria estable (PMI), pacientes con angina inestable (AU) y pacientes con infarto agudo de miocardio (AMI). La neopterina está significativamente elevada en el suero de pacientes con angina inestable o infarto de miocardio.
Los niveles elevados de neopterina representan un marcador de enfermedad coronaria que, en mi opinión, puede ser más específico que otros marcadores de inflamación que están siendo postulados en la actualidad, porque esta molécula está producida directamente por los macrófagos activados.
La proteína C reactiva
Uno de los marcadores de riesgo de infarto de miocardio que está recibiendo mayor atención es la proteína C reactiva. Varios estudios prospectivos bien diseñados han demostrado una asociación entre los niveles altos de proteína C reactiva y el aumento de la incidencia de infarto de miocardio y accidentes cerebrovasculares. Esta asociación ocurre en distintos grupos de individuos: individuos sanos, ancianos, fumadores, pacientes con angina de pecho y pacientes que han tenido un infarto de miocardio previo. Se puede puede reducir este riesgo mediante tratamiento con aspirina.
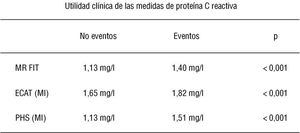
En la figura 2 se muestran los resultados de los estudios MRFIT, ECAT y PHS con relación a la proteína C reactiva en pacientes con y sin eventos. Se trata, en todos los casos, de grandes estudios epidemiológicos con miles de pacientes, en los que los puntos de corte varían según el estudio y es difícil saber con exactitud cuál es el nivel de proteína C reactiva que identifica al paciente con alto riesgo respecto a aquel que tiene un riesgo moderado. Esta importante limitación hace que en el momento actual sea un poco prematuro extrapolar los resultados de los estudios epidemiológicos al paciente individual.
Fig. 2. Niveles séricos de proteína C reactiva en pacientes con y sin eventos coronarios en los estudios MRFIT, ECAT y PHS. Obsérvese la gran variabilidad en los valores de referencia. Por ejemplo, los valores de los pacientes control en el estudio ECAT son mayores que los valores de los pacientes con eventos en los estudios MRFIT y PHS.
Los niveles altos de proteína C reactiva son posiblemente un marcador de los procesos inflamatorios que tienen que ver con la aterogénesis, pero también pueden indicar la presencia de infecciones crónicas que no son aparentes desde un punto de vista clínico. También pueden reflejar el grado de isquemia, y no necesariamente, o solamente, el grado de inflamación de una placa, o el grado de actividad de citocinas proinflamatorias no asociadas a una placa en particular. Recientemente se ha sugerido que la proteína C reactiva puede desempeñar por sí misma un papel patogénico en la aterosclerosis a través de la activación del sistema de complemento 4.
No cabe duda de que la inflamación desempeña un papel en la aterogénesis y la progresión rápida de la enfermedad coronaria. La relación demostrada por diversos estudios entre los niveles altos de proteína C reactiva, el fibrinógeno y la eritrosedimentación y el pronóstico de pacientes con angina inestable confirman la importancia de los procesos inflamatorios 5. También el recuento de glóbulos blancos se ha propuesto como marcador pronóstico. Incluso, a pesar de no haber diferencias en el recuento total, sí se han visto diferencias en el recuento específico, de manera que, por ejemplo, cuanto más bajo es el número de linfocitos mayor es el riesgo de eventos serios, como muerte o infarto no fatal. Se ha documentado también la presencia de citocinas proinflamatorias en pacientes con angina crónica estable 6.
Factor de transcripción nuclear kappa B (NF-κB)
El NF-κB está asociado a la inducción de genes codificadores de proteínas que son vitales para los procesos inflamatorios asociados a la ruptura de las placas ateromatosas. La importancia de los procesos inflamatorios en la aterogénesis y en los eventos coronarios agudos se confirma, una vez más, con la observación de que el aumento de la actividad de este factor de transcripción nuclear, tanto en modelos animales como en humanos, se correlaciona directamente con la severidad de la enfermedad coronaria 7. Un trabajo publicado recientemente sugiere que el NF-κB está específica y selectivamente aumentado en pacientes con angina inestable y no se halla afectado por la severidad de la enfermedad coronaria o el tratamiento médico 8. Estudios llevados a cabo por nuestro grupo han demostrado que, contrariamente a lo sugerido por Ritchie 3, la actividad del NF-κB se halla aumentada no solo en la angina inestable sino también en pacientes con angina crónica estable. Más aún, hemos demostrado que existe una correlación directa entre actividad de NF-κB y severidad de las lesiones coronarias.
Métodos diagnósticos para identificar las placas vulnerables
Aunque inicialmente se pensó que la angiografía podía servir para identificar a los pacientes que podían tener eventos coronarios agudos, en los últimos años ha quedado establecido que la información que proporciona la angiografía no es totalmente adecuada para conocer la «actividad» de la placa, de la cual depende el curso de la enfermedad coronaria. Tanto las placas que tienen gran actividad (con un núcleo lipídico grande y elevada actividad inflamatoria) como aquellas que presentan poca actividad (con una pared fibrosa importante) pueden tener una imagen angiográfica similar. Estenosis coronarias de poca monta en la angiografía pueden ser en realidad placas con alta tendencia a la ruptura. Puede hacerse una analogía con los volcanes, cuya apariencia puede ser similar externamente y uno no sabe de su actividad hasta que aparece una erupción. De este modo, existen placas que son «volcanes» muy activos y que, sin embargo, no podemos detectarlas por las limitaciones de nuestros métodos diagnósticos. La principal limitación con la que nos encontramos para identificar las placas vulnerables es que lo esencial, aquello que está ocurriendo en el interior de la placa, no es accesible a nuestros métodos diagnósticos. En el momento actual se están realizando importantes intentos por utilizar métodos de diagnóstico por imagen para identificar las placas activas. El grupo de Valentín Fuster es uno de los pioneros en este prometedor campo. Las técnicas por imagen, como la resonancia magnética, nos permitirían ver no sólo la anatomía de la lesión sino también caracterizar el tipo de tejido (fibroso, lipídico, inflamatorio, etc.) que constituye la placa. Esto nos daría una idea más clara de cuál es el grado de actividad de la lesión coronaria.
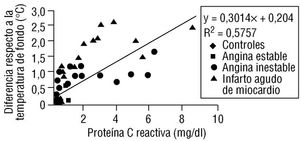
Otra posibilidad es usar el termómetro y determinar la temperatura de las lesiones coronarias. Algunos investigadores han utilizado este método y han observado que los pacientes con angina estable tienen una temperatura más baja en las placas de ateroma que los pacientes que presentan angina inestable o infarto de miocardio 9. Es interesante señalar que estos investigadores también documentaron una relación directa entre la temperatura de las placas y los niveles de proteína C reactiva en el plasma (fig. 3).
Fig. 3. Correlación entre los niveles de proteína C reactiva y la temperatura de las placas de ateroma en distintos grupos de pacientes9.
En resumen, nos encontramos en un momento en el que disponemos de muy pocas herramientas para abordar un problema tan complejo como es el identificar aquellas placas activas que pueden causar un infarto de miocardio. Sin embargo, quizá pudiésemos avanzar más rápidamente en este terreno si replanteamos nuestro tradicional enfoque terapéutico de la enfermedad coronaria. En el momento actual estamos, en la mayoría de los casos, solucionando el problema una vez que éste se halla establecido. Por ejemplo, dilatamos las arterias o les hacemos un puente. En un futuro quizá no muy lejano, nuestra terapéutica podría consistir en reducir la actividad de las placas, antes que de se hayan producido las consecuencias de su vulnerabilidad. Hoy por hoy existe evidencia de que el uso de estatinas baja la actividad de los macrófagos, reduce la expresión de metaloproteinasas y disminuye la actividad inflamatoria y trombogénica en las placas de ateroma de los animales de experimentación. Otras intervenciones antiinflamatorias deberán también ser exploradas.
Papel de la infección
Como se ha mencionado más arriba, se ha descrito la presencia de linfocitos activados en placas de pacientes con angina inestable. Este hecho sugiere que hay una estimulación antigénica. La pregunta es ¿cuál es el estímulo responsable de la activación inmunológica?
Se han propuesto varios agentes infecciosos que pueden actuar como antígenos en este contexto, tanto virus ( Herpes simplex o citomegalovirus) como bacterias ( Helicobacter pylori o Chlamydia pneumoniae). Más recientemente se ha agregado a esta lista Mycobacterium tuberculosis. También se ha sugerido que las bacterias que colonizan la cavidad bucal podrían tener relación con los eventos coronarios severos. Los estudios piloto que hemos llevado cabo en el Saint George's Hospital muestran una relación entre la infección por M. tuberculosis y la progresión de la enfermedad coronaria. Sin embargo, este hallazgo debe ser tomado con cautela, ya que necesitamos confirmarlo en un número mayor de pacientes.
Chlamydia pneumoniae se perfila como un buen candidato en cuanto a su asociación con enfermedad coronaria. Chlamydia pneumoniae causa infecciones respiratorias en un alto porcentaje de la población (entre un 40% y un 80%, dependiendo de la población que se estudie, muestra algún grado de infección por Chlamydia pneumoniae). Esta bacteria gram negativa parasita las células de forma obligada (bacteria intracelular) y la infección intracelular que causa es persistente. De este modo, ella coloniza las placas durante períodos muy prolongados. Por último, habría que resaltar también la capacidad que Chlamydia pneumoniae tiene para escapar a la acción bactericida del suero. Chlamydia pneumoniae presenta varios antígenos, que se usan para identificar su presencia con los tests diagnósticos habituales: el antígeno de la membrana exterior, el lipopolisacárido (endotoxina) y la proteína HSP 60, que es particularmente importante en relación con la enfermedad coronaria, como veremos más adelante.
Infección por Chlamydia pneumoniae y enfermedad coronaria
Desde las primeras evidencias epidemiológicas que documentaron un aumento de la prevalencia de infartos de miocardio y enfermedad coronaria en pacientes con títulos elevados de Chlamydia pneumoniae, varios investigadores han confirmado esta asociación. Sin embargo, en el momento actual existe una controversia no resuelta sobre este asunto. Porque si bien por un lado, han aparecido en los últimos 2 años artículos muy importantes (estudios epidemiológicos) que sugieren que no hay una asociación entre la presencia de anticuerpos contra Chlamydia pneumoniae y la enfermedad coronaria 10-14, también se han publicado datos no menos relevantes que sí muestran una asociación positiva entre títulos elevados de anticuerpos y eventos coronarios 15-18.
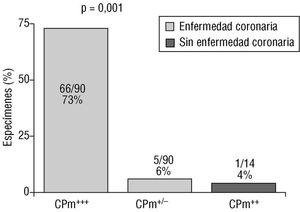
En relación al posible papel de Chlamydia pneumoniae en aterosclerosis, es importante el hecho de que esta bacteria se ha encontrado en arterias coronarias ateroscleróticas. Muhlestein et al 19 observaron que había un aumento de la incidencia de esta bacteria, detectada por técnicas inmunohistoquímicas, en las muestras que se obtenían de placas de pacientes con enfermedad coronaria. Además, estos autores vieron que no sólo se podía detectar la presencia de la bacteria sino que su concentración era mucho mayor en muestras de tejido enfermo que en muestras de tejido normal (más del 70% de muestras procedentes de placas ateroscleróticas presentaban Chlamydia pneumoniae comparado con el 4% de muestras de tejido no aterosclerótico) (fig. 4). Otro aspecto importante de la relación entre infección por Chlamydia pneumoniae y enfermedad coronaria es la demostración de que en las placas vulnerables con tendencia a romperse existe un aumento de la presencia del ADN de la bacteria, detectado por PCR, y también la presencia de Chlamydias activas que pudieron ser cultivadas posteriormente en el 16% de las muestras obtenidas en estas placas 20.
Fig. 4. Presencia de Chlamydia pneumoniae en muestras obtenidas de placas de ateroma y en muestras de tejido normal. La bacteria muestra una clara preferencia por colonizar el tejido enfermo.
Papel de los macrófagos en la infección por Chlamydia pneumoniae
Existen evidencias sólidas que demuestran que Chlamydia pneumoniae llega a los tejidos a través de una infección respiratoria. Los macrófagos alveolares infectados pasan a la sangre y diseminan la bacteria a otros tejidos. Tanto en ratones transgénicos como en los que desarrollan aterosclerosis con dietas ricas en colesterol, Chlamydia pneumoniae alcanza las zonas de ateroma a través de los macrófagos alveolares que actúan como un reservorio de esta bacteria y permiten su infección persistente, porque son células que muestran una clara preferencia por este tipo de infección. Una vez que son colonizados, los macrófagos alveolares mantienen un alto nivel metabólico tanto de tipo inmune como inflamatorio. Es esta actividad la que podría tener un papel en la aterogénesis.
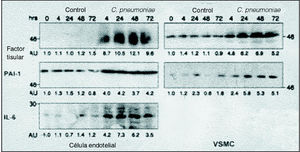
Surge entonces la pregunta de si la presencia de Chlamydias en las lesiones ateromatosas es debida a que los macrófagos son atraídos a estas zonas y depositan, pasivamente a la bacteria en el tejido enfermo, o si son las propias bacterias las causantes directas de la lesión endotelial que puede llevar a la aterosclerosis. Hay evidencia que los macrófagos pueden contribuir en gran medida al daño endotelial. Por una parte, se sabe a partir de estudios experimentales in vitro, que el macrófago alveolar colonizado por Chlamydia pneumoniae produce citocinas inflamatorias y radicales libres de oxígeno capaces de dañar el vaso. Por otra parte, la presencia de Chlamydia pneumoniae en los macrófagos y células endoteliales actúa estimulando la migración transendotelial de neutrófilos y monocitos hacia la placa de ateroma. Además, los macrófagos colonizados por la bacteria sintetizan las metaloproteinasas a las que me he referido más arriba, y también citocinas capaces de aumentar la expresión de las proteínas de shock por las células endoteliales. Estas proteínas de shock de procedencia endotelial tienen una analogía estructural con las proteínas de shock que sintetiza la propia Chlamydia pneumoniae. Como resultado de una reacción antigénica cruzada, los anticuerpos que se fabrican contra la bacteria acaban dañando la estructura de los vasos. Pero además, Chlamydia pneumoniae puede inducir daño vascular por sí misma. Muy recientemente se ha publicado un trabajo en el que se demuestra que en las células infectadas se activa la expresión de NF-κB, factor tisular, interleucina 6 (IL-6) e inhibidor del activador del plasminógeno 21 (fig. 5).
Fig. 5. Expresión del factor tisular, inhibidor del activador de plasminógeno (PAI-1) e IL-6 en células endoteliales y en células musculares lisas de la vasculatura (VSMC). La presencia de Chlamydia pneumoniae se asocia en todos los casos a un aumento de la expresión de estos tres marcadores.
Existe, pues, evidencia de que la infección por Chlamydia pneumoniae puede inducir todos los fenómenos que sabemos se hallan asociados a la progresión de las placas de ateroma. Se ha confirmado esta asociación en animales de experimentación en los que se ha podido inducir la formación de placas de ateroma mediante la infección con Chlamydia pneumoniae22.
Efectos del tratamiento antibiótico
En pacientes se han realizado estudios con antibióticos que demuestran de modo indirecto la posible asociación entre infección y enfermedad coronaria. En nuestra institución se ha llevado a cabo uno de estos estudios que muestra que, en pacientes que han tenido un infarto de miocardio, hay menor incidencia de eventos en el seguimiento cuando son tratados con azitromicina. Resultados similares se obtuvieron en el estudio ROXIS en pacientes con angina inestable, aunque después de 6 meses de seguimiento ya no se observó una relación significativa entre el tratamiento con antibióticos y los eventos coronarios. Recientemente el estudio ACADEMIC presentó los hallazgos de los primeros 6 meses de seguimiento y aunque el tratamiento con antibióticos no modificó las variables clínicas, sí ejerció efectos importantes sobre la actividad inflamatoria.
No sabemos exactamente qué es lo que nos dicen los resultados de estos estudios piloto: ¿es el efecto beneficioso observado un efecto anti- Chlamydia o un efecto antiinflamatorio (puesto que los antibióticos que se han usado tienen una marcada actividad antiinflamatoria)? Por el momento esta pregunta no tiene una respuesta definitiva. Tendremos que esperar los resultados de grandes estudios epidemiológicos que se están llevando a cabo, como el estudio MARBLE, que se está realizando en el Saint George's Hospital en pacientes en lista de espera para cirugía, el estudio WIZARD -un estudio multicéntrico en el que participan más de 3.500 pacientes postinfarto-, el estudio STAMINA, que también se está realizando en el Saint George's Hospital, y el ensayo ACES, que se desarrolla en Estados Unidos, antes de poder saber cuál es el verdadero papel que desempeña Chlamydia pneumoniae en la enfermedad coronaria. Aunque los estudios con animales de experimentación son alentadores, no hay evidencias concluyentes que afirmen que existe una asociación causal entre la infección por Chlamydia pneumoniae y la enfermedad coronaria (fig. 6).
Fig. 6. Grosor de la íntima de la aorta en animales infectados con Chlamydia pneumoniae que no fueron tratados, respecto a aquellos que fueron tratados con azitromicina y los controles no infectados. En el grupo de animales infectados y no tratados el grosor de la íntima de la aorta fue mucho mayor, como indicación de la formación de un ateroma.
En mi opinión, independientemente de que Chlamydia pneumoniae sea la causa o el acelerador, o tenga poca relación con la aterogénesis o la ruptura de las placas, esta hipótesis nos ha servido para remarcar el hecho de que la enfermedad coronaria es un proceso polifacético, en el que los mecanismos inflamatorios tienen gran importancia. En efecto, podemos resumir su fisiopatología en términos inflamatorios: los factores de riesgo convencionales, las infecciones crónicas y la producción de radicales libres de oxígeno causan una inflamación que produce citocinas proinflamatorias (IL-6, IL-1, TNF-α, IL-8, etc.), que pasan a la sangre y actúan sobre otras células, por ejemplo las células endoteliales, que a su vez contribuyen a atraer a otras células inflamatorias, las cuales contribuyen a dañar el vaso.
En esta redimensionada comprensión de la fisiopatología de la enfermedad coronaria nos encontramos ante un ejemplo de cómo algunos viejos conceptos perecen en el transcurso del tiempo a medida que vamos siendo capaces de identificar nuevos mecanismos, y cómo debemos ser capaces de aceptar este cambio. Esto ha sido descrito muy elegantemente por William James, quien hablando del progreso de la ciencia, dijo: «Nuevos hechos queman viejas reglas y la Ciencia, como la Vida, se alimenta de su propia descomposición».
Bibliografía
[1]
Macrophage infiltration in acute coronary syndromes. Implications for plaque rupture. Circulation 1994; 90: 775-778.
[2]
Serum neopterin in acute coronary syndromes. Lancet 1997; 349: 1252-1253.
[3]
Serum neopterin and complex stenosis morphology in patients with unstable angina. J Am Coll Cardiol 2000; 35: 958-962.
[4]
C-reactive protein as a cardiovascular risk factor: more than an epiphenomenon? Circulation 1999; 100: 96-102.
[5]
Inflammatory status as a main determinant of outcome in patients with unstable angina, independent of coagulation activation and endothelial cell function. Eur Heart J 1999; 20: 567-574.
[6]
Increased proinflammatory cytokines in patients with chronic stable angina and their reduction by aspirin. Circulation 1999; 100: 793-798.
[7]
Angiotensin-converting enzyme inhibition prevents arterial nuclear factor-kappa B activation, monocyte chemoattractant protein-1 expression, and macrophage infiltration in a rabbit model of early accelerated atherosclerosis. Circulation 1997; 95: 1532-1541.
[8]
Nuclear factor-kappa B is selectively and markedly activated in humans with unstable angina pectoris. Circulation 1998; 98: 1707-1713.
[9]
Thermal heterogeneity within human atherosclerotic coronary arteries detected in vivo. A new method of detection by application of a special thermography catheter. Circulation 1999; 99: 1965-1971.
[10]
Previous cytomegalovirus or Chlamydia pneumoniae infection and risk of restenosis after percutaneous transluminal coronary angioplasty. Lancet 1997; 350: 1225.
[11]
Chlamydia pneumoniae is frequent but not associated with coronary arteriosclerosis in cardiac transplant recipients. Am J Cardiol 1998; 82: 479-483.
[12]
Circulating Chlamydia pneumoniae DNA as a predictor of coronary artery disease. J Am Coll Cardiol 1999; 34: 1435-1439.
[13]
Prospective study of Chlamydia pneumoniae IgG seropositivity and risks of future myocardial infarction. Circulation 1999; 99: 1161-1164.
[14]
Chronic infection with Helicobacter pylori, Chlamydia pneumoniae, or cytomegalovirus: population based study of coronary heart disease. Heart 1999; 81: 245-247.
[15]
Endovascular presence of Chlamydia pneumoniae is a common phenomenon in coronary artery disease. J Am Coll Cardiol 1998; 31: 827-832.
[16]
Chlamydia pneumoniae but not cytomegalovirus antibodies are associated with future risk of stroke and cardiovascular disease: a prospective study in middle-aged to elderly men with treated hypertension. Stroke 1999; 30: 299-305.
[17]
Detection of Chlamydia pneumoniae but not cytomegalovirus in occluded saphenous vein coronary artery bypass grafts. Circulation 1999; 99: 879-882.
[18]
Relation of Chlamydia pneumoniae serology to mortality and incidence of ischaemic heart disease over 13 years in the caerphilly prospective heart disease study. Br Med J 1999; 318: 1035-1039.
[19]
Increased incidence of Chlamydia species within the coronary arteries of patients with symptomatic atherosclerosis versus other forms of cardiovascular disease. J Am Coll Cardiol 1996; 27: 1555-1561.
[20]
Endovascular presence of viable Chlamydia pneumoniae is a common phenomenon in coronary artery disease. J Am Coll Cardiol 1998; 31: 827-832.
[21]
Chlamydia pneumoniae infection of vascular smooth muscle and endothelial cells activates NF-kappa B and induces tissue factor and PAI-1 expression: a potential link to accelerated arteriosclerosis. Circulation 1999; 100: 1369-1373.
[22]
Infection with Chlamydia pneumoniae accelerates the development of atherosclerosis and treatment with azithromycin prevents it in a rabbit model. Circulation 1998; 97: 633-636.