La estenosis aórtica (EAo) es la valvulopatía más frecuente, y está previsto que su incidencia aumente de manera importante en las próximas décadas debido al envejecimiento progresivo de la población. La cirugía de reemplazo valvular aórtico (RVA) se ha asociado a una mejora sustancial de la supervivencia, la capacidad funcional y la calidad de vida de los pacientes con EAo sintomática, y representa actualmente el tratamiento de elección para esta afección. Sin embargo, se ha documentado que hasta un 30% de los pacientes con EAo sintomática no se somete a RVA debido a un riesgo quirúrgico muy alto o prohibitivo1. En el año 2002 se realizó la primera implantación percutánea de una prótesis valvular en posición aórtica (IPPVA) en un paciente en shock cardiogénico rechazado para cirugía de RVA2, y en los años posteriores la IPPVA se desarrolló como una alternativa menos invasiva a la cirugía de RVA en pacientes con EAo severa sintomática y riesgo quirúrgico muy alto o prohibitivo. La expansión de esta nueva tecnología para el tratamiento de la EAo ha sido muy rápida, y actualmente ya se han implantado más de 40.000 válvulas aórticas percutáneas. Las dos prótesis percutáneas con las que se ha construido la base de la experiencia clínica en IPPVA hasta el momento son la válvula de tipo Edwards (expansible mediante balón, Edwards Lifesciences, Irvine, California, Estados Unidos) y la de tipo CoreValve (autoexpansible, Medtronic, Minneapolis, Minnesota, Estados Unidos) (Figura 1). En los últimos años se ha realizado una serie de registros multicéntricos en Europa y Canadá, en los que se ha incluido a unos 4.000 pacientes3, 4, 5, 6, 7, 8, 9, 10, 11, 12. Los resultados más destacados de estos estudios se resumen en la Tabla 1. La tasa de éxito del procedimiento de IPPVA fue sistemáticamente superior al 90%, con una mortalidad a 30 días y a 1 año de seguimiento de aproximadamente un 9% (6,6-12,7%) y un 20% (15-24%), respectivamente. Sin embargo, estos estudios presentan una serie de limitaciones importantes, como la relativa heterogeneidad de las poblaciones incluidas debido a la falta de criterios uniformes para la inclusión de pacientes, la ausencia de estandarización para la definición de los eventos clínicos y las complicaciones tras el procedimiento, la falta de monitorización y adjudicación por comité independiente de los eventos clínicos (excepto para el registro SOURCE), y la falta de aleatorización respecto a la cirugía de RVA o el tratamiento médico.
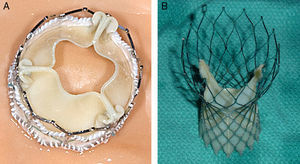
Figura 1. A: válvula percutánea de tipo Edwards SAPIEN XT. B: válvula percutánea de tipo CoreValve (gentileza del Dr. Marc Ruel, Ottawa Heart Institute, Ottawa, Ontario, Canadá).
Tabla 1. Resumen de los últimos registros en implantación percutánea de una prótesis valvular en posición aórtica
| Registros | n | EuroSCORE logístico (%) | Prótesis (%) | Acceso (%) | Éxito (%) | Evolución 30 días | Evolución 1 año | |||
| Mortalidad (%) | Ictus (%) | Complicaciones vasculares (%) | Marcapasos (%) | Mortalidad (%) | ||||||
| Registro europeo 3 | 646 | 23,1±13,8 | CoreValve(100) | TF (100) | 97 | 8 | 1,9 | ND | 9,3 | ND |
| Registro canadiense 4 | 339 | 27,7±16,3 | Cribier-EdwardsEdwards SAPIEN (100) | TF (50)TA (50) | 93,3 | 10,4 | 2,3 | 13 | 4,9 | 24 |
| Registro español 5 | 108 | 16±13,9 | CoreValve (100) | TF (95,4)SC (4,6) | 98,1 | 7,4 | 0 | 5,6 | 35,2 | 17,7 |
| Registro SOURCE 6,7 | 1.038 | 27,6±15,5 | Edwards SAPIEN (100) | TF (45)TA (55) | 93,8 | 8,5 | 2,5 | 12,8 | 7 | 23,9 |
| Registro alemán 8 | 697 | 20,5±13,2 | Edwards SAPIEN (26)CoreValve (84) | TF (92)SC (3)TA (4)TAo (1) | 98,4 | 12,4 | 2,8 | ND | 39,3 | ND |
| Registro italiano 9 | 656 | 23±14 | CoreValve (100) | TF (90)SC (10) | 98 | 6,6 | 1,2 | ND | 18,5 | 14,9 |
| Registro belga 10 | 328 | 28±16 | Edwards SAPIEN (57)CoreValve (43) | TF (71)TA (27)SC (2) | 97 | 11 | 5 | ND | 13 | 17 |
| Registro francés 11 | 244 | 25,6±11,4 | Edwards SAPIEN (68)CoreValve (32) | TF (66)TA (29)SC (5) | 98,3 | 12,7 | 3,6 | 6,9 | 4,826,9 | ND |
| Registro Reino Unido 12 | 870 | 18,5 (11,7-27,9) | Edwards SAPIEN (47)CoreValve (52) | TA (65)TF (31)SC (4) | 97,2 | 7,1 | 4,1 | 6,3 | 7,424,4 | 21,4 |
ND: no disponible; SC: subclavia; SOURCE: SAPIEN Aortic Bioprosthesis European Outcome; TA: transapical; TAo: transaórtico; TF: transfemoral.
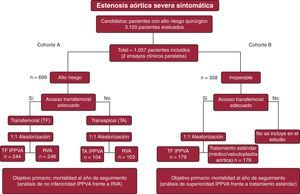
El estudio PARTNER es un test clínico multicéntrico y aleatorizado con dos cohortes de tratamiento con el objetivo de comparar la IPPVA frente a la cirugía convencional de RVA (cohorte A)13 o el tratamiento médico estándar/valvuloplastia aórtica (cohorte B)14, en pacientes con EAo severa sintomática. Los detalles sobre el diseño del estudio se resumen en la Figura 2. En la cohorte A se incluyó a pacientes de alto riesgo quirúrgico según un riesgo estimado de mortalidad ≥ 15% a los 30 días (una escala de riesgo quirúrgico de la Society of Thoracic Surgeons [STS]>10% se utilizó como guía para la inclusión de pacientes). Se consideró inoperables a todos los pacientes incluidos en la cohorte B por al menos dos cirujanos cardiacos con base en una estimación de mortalidad o morbilidad grave irreversible ≥ 50% a 30 días. La mayoría de la población incluida en el estudio era octogenaria, y entre las comorbilidades más importantes destacaban los antecedentes de accidente cerebrovascular (ACV) (∼27%), enfermedad pulmonar obstructiva crónica (∼40%) y enfermedad coronaria (∼70%) lo que, junto con otras comorbilidades, daba lugar a unas puntuaciones medias de riesgo quirúrgico estimado muy altos (STS ∼11% y EuroSCORE logístico ∼29%). La prótesis percutánea utilizada fue la de tipo Edwards-SAPIEN. Los principales resultados del estudio PARTNER se resumen en la Figura 3.
Figura 2. Características principales del diseño del estudio PARTNER. IPPVA: implantación percutánea de una prótesis valvular en posición aórtica; RVA: reemplazo valvular aórtico.
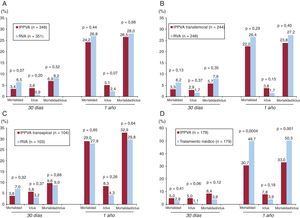
Figura 3. Resultados principales de mortalidad e ictus tras seguimiento a 30 días y 1 año del estudio PARTNER. A: cohorte A, pacientes de alto riesgo quirúrgico, implantación percutánea de una prótesis valvular en posición aórtica frente a cirugía de reemplazo valvular aórtico. B: cohorte A, pacientes candidatos a implantación percutánea de una prótesis valvular en posición aórtica por abordaje transfemoral frente a cirugía de reemplazo valvular aórtico. C: cohorte A, pacientes no candidatos a implantación percutánea de una prótesis valvular en posición aórtica por abordaje transfemoral tratados por abordaje transapical frente a cirugía de reemplazo valvular aórtico. D: cohorte B, pacientes inoperables, implantación percutánea de una prótesis valvular en posición aórtica frente a tratamiento médico. IPPVA: implantación percutánea de una prótesis valvular en posición aórtica; RVA: reemplazo valvular aórtico.
Pacientes de alto riesgo quirúrgico (cohorte A)No se observaron diferencias al año de seguimiento entre la IPPVA y el RVA en la mortalidad total (IPPVA, 24,2%; RVA, 26,8%; p=0,44) o mortalidad cardiovascular (IPPVA, 14,3%; RVA, 13%; p=0,63). La IPPVA se asoció a mayor incidencia de eventos cerebrovasculares (el 8,3 frente al 4,3%; p=0,04), si bien el objetivo combinado de muerte y ACV mayor fue similar al año de seguimiento (IPPVA, 26,5%; RVA, 28%; p=0,68). El grupo IPPVA presentó más complicaciones vasculares mayores (el 11 frente al 3,2%; p<0,001), pero menos complicaciones hemorrágicas severas (el 9,3 frente al 19,5%; p<0,001) y fibrilación auricular de novo (el 8,6 frente al 16,0%; p<0,001). No hubo diferencias entre los grupos en cuanto a la necesidad de marcapasos permanente tras el procedimiento (IPPVA, 3,8%; RVA, 3,6%). El análisis de subgrupos reveló que el antecedente de cirugía coronaria previa favorecía el RVA sobre la IPPVA, mientras que la IPPVA se asociaba a mejores resultados (respecto al RVA) en las mujeres. Finalmente, en ambos grupos se observó una mejoría funcional al año del procedimiento, aunque fue más rápida en el grupo de la IPPVA, con más pacientes en clase funcional ≤II de la New York Heart Association (NYHA) y una mayor distancia recorrida en el test de 6 min de marcha al mes del procedimiento.
Pacientes inoperables (cohorte B)La IPPVA se asoció a una disminución del 20% de la mortalidad por cualquier causa al año de seguimiento (el 30,7 frente al 50,7%; p<0,001), lo que significa que tan sólo 5 pacientes necesitaron un tratamiento de IPPVA para que 1 paciente adicional sobreviviera al año de seguimiento respecto al tratamiento estándar médico/valvuloplastia aórtica. Se observó también una disminución significativa de la mortalidad por causa cardiovascular (el 20,5 frente al 44,6%; p<0,001) y las rehospitalizaciones (el 22,3 frente al 44,1%; p<0,001). Cabe destacar que hasta un 84% de los pacientes en el grupo de tratamiento médico recibieron una valvuloplastia aórtica, lo que confirma la relativa ineficacia de este tratamiento a medio plazo para los pacientes añosos con EAo severa. La IPPVA también se asoció a una mejoría significativa de la capacidad funcional (clase funcional de la NYHA I o II: el 75 frente al 42%; p<0,001) y de la calidad de vida al año de seguimiento15. En el análisis de coste/efectividad se concluyó que la IPPVA suponía un coste de aproximadamente 50.000 dólares por año de vida adicional.
Los resultados del estudio PARTNER permiten establecer las siguientes recomendaciones:
1. El tratamiento de IPPVA debería ofrecerse a los pacientes con EAo severa sintomática con riesgo quirúrgico prohibitivo tras su evaluación por un equipo multidisciplinario compuesto de cardiólogos y cirujanos cardiacos. Tal equipo multidisciplinario debería evaluar, probablemente con la ayuda de otros especialistas (geriatras, internistas, neumólogos, etc.), la expectativa de vida y el potencial de mejora funcional y de calidad de vida de cada paciente (más allá de la estenosis aórtica). Tan sólo los pacientes con una expectativa de vida de al menos 1 año (criterio de inclusión en PARTNER) y con capacidad de mejora funcional y de calidad de vida deberían recibir el tratamiento de IPPVA.
2. El tratamiento de IPPVA se debe considerar una alternativa al RVA para los pacientes que se estima en alto riesgo quirúrgico. A la espera de una escala de riesgo específica para los candidatos a IPPVA, se debería utilizar como guía un riesgo evaluado por la escala STS>8% (que equivale de forma aproximada a un EuroSCORE logístico > 20) para considerar a un paciente como de alto riesgo quirúrgico. La evaluación de la expectativa de vida y el potencial de mejora funcional y de calidad de vida deberían seguir las mismas recomendaciones que para los pacientes considerados inoperables (véase el párrafo precedente).
El estudio PARTNER es, sin duda alguna, uno de los estudios más importantes que se han realizado en el tratamiento de la EAo y representa la confirmación de la IPPVA como alternativa al RVA. Sin embargo, quedan todavía numerosas dudas y puntos por resolver tras el estudio PARTNER.
Pacientes excluidos del estudio PARTNEREs importante tener en cuenta que el estudio PARTNER contaba con numerosos e importantes criterios de exclusión. Entre los más destacados, estarían la presencia de válvula aórtica bicúspide, insuficiencia mitral severa, función ventricular izquierda severamente deprimida e insuficiencia renal crónica severa. También se excluyó a los pacientes con cirugía valvular previa, por lo que no hubo casos de IPPVA para el tratamiento de disfunción protésica quirúrgica («válvula dentro de válvula»). A pesar de que numerosos estudios observacionales se han asociado a resultados prometedores en los diferentes subgrupos de pacientes no incluidos en el PARTNER3, 4, 5, 6, 7, 8, 9, 10, 16, no hay evidencia de que la IPPVA sea superior al tratamiento médico/valvuloplastia aórtica o equivalente al RVA para el tratamiento de estos pacientes. También es importante destacar que muchos pacientes no fueron incluidos en el PARTNER debido a que no se consideró suficientemente elevado (o prohibitivo en el caso de la cohorte B) el riesgo quirúrgico.
Los buenos resultados del estudio PARTNER invitarían a extender la indicación de IPPVA a grupos de pacientes de menos riesgo, hecho que ya ha empezado a ocurrir con resultados prometedores en algunos centros europeos. Sin embargo es importante tener en cuenta que, la cirugía de RVA en pacientes de riesgo intermedio o bajo se asocia a excelentes resultados en la gran mayoría de los centros. En los próximos años se llevarán a cabo dos estudios aleatorizados (SURTAVI y PARTNER II) en los que se va a comparar los resultados de la IPPVA y el RVA en pacientes con EAo sintomática y riesgo quirúrgico intermedio (puntuación STS entre el 4 y el 8%). El resultado de estos estudios deberá confirmar si la IPPVA es equivalente al RVA para el tratamiento de estos pacientes.
Finalmente, los resultados del estudio PARTNER se limitan a la IPPVA utilizando la válvula percutánea tipo Edwards-SAPIEN. Se está realizando en estos momentos un estudio prospectivo aleatorizado que compara la válvula percutánea de tipo CoreValve con el RVA en pacientes de alto riesgo quirúrgico (clinicaltrials.gov Identifier#NCT01240902).
Alta incidencia de accidentes cerebrovascularesEl ACV es una de las complicaciones más temidas en relación al procedimiento de IPPVA. El estudio PARTNER ha confirmado que: a) la incidencia de ACV tras IPPVA es una de las más altas registradas en cardiología intervencionista, y b) que esta alta tasa de ACV supera a la observada tras cirugía de RVA (cohorte A) y valvuloplastia aórtica (cohorte B). Los estudios con Doppler transcraneal han demostrado que las embolias cerebrales pueden ocurrir en cualquier momento del procedimiento, pero parecen ser más frecuentes durante el posicionamiento y la implantación de la válvula percutánea, lo que indica que la embolización de partículas a partir de las valvas de la válvula aórtica nativa calcificada es un mecanismo importante en la embolia cerebral relacionada con IPPVA17. Esto también explicaría la ausencia de diferencias en la tasa de ACV entre los procedimientos realizados por vía transfemoral y por vía transapical, pese a que por esta se evita el uso de catéteres de gran tamaño en el arco aórtico y la aorta ascendente y el paso retrógrado de la válvula aórtica nativa. Hay algunos resultados preliminares en relación con la utilización de dispositivos de protección embólica cerebral durante la IPPVA, y en los próximos años se evaluará la eficacia de estos dispositivos en la reducción de los eventos isquémicos cerebrales (clínicos y evaluados por resonancia magnética cerebral) durante estos procedimientos. Sin embargo, datos del estudio PARTNER13, 14 han revelado que aproximadamente un 50% de los ACV ocurren más allá de las primeras 24 h tras el procedimiento, lo que indica que mecanismos no directamente relacionados con el procedimiento también pueden ser importantes en un alto porcentaje de los ACV tras IPPVA. Amat-Santos et al18 han señalado recientemente que la aparición de arritmias auriculares (fibrilación auricular) tras IPPVA puede ser el factor más importante en relación con los ACV que ocurren más de 24 h después del procedimiento. Aunque la combinación de aspirina y clopidogrel es el tratamiento que se ha recomendado empíricamente tras IPPVA, futuros estudios deberán determinar cuál es el tratamiento antitrombótico óptimo tras estos procedimientos. Finalmente, un subestudio del PARTNER (cohorte A) ha evidenciado que los ACV que ocurren en la fase aguda tras IPPVA se relacionaron con una menor área valvular previa al procedimiento, mientras que los eventos tardíos se relacionaron con una mayor carga de factores de riesgo cardiovascular, y destacan de nuevo que los mecanismos de los eventos agudos y tardíos probablemente sean diferentes19. Este subestudio también confirmó que las prótesis aórticas percutáneas no se asociaron a mayor incidencia de eventos neurológicos en el seguimiento que con las quirúrgicas.
Alta tasa de complicaciones vascularesLa utilización de catéteres de gran tamaño en pacientes de edad muy avanzada se ha asociado a una alta tasa de complicaciones vasculares, tal como también reflejan los datos del estudio PARTNER, con un 16 y un 11% de complicaciones vasculares severas en las cohortes B y A, respectivamente. Es importante destacar que en el estudio PARTNER se utilizaron catéteres de 22 y 24 Fr, en vez de los catéteres de 18 Fr que se están utilizando actualmente. También la ausencia de una vía alternativa a la transfemoral en la cohorte B del estudio PARTNER pudo condicionar la inclusión de pacientes con un diámetro arterial o un grado extremo de calcificación a nivel iliofemoral, ambos factores relacionados con mayor número de complicaciones vasculares. Una evaluación rigurosa del acceso iliofemoral, la utilización de vías de acceso alternativas a la transfemoral (transapical, transaórtica, subclavia, axilar) en casos con arterias iliofemorales al límite, el uso de catéteres de menor tamaño y una mayor experiencia en procedimientos de IPPVA deberían asociarse en el futuro a una disminución significativa de las complicaciones vasculares.
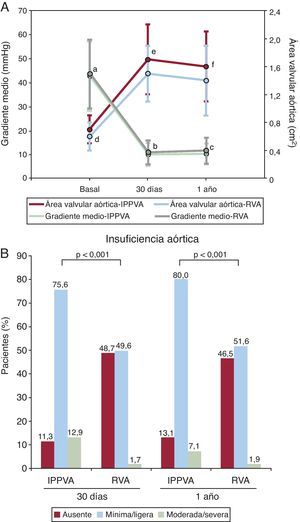
Insuficiencia aórtica residualLos diferentes estudios en el campo de IPPVA en la era pre-PARTNER ya demostraron que las válvulas percutáneas de tipo Edwards y CoreValve habitualmente se asocian a excelentes resultados hemodinámicos, aunque la insuficiencia paravalvular residual es frecuente, mínima o ligera en la mayoría de casos y moderada en ∼10% de los pacientes3, 4, 5, 6, 7, 8, 9, 10, 11, 12. Es importante resaltar que el estudio PARTNER incluye, por primera vez en un estudio de IPPVA, el análisis de los datos ecográficos en un core lab de ecocardiografía independiente. Los resultados confirman la excelente hemodinámica de la válvula percutánea Edwards-SAPIEN, que fue incluso superior a la hemodinámica de las prótesis valvulares quirúrgicas (cohorte A, Figura 4). Sin embargo, la aparición de insuficiencia aórtica residual, mayoritariamente paravalvular, ocurrió en un 89% de casos (moderada en un 13%), lo que es un porcentaje muy superior al observado tras reemplazo valvular quirúrgico. No cabe duda que la existencia de insuficiencia aórtica al menos moderada en aproximadamente un 10% de los casos representa una limitación significativa de la IPPVA, ya que se asocia a un peor pronóstico tras el procedimiento y puede generar dudas respecto a la expansión de esta tecnología para el tratamiento de un grupo de población de menores edad y riesgo quirúrgico. Sin embargo, ya se han identificado numerosos factores predictores de la aparición de insuficiencia aórtica al menos moderada tras IPPVA: mayor grado de calcificación de la válvula nativa, mayor tamaño del anillo valvular, desproporción entre el tamaño del anillo y la prótesis valvular, implantación de la prótesis demasiado baja o demasiado alta y excesiva angulación entre aorta ascendente y tracto de salida ventricular izquierdo. Por lo tanto, en los próximos años se desarrollarán muy probablemente escalas de riesgo para la aparición de insuficiencia aórtica moderada o severa tras IPPVA que permitirán determinar qué pacientes tienen mayor riesgo de esta complicación. También se está investigando en la mejora del diseño de las prótesis percutáneas para poder reducir la incidencia de esta complicación. Finalmente, es importante destacar que la valoración de la severidad de la insuficiencia paravalvular tras IPPVA mediante ecocardiografía no es sencilla. En el estudio PARTNER se utilizó el área color en el plano corto como único criterio, lo que parece insuficiente para una correcta evaluación de la severidad de la insuficiencia paravalvular. En un futuro también deberán validarse los parámetros para una evaluación adecuada del grado de insuficiencia paravalvular residual tras IPPVA.
Figura 4. Resultados hemodinámicos en el estudio PARTNER (cohorte A). A: gradiente transaórtico medio y área valvular tras implantación percutánea de una prótesis valvular en posición aórtica frente a reemplazo valvular aórtico. B: insuficiencia aórtica residual tras implantación percutánea de una prótesis valvular en posición aórtica frente a reemplazo valvular aórtico. IPPVA: implantación percutánea de una prótesis valvular en posición aórtica; RVA: reemplazo valvular aórtico. ap=0,51. bp=0,04. cp=0,008 (entre IPPVA y RVA). dp=0,032. ep=0,001. fp=0,002 (entre IPPVA y RVA).
Alta mortalidad al año de seguimientoA pesar de que la mayoría de los procedimientos de IPPVA se realizaron al inicio de la curva de aprendizaje de la mayoría de los centros participantes y que se utilizaron dispositivos menos evolucionados que los disponibles actualmente, el estudio PARTNER se asoció a una excelente supervivencia a 30 días, con una mortalidad<6% (el 3,4% en intención de tratamiento y el 5,2% en los pacientes que recibieron la IPPVA) en el grupo IPPVA transfemoral de la cohorte A, muy inferior al riesgo estimado de mortalidad por puntuación STS (∼11%). Sin embargo, la mortalidad fue relativamente alta al año de seguimiento (el 30,7% en la cohorte B y el 24,2% en la cohorte A). Este dato indica que, a pesar de que por protocolo los pacientes con una expectativa de vida inferior al año estaban excluidos, se acabó incluyendo a pacientes con procesos cardiacos y/o no cardiacos demasiado avanzados para que pudieran beneficiarse de cualquier tratamiento invasivo, incluida la IPPVA. De hecho, el paciente que supera sin complicaciones mayores la IPPVA pero fallece a los pocos meses del procedimiento pertenece a la denominada «cohorte C» (en contraposición a las cohortes A y B del PARTNER), que corresponde a los pacientes con un riesgo probablemente demasiado elevado para someterse a IPPVA y que deberían recibir tan sólo tratamiento médico. La aceptación de estos pacientes para procedimientos de IPPVA penaliza sobremanera el cociente coste/eficacia asociado a esta técnica. Cabe destacar que algunos estudios han evidenciado que la mortalidad tardía (> 30 días) tras IPPVA está básicamente relacionada con causas no cardiacas, fundamentalmente de origen respiratorio y renal4, 7, 20. Por desgracia, las escalas de riesgo quirúrgico, muy especialmente el EuroSCORE logístico, no parecen apropiadas para determinar el riesgo a corto y medio plazo de los pacientes sometidos a IPPVA, y en los próximos años será importante elaborar una escala de riesgo específico para IPPVA. Varios estudios han evaluado los factores predictores de mortalidad a medio plazo asociados con la IPPVA4, 7, 9, que pueden dividirse en tres grupos: a) comorbilidad cardiaca (fracción ventricular izquierda severamente deprimida, hipertensión pulmonar, insuficiencia mitral severa); b) complicaciones durante el procedimiento (ACV, complicaciones vasculares severas, sepsis, insuficiencia aórtica residual moderada-severa), y c) comorbilidad no cardiaca (enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, cirrosis hepática). La validación de estos y otros factores en estudios con un mayor número de pacientes debería permitir en los próximos años elaborar una escala de riesgo específico para IPPVA, lo que sin duda permitirá mejorar el proceso de selección de este difícil grupo de pacientes. Este es un paso fundamental si se quiere mejorar los resultados a medio plazo de la IPPVA.
Ausencia de datos de durabilidad a largo plazo de las prótesis percutáneasLos datos ecocardiográficos al año de seguimiento del estudio PARTNER confirman los buenos resultados de estudios observacionales previos sobre la estabilidad de los resultados hemodinámicos asociados con las válvulas percutáneas. Sin embargo, en estos momentos hay pocos datos a largo plazo sobre la durabilidad y la ausencia de fallos estructurales de las prótesis percutáneas. El seguimiento más largo hasta el momento es el publicado por el grupo de Vancouver, con una serie de 70 pacientes con una media de casi 4 años de seguimiento20, en los que se demostró la ausencia de disfunción o fallo estructural de la válvula percutánea. No obstante, menos del 5% de las prótesis quirúrgicas presentan fallos estructurales a largo plazo (> 5-10 años de seguimiento), con lo que deberemos esperar todavía unos años para comprobar si se obtienen los mismos resultados de durabilidad con las prótesis percutáneas. Esta información es de gran importancia para la posible expansión de esta técnica al tratamiento de pacientes más jóvenes con expectativas de vida > 10 años tras el procedimiento.
ConclusionesLa IPPVA representa una alternativa menos invasiva que la cirugía de RVA para el tratamiento de la EAo severa sintomática. El estudio PARTNER ha confirmado que la IPPVA es actualmente el tratamiento de elección para pacientes con riesgo quirúrgico prohibitivo y una alternativa válida al RVA para pacientes considerados de alto riesgo quirúrgico. Sin embargo, en los próximos años deberemos mejorar el proceso de selección de pacientes y reducir algunas de las complicaciones asociadas al procedimiento, como ACV, complicaciones vasculares e insuficiencia aórtica residual moderada-severa. Hay datos preliminares prometedores en el tratamiento mediante IPPVA de pacientes de riesgo quirúrgico moderado y de la disfunción de prótesis quirúrgicas («válvula dentro de válvula»), así como en el seguimiento a medio-largo plazo de las prótesis percutáneas. La confirmación de estos resultados en futuros estudios debería permitir la expansión del tratamiento de IPPVA a un espectro mucho más amplio de pacientes con EAo severa sintomática.
FinanciaciónLa Dra. Urena ha obtenido financiación de una beca de investigación en centros extranjeros de la Sociedad Española de Cardiología. El Dr. Nombela-Franco ha obtenido financiación de una beca de investigación de la Fundación Alfonso Martín Escudero de Madrid (España).
Conflicto de interesesEl Dr. Josep Rodés-Cabau es consultor para Edwards Lifesciences y St. Jude Medical.
Agradecimientos
Los autores agradecen el trabajo de Melanie Côté, MSc, Quebec Heart & Lung Institute, en la preparación de las figuras.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Quebec Heart & Lung Institute, 2725 chemin Ste-Foy, G1V 4G5 Quebec city, Quebec, Canadá. josep.rodes@criucpq.ulaval.ca