La mortalidad cardiovascular se ha reducido en las últimas décadas. Este hecho, junto con el envejecimiento de la población, ha producido un aumento de las prevalencias de la cardiopatía isquémica crónica y la angina de pecho estable y, por lo tanto, un incremento de pacientes con comorbilidades relacionadas. Las comorbilidades más prevalentes son la hipertensión y la diabetes mellitus, aunque la vasculopatía periférica, la enfermedad obstructiva crónica, la insuficiencia cardiaca y la fibrilación auricular también son frecuentes. En este contexto, el tratamiento médico es cada vez más complejo por la necesidad de utilizar múltiples fármacos, aunque los nuevos antianginosos como la ranolazina y la ivabradina ofrecen nuevas posibilidades para controlar los síntomas. En cualquier caso, el tratamiento médico óptimo siguiendo las recomendaciones de las guías de práctica clínica es la primera opción terapéutica.
Palabras clave
En las últimas décadas se ha producido una disminución de la mortalidad por cardiopatía isquémica1. La supervivencia tras presentar un síndrome coronario agudo ha aumentado de manera significativa2 y esto, junto con el envejecimiento general de la población, conlleva que la cardiopatía isquémica crónica (CIC) sea cada vez más prevalente.
Los pacientes alcanzan fases más avanzadas de la enfermedad a edad más avanzada, con el consiguiente incremento de las comorbilidades y la dificultad de manejo.
En este artículo se revisa el tratamiento médico de la CIC, con especial referencia a la angina de pecho estable (AP), y se analiza la repercusión de la comorbilidad en su manejo y sus posibles soluciones.
Tratamiento médico óptimo de la angina de pechoLa AP es el síntoma más frecuente de la CIC y aumenta con la edad3. La revascularización no consigue controlarla definitivamente. Hemingway et al4 señalaron que la tasa de angina era del 52% 1 año después de una angioplastia y un 40% tras cirugía coronaria. Un estudio sueco5 situaba en el 44% los pacientes con angina a los 5 años de la cirugía.
El tratamiento médico recomendado por las guías de práctica clínica hoy vigentes3,6 incluye recomendaciones encaminadas a prolongar la vida, controlar los síntomas y cambiar el estilo de vida (tabla 1). El conjunto de los tres grupos de terapias es lo que se conoce por tratamiento médico óptimo (TMO)7.
| Mejoría pronóstica | Mejoría de síntomas | Ambos |
| Ácido acetilsalicílico | Bloqueadores beta | Actividad física |
| Estatinas | Antagonistas del calcio | Dieta mediterránea |
| IECA | Nitratos | Control del peso |
| Bloqueadores beta* | Nicorandil | Control del tabaquismo |
| Ivabradina |
IECA: inhibidores de la enzima de conversión de la angiotensina.
Los bloqueadores beta son los fármacos antianginosos de primera línea en ausencia de contraindicaciones. Si no se controlan los síntomas, se recomienda añadir un antagonista del calcio o un nitrato de acción prolongada. Otras opciones son un estimulador de los canales de potasio (nicorandil) o un inhibidor del canal If (ivabradina). Se recomienda considerar la revascularización cuando se utilizan al menos dos fármacos a dosis adecuadas y persisten los síntomas.
Después de publicadas las guías, varios ensayos clínicos han confirmado la bondad del TMO. El estudio COURAGE8 analizó si la angioplastia coronaria inicial junto con TMO era superior al TMO solo. Se aleatorizó a 2.287 pacientes con isquemia en el ECG basal o en el test de provocación. El 78% tenía AP. La mediana de seguimiento fue 4,6 años y no se encontraron diferencias significativas en el objetivo compuesto de muerte, infarto de miocardio o accidente cerebrovascular (ACV) (el 20% con angioplastia frente al 19,5% en el TMO). En el grupo de TMO, a los 5 años mantenían tratamiento con antiagregantes el 95%, con bloqueadores beta el 85%, con antagonistas del calcio el 52%, con nitratos el 57%, con inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA-II) el 78% y con estatinas el 93%. El porcentaje de pacientes libres de angina fue mayor con angioplastia durante los primeros 2 años, si bien se igualó a partir del tercero9.
En 2011 se publicó el estudio STICH10, con 1.212 pacientes con CIC y fracción de eyección ≤ 35% susceptibles de revascularización quirúrgica. Se los aleatorizó en dos grupos: tratamiento médico sólo o tratamiento médico más cirugía coronaria. Más del 60% de los pacientes tenían angina. Al final del seguimiento (mediana, 56 meses), no hubo diferencias significativas respecto a mortalidad por cualquier causa—que era el objetivo principal—, aunque sí se produjeron menos reingresos en el grupo quirúrgico. Es de destacar que, al final del estudio, el seguimiento era superior al 85% para cada uno de los fármacos que prolongan la vida en la CIC (tabla 1) en ambos grupos.
Sin embargo, la aplicación del TMO en la práctica diaria no ha cambiado a pesar de estos resultados. En una publicación reciente, Borden et al11, con más de 450.000 pacientes de Estados Unidos, comprobaron que el TMO había aumentado apenas un 2% después de la publicación del COURAGE, alcanzando el 44,7% antes de la angioplastia y el 63,5% al alta hospitalaria tras la revascularización.
La explicación a estos hallazgos no es fácil. En el Euro Heart Survey12, la presencia de contraindicaciones de la medicación alcanza a alrededor del 20% de los pacientes, y es probable que la educación sanitaria y la labor de los profesionales de enfermería puedan mejorar esta situación13. Otro factor que seguro que limita la utilización de algunos fármacos es la presencia de comorbilidades.
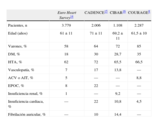
Comorbilidades relacionadas con la cardiopatía isquémica crónicaPara analizar la dimensión del problema en los pacientes con AP son especialmente apropiados los registros extrahospitalarios, ya que así es el entorno habitual de estos enfermos. En la tabla 2 aparecen los datos de tres registros extrahospitalarios, dos con sólo pacientes con AP (Euro Heart Survey14 y el estudio CADENCE15), mientras el estudio gallego CIBAR16 incluye a pacientes con CIC en general. Como referencia se aportan datos del estudio COURAGE8. Se puede comprobar que en este caso la distancia entre los registros y los ensayos clínicos no es muy marcada.
Comorbilidades relacionadas con la cardiopatía isquémica crónica. Datos de tres registros extrahospitalarios y un ensayo clínico.
| Euro Heart Survey14 | CADENCE15 | CIBAR16 | COURAGE8 | |
| Pacientes, n | 3.779 | 2.006 | 1.108 | 2.287 |
| Edad (años) | 61±11 | 71±11 | 69,2±11 | 61,5±10 |
| Varones, % | 58 | 64 | 72 | 85 |
| DM, % | 18 | 30 | 28,7 | 35 |
| HTA, % | 62 | 72 | 65,5 | 66,5 |
| Vasculopatía, % | 7 | 17 | 13,8 | — |
| ACV o AIT, % | 5 | — | — | 8,8 |
| EPOC, % | 8 | 22 | — | — |
| Insuficiencia renal, % | 1 | — | 9,2 | — |
| Insuficiencia cardiaca, % | — | 22 | 10,8 | 4,5 |
| Fibrilación auricular, % | — | 10 | 14,4 | — |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión arterial.
El hallazgo común de los tres registros es que las comorbilidades relacionadas más frecuentemente con AP o CIC son la hipertensión arterial (un 60–70% de los pacientes) y la diabetes mellitus (DM) (20–30%). La vasculopatía periférica, la enfermedad pulmonar obstructiva crónica (EPOC), la insuficiencia cardiaca y la fibrilación auricular afectan a un 10–20% de los pacientes.
La comorbilidad es un factor independiente respecto a mortalidad y calidad de vida. En la escala de riesgo pronóstico para pacientes con AP propuesta por el Euro Heart Survey17, la DM añade 57 puntos al cálculo del riesgo, mientras que las demás comorbilidades tienen un peso de 86 puntos. En ese estudio, la comorbilidad incluye eventos cerebrovasculares, enfermedad arterial periférica, EPOC, enfermedad hepática, insuficiencia renal, enfermedades inflamatorias y neoplasias (las cuatro últimas con prevalencia < 2%).
En el estudio CIBAR-BARBANZA18, realizado con pacientes de la zona de Santiago de Compostela, el principal factor pronóstico de muerte cardiovascular fue la insuficiencia cardiaca previa. También se relacionaron con la mortalidad de modo significativo el ingreso hospitalario reciente, la DM y la insuficiencia renal.
En el estudio CADENCE15, que es un registro estratificado entre los médicos de atención primaria de Australia, el número de crisis de angina que los pacientes habían sufrido y, por lo tanto, la calidad de vida percibida se relacionaron significativamente con el sexo femenino, la insuficiencia cardiaca previa y la vasculopatía periférica.
Por otro lado, todas estas comorbilidades conllevan la necesidad de utilizar tratamientos específicos, con lo que es más posible la «polifarmacia », que implica peor cumplimiento terapéutico y mayor riesgo de interacciones medicamentosas. En la tabla 3 se exponen las implicaciones en el manejo terapéutico de las diferentes comorbilidades.
Comorbilidades más frecuentes y sus consecuencias en el manejo farmacológico.
| Comorbilidad | Consecuencia en el manejo |
| Diabetes mellitus | Dificultad para conseguir objetivos con BB |
| Hipertensión arterial | Posibilidad de curva en J |
| Enfermedad vascular periférica | Dificultad de manejo con BB |
| ACV o AIT | Antitrombóticos |
| Asma bronquial | Contraindicación para BB |
| Insuficiencia renal | Ajustes de dosis, famacocinética |
| Insuficiencia cardiaca | Contraindicación para verapamilo, diltiazem |
| Fibrilación auricular | Antitrombóticos, hemorragias |
| Hipotensión | La mayoría de los fármacos están contraindicados |
| Bradicardia extrema | Contraindicados BB, diltiazem y verapamilo |
| Anemia | Antitrombóticos, hemorragias |
| Demencia, trastornos cognitivos | Adherencia |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; BB: bloqueadores beta.
Las guías de práctica clínica del manejo de AP europeas y americanas3,6 recomiendan un control estricto de la presión arterial en presencia de DM y/o insuficiencia renal, con un objetivo terapéutico < 130/80mmHg. Sin embargo, esta recomendación se modificó en la actualización de las guías de la hipertensión del año 2009, y las nuevas cifras son 130–139/80–85mmHg19.
Publicaciones posteriores avalan esta recomendación. Así, un análisis post-hoc del estudio INVEST sobre 6.400 pacientes con enfermedad coronaria y DM, un control estricto de presión arterial a 130mmHg no redujo eventos respecto a un grupo control con 130–140mmHg; incluso en el seguimiento el control estricto de la presión arterial se asoció a un incremento de la mortalidad20.
En el estudio PROVE-IT, en el análisis de pacientes con enfermedad coronaria los pacientes con presiones de 136/85mmHg presentaban el menor riesgo de eventos vasculares, y sin embargo había mayor mortalidad entre los pacientes con los valores de presión arterial más bajos21.
En el análisis del TNT, con 10.001 pacientes con CIC, las cifras de presión arterial de 146/81mmHg se asociaron al menor riesgo de eventos cardiovasculares. Se observó una relación no lineal en curva J entre presión arterial sistólica y diastólica y eventos, excepto para la presión arterial sistólica y el ictus22.
En el estudio ACCORD, se evaluó bajar la presión arterial a 120 frente a 140mmHg en pacientes con DM. La tercera parte de los pacientes tenían enfermedad vascular, y se demostró que las cifras más próximas a 120mmHg no reportaban beneficio clínico23.
Recientemente se ha publicado el seguimiento de 5.788 pacientes con enfermedad vascular sintomática en relación con la aparición de nuevos eventos vasculares (infarto agudo de miocardio, ictus o muerte vascular) y todas las causas de mortalidad, con un seguimiento de 5 (2,6–8,1) años. La relación con ajuste de covariables entre la presión arterial sistólica media, la diastólica y la de pulso de presión seguía una curva en J con incremento de los eventos por encima y por debajo de 143/82mmHg. Una relación no lineal similar se encontró entre la presión arterial diastólica y todas las causas de mortalidad24.
Así pues, hay datos suficientes para aceptar un efecto en J en el control de la presión arterial y, por lo tanto, la reducción por debajo de 130–139/80–85mmHg tiene efectos deletéreos para los pacientes con CIC e hipertensión.
Enfermedad pulmonar obstructiva crónicaCon frecuencia se evita usar bloqueadores beta por la preocupación relacionada con el broncospasmo o la posibilidad de bloquear el efecto de los broncodilatadores que utilizan agonistas beta y empeorar la calidad de vida de los pacientes con EPOC. Sin embargo, datos recientes confirman la conveniencia de su utilización en pacientes con esta enfermedad.
Short et al25, en un estudio retrospectivo de 5.977 pacientes mayores de 50 años y un seguimiento medio de 4,3 años, comprobaron que los bloqueadores beta cardioselectivos pueden reducir la mortalidad en los pacientes con EPOC y disminuir las exacerbaciones cuando se utilizan con la terapia inhalada progresiva convencional, independientemente de la enfermedad cardiovascular subyacente y el tratamiento cardioactivo.
Bien es cierto que en más del 50% de los casos no se puede utilizar dosis de estos fármacos hasta situar la frecuencia cardiaca en torno a 60–70lpm. En una revisión de la Cochrane de 22 ensayos aleatorizados en que se utilizaron bloqueadores beta cardioselectivos en pacientes con EPOC, no hubo efectos adversos en los síntomas respiratorios ni en los tests de función respiratoria respecto a placebo26. Los bloqueadores beta están formalmente contraindicados en el asma o la hiperreactividad bronquial graves.
Psicofármacos y depresiónLos pacientes psiquiátricos presentan un exceso de muerte súbita de origen no explicado. Algunos estudios han relacionado la enfermedad mental en sí misma con una mayor prevalencia de factores de riesgo cardiovascular como dislipemia o DM. Sin embargo, otras observaciones indican que la utilización de fármacos antipsicóticos o antidepresivos podría estar relacionada con la muerte súbita27.
Un estudio reciente ha analizado la incidencia de muerte súbita en el infarto agudo de miocardio. Se comparó a los pacientes que murieron súbitamente en la fase aguda con una cohorte de pacientes que sobrevivieron al infarto. Se compararon diferentes parámetros, como el uso previo de antipsicóticos y antidepresivos. Las víctimas de muerte súbita consumían fármacos antipsicóticos más frecuentemente que los supervivientes—odds ratio (OR)=4,36 (287–6,62)—, aunque también los antidepresivos mostraron OR=1,60 (1,17–2,19), con un efecto aditivo de la utilización de un antidepresivo y un antipsicótico. Aparece como especialmente maligna la combinación de fenotiacidas con fármacos antidepresivos28.
Por lo tanto, hay que extremar las precauciones en el tratamiento de pacientes con problemas psiquiátricos que precisan fármacos potencialmente proarrítmicos por alargamiento del intervalo QT con fármacos antiisquémicos.
Nuevos fármacos antianginososLa aparición de dos nuevos fármacos antianginosos en los últimos años ha abierto nuevas opciones al manejo de los pacientes con CIC y comorbilidad, como exponemos a continuación.
IvabradinaLa ivabradina bloquea selectivamente los canales If del nodo sinusal y reduce la pendiente de despolarización diastólica espontánea de las células marcapasos. De este modo disminuyen la frecuencia cardiaca y el consumo miocárdico de oxígeno sin modificar la contractilidad miocárdica, la conducción intracardiaca ni la repolarización ventricular.
La eficacia antianginosa es similar a la del atenolol 100mg/día29 y además presenta un efecto aditivo al combinar ambos fármacos. Tardiff et al30 estudiaron a 889 pacientes con AP tratados con atenolol 50mg/día. A los 2 y a los 4 meses con ivabradina, todos los parámetros de la prueba de esfuerzo mejoraron respecto a placebo, con buena tolerancia clínica de la combinación.
En un subestudio del BEAUTIFUL, la ivabradina redujo un 24% el objetivo primario de la mortalidad cardiovascular u hospitalización por infarto de miocardio o insuficiencia cardiaca en pacientes con AP y disfunción sistólica (fracción de eyección < 40%) que tenían una frecuencia cardiaca en reposo > 70lpm a pesar del tratamiento con bloqueadores beta31.
De hecho, la frecuencia cardiaca en reposo es un factor pronóstico en la CIC y la disfunción sistólica. Así, el efecto beneficioso de los bloqueadores beta en pacientes con insuficiencia cardiaca guarda más relación con la magnitud de la reducción de la frecuencia que con la dosis alcanzada32. En pacientes con CIC y disfunción ventricular izquierda, la frecuencia cardiaca ≥ 70lpm se asocia a un aumento de muerte cardiovascular o ingreso por insuficiencia cardiaca, y estos efectos aumentan por cada incremento de 5lpm de la frecuencia cardiaca basal33. En el estudio SHIFT34, se aleatorizó a recibir hasta 7,5mg de ivabradina cada 12h o placebo a 6.558 pacientes con insuficiencia cardiaca y fracción de eyeccion ≤ 35% en ritmo sinusal con frecuencia cardiaca > 70lpm ingresados en el último año por insuficiencia cardiaca. Tras una mediana de seguimiento de 22,9 meses, el objetivo principal del estudio (muerte cardiovascular o reingreso por insuficiencia cardiaca) se redujo significativamente en el grupo de ivabradina. La utilización de bloqueadores beta era del 89% en el grupo de ivabradina y el 90% en el grupo de placebo respectivamente.
Por todo lo expuesto, se puede concluir que la ivabradina es una buena opción para los pacientes con angina que tienen intolerancia o contraindicación para los bloqueadores beta. Se puede agregar a estos para los pacientes que no tienen un control apropiado de la frecuencia cardiaca en reposo, como los que sufren disfunción ventricular izquierda o insuficiencia cardiaca.
RanolazinaLa ranolazina es un fármaco antianginoso que inhibe la corriente tardía de entrada de Na (INaL) en las células miocárdicas, reduce la acumulación intracelular de Na+ y la posterior de Ca++, así como las anomalías mecánicas, eléctricas y metabólicas en el miocardio isquémico o insuficiente.
Ranolazina en la cardiopatía isquémica crónicaSe han realizado tres ensayos clínicos con ranolazina en el contexto de la AP. El estudio MARISA35 incluyó a 175 pacientes con ergometría positiva limitante, a los que se aleatorizó a placebo o ranolazina en dosis de 500, 1.000 y 1.500mg cada 12h. Se comprobó un alargamiento del tiempo de ejercicio al aumentar la dosis del fármaco respecto a placebo.
El estudio CARISA valoró el efecto de añadir ranolazina o placebo en 823 pacientes con AP tratados con atenolol (50mg), amlodipino (5mg) o diltiazem (180mg) que seguían sintomáticos. Tanto la dosis de 750mg como la de 1.000mg de ranolazina prolongaron el tiempo de ejercicio y disminuyeron los episodios de angina respecto a placebo36.
En el estudio ERICA se aleatorizó a 565 pacientes con AP que persistían sintomáticos o con isquemia objetivada con pruebas de imagen a pesar del tratamiento con amlodipino 10mg/día. La ranolazina 1.000mg dos veces al día consiguió disminuir el número de episodios de angina y la necesidad de nitroglicerina sublingual en comparación con placebo37.
Recientemente se han publicado algunos estudios clínicos muy sugerentes pero que se deben valorar con cautela, dado el escaso número de pacientes. Así, Figueredo et al38 comprobaron una mejora en la función sistólica y diastólica en 22 pacientes con angina tras 2 meses con ranolazina. Mehta et al39 han publicado un estudio aleatorizado y controlado con placebo en 20 mujeres diagnosticadas de angina microvascular. Además de una mejoría sintomática, la ranolazina disminuyó la isquemia miocárdica evaluada con cardiorresonancia. Por último, Greene et al40 han comprobado la eficacia clínica de ranolazina en 18 pacientes con angina refractaria a pesar de revascularización previa y tratamiento previo con bloqueadores beta (94%), nitratos (83%) y antagonistas del calcio (61%).
Ranolazina y comorbilidadesLa DM es una de las comorbilidades más frecuentemente relacionada con la CIC (tabla 2). En un análisis post-hoc del estudio CARISA, se comprobó por vez primera una reducción significativa de la glucohemoglobina (HbA1c) con la ranolazina respecto a placebo. Las dosis de ranolazina 750 y 1.000mg dos veces al día redujeron la HbA1c un 0,48±0,18% y un 0,70±0,18% respectivamente41. Se observaron resultados similares en el estudio MERLIN-TIMI 36. Después de 4 meses de tratamiento con ranolazina o placebo, la HbA1c disminuyó significativamente tanto en los pacientes diabéticos como en los no diabéticos, siendo mayor el descenso en el grupo de diabéticos. Además, los pacientes diabéticos tuvieron mayor probabilidad de alcanzar una HbA1c < 7% al finalizar el tratamiento con ranolazina42. En un análisis posterior en pacientes con DM e hiperglucemia de moderada a grave (HbA1c, 8–10%) se repitieron los resultados favorables con ranolazina43, lo que indica que la respuesta puede estar relacionada con la concentración plasmática de glucosa basal.
Los efectos antiarrítmicos de la ranolazina también merecen un comentario. En un subanálisis preespecificado del estudio MERLINTIMI 36, se comprobó que entre los pacientes con ranolazina hubo durante la fase hospitalaria menor incidencia de arritmias ventriculares y taquicardias supraventriculares de más de 4 latidos y > 120lpm, sin menor incidencia de fibrilación auricular44. Sin embargo, Murdock et al45 consiguieron la reversión a ritmo sinusal en el 72% de los 18 pacientes con fibrilación auricular paroxística de menos de 48h de evolución a los que administraron 2 g de ranolazina. Por último, conviene destacar la experiencia preliminar en la prevención de la fibrilación auricular tras cirugía coronaria en un estudio retrospectivo con 111 pacientes tratados con ranolazina y 145 tratados con amiodarona. Presentaron la arritmia el 15% de los tratados con amiodarona y el 11% de los de ranolazina46.
De hecho, en una revisión reciente sobre ranolazina se comentan varios ensayos clínicos en marcha que aportarán datos sobre el papel de la ranolazina oral e intravenosa en diversos entornos cardiovasculares: arritmias auriculares y ventriculares, insuficiencia cardiaca, síndrome coronario agudo, DM y vasculopatía periférica47,48.
Propuesta final y conclusionesCreemos que los datos aportados sobre comorbilidades y su manejo, así como las posibilidades que abren los nuevos fármacos antianginosos, justifican el manejo que proponemos en la tabla 4.
Manejo de los fármacos antianginosos según comorbilidad.
| BB | ACa | Nitratos | Ivabradina | Ranolazina* | |
| Diabetes mellitus | Difícil control | OK | OK | OK | OK |
| EPOC | Cardioselectivos | OK | OK | OK | OK |
| IC | OK | Contraindicados | OK | OK | OK |
| FA | OK | OK | OK | No indicado | Datos preliminares |
| Hipotensión | Limitación | Limitación | Limitación | OK | OK |
ACa: antagonistas del calcio; BB: bloqueadores beta; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IC: insuficiencia cardiaca.
En cualquier caso, consideramos bien documentado que las comorbilidades empeoran el pronóstico y la calidad de vida de los pacientes con cardiopatía isquémica crónica y dificultan su manejo. A pesar de ello, el TMO recomendado por las guías de práctica clínica es la primera opción terapéutica.
Conflicto de interesesNinguno.