El hiperaldosteronismo primario es la causa de hipertensión arterial secundaria más frecuente. Las concentraciones de aldosterona elevadas producen daño cardiaco y mayor morbimortalidad cardiovascular, por lo que un diagnóstico precoz modificará su evolución. El objetivo es estudiar las características clínicas, la repercusión cardiaca y el riesgo cardiovascular en el hiperaldosteronismo primario.
MétodosSe estudió a 157 pacientes con este diagnóstico. Se revisó el motivo del estudio y las exploraciones complementarias, ecocardiograma incluido. Como comparador se utilizó una cohorte de 720 pacientes con hipertensión arterial esencial seguida en nuestra unidad.
ResultadosLos pacientes con hiperaldosteronismo eran más jóvenes que los hipertensos esenciales (56,9 ± 11,7 frente a 60 ± 14,4 años; p < 0,001) y tenían presiones arteriales previas al diagnóstico etiológico mayores (136 ± 20,6 frente a 156 ± 23,2 mmHg), más antecedentes de enfermedad cardiovascular precoz (el 25,5 frente al 2,2%; p < 0,001), mayor prevalencia de hipertrofia ventricular concéntrica (el 69 frente al 25,7%) y mayor riesgo cardiovascular. El tratamiento específico permitió el óptimo control de las presiones arteriales sistólica y diastólica (de 150,7 ± 23,0 y 86,15 ± 14,07 mmHg a 127,69 ± 15,3 y 76,34 ± 9,7 mmHg). Motivaron el estudio de hiperaldosteronismo: hipertensión resistente (33,1%), hipopotasemia (38,2%) y crisis hipertensivas (12,7%). Sólo el 4,6% de los pacientes llegaron remitidos desde atención primaria con diagnóstico de sospecha de hiperaldosteronismo.
ConclusionesDebe sospecharse hiperaldosteronismo en pacientes con hipertensión resistente, hipopotasemia o crisis hipertensivas. El diagnóstico de hiperaldosteronismo permite un mejor control de la presión arterial. La hipertrofia ventricular izquierda es la lesión de órgano diana más frecuente.
Palabras clave
La aldosterona, principal y más potente hormona mineralocorticoide en el ser humano, se sintetiza en la corteza de la glándula adrenal a partir del colesterol1 y es la responsable fisiológica del balance electrolítico renal2. En el individuo sano, la aldosterona mantiene entre sus efectos el óptimo equilibrio que permite mantener saludable el sistema vascular. Sin embargo, cuando este está dañado, los efectos beneficiosos de la aldosterona se pierden y predominan los deletéreos para el sistema vascular, por lo que se producen disfunción orgánica3 e hipertensión arterial (HTA).
Actualmente la prevalencia del hiperaldosteronismo primario (HAP) es mucho más elevada que lo previamente aceptado, menos del 1% de la población hipertensa, y se asume que en consultas especializadas puede ser superior al 10%4. La prevalencia de HAP que se ha comunicado en España está entre el 5,1 y el 6%5,6 en unidades de medicina interna y cardiología.
El HAP es la más frecuente causa endocrina de HTA secundaria7. Bajo este epígrafe se conoce una variedad de alteraciones caracterizadas por producción elevada de aldosterona, relativamente autónoma del sistema renina-angiotensina-aldosterona y que no se suprime con la sobrecarga de sodio8. Esta sobreproducción de aldosterona ocasiona daño en el sistema cardiovascular, supresión de renina plasmática, HTA, retención de sodio y excreción de potasio que conduce a hipopotasemia. La exposición prolongada a elevadas concentraciones plasmáticas de aldosterona se asocia con mayor estrés oxidativo, remodelado cardiovascular, hipertrofia y fibrosis9. Esta hormona también está implicada en la síntesis de colágeno, y produce remodelación vascular y fibrosis miocárdica, en un proceso independiente de su efecto en la presión arterial (PA)10,11.
Todo lo anterior se traduce en la mayor morbimortalidad cardiovascular que los pacientes con HAP tienen comparados con pacientes hipertensos esenciales apareados por edad, sexo y PA12.
Además, la aldosterona tiene un papel importante en el metabolismo hidrocarbonado, con efectos directos en las células beta pancreáticas13 y la señalización de la insulina14, con lo que contribuye, mediante la disfunción endotelial, al síndrome metabólico, que a su vez ejerce su efecto en el desarrollo de la HTA refractaria y la enfermedad cardiovascular15. De hecho, en el HAP se ha documentado mayor frecuencia de casos de síndrome metabólico16.
Por todas estas causas, algunos autores postulan que es necesario realizar estudio de cribado a todos los pacientes hipertensos17, incluso en el contexto de HTA leve, sin hipopotasemia ni antecedentes familiares, debido a que, cuanto más se retrase el diagnóstico, más larga es la exposición a elevadas concentraciones de aldosterona y mayor la posibilidad de sufrir cambios morfológicos irreversibles.
Clásicamente se ha asumido que el HAP es una enfermedad poco frecuente, de evolución benigna y que se sospecha sólo en presencia de hipopotasemia. Este perfil ha cambiado sustancialmente a raíz de los trabajos publicados en los últimos años. Su prevalencia puede llegar al 10% entre los hipertensos4 y se ha descrito que la hipopotasemia está presente en aproximadamente la mitad de los casos de HAP y que el riesgo cardiovascular de los pacientes es mayor10,11.
ObjetivosDada la importancia de esta causa secundaria de HTA y los pocos estudios publicados sobre el tema, nos propusimos:
- •
Conocer las características de los pacientes con HAP, en lo referente al motivo del estudio etiológico, cuadro clínico y bioquímico, el patrón morfológico y el perfil evolutivo que presentaban los pacientes diagnosticados de esta enfermedad en la Unidad de HTA (UHTA) del Hospital Clínico San Carlos (Madrid).
- •
Valorar el daño cardiaco y renal y el riesgo cardiovascular de los pacientes con HAP.
- •
Comparar el perfil clínico de los pacientes con HAP con una cohorte de hipertensos esenciales de nuestra UHTA.
Se trata de un estudio retrospectivo en el que se seleccionó a 172 pacientes de la UHTA, con diagnóstico de HAP desde 1983 hasta marzo del 2010. De los 172 pacientes seleccionados, se incluyó en el estudio a 157 que cumplían los siguientes criterios de inclusión para el diagnóstico de HAP: a) concentración de aldosterona por encima de la media, con actividad plasmática de renina suprimida y cociente de concentración de aldosterona (ng/dl)/renina (pg/dl) > 38, con demostración de anatomía de las glándulas adrenales patológica mediante técnicas de imagen (hiperplasia o adenoma); b) demostración de actividad funcional a pesar de supresión farmacológica mediante gammagrafía con colesterol marcado, o c) en caso de valoración de tratamiento quirúrgico, demostración de lateralización en la secreción de aldosterona en la toma de muestras de venas adrenales con determinación de concentración de aldosterona y de cortisol, previa a procedimiento invasivo.
Como comparador se utilizó una población de 720 pacientes hipertensos esenciales18 como representación de la población hipertensa seguida en nuestra UHTA.
Se excluyó a los pacientes de los que faltaban datos completos de la determinación de renina/aldosterona circulante o la prueba de imagen, que ocurrió en 15 casos.
La determinación de la PA en la consulta se realizó con aparatos validados y por personal entrenado siguiendo las normas propuestas por la Sociedad Europea de Hipertensión19. Se registraron las PA tanto a la llegada a la UHTA como en la visita posterior al diagnóstico tras instauración de tratamiento específico. Se recogieron de la historia clínica los datos biográficos y antropométricos, los antecedentes personales y familiares de enfermedad cardiovascular y de factores de riesgo, así como el tiempo desde el diagnóstico de HTA. Además, se registró el motivo para el estudio de HTA secundaria que finalizó con el diagnóstico de HAP y si el médico de cabecera había derivado al paciente a la UHTA por sospecha de HAP.
Se registraron las exploraciones complementarias realizadas en la UHTA con las determinaciones analíticas al uso de función renal, perfil glucémico, perfil lipídico, determinación de sodio y potasio séricos y en orina de 24 h. Además, se recogieron los datos del ecocardiograma realizado en el Laboratorio de Ecocardiografía del Hospital Clínico San Carlos, con determinación de morfología del ventrículo izquierdo. Se consideró hipertrofia concéntrica del ventrículo izquierdo en el ecocardiograma cuando el grosor relativo de la pared fuera > 0,44 y el índice de masa ventricular izquierda, > 125 g/m2 (índice de masa ventricular izquierda normal, < 125 y grosor relativo de la pared < 0,44). Se diagnosticó remodelado concéntrico cuando el índice de masa ventricular izquierda fuera < 125 y el grosor relativo de la pared, > 0,44; finalmente, se consideró hipertrofia ventricular izquierda (HVI) excéntrica si el índice de masa ventricular izquierda era > 125 y el grosor relativo de la pared, < 0,4420.
Las concentraciones plasmáticas de aldosterona y renina se determinaron en todos los pacientes después de suspender los fármacos antialdosterónicos, al menos con 4 semanas de antelación a la obtención de la muestra. Cuando fue posible se realizó la determinación sin tratamiento farmacológico, y cuando no fue posible la retirada del tratamiento (HTA refractaria), se administraron fármacos que aumentasen el valor predictivo positivo del cociente (inhibidores de la enzima de conversión de la angiotensina, antagonistas del receptor de la angiotensina II, antagonistas del calcio). Las muestras de sangre para estas determinaciones se extrajeron de pacientes en régimen ambulatorio y en condiciones basales tras 15 min de reposo. Antes de la determinación, se administró suplementación con potasio oral a los pacientes que presentaban hipopotasemia. Si el cociente entre la aldosterona plasmática y la concentración plasmática de renina era > 38, con cifras de aldosterona elevadas, se proseguía con el estudio etiológico.
A continuación se realizaba el estudio morfológico de las glándulas suprarrenales, mediante tomografía computarizada o gammagrafía con NP-59, es decir, 6β-[I-131] yodometil-19-norcolesterol, previa supresión con dexametasona. Considerando el resultado de las pruebas de imagen y según lo expuesto en la guía de consenso de la Sociedad de Endocrinología4, la población con HAP se subdividió en tres categorías: adenoma, hiperplasia simple e hiperplasia nodular.
Después del estudio morfológico, se realizaba venografía con toma de muestras de venas adrenales cuando había sospecha de lateralización, y se valoraba la posibilidad de tratamiento invasivo (quirúrgico o ablación por radiofrecuencia). Se respetaron los requisitos de tratamiento farmacológico y de normopotasemia similares al realizado antes del estudio hormonal.
Para la estratificación del riesgo cardiovascular, se utilizó la tabla de la Sociedad Europea de Hipertensión/Sociedad Europea de Cardiología19 y se aplicaron los criterios del Adult Treatment Panel III para el diagnóstico del síndrome metabólico21.
El estudio fue aprobado por el Comité Ético del Hospital Clínico San Carlos y se siguieron las normas de buenas prácticas clínicas.
Análisis estadísticoEl análisis estadístico se llevó a cabo mediante sus frecuencias o porcentajes en el caso de variables cualitativas y con media ± desviación estándar o error estándar en el caso de las cuantitativas.
La comparación de variables cualitativas se efectuó mediante la prueba de la χ2. La comparación de variables cuantitativas se determinó mediante: a) la t de Student cuando la variable tenía dos categorías, y b) test de ANOVA cuando tenía más de dos. La t de Student y el test de ANOVA se basan en la normalidad de las distribuciones y la homogeneidad de las varianzas. Estos supuestos fueron testados mediante las pruebas de Kolmogorov-Smirnov y de Levene respectivamente. Cuando no se cumplían estos supuestos se categorizó la variable en terciles y se aplicó el test no paramétrico de Kruskal-Wallis.
El análisis estadístico se realizó con el programa SPSS (versión 15.0). En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo I o error α < 0,05.
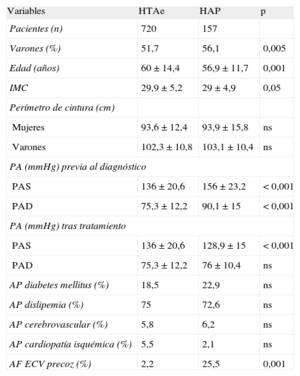
RESULTADOSLas características generales de nuestra población con HAP se describen en la tabla 1.
Características generales de la población con hiperaldosterismo primario y comparación con los hipertensos esenciales
| Variables | HTAe | HAP | p |
| Pacientes (n) | 720 | 157 | |
| Varones (%) | 51,7 | 56,1 | 0,005 |
| Edad (años) | 60 ± 14,4 | 56,9 ± 11,7 | 0,001 |
| IMC | 29,9 ± 5,2 | 29 ± 4,9 | 0,05 |
| Perímetro de cintura (cm) | |||
| Mujeres | 93,6 ± 12,4 | 93,9 ± 15,8 | ns |
| Varones | 102,3 ± 10,8 | 103,1 ± 10,4 | ns |
| PA (mmHg) previa al diagnóstico | |||
| PAS | 136 ± 20,6 | 156 ± 23,2 | < 0,001 |
| PAD | 75,3 ± 12,2 | 90,1 ± 15 | < 0,001 |
| PA (mmHg) tras tratamiento | |||
| PAS | 136 ± 20,6 | 128,9 ± 15 | < 0,001 |
| PAD | 75,3 ± 12,2 | 76 ± 10,4 | ns |
| AP diabetes mellitus (%) | 18,5 | 22,9 | ns |
| AP dislipemia (%) | 75 | 72,6 | ns |
| AP cerebrovascular (%) | 5,8 | 6,2 | ns |
| AP cardiopatía isquémica (%) | 5,5 | 2,1 | ns |
| AF ECV precoz (%) | 2,2 | 25,5 | 0,001 |
AF: antecedentes familiares; AP: antecedentes personales; ECV: enfermedad cardiovascular; HAP: hiperaldosteronismo primario; HTAe: hipertensión arterial esencial; IMC: índice de masa corporal; ns: no significativo; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Salvo otra indicación, los datos expresan media ± desviación estándar.
El tiempo medio de evolución de la HTA en estos pacientes era de 13,2 años y la prevalencia de fibrilación auricular crónica, del 4,8%. Había una importante carga familiar de HTA (56,9%) y diabetes mellitus (15,4%). En la familia, el 16,8% tenía antecedentes de eventos cerebrovasculares precoces y el 15,4%, de cardiopatía isquémica precoz.
De los resultados del ecocardiograma, disponible en 126 pacientes de la serie, el hallazgo más frecuente es la HVI concéntrica, que apareció en un 69% de los casos; el 25,4% eran normales, el 1,4% tenía remodelado y el 4,2%, hipertrofia excéntrica, es decir, el 74,6% tenía alteraciones en la morfología del ventrículo izquierdo.
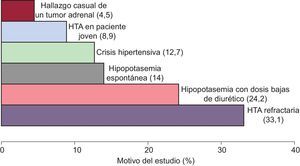
Respecto al motivo por el que se realizó el estudio, la causa más frecuente fue la HTA refractaria (33,1%), seguida de la hipopotasemia (38,2%; el 14% espontánea y el 24,2% inducida por dosis baja de diuréticos, 12,5 o 25 mg de hidroclototiazida) (fig.).
De los pacientes diagnosticados, solo el 4,6% venía derivado desde atención primaria por sospecha de HAP.
La media del potasio antes de llegar al diagnóstico etiológico fue de 3,42 ± 0,61 mmol/l (normal, 3,5-5,1 mmol/l); el potasio sérico tras tratamiento específico, 4,33 ± 0,51 mmol/l; sodio sérico, 140 ± 3 mmol/l (normal, 135-145 mmol/l); sodio en orina, 136 ± 73 mmol/24 h, y potasio en orina, 65,7 ± 28 mmol/24 h. La concentración plasmática media de renina fue 4,4 ± 3,0 pg/ml (normal, 3,0-33 pg/ml). La concentración sérica de aldosterona, 305 ± 260,7 pg/ml (normal, 97-626 pg/ml). El cociente medio aldosterona/renina fue de 425 ± 1.301,4 (normal, < 38).
Para el diagnóstico con pruebas de imagen, la técnica más utilizada fue la tomografía computarizada, que se realizó al 83,4% de los pacientes. Según esta técnica, la imagen más frecuente es la hiperplasia nodular, que se diagnostica al 38,9%, seguida por el adenoma (28,3%) y la hiperplasia simple (25,9%).
Se realizaron 77 (49%) gammagrafías con colesterol marcado tras supresión con dexametasona, y el diagnóstico más frecuente con esta técnica fue la hiperplasia simple bilateral (el 51,9% de los casos).
Para el diagnóstico final, en más de un tercio de la población (34,4%), se completó el estudio con una venografía adrenal con toma de muestras para determinación de aldosterona y cortisol. Tras completar el estudio diagnóstico (pruebas de imagen, gammagrafía y venografía), los diagnósticos asumidos como definitivos fueron: adenoma (17,4%), hiperplasia simple única (5,8%), hiperplasia simple bilateral (31,6%), hiperplasia nodular unilateral (10,9%) e hiperplasia nodular bilateral (34,2%).
La venografía modificó el diagnóstico en el 46,3%. Así, en el diagnóstico final se puede observar que hay mayor frecuencia de afección bilateral (65,8%), con una prevalencia de adenomas del 17,4%.
En la tabla 1 se comparan las características clínicas entre los pacientes con HAP y los de la cohorte de pacientes hipertensos esenciales. Respecto a la población con pacientes hipertensos esenciales seguidos en la UHTA, los pacientes con HAP son más jóvenes y tienen mayor PA antes del diagnóstico etiológico, mejor control tras la instauración del tratamiento específico y más antecedentes familiares de enfermedad cardiovascular precoz, con diferencias estadísticamente significativas.
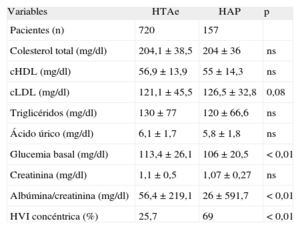
En la tabla 2 se muestra la comparativa del perfil bioquímico y de lesión de órgano diana entre ambas cohortes. Los pacientes con HAP presentan una prevalencia de lesión cardiaca de órgano diana significativamente mayor.
Comparación del perfil bioquímico y de la lesión de órgano diana entre la cohorte de hipertensos esenciales y los pacientes con hiperoaldosterismo primario
| Variables | HTAe | HAP | p |
| Pacientes (n) | 720 | 157 | |
| Colesterol total (mg/dl) | 204,1 ± 38,5 | 204 ± 36 | ns |
| cHDL (mg/dl) | 56,9 ± 13,9 | 55 ± 14,3 | ns |
| cLDL (mg/dl) | 121,1 ± 45,5 | 126,5 ± 32,8 | 0,08 |
| Triglicéridos (mg/dl) | 130 ± 77 | 120 ± 66,6 | ns |
| Ácido úrico (mg/dl) | 6,1 ± 1,7 | 5,8 ± 1,8 | ns |
| Glucemia basal (mg/dl) | 113,4 ± 26,1 | 106 ± 20,5 | < 0,01 |
| Creatinina (mg/dl) | 1,1 ± 0,5 | 1,07 ± 0,27 | ns |
| Albúmina/creatinina (mg/dl) | 56,4 ± 219,1 | 26 ± 591,7 | < 0,01 |
| HVI concéntrica (%) | 25,7 | 69 | < 0,01 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; HAP: hiperaldosteronismo primario; HTAe: hipertensión arterial esencial; HVI: hipertrofia ventricular izquierda; ns: no significativo.
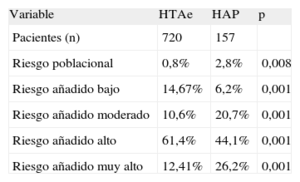
En la tabla 3 se muestra la comparación del perfil de riesgo cardiovascular entre ambas cohortes. Como puede verse, los pacientes con HAP se sitúan en las bandas más altas de la estratificación del riesgo.
Comparación de la distribución del riesgo cardiovascular entre los hipertensos esenciales seguidos en la Unidad de Hipertensión Arterial y los pacientes diagnosticados de hiperaldosteronismo primario (valorados según la guía SEC/SEH 2007)20
| Variable | HTAe | HAP | p |
| Pacientes (n) | 720 | 157 | |
| Riesgo poblacional | 0,8% | 2,8% | 0,008 |
| Riesgo añadido bajo | 14,67% | 6,2% | 0,001 |
| Riesgo añadido moderado | 10,6% | 20,7% | 0,001 |
| Riesgo añadido alto | 61,4% | 44,1% | 0,001 |
| Riesgo añadido muy alto | 12,41% | 26,2% | 0,001 |
HAP: hiperaldosteronismo primario; HTAe: hipertensión arterial esencial.
Durante los últimos años han aumentado las publicaciones sobre la causa más frecuente de HTA secundaria, el HAP7, lo que puede deberse a que su diagnóstico ha aumentado de manera significativa al disponerse de métodos diagnósticos más sencillos4.
Nuestro estudio aporta, y por ello es una de sus fortalezas, la valoración exhaustiva de la serie de un registro unicéntrico más numerosa de las publicadas12,22,23. En España, pocos han sido los estudios publicados sobre la materia5,6, por lo que nuestra cohorte aporta información de gran interés para el conocimiento no sólo de sus características clínicas y de daño orgánico, sino también de sus formas de presentación y la valoración del riesgo cardiovascular.
La población hipertensa que habría que evaluar para descartar HAP está en debate7. Según algunos expertos, ciertos grupos de pacientes tienen mayor prevalencia de HAP y deberían ser los estudiados: los grados de HTA moderada/grave22, la HTA resistente24, la HTA asociada a hipopotasemia, espontánea o inducida por diuréticos8,25,26, la HTA asociada al hallazgo casual de un tumor adrenal25, la HTA asociada a antecedentes familiares de HTA de inicio temprano o a ictus a edad temprana (< 50 años)25, y en familiares de primer grado de pacientes diagnosticados de HAP4. En nuestra serie, se confirma el HAP como una causa muy frecuente de HTA resistente (33,1%). También es una causa que descartar siempre que haya hipopotasemia espontánea o inducida por dosis bajas de diuréticos (38,2%).
Un hallazgo de importancia es la evolución en forma de crisis hipertensivas que presenta el 12,7% de estos pacientes y que no se había descrito previamente en la bibliografía, aunque sí la relación con emergencias hipertensivas en una serie de sólo 7 pacientes27.
Su aparición en hipertensos menores de 40 años (8,9%) indica que se trata de una entidad que sospechar también en estos grupos de población que no muestran clínica sospechosa de otro secundarismo. Coincidimos con lo comunicado por Mosso et al22 en que los hipertensos con HAP son más jóvenes que los pacientes con HTA esencial, dato importante pues, al tratarse de una población con una expectativa de vida prolongada, su curación o, al menos, la instauración de un tratamiento específico les aportará un beneficio clínico importante.
En el reciente estudio de Scheuner et al28, se ha demostrado que la valoración de antecedentes familiares de cardiopatía isquémica puede incrementar el valor predictivo positivo de determinadas estimaciones de riesgo, argumentando que subyace una agrupación de factores de riesgo genéticos, a los que, una vez identificados, se podrá aplicar tests genéticos. Así, en nuestra población cobran más relevancia los antecedentes familiares de enfermedad cardiovascular precoz, puesto que pueden indicar un estrato genético común.
A pesar del aumento de prevalencia del HAP, en nuestro país sigue siendo poco sospechado, como refleja el bajo porcentaje (4,6%) de pacientes derivados con sospecha de HAP a la UHTA desde primaria. Esto podría estar justificado por la dificultad de realizar un cribado sistemático en atención primaria29, la variabilidad en la presentación clínica del HAP, el alto coste del estudio y la aceptación generalizada de la espironolactona como cuarto fármaco en los pacientes con HTA resistente, que controlaría muchos casos de HAP30.
En nuestro trabajo, a pesar de la menor edad de los pacientes con HAP, la PA es más elevada antes del diagnóstico etiológico que la de los hipertensos esenciales, y tras el diagnóstico se consigue un mejor control que en estos, lo que concuerda con los datos publicados en otras series22,31,32.
De la lesión de órgano diana de los pacientes con HAP, destaca la elevada prevalencia de HVI valorada por ecocardiograma, resultado congruente con el comunicado por Morillas et al6, lo que puede estar justificado por el efecto deletéreo de las elevadas concentraciones de aldosterona que, actuando en tejido miocárdico, produce hipertrofia y fibrosis11. Por lo observado, la asociación entre HVI y HAP es muy estrecha, por lo que, desde nuestro punto de vista, la presencia de HVI no justificada por la PA debería aconsejar el estudio etiológico.
Se ha descrito el papel deletéreo de la aldosterona en el metabolismo hidrocarbonado14. Nuestros pacientes presentan menor glucemia basal que los hipertensos esenciales, lo que coincide con los resultados de Matrozova et al33 y es contrario a los datos publicados previamente34,35.
Respecto a la similitud en el perfil lipídico, nuestros datos coinciden con los publicados por otros autores33,35,36. Holaj et al35 sí encontraron cifras estadísticamente inferiores de colesterol unido a lipoproteínas de alta densidad en los pacientes con HAP.
Los pacientes con HAP tienen un claro aumento de su riesgo cardiovascular, al igual que ocurre con los sujetos de nuestra cohorte, cuando se los compara con la HTA esencial, dato aceptado en la bibliografía4,12,37. Esta diferencia aparece a pesar de que la población con HAP es más joven y que se la compara con una cohorte de hipertensos seguidos en una unidad terciaria de HTA, con un riesgo cardiovascular superior al de otras poblaciones de hipertensos.
Este aumento de riesgo probablemente se relacione con los efectos deletéreos que produce la exposición prolongada a elevadas concentraciones de aldosterona12, y se da pese a la menor prevalencia de síndrome metabólico en la población con HAP comparada con la población de hipertensos esenciales18 (datos no mostrados).
Fortalezas y limitacionesEste trabajo tiene las limitaciones inherentes a los estudios retrospectivos. La serie se ha recogido durante 25 años, por la baja prevalencia de la enfermedad. La fortaleza del estudio es el elevado número de casos recogidos. En cuanto a la comparación entre hipertensos esenciales y los casos, los resultados serían más sólidos si se hubiese realizado como un estudio de casos y controles; no obstante, 720 pacientes con HTA esencial son representativos de la población seguida en nuestra UHTA.
CONCLUSIONESEs esencial una actitud más activa en el estudio etiológico de los pacientes con HTA que presenten hipopotasemia espontánea o secundaria a dosis bajas de diuréticos o HTA resistente y también en hipertensos que en su evolución hayan sufrido episodios repetidos de crisis hipertensivas.
Más del 70% de los pacientes con HAP tienen HVI.
El tratamiento etiológico del HAP, reduciendo la exposición a elevadas concentraciones de aldosterona, permite llevar a los pacientes al óptimo control de la PA, lo que probablemente reduzca la HVI y el riesgo cardiovascular.
CONFLICTO DE INTERESESNinguno.