En la diabetes mellitus, la insuficiencia renal, las dislipemias genéticas o las enfermedades autoinmunes se produce una aterosclerosis prematura y una progresión acelerada de esta enfermedad. Por ello, se consideran situaciones de alto riesgo cardiovascular en las que se necesita adoptar estrategias de prevención que incluyan unos objetivos más estrictos. En todas ellas existen alteraciones cualitativas y cuantitativas de las lipoproteínas plasmáticas que pueden corregirse parcialmente modificando el estilo de vida y adoptando hábitos saludables, si bien en general va a ser necesario recurrir a medidas farmacológicas. Las estatinas son fármacos eficaces para disminuir el colesterol y, en menor proporción, los triglicéridos. Además, aumentan moderadamente el colesterol unido a lipoproteínas de alta densidad y disminuyen la incidencia de enfermedad cardiovascular aterosclerótica, por lo que se los considera medicamentos de primera elección en el tratamiento de la dislipemia aterogénica. El control de los demás factores de riesgo cardiovascular ha de ser sistemático.
Palabras clave
colesterol unido a lipoproteínas de alta densidad
colesterol unido a lipoproteínas de baja densidad
enfermedad cardiovascular aterosclerótica
factor de riesgo cardiovascular
riesgo cardiovascular
triglicéridos
La arteriosclerosis y sus consecuencias, principalmente la enfermedad coronaria y el accidente cerebrovascular, son la principal causa de muerte en Occidente y una importante causa de discapacidad.
En Europa, la enfermedad cardiovascular aterosclerótica (ECVA) sigue siendo la principal causa de muerte prematura en ambos sexos y su prevalencia va en aumento, en parte debido al envejecimiento poblacional. A pesar de ello, hay que destacar que al ajustar por edad, la tasa de fallecimientos por ECVA se ha reducido significativamente, debido a los avances terapéuticos, pero aún más por el progreso en la detección y el control de algunos factores de riesgo cardiovascular (FRCV), particularmente el tabaquismo, la hipercolesterolemia y la hipertensión arterial1.
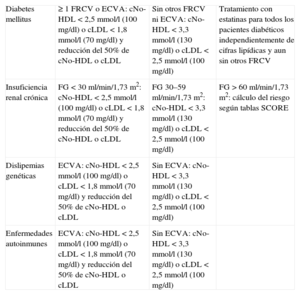
Según la Organización Mundial de la Salud (OMS), tres cuartas partes de las muertes por ECVA podrían evitarse con adecuadas modificaciones en el estilo de vida, no solo de los pacientes de alto riesgo cardiovascular (RCV), sino en el conjunto poblacional. En las últimas décadas ha aumentado la prevalencia de obesidad y diabetes mellitus (DM), en gran medida debido a la alimentación inadecuada y al sedentarismo, y ambas entidades alcanzan proporciones epidémicas. En la tabla se sintetizan los objetivos terapéuticos en el tratamiento de la hipercolesterolemia en distintas situaciones clínicas y atendiendo al grado de riesgo vascular y los antecedentes de enfermedad cardiovascular ateromatosa, los cuales se describen en el presente artículo.
Objetivos terapéuticos de la hipercolesterolemia en distintas situaciones clínicas y según el grado de riesgo vascular o los antecedentes de enfermedad cardiovascular ateromatosa
| Diabetes mellitus | ≥ 1 FRCV o ECVA: cNo-HDL < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l (70mg/dl) y reducción del 50% de cNo-HDL o cLDL | Sin otros FRCV ni ECVA: cNo-HDL < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl) | Tratamiento con estatinas para todos los pacientes diabéticos independientemente de cifras lipídicas y aun sin otros FRCV |
| Insuficiencia renal crónica | FG < 30ml/min/1,73m2: cNo-HDL < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l (70mg/dl) y reducción del 50% de cNo-HDL o cLDL | FG 30–59ml/min/1,73m2: cNo-HDL < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl) | FG > 60ml/min/1,73m2: cálculo del riesgo según tablas SCORE |
| Dislipemias genéticas | ECVA: cNo-HDL < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l (70mg/dl) y reducción del 50% de cNo-HDL o cLDL | Sin ECVA: cNo-HDL < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl) | |
| Enfermedades autoinmunes | ECVA: cNo-HDL < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l (70mg/dl) y reducción del 50% de cNo-HDL o cLDL | Sin ECVA: cNo-HDL < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl) |
cLDL: colesterol unido a lipoproteínas de baja densidad; cNo-HDL: colesterol unido a lipoproteínas no de alta densidad; ECVA: enfermedad cardiovascular aterosclerótica; FG: filtrado glomerular; FRCV: factor de riesgo cardiovascular.
La DM se define por alteraciones en el metabolismo de la glucosa y una predisposición al daño tisular macrovascular y microvascular2. La DM es en sí misma un FRCV de primer orden. La DM tipo 2 se suele asociar a obesidad y a factores propios del síndrome metabólico, hecho que multiplica el RCV. Los pacientes diabéticos tienen el doble de riesgo de sufrir un infarto agudo de miocardio o un ictus que la población general2, y se postula que hasta un 80% de ellos fallecen de ECVA3.
En el paciente diabético, el control glucémico es fundamental para disminuir las complicaciones macrovasculares, y se ha establecido como un objetivo razonable lograr que la glucohemoglobina (HbA1c) sea < 7%. Para los pacientes con diagnóstico reciente de DM y esperanza de vida larga sin antecedentes de ECVA, se recomienda alcanzar valores de HbA1c < 6,5%, mientras que para diabéticos ancianos, pacientes con ECVA o que presentan determinadas comorbilidades, se consideran razonables unos objetivos de HbA1c < 8%4.
La reducción del colesterol unido a lipoproteínas de baja densidad (cLDL) en los diabéticos disminuye el RCV de manera independiente del control glucémico.
La dislipemia de los pacientes con DM2, también conocida como dislipemia aterogénica, se caracteriza por la tríada constituida por la elevación de triglicéridos (TG), la reducción del colesterol unido a lipoproteínas de alta densidad (cHDL) y un predominio de las partículas de cLDL pequeñas y densas con potencial aterogénico aumentado, pero a concentraciones que suelen ser normales o moderadamente elevadas5.
La resistencia periférica a la acción de la insulina, principal mecanismo etiopatogénico de la DM2, es la causa inmediata de dichas alteraciones. En circunstancias fisiológicas, la insulina inhibe la lipolisis en el tejido adiposo y activa la lipoproteinlipasa (LPL), que es la enzima que interviene en el aclaramiento plasmático de los TG de las lipoproteínas de muy baja densidad (VLDL) y los quilomicrones (QM).
La resistencia a la insulina en las primeras etapas y, posteriormente, el desarrollo de insulinopenia incrementan la lipolisis de los TG de los adipocitos; así, aumentan las concentraciones de ácidos grasos libres (AGL) en plasma que llegan al hígado. Estos son metabolizados para producir TG, que se excretan a la sangre mediante las VLDL. La hipertrigliceridemia diabética es consecuencia del aumento de la producción hepática de VLDL y la deficiente actividad de la LPL.
Las HDL también sufren modificaciones en su concentración plasmática y su composición, haciéndose más ricas en TG y más pobres en colesterol. La proteína transferidora de ésteres de colesterol (CETP) intercambia TG desde las VLDL a las HDL y genera unas HDL anormalmente enriquecidas en TG. Cuando llegan al hígado, estas HDL son metabolizadas por la lipasa hepática que hidroliza sus TG y las transforma en unas partículas más pequeñas y densas, con reducida capacidad antioxidante, antiinflamatoria y antiaterogénica respecto a las HDL normales6,7, que sufren un catabolismo acelerado. Estas HDL tienen mermada su capacidad para eliminar el colesterol de la pared arterial y transportarlo hacia el hígado, es decir, realizan un menor transporte inverso del colesterol.
De modo fisiológico, existen partículas de LDL de distintos tamaños y densidades, con predominio de las más grandes y menos densas (patrón A); conforme aumentan los TG, se incrementa la proporción de LDL pequeñas y densas (patrón B) con mayor potencial aterogénico. Estas LDL tienen menor afinidad por su receptor, con lo que permanecen más tiempo en la circulación sanguínea. Estas partículas se oxidan con mayor rapidez y se unen más fácilmente a los proteoglucanos de la íntima arterial, con el consiguiente incremento de su ritmo de entrada en las arterias, lo que genera un mayor daño aterosclerótico. Por lo tanto, una determinada concentración de colesterol plasmático en el paciente diabético se asocia a mayor RCV del que correspondería a la población no diabética, puesto que las partículas de LDL en los pacientes diabéticos son más aterogénicas.
En la DM1 existe insulinopenia, pero sin resistencia a la insulina, por lo que, como consecuencia de lo explicado, el metabolismo lipídico se normaliza si hay un buen control glucémico.
Las alteraciones lipídicas aparecen en las situaciones de descompensación aguda y la hiperglucemia crónica. En estos periodos, la lipolisis del tejido adiposo es estimulada por la ausencia de insulina y la liberación de adrenalina y glucagón, lo cual origina un aumento de la producción de AGL para compensar la carencia de glucosa en los tejidos. Por un lado, se incrementa la producción de VLDL y, por otro, se inactiva la LPL por el déficit de insulina. El resultado es un incremento de los TG en sangre que, si supera el umbral de la hiperquilomicronemia, puede ser causa de pancreatitis. En relación con ello, en esta situación se han descrito bajas concentraciones de cHDL.
Es recomendable realizar una primera determinación del perfil lipídico tras 8 h de ayuno para objetivar el colesterol total, el cLDL, el cHDL y los TG en el momento del diagnóstico de DM; posteriormente, con frecuencia anual/bianual o cada 3–6 meses si hemos iniciado un tratamiento hipolipemiante.
El cLDL se puede medir de manera directa, pero habitualmente se calcula utilizando la ecuación de Friedewald. No obstante, este cálculo solo es válido si las concentraciones de TG son < 4,5mmol/l o 400mg/dl, ya que a partir de TG > 200mg/dl se produce una pérdida progresiva de la precisión de la ecuación que da lugar a subestimación del valor de cLDL.
El colesterol no unido a HDL (cNo-HDL) se calcula restando el cHDL al colesterol total, e indica el conjunto del colesterol transportado por las lipoproteínas con apolipoproteína B, que son las lipoproteínas con potencial aterogénico, es decir las LDL, IDL y VLDL. Por ello, se considera que el cNo-HDL es mejor predictor de RCV en dichos pacientes con TG elevados8–10. Los objetivos del cNo-HDL son los que corresponden a sumar 0,8mmol (30mg/dl) a los valores objetivo de cLDL.
Según las recientes recomendaciones de la guía europea, todas las personas diabéticas, tanto con DM1 como con DM2, aun sin FRCV ni lesión de órgano diana –es decir, sin ECVA establecida (prevención primaria)–, deben ser consideradas pacientes de alto RCV, y se marcan para ellos unos objetivos de cNo-HDL < 3,3mmol/l (130mg/dl), lo que corresponde a unos valores de cLDL < 2,5mmol/l (100mg/dl).
Los pacientes diabéticos con uno o más FRCV o evidencia de ECVA establecida (incluida lesión de órgano diana; p. ej., microalbuminuria > 30/300mg/24 h) se consideran de muy alto RCV, y los límites recomendados de cNo-HDL son < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l (70mg/dl). Si no se puede alcanzar dichos valores, se considera adecuada una reducción ≥ 50% del cNo-HDL o el cLDL1.
En la guía de AHA/ACC de 2013, se propone el control de la dislipemia atendiendo a los porcentajes de reducción del cLDL, en lugar de fijar un objetivo final. En ellas, las estatinas se clasifican en una categoría de moderada intensidad, disminuyendo el cLDL un 30–50%, y otra de alta intensidad, con reducciones incluso ≥ 50%, incluidas solamente la atorvastatina 40–80mg/día y la rosuvastatina 20–40mg/día. En la guía de AHA/ACC son subsidiarios de tratamiento con estatinas de alta intensidad los pacientes con ECVA establecida (prevención secundaria), considerando ECVA el síndrome coronario agudo, el infarto de miocardio, la angina estable/inestable, la revascularización arterial, el ictus, el accidente isquémico transitorio y la enfermedad arterial periférica. A los pacientes diabéticos de 40–75 años con cLDL entre 1,7 y 4,9mmol/l (70–189mg/dl) sin ECVA (prevención primaria) se los considera candidatos a recibir tratamiento con estatinas de moderada intensidad11.
Por último, la American Diabetes Association (ADA) justifica el tratamiento con estatinas en todos los grupos anteriormente citados independientemente de las cifras de cNo-HDL o cLDL basales4.
En resumen, los pacientes diabéticos presentan un elevado RCV, por lo que se debe controlar el cNo-HDL o el cLDL de manera más estricta que en la población general, lo que supone la administración de estatinas incluso con concentraciones lipídicas consideradas «normales» para la población general no diabética. La demostración de daño orgánico o lesión de órgano diana pone de manifiesto una situación de muy alto RCV en la que los esfuerzos han de dirigirse no solo al control lipídico y la consecución de objetivos, sino a la reducción de al menos un 50% del cNo-HDL o el cLDL usando estatinas de alta potencia.
La ADA y las sociedades europeas han establecido que, en la población de alto RCV, las concentraciones adecuadas de cHDL sean ≥ 1,1mmol/l (40mg/dl) para los varones y ≥ 1,3mmol/l (50mg/dl) para las mujeres, y las concentraciones de TG, < 1,7mmol/l (150mg/dl). Para los pacientes diabéticos que tras ser tratados con una estatina y alcanzar los objetivos de cLDL o cNo-HDL presentan unas concentraciones de cHDL o TG fuera de los mencionados valores, es razonable considerar la asociación de un segundo fármaco, en particular el fenofibrato, ya que es el más eficaz para disminuir los TG; además reduce la proporción de partículas de LDL pequeñas y densas y aumenta moderadamente el cHDL. En este sentido, la European Medicines Agency ha formulado unas recomendaciones en las que se considera razonable el uso de fenofibrato, además de medidas no farmacológicas para el tratamiento de la dislipemia mixta, para los pacientes de alto RCV que, una vez tratados con estatinas, mantengan unas concentraciones de cHDL y TG fuera de los valores de referencia12,13.
El fenofibrato para la dislipemia aterogénica, tanto en monoterapia como combinado con estatinas, ha mostrado un efecto favorable contra la macroangiopatía y la microangiopatía diabética, con un escaso perfil de efectos secundarios y una tolerabilidad adecuada14. En la población diabética con hipertrigliceridemia o déficit de cHDL, el fenofibrato ha disminuido la incidencia de ECVA, en particular la enfermedad coronaria no mortal, y ha mostrado un efecto favorable contra la microangiopatía, tanto con respecto a retinopatía como a nefropatía y enfermedad vascular periférica15.
Los pacientes con síndrome metabólico también son, en la mayoría de los casos, pacientes de alto RCV. En ellos concurren habitualmente obesidad, resistencia a la insulina, hipertensión y alteraciones del metabolismo de los TG y las HDL, variaciones físico-químicas y funcionales de las lipoproteínas y un estado proinflamatorio y protrombótico16. En un metanálisis de los principales estudios realizados sobre la relación entre el RCV y el síndrome metabólico, se observó que este incrementaba más de 2 veces el riesgo de padecer una enfermedad cardiovascular (riesgo relativo [RR] = 2,35; intervalo de confianza del 95% [IC95%], 2,02–2,73)17. En este sentido, en la última guía europea de prevención cardiovascular1 se recomienda que los pacientes con obesidad, hipertrigliceridemia o déficit de cHDL sean valorados como de mayor riesgo que el obtenido con las tablas SCORE. En un documento previo de las sociedades británicas elaborado como consenso de expertos, se advertía que la presencia de obesidad incrementa un 30% el RCV calculado con las tablas, y la glucosa basal alterada, un 50%18.
Insuficiencia renalLa insuficiencia renal crónica (IRC) ha sido ampliamente reconocida como entidad proaterogénica debido a los mecanismos de daño endotelial intrínsecos y a los FRCV que habitualmente la acompañan14. La microalbuminuria > 30–300mg/24h, considerada lesión de órgano diana en pacientes diabéticos, y la disminución del filtrado glomerular (FG) incrementan el RCV de modo proporcional a su gravedad, y llegan a suponer para los pacientes con FG < 15ml/min/1,73m2 o en diálisis un riesgo 10 veces mayor que para la población general. De manera práctica, podemos subdividir a los pacientes con IRC en tres grupos de estratificación de riesgo:
- •
Muy alto RCV: IRC grave con FG < 30ml/min/1,73m2 (estadio IV en adelante). Son pacientes en quienes la restricción ha de ser mayor para llegar a un cNo-HDL < 2,5mmol/l (100mg/dl) o cLDL < 1,8mmol/l o 70mg/dl, o una reducción ≥ 50% si no se llega a objetivo.
- •
Alto RCV: IRC moderada con FG 30–59ml/min/1,73m2 (estadio III) y sin ECVA establecida. Se plantean objetivos de cNo-HDL < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl).
- •
Riesgo habitual: IRC leve con FG > 60ml/min/1,73m2. Estos pacientes han de ser evaluados según su riesgo SCORE, del mismo modo que la población general.
El tratamiento con estatinas podría reducir hasta en un 23% los episodios cardiovasculares mayores sin un incremento significativo de los eventos adversos14. La seguridad y la eficacia de las estatinas en prevención cardiovascular para los pacientes con IRC moderada (grado III o superior) están bien demostradas en ensayos clínicos, especialmente en diabéticos con IRC19. La guía europea de dislipemia20 recomienda que en la IRC se utilicen estatinas de escasa eliminación renal, como atorvastatina (< 5%), fluvastatina (6%) o rosuvastatina (10%), la monitorización frecuente y el ajuste de dosis según el FG21.
Por otro lado, la información sobre el beneficio clínico y la seguridad de los fibratos para la población con IRC es escasa. Disponemos de datos de análisis agrupados sobre la eficacia y la seguridad del uso de estos fármacos en la IRC grado III, tanto en control de la dislipemia como en prevención de la ECVA y evolución de la función renal. En una revisión sistemática de 10 estudios con casi 17.000 sujetos22, se observó que en los pacientes con IRC ligera o moderada, los fibratos mejoraron el perfil lipídico, es decir, disminuyeron los TG (–0,56mmol/l; p=0,03), aumentaron el cHDL (0,06mmol/l; p=0,001) y redujeron el colesterol total (−0,32mmol/l; p=0,05), pero no el cLDL (−0,01mmol/l; p=0,83). Los fibratos aumentaron la creatinina sérica (33μmol/l; p < 0,001) y disminuyeron el FG estimado (−2,67ml/min/1,73m2; p=0,01), pero no se detectó un incremento del riesgo de insuficiencia renal terminal (RR=0,85; IC95%, 0,49–1,49; p=0,575). El aumento de creatinina inducido por los fibratos es reversible al interrumpir el tratamiento, según se ha observado en los estudios Field23 y ACCORD24, donde también se constata una disminución de la proteinuria y, por lo tanto, del RCV.
En la última guía de AHA/ACC11 se recomienda que, para los pacientes con FG 30–59ml/min/1,73m2, no se supere la dosis de fenofibrato de 54mg/día, y en la guía Kdigo25 se desaconseja su utilización. Paralelamente, la guía europea de dislipemia desaconseja el uso de fenofibrato en pacientes con FG < 50ml/min/1,73m2 y se acepta el uso de gemfibrozilo para pacientes con FG inferiores por su menor eliminación renal. Sin embargo, hay que tener en cuenta que el uso concomitante de gemfibrozilo y estatinas está contraindicado debido a las interacciones.
Según lo expuesto, puede afirmarse que actualmente no existen recomendaciones uniformes y consensuadas sobre el uso de fibratos en la IRC, aunque sí es común la advertencia para los pacientes con IRC grave y FG < 30ml/min/1,73m2, para los que se acepta que se debe evitar los fibratos. En este escenario, una alternativa a esta combinación sería la asociación de estatinas con ácido nicotínico (AN) o con ácidos grasos omega-3 (AGO3). No obstante, el AN se puede prescribir solamente mediante fórmula magistral y es de difícil utilización por sus efectos secundarios, y los AGO3, que tienen un escaso perfil de efectos secundarios y son seguros en el paciente con IRC, tienen un uso restringido a los pacientes con hipertrigliceridemia grave debido a su elevado coste.
Dislipemias genéticasLas alteraciones primarias en el metabolismo de los lípidos, como la hipercolesterolemia familiar, la hiperlipidemia familiar combinada, la hipertrigliceridemia familiar o la disbetaliproteinemia, conllevan por sí solas un elevado riesgo de ECVA, aun en ausencia de otros FRCV. Es fundamental la pronta identificación de estos pacientes mediante la anamnesis detallada de la historia familiar, el examen físico y los estudios de laboratorio26. La intervención farmacológica en prevención primaria ha de ser precoz, independientemente de que concurran o no otros FRCV, puesto que son pacientes de alto RCV. Así, en la última guía de prevención cardiovascular europea1, las dislipemias familiares, incluidas las que cursan con un patrón de dislipemia mixta debido a un incremento de las VLDL y LDL, como la hiperlipemia familiar combinada, y las dislipemias genéticas que se deben a aumento de las IDL de alto potencial aterogénico, como la disbetalipoproteinemia, se consideran situaciones de alto RCV. En ellas, además de lograr un control óptimo del cLDL y el cNo-HDL con una estatina en monoterapia o combinada con otro fármaco, es necesario considerar el control integral de la dislipemia5 incluyendo la disminución de la concentración de lipoproteínas ricas en colesterol (principalmente LDL e IDL) y TG (principalmente VLDL e IDL) y el aumento de la concentración de lipoproteínas antiaterogénicas (HDL)27. Para logarlo puede ser necesaria una terapia hipolipemiante combinada con una estatina y ezetimiba o resina en las hipercolesterolemias graves, o una estatina y un fibrato o AGO3 en el caso de las hiperlipemias mixtas. En general, se acepta que en las hiperlipemias genéticas de alto RCV el objetivo terapéutico de cNo-HDL sea < 3,3mmol/l (130mg/dl) o cLDL < 2,5mmol/l (100mg/dl). En un futuro cercano estarán disponibles los nuevos fármacos inhibidores de la proteína PCSK9, cuya administración a los pacientes que están en tratamiento con estatinas asocia descensos de cLDL y cNo-HDL > 50% y la consecución de los objetivos terapéuticos en casi la totalidad de los pacientes37.
Enfermedades autoinmunesLos estudios epidemiológicos han evidenciado que los pacientes con enfermedades autoinmunes –como el lupus eritematoso sistémico (LES), la artritis reumatoide, la psoriasis o el síndrome antifosfolipídico– presentan más RCV que la población general. Clínicamente, se inicia en forma de enfermedad coronaria o cerebrovascular precoz y su origen se relaciona con la presencia de aterosclerosis acelerada. Los FRCV «clásicos» se asocian a otros FRCV menos convencionales como la homocisteína o los anticuerpos antifosfolípido que, además de causar la agresión autoinmune, generan una situación de inflamación crónica que produce disfunción endotelial y una tendencia a la trombosis. Este hecho es atribuible tanto a factores dependientes de la propia enfermedad como probablemente a factores dependientes del tratamiento recibido. El riesgo de padecer un infarto agudo de miocardio de los pacientes con LES es hasta 50 veces mayor que para un paciente de la misma edad sin LES28,29.
A pesar de ello, se subestima a estos pacientes en algunas recomendaciones de prevención cardiovascular. Varios estudios han demostrado que la administración de estatinas a estos pacientes se relaciona con una reducción de biomarcadores proinflamatorios y protrombóticos30. Pese a que son necesarios más estudios, cabe pensar que los pacientes con enfermedades autoinmunes están en alto RCV y el control lipídico y el tratamiento con estatinas tendrían que ser valorados de modo sistemático1 con los mismos objetivos que para los grupos previos, alto RCV (prevención primaria) y objetivo de cLDL < 2,5mmol/l o 100mg/dl, y muy alto RCV en pacientes con ECVA y objetivo de cLDL < 1,8mmol/l o 70mg/dl o una reducción ≥ 50% si no se llega a objetivo.
Medidas higiénico-dietéticasLa modificación de hábitos de vida debe ser coadyuvante, nunca sustituida por el tratamiento farmacológico, y en los pacientes de alto RCV ha de ser simultánea. La adquisición de hábitos de vida saludables supone un beneficio tanto para los pacientes con alto RCV como para el resto de la población; por lo tanto, es aplicable a todas las edades desde la infancia.
Se ha de desaconsejar rotundamente el consumo de tabaco y remitir al paciente a una unidad especializada en deshabituación si lo precisa.
Es recomendable el control de peso con una pérdida ponderal de al menos un 10% del peso corporal si el índice de masa corporal es > 25 mediante dieta hipocalórica y ejercicio físico; asimismo es aconsejable la valoración de cirugía bariátrica en circunstancias de obesidad mórbida con dificultades para la reducción de peso4.
Hemos de potenciar los cambios dietéticos y la adopción de hábitos saludables como la dieta mediterránea31,32. Se recomienda usar aceite de oliva33 y cereales integrales, el consumo diario de cinco porciones de fruta y verdura y el consumo de pescado al menos dos veces a la semana, una de ellas de pescado azul. El consumo moderado de alcohol, fundamentalmente vino tinto o cerveza (máximo 1 UBE/día para mujeres y 2 UBE/día para varones)34 puede permitirse, aunque no se aconseja. Dos situaciones excepcionales: las gestantes, a las que se aconseja evitar el consumo de alcohol y pescados azules de gran tamaño por su contenido en mercurio, y los pacientes con hipertrigliceridemia, a los que se desaconseja el alcohol.
El sedentarismo se ha asociado a un incremento del RCV. El ejercicio físico previene la obesidad, reduce los TG, eleva el cHDL y disminuye la hipertensión arterial. Es recomendable la práctica de actividad física de carácter moderado al menos 30min/día o 150min/semana2 repartidos en 5 días o a días alternos de ejercicios cardiovasculares aeróbicos como nadar, montar en bicicleta o caminar a paso rápido. A los pacientes isquémicos o de alto RCV se les podría realizar una prueba de detección de isquemia antes de iniciar la actividad física reglada. Evidentemente, siempre hemos de favorecer la práctica de deportes acordes con la edad, la capacidad y los gustos del paciente.
Tratamiento farmacológicoYa que el principal objetivo terapéutico en el tratamiento de las dislipemias es el cLDL o (cuando hay un exceso de TG y no se puede calcular el cLDL) el cNo-HDL, el tratamiento con estatinas ha de ser el primer escalón terapéutico. En la figura se describen las indicaciones y el grado de eficacia de los principales fármacos hipolipemiantes. Solo para pacientes con hipertrigliceridemia grave (es decir, > 11,2mmol/l o 1.000mg/dl) la utilización de un fibrato o dosis altas de AGO3 para disminuir la trigliceridemia será prioritaria para prevenir la pancreatitis aguda35. Las estatinas pueden disminuir el cLDL en más de un 50%, aumentan el cHDL entre un 5 y un 15% y disminuyen los TG de modo muy variable, entre un 10 y un 40%, dependiendo de la magnitud de la hipertrigliceridemia36. La ezetimiba, los fibratos, la niacina o las resinas de intercambio se mantienen en un segundo plano como alternativa para los pacientes con contraindicación para el tratamiento con estatinas, que no las toleren o tengan respuesta inadecuada. La ezetimiba a dosis de 10mg/día, en monoterapia o asociada a estatinas, disminuye el cLDL alrededor de un 20–25% y los TG hasta un 13% y carece de efectos significativos en el cHDL. El AN a dosis de 1–2g/día disminuye los TG más de un 30% y el cLDL un 10–20% y aumenta el cHDL un 20–30%. Los AGO3 a dosis de 2–4 g/día31 disminuyen los TG más de un 30%, y sus efectos en el cLDL y el cHDL son escasos. Los fitosteroles (1 bebida láctea/día) aportan un descenso adicional del cLDL de alrededor de un 8%.
Las combinaciones de fármacos dependerán del tipo de alteración lipídica que se quiera tratar, sabiendo que las estatinas son la pieza clave del tratamiento. Todavía no se ha demostrado de modo inequívoco que la terapia combinada añada beneficio en la reducción del RCV.
Las estatinas están formalmente contraindicadas en la gestación, y así debe informarse a las pacientes, advirtiéndolas de su suspensión meses antes de una concepción deseada o posible.
En todos los pacientes de alto RCV hemos de procurar mantener adecuadas concentraciones de cHDL y TG, ya que ambos son reconocidos factores independientes de RCV. Los objetivos de cHDL para los varones son > 1,1mmol/l o 40mg/dl y para las mujeres, > 1,3mmol/l o 50mg/dl, y los de TG, < 1,7mmol/l o 150mg/dl para ambos sexos. Las estatinas en monoterapia con frecuencia no logran normalizar por completo el RCV atribuido a la dislipemia aterogénica5. Si a pesar del tratamiento con estatinas las concentraciones de cHDL y TG se mantienen fuera de los objetivos ideales, estaría indicada la asociación de un fibrato, en particular el fenofibrato, para optimizar el perfil lipídico.
Conflicto de interesesNinguno.


 cLDL: colesterol unido a lipoproteínas de baja densidad;
cLDL: colesterol unido a lipoproteínas de baja densidad;