La endocarditis infecciosa es una enfermedad que afecta, fundamentalmente, a las válvulas cardíacas, con mal pronóstico y que es originada por gran variedad de microorganismos. La profilaxis es muy importante, pero hay muchos interrogantes sobre su verdadera efectividad y la mejor forma de llevarla a cabo. En este artículo se presentan unas recomendaciones en este sentido. El diagnóstico se basa en hallazgos clínicos, bacteriológicos y ecocardiográficos, fundamentalmente siguiendo los criterios de Duke. Los ecocardiogramas transtorácico y transesofágico tienen no sólo valor diagnóstico, sino que son una buena guía para decidir la actitud terapéutica. El tratamiento antibiótico se basa en los hallazgos del hemocultivo, si bien se presentan pautas no sólo específicas para los diferentes gérmenes hallados, sino también en caso de hemocultivos negativos. Por último se valoran las indicaciones y el momento adecuado de la cirugía.
Palabras clave
Profilaxis
Endocarditis
Guías
INTRODUCCIÓN
La endocarditis infecciosa (EI) es una enfermedad inflamatoria, exudativa y proliferativa del endocardio, que afecta más frecuentemente a las valvas, producida por gran variedad de microorganismos. Las lesiones más frecuentes son las verrugas o vegetaciones que se forman y crecen a través de la colonización por gérmenes de agregados de fibrina y plaquetas, el denominado trombo fibrinoplaquetario. En la gran mayoría de los casos, estos fenómenos se originan a partir de pequeñas lesiones del endotelio causadas por alteraciones hemodinámicas o presencia de material extraño intracavitario (prótesis, etc.).
Bouillaud empleó los términos de endocardio y endocarditis en 1835, pero fue Osler, desde 1835, quien estudió ampliamente la enfermedad. En 1940 fue tratado el primer paciente con penicilina, y desde entonces se han ido produciendo mejoras en los aspectos clínicos, microbiológicos, diagnósticos y terapéuticos, con mejoría del pronóstico de la enfermedad. La mortalidad, en la fase activa de la EI sobre válvula nativa, es del 12%, con una supervivencia del 81% a los 10 años. En la EI protésica tardía, la mortalidad es inferior al 5% si está causada por estreptococos, y puede ser del 50% si son estafilococos 1. En conjunto, las EI de peor pronóstico son las causadas por gérmenes como los citados estafilococos, hongos, Coxiella burnetii y las protésicas precoces.
PROFILAXIS ANTIBIÓTICA DE LA ENDOCARDITIS INFECCIOSA
Dado que determinados procedimientos diagnóstico-terapéuticos se acompañan de bacteriemia y teniendo en cuenta el especial riesgo que presentan algunas lesiones cardiovasculares a la colonización del germen sobre las mismas, la utilización de agentes antimicrobianos como medida profiláctica para la prevención de endocarditis es una práctica recomendada en la actualidad 2.
En cualquier caso, todo protocolo de profilaxis antimicrobiana de endocarditis debe considerar: el riesgo que la enfermedad cardiovascular de base supone para contraer la enfermedad, el riesgo de bacteriemia que el procedimiento conlleva, los potenciales efectos secundarios del tratamiento a instaurar y la valoración del cociente riesgo/beneficio de dicho tratamiento 3.
No disponemos, hasta el momento, de estudios controlados y aleatorizados que permitan concluir que durante los procedimientos que conllevan una bacteriemia en los pacientes con lesiones cardiovasculares el tratamiento profiláctico con antibiótico asegure una protección frente a la endocarditis. En este sentido, uno de los estudios más amplios realizados hasta el momento demostró que sólo un 6% de los casos de endocarditis podrían haberse prevenido 4.
Por el contrario, otro estudio realizado en pacientes con prótesis valvular que fueron sometidos a extracciones dentales o procedimientos quirúrgicos, y por ello con un riesgo alto de endocarditis bacteriana, demuestra con resultados estadísticamente significativos que los pacientes con tratamiento antibiótico profiláctico, tienen una incidencia menor de endocarditis cuando se comparan con aquellos en los que no se utilizó dicha protección 5. Por ello, y pese a los resultados en ocasiones no superponibles, la morbilidad y mortalidad que conlleva la endocarditis bacteriana así como otras razones de orden médico-legal, justifican que el consenso general sea el del empleo de profilaxis en los pacientes en los que la enfermedad cardíaca, junto con el procedimiento a emplear, comporte un riesgo significativo 6.
Bacteriemia y endocarditis: patogenia
Se ha demostrado una relación entre determinados procedimientos dentales, quirúrgicos y terapéuticos con el hallazgo de bacteriemia causada por microorganismos comúnmente asociados a endocarditis y atribuibles al procedimiento en cuestión. En la tabla 1 se enumeran los procedimientos en los que hay que considerar la necesidad o no de profilaxis, en función, como se explicará, de la cardiopatía existente.
Sin embargo, estas recomendaciones clásicas se han puesto en duda recientemente tras la publicación por Strom et al de un estudio de casos y controles en el que se incluyen 273 casos con endocarditis infecciosa diagnosticados en 54 hospitales y sus correspondientes controles 7. En este estudio, cuyos resultados apoyan los de otros trabajos previos, se concluye que los pacientes con endocarditis, a pesar de tener en una proporción mucho más elevada una cardiopatía predisponente previa (el 38 frente al 6% de los controles), se habían realizado procedimientos dentales en los 3 meses previos con una frecuencia similar a la de los controles (el 16,8% frente al 14,3%), con lo que la odds ratio era de 1,2 (0,7-1,9); es decir, que la realización de un procedimiento dental no representaba un riesgo significativo para el desarrollo de endocarditis, incluso en una población de mayor riesgo para ello. Sólo la extracción de una pieza dental y la cirugía gingival eran ligeramente más frecuentes en el grupo de pacientes con endocarditis que en los controles, pero con un número de casos muy reducido para poder extraer conclusiones tajantes. En un editorial sobre este trabajo, Durack 8 subraya que no se ha demostrado nunca la efectividad de la profilaxis antibiótica en humanos, y mucho menos la relación coste-beneficio, y que el trabajo citado añade más dudas todavía a la necesidad de estas normas de profilaxis. Es posible que en una próxima revisión de dichas pautas se rebajen las exigencias y recomendaciones, y que sólo se mantengan como situaciones de riesgo que necesitan profilaxis la extracción dental y la cirugía gingival (incluyendo la colocación de implantes), y algunas situaciones de riesgo, como las prótesis valvulares y la endocarditis previa. Sin embargo, hasta que estos cambios se produzcan se deben seguir las recomendaciones clásicas referidas en este capítulo (tablas 1 y 2).
Patologías cardíacas
Se considera indicado el tratamiento antibiótico cuando la enfermedad cardíaca subyacente y el procedimiento a emplear comportan un riesgo importante. O lo que es lo mismo, en aquellas enfermedades cardíacas consideradas de riesgo alto y moderado 9,10 (tabla 2), cuando coinciden con procedimientos diagnósticos o terapéuticos en los que se presume la bacteriemia de un germen con potencialidad de producir endocarditis. Por el contrario, y aunque la endocarditis puede aparecer en una persona sin lesión cardíaca previa, no se considera indicada la profilaxis en los pacientes cuya lesión vascular es considerada de bajo riesgo.
Por lo que respecta a la profilaxis en pacientes que son sometidos a la implantación de material protésico endovascular mediante técnicas percutáneas, no existen datos que justifiquen el empleo de dicha profilaxis.
La profilaxis en los casos de prolapso mitral continúa siendo motivo de controversia debido a su amplio espectro en las formas de presentación 9,11. En el momento actual se ha demostrado una relación positiva en el análisis del coste/beneficio de los pacientes con valvas muy engrosadas y con degeneración mixoide y/o la presencia de regurgitación mitral 12,13. En casos menores, el riesgo de endocarditis es similar al de la población normal 11.
Pautas de profilaxis
Con la finalidad de reducir la posibilidad de crear resistencias bacterianas se recomienda iniciar la profilaxis antibiótica inmediatamente antes del procedimiento y sin prolongarlo más de 6-8 h después del mismo, salvo en los casos en los que, por la existencia de una infección establecida, se haga necesario su tratamiento.
En las tablas 3 y 4 se especifican distintos regímenes antibióticos en función del órgano sobre el que se actúa y las circunstancias individuales del paciente.
Los pacientes que van a ser sometidos a cirugía cardíaca constituyen un grupo especial; en ellos debe realizarse una evaluación dental preparatoria completa. Debido a la elevada morbimortalidad de la endocarditis bacteriana en pacientes sometidos a implantes de material protésico intracardíaco o intravascular, se recomienda en ellos la profilaxis perioperatoria antibiótica.
Staphylococcus aureus, estafilococo coagulasa negativo y difteria son gérmenes asociados con la endocarditis durante cirugía cardíaca abierta. Por ello, en estos casos se recomienda el empleo de cefalosporinas u otro antimicrobiano, cuya elección estará en función con el patrón de susceptibilidad de cada centro hospitalario 3. El tratamiento debe ser iniciado inmediatamente antes de la cirugía, con valores intraoperatorios adecuados y mantenidos durante no más de 24 h en el curso postoperatorio.
EL ECOCARDIOGRAMA EN LA ENDOCARDITIS INFECCIOSA
El ecocardiograma tiene un papel muy importante en el diagnóstico y tratamiento de los pacientes con endocarditis infecciosa 14. En la actualidad, la presencia de vegetaciones, abscesos y seudoaneurismas, o la detección de una dehiscencia protésica o una regurgitación valvular de nueva aparición, representan un criterio diagnóstico mayor de endocarditis infecciosa. Estos hallazgos ecocardiográficos forman, junto con los hemocultivos, los pilares básicos en los que se asienta el diagnóstico clínico de endocarditis. Sin embargo, la utilidad de la ecocardiografía en los pacientes con endocarditis va más allá de un simple papel diagnóstico. Puede detectar la extensión perianular de la infección (abscesos, seudoaneurismas, fístulas) y otras complicaciones intracardíacas (rotura de cuerdas, derrame pericárdico, etc.), valorar la existencia y el grado de disfunción valvular, nativa o protésica, y su repercusión hemodinámica, estudiar los aspectos morfológicos y dinámicos de la vegetación y su relación con el embolismo, influir en la decisión de cuándo y cómo debe ser intervenido un paciente, efectuar una evaluación posquirúrgica del enfermo y, por último, proporcionar una idea sobre el pronóstico del paciente 15.
En todo paciente con sospecha de endocarditis se debe realizar un ecocardiograma. No es correcta la utilización rutinaria del ecocardiograma en todo paciente con fiebre. El ecocardiograma permite la visualización de las vegetaciones, que son la lesión fundamental de la endocarditis y constituyen un criterio diagnóstico mayor. Se trata de masas de morfología y márgenes irregulares con una densidad ecogénica parecida a la de los trombos, adheridas al anillo protésico o a las valvas y con un movimiento caótico independiente de las mismas. La sensibilidad de la ecocardiografía transtorácica en la detección de vegetaciones está en torno al 60%, porcentaje que depende fundamentalmente de la población estudiada y de la experiencia en la realización de la prueba. La alta resolución de las imágenes ecocardiográficas obtenidas con sondas transesofágicas aumenta las posibilidades diagnósticas de la ecocardiografía. La sensibilidad de la ecocardiografía transesofágica en la detección de vegetaciones oscila entre el 94 y el 100%. Por tanto, ante un cuadro clínico sugestivo, la negatividad de la exploración ecocardiográfica convencional obliga a la práctica de un ecocardiograma transesofágico, sobre todo en pacientes con prótesis valvulares o en sujetos con una ventana acústica transtorácica inadecuada 16.
Las vegetaciones pueden aumentar de tamaño si el tratamiento antibiótico no es efectivo, disminuir e incluso desaparecer. Es un hecho frecuente la persistencia de la vegetación después del tratamiento efectivo de un episodio de endocarditis 17. La detección de vegetaciones tras el tratamiento de la endocarditis no influye en el pronóstico del paciente. No está claro si el tamaño de las vegetaciones influye en la valoración pronóstica inicial; en cualquier caso, su papel en la indicación quirúrgica del paciente debe ser cuidadosamente individualizado y valorado en el contexto clínico general.
En la endocarditis protésica, el ecocardiograma transesofágico es superior al transtorácico por tres razones: es capaz de visualizar vegetaciones de pequeño tamaño, cuantificar mejor la insuficiencia protésica y periprotésica y detectar con más exactitud la presencia de complicaciones perianulares. La modalidad transesofágica es capaz de visualizar vegetaciones de pequeño tamaño; por el contrario, la ecocardiografía transtorácica sólo detecta el 25% de las vegetaciones menores de 5 mm y el 69% de las vegetaciones entre 6 y 10 mm. En presencia de una prótesis, sobre todo en posición mitral, el ecocardiograma transtorácico es claramente inferior, pues la atenuación, las reverberaciones y otros artefactos que producen las estructuras protésicas, en particular las mecánicas, en la aurícula izquierda impiden la visualización de las vegetaciones y la detección de chorros de regurgitación perivalvular, que si son de nueva aparición constituyen un criterio mayor de endocarditis. Hay que señalar, no obstante, que la regurgitación periprotésica no es específica de endocarditis. En las prótesis aórticas, el ecocardiograma transesofágico también es superior al transtorácico en la visualización de vegetaciones pero, además, también lo es en la detección de la extensión perivalvular de la infección (abscesos, seudoaneurismas y fístulas periaórticas y de la continuidad mitroaórtica) 18. Estas complicaciones son, al igual que las vegetaciones, un criterio mayor de endocarditis. En algunos casos de endocarditis protésica no se detectan vegetaciones y sí complicaciones perianulares de la endocarditis. El tamaño de la vegetación no es útil para predecir la extensión perianular de la infección. Ésta es más frecuente en la endocarditis aórtica y, sobre todo, en la endocarditis aórtica protésica precoz. Los seudoaneurismas son cavidades ecolucentes en contacto con la luz vascular y, por tanto, tienen flujo en su interior. El absceso es una cavidad cerrada, sin flujo en su interior y suele tener una densidad ecográfica inferior a la de las estructuras adyacentes. La sensibilidad y especificidad de la ecocardiografía transesofágica en la detección de estas complicaciones son muy altas, alrededor del 90% 18, y la exactitud diagnóstica de esta técnica es más elevada para el seudoaneurisma que para el absceso. Una perforación secundaria del seudoaneurisma o del absceso en otra cavidad provoca la formación de una fístula, siendo las más frecuentes con la aurícula izquierda; sin embargo, esta complicación es muy poco frecuente. En algunos pacientes con endocarditis protésica y afectación perianular se puede objetivar una dehiscencia parcial de la prótesis que, si es lo suficientemente extensa, puede ocasionar un movimiento protésico muy característico conocido como Òcabeceo protésicoÓ. La dehiscencia protésica es también un criterio mayor de endocarditis.
A pesar de que la modalidad ecográfica preferida para el estudio de las prótesis en la endocarditis es la transesofágica, la ecocardiografía convencional ofrece datos sobre la función ventricular y la hemodinámica valvular, de modo que su información es complementaria y puede servir de guía al estudio transesofágico. Por tanto, es aconsejable realizar un estudio ecográfico secuencial, primero transtorácico y después transesofágico.
El valor predictivo negativo de un ecocardiograma transesofágico en el diagnóstico de endocarditis es muy alto (95%), lo que significa que si no hay lesiones ecocardiográficas típicas de endocarditis en el estudio transesofágico es muy probable que el paciente no tenga esta enfermedad 19. Sin embargo, si la sospecha clínica es importante, sobre todo si el paciente es portador de una prótesis aórtica, no se puede descartar el diagnóstico de endocarditis y conviene repetir el estudio una días después.
En la actualidad, en la mayoría de centros en los que se dispone de ecocardiografía transesofágica se utiliza esta técnica en casi todos los pacientes con endocarditis. Sin embargo, no siempre es imprescindible. En pacientes con endocarditis sobre válvula nativa con un estudio transtorácico adecuado, sin insuficiencia cardíaca, buena respuesta al tratamiento antibiótico y sin imágenes sugerentes de complicaciones perivalvulares no es necesario recurrir a la vía transesofágica. En la endocarditis derecha, el ecocardiograma transesofágico no es superior al transtorácico, sobre todo en heroinómanos 20; la válvula tricúspide al ser una estructura anterior se estudia bien con el ecocardiograma transtorácico. Estos pacientes suelen ser jóvenes y delgados y, por tanto, tienen una ventana acústica adecuada y, además, las vegetaciones derechas son de mayor tamaño que las de las válvulas izquierdas. Estos hechos explican la suficiencia del ecocardiograma transtorácico en estos pacientes. Una excepción es la infección de los marcapasos y de otros catéteres intracavitarios: en estos casos el ecocardiograma transesofágico es de elección 21. Las indicaciones de la ecocardiografía transesofágica en la endocarditis infecciosa se señalan en la tabla 5.
CRITERIOS DIAGNÓSTICOS DE LA ENDOCARDITIS INFECCIOSA
El diagnóstico definitivo de la endocarditis infecciosa sólo puede realizarse con seguridad absoluta mediante la demostración del germen o de la histología específica en las vegetaciones o en material embólico, generalmente obtenidos a través del acto quirúrgico o de la necropsia. Sin embargo, y debido a la necesidad de alcanzar un diagnóstico lo más precoz posible, en la mayoría de los casos dicho diagnóstico se realiza sobre la base de la clínica del paciente. Las dificultades diagnósticas de la endocarditis infecciosa derivan de la gran variedad de manifestaciones clínicas con que puede presentarse la enfermedad, que pueden confundirse con otras enfermedades sistémicas. Por ello, un alto grado de sospecha es fundamental para su diagnóstico.
El diagnóstico es evidente en los pacientes que presentan todas o la mayoría de las manifestaciones clínicas clásicas: bacteriemia o fungemia, evidencia de valvulitis activa, fenómenos embólicos o fenómenos vasculares de origen inmunológico. Sin embargo, en muchos pacientes estos signos pueden estar ausentes 22, por lo que ha sido preciso establecer una serie de criterios diagnósticos que reúnan una sensibilidad y especificidad adecuadas. Es importante tener en cuenta que la ausencia de cualquiera de las manifestaciones clásicas de endocarditis no excluye su diagnóstico; es decir, puede existir una endocarditis infecciosa en pacientes sin gérmenes aislados en los cultivos, vegetaciones en el ecocardiograma, fenómenos embólicos o sin cardiopatía predisponente, por poner unos ejemplos.
Los datos y parámetros valorados en los criterios diagnósticos de endocarditis infecciosa son de tres tipos: clínicos, microbiológicos y ecocardiográficos. En 1981, Von Reyn et al propusieron unos criterios diagnósticos estrictos basados fundamentalmente en datos clínicos y microbiológicos 23, que son los que se han venido utilizando hasta la introducción más reciente, en 1994, por Durack et al, de los criterios de Duke 24. Von Reyn distinguía tres tipos de diagnóstico, con mayor o menor seguridad: diagnóstico de certeza, de probabilidad y de posibilidad. En la tabla 6 se reflejan los requerimientos necesarios para considerar como endocarditis un caso sospechoso; los datos diagnósticos más importantes son los microbiológicos (aislamiento del mismo germen en la mayoría de los hemocultivos obtenidos, 2 al menos), la existencia de una cardiopatía predisponente y algunos hallazgos clínicos (fiebre, fenómenos embólicos o vasculares, nuevos soplos).
Algunas limitaciones de estos criterios se han ido viendo con el paso de los años. En primer lugar, sólo en una minoría de los pacientes era posible establecer un diagnóstico de certeza. En segundo lugar, no se tenía en cuenta la aparición de nuevos factores predisponentes, como la adicción a drogas por vía parenteral. En tercer lugar, tampoco se establecía el valor de los hallazgos del ecocardiograma 14. Por tanto, la aplicación de estos criterios, aunque muy importante por sentar las bases del diagnóstico y tratamiento de la endocarditis infecciosa, presenta la limitación de que muchos casos de endocarditis podrían no ser diagnosticados como tales (sensibilidad reducida). Este problema parece haberse resuelto en gran parte con los nuevos criterios de Durack, que se especifican en la tabla 7 24. Esta clasificación establece un diagnóstico definitivo, basado no sólo en los criterios histomicrobiológicos (que corresponderían al diagnóstico de certeza de Von Reyn), sino también en criterios clínicos, microbiológicos y ecocardiográficos mayores o menores (tablas 7 y 8), y un diagnóstico de posibilidad (tabla 7). Así mismo, se establecen también criterios para descartar el diagnóstico de endocarditis (tabla 7).
Las ventajas de esta clasificación son la inclusión, entre los criterios diagnósticos, de la adicción a drogas por vía parenteral y los hallazgos del ecocardiograma, además de los clínicos y microbiológicos clásicos de Von Reyn (tabla 8) y, por tanto, la sensibilidad alcanzada es mayor sin haber perdido especificidad 14, así como el mayor porcentaje de casos con diagnóstico de certeza. Entre los hallazgos ecocardiográficos, sólo 3 se consideran criterios mayores: vegetaciones claras, abscesos perianulares o dehiscencia protésica nueva; otras alteraciones sugestivas pero distintas a estas 3 se consideran criterios menores. Entre los criterios menores se incluye también la evidencia serológica de infección activa por gérmenes que típicamente causan endocarditis (criterio también ausente en la clasificación de Von Reyn) 24. Diversos estudios, en los que se incluyen más de 1.700 pacientes, han confirmado la mayor sensibilidad de estos criterios respecto a los de Von Reyn 14 en todos los subgrupos de pacientes (distintas edades, endocarditis protésicas y nativas, adictos a drogas o no, etc.). El valor predictivo negativo de los criterios de Duke también es muy elevado; en un estudio reciente fue superior al 98% 25, lo que indica que cuando no se cumplen los criterios de endocarditis la probabilidad de que a pesar de todo se trate de una endocarditis es casi nula. La especificidad en otro estudio sobre 100 pacientes fue del 99%; sólo en un paciente en que existía otro diagnóstico alternativo se confirmó posteriormente la existencia de endocarditis 26.
Todos estos estudios indican que el diagnóstico de endocarditis infecciosa en la actualidad debe hacerse aplicando los criterios de Duke, que presentan una sensibilidad, especificidad y valor predictivo negativo muy elevados, superiores al 95% 14. Es posible que estos parámetros puedan mejorarse aún más, sobre todo la sensibilidad (para evitar falsos diagnósticos negativos), aumentando el número de criterios menores: evidencias serológicas específicas para algunos gérmenes, como Coxiella, Brucella o Bartonella27; datos analíticos, como aumento de la velocidad de sedimentación, proteína C reactiva o microhematuria; hallazgos clínicos, como esplenomegalia, etc. En un estudio reciente, la adición de estos criterios menores a los originales de Durack aumentó la sensibilidad en un 10%, sin que disminuyera la especificidad.
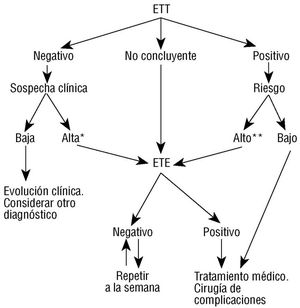
El importante papel que desempeñan los hallazgos de los ecocardiogramas transtorácico y transesofágico no se circunscribe sólo al diagnóstico de la endocarditis, sino que también aporta trascendentes implicaciones terapéuticas y de manejo. Otro aspecto a considerar es que la negatividad inicial de un estudio ecocardiográfico no excluye de forma absoluta el diagnóstico de endocarditis, por lo que pueden ser necesarios estudios seriados con un cierto intervalo de tiempo o por diferentes vías. En la figura 1 28 se propone un protocolo de actuación, basado en los datos clínicos y ecocardiográficos, en pacientes con sospecha de endocarditis infecciosa.
Fig. 1. Aportación del ecocardiograma al diagnóstico y manejo de la endocarditis infecciosa. ETT: ecocardiograma transtorácico; ETE: ecocardiograma transesofágico. *Sospecha clínica alta: bacteriemia persistente, cardiopatía predisponente. **Datos de alto riesgo: gérmenes virulentos, destrucción valvular o perivalvular, evolución clínica desfavorable.
TRATAMIENTO
Normas generales
El tratamiento de la EI se basa en la administración del antibiótico más adecuado, a la dosis necesaria y durante el tiempo suficiente para erradicar el germen responsable de las vegetaciones endocárdicas 29. Este tratamiento requiere en algunos casos ser complementado con cirugía cardíaca (infección persistente, extensión perivalvular de la infección, inestabilidad hemodinámica), siendo recomendable que las formas de mayor riesgo (endocarditis aórticas, endocarditis protésicas y las causadas por microorganismos virulentos) sean tratadas en medios hospitalarios que dispongan de cirugía cardíaca o de un drenaje rápido a un servicio de cirugía cardíaca.
Los antibióticos deben utilizarse a dosis altas y por vía intravenosa, excepto cuando no sea posible, durante un tiempo prolongado, de 4-6 semanas, para evitar las recidivas y erradicar los focos metastásicos. En la mayoría de los pacientes el tratamiento se inicia una vez conocido el germen responsable y el tratamiento se realiza según el antibiograma. Las pautas más habituales se describen en las tablas 9-12 30,31.
En determinadas circunstancias, el estado clínico del paciente requiere una actuación rápida (estado séptico, insuficiencia cardíaca con importante destrucción valvular), siendo necesario pautar un tratamiento antibiótico empírico, siempre tras la toma de al menos 3 hemocultivos. En la selección de la pauta antibiótica es necesario considerar los microorganismos causales más frecuentes tabla 13 29, su perfil clínico característico y sus peculiaridades epidemiológicas.
Las EI sobre válvula nativa con curso agudo generalmente son estafilocócicas y las de curso subagudo estreptocócicas. En la EI en pacientes con prótesis valvulares 32, se distinguen dos grupos: a) las precoces que se presentan en los primeros 12 meses tras la cirugía y sus gérmenes productores son de adquisición nosocomial, siendo Staphylococcus epidermidis el más frecuente, y b) las tardías, que tiene un espectro microbiológico similar a la EI sobre válvula nativa. Además, existen peculiaridades epidemiológicas que decantan la máxima probabilidad hacia un microorganismo concreto; así, en la EI en un paciente con neoplasia intestinal generalmente el germen responsable es Streptococcus bovis, y en las aparecidas tras manipulaciones obstétricas o genitourinarias el germen productor típico es el enterococo.
Una vez conocido el germen responsable, aislado de los hemocultivos, se optimizará el tratamiento antibiótico empírico utilizado (tabla 14). En la EI es necesaria una estrecha monitorización de la eficacia antibiótica 33 para el ajuste individualizado de la dosis y para conseguir la máxima eficacia terapéutica. Se utiliza la CMI (concentración mínima inhibitoria), que es la concentración mínima necesaria del antibiótico para matar in vitro al microorganismo causal de la infección, con el objetivo de asegurarse de que en el lugar de la infección se alcancen concentraciones superiores a la CMI en los intervalos entre las dosis del fármaco. Una alternativa es el PBS (poder bactericida del suero): a las 48 h de empezar el tratamiento se mezcla el suero del paciente extraído en el pico y en el valle de los antibióticos, se diluye y se inocula con el microorganismo causante de la infección. Para que el tratamiento sea eficaz se requiere como mínimo que el suero diluido 8 veces sea capaz de destruir la bacteria infectante (es muy útil con microorganismos multirresistentes o poco habituales). La EI con buena evolución con la pauta antibiótica prescrita al inicio no requieren esta monitorización tan especifica, que está especialmente indicada en los pacientes con evolución tórpida.
El estado clínico de los pacientes debe revisarse a diario 29-34, vigilando la posible aparición de signos de insuficiencia cardíaca, alteraciones del ritmo o conducción cardíaca, fenómenos embólicos o clínica neurológica. Debe, así mismo, vigilarse la posibilidad de que aparezcan efectos tóxicos de los antibióticos. La persistencia del cuadro febril o la aparición de fiebre durante el tratamiento plantea varias posibilidades diagnósticas que deben descartarse en cada caso: fiebre medicamentosa (en general asociada a eosinofilia), flebitis superficial en relación con la vía de administración del antibiótico, foco séptico extracardíaco o absceso intracardíaco.
Una vez finalizado el tratamiento antibiótico, debe procederse a realizar hemocultivos de control antes de asegurar la curación bacteriológica, siendo recomendable realizar el último hemocultivo a los 2 meses de completado el ciclo antibiótico, que es el período con mayor riesgo de recidiva. Si reaparece la infección, se tratará de nuevo médicamente y se planteará el recambio valvular si se trata de gérmenes de tratamiento difícil o muy virulentos.
La anticoagulación 34 está contraindicada como norma en los pacientes con EI ya que no previene los fenómenos embólicos e incrementa el riesgo de hemorragia cerebral por rotura de un aneurisma micótico o la conversión de un infarto isquémico en hemorrágico. Sin embargo, si la cardiopatía de base lo hace necesario, como ocurre en los pacientes portadores de prótesis valvulares, la anticoagulación debe mantenerse. En las fases iniciales del tratamiento, cuando el riesgo embolígeno es más alto, es prudente sustituir los dicumarínicos por heparina. Tras la aparición de una complicación neurológica la anticoagulación debe suspenderse transitoriamente.
Endocarditis con hemocultivos negativos
Actualmente los hemocultivos son negativos en el 5% de las EI diagnosticadas con criterios estrictos 14. Las causas implicadas son:
1. La más frecuente es el tratamiento antimicrobiano previo derivado de un diagnóstico incorrecto. Lógicamente la susceptibilidad del microorganismo y el tiempo del tratamiento antimicrobiano determinan la persistencia de los hemocultivos negativos. Si el tratamiento ha durado 2-3 días, los hemocultivos son negativos sólo los primeros días. Si se ha recibido un tratamiento antibiótico completo, los hemocultivos son negativos durante semanas. En estos pacientes debe diferirse el tratamiento antimicrobiano empírico durante 3-4 días y seriar los hemocultivos para detectar el microorganismo causal y realizar el tratamiento antimicrobiano óptimo, disminuyendo la morbimortalidad de la EI. Sin embargo, si el paciente tiene un aspecto séptico, insuficiencia cardíaca o existen datos ecocardiográficos de insuficiencia valvular progresiva se debe iniciar tratamiento antibiótico empírico; actualmente el más recomendado 2 es vancomicina, 15 mg/kg/12 h i.v. más gentamicina, 1 mg/kg/8 h i.m. o i.v.
2. La naturaleza del agente causal 33, que requiere para su correcto aislamiento técnicas microbiológicas especificas: a) la prolongación de los tiempos de incubación y el uso de medios especiales han permitido el aislamiento de bacterias del grupo HACEK ( Haemophilus spp., Actinobacillus actinomycetem comitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae), Brucella spp., Legionella spp. y Mycobacterium spp.; b) la utilización de técnicas serológicas específicas ha supuesto una importante ayuda para la identificación de determinados microorganismos ( Coxiella burnetii, Chlamydia psittaci, Chlamydia pneumoniae, Mycoplasma spp., Legionella pneumoniae, Brucella spp. y Bartonella spp.), y c) en pacientes con riesgo especial de sufrir endocarditis fúngica ( Candida spp., Aspergillus spp., Cephalosporium spp.) como consumidores de droga por vía parenteral o pacientes con tratamientos antimicrobianos prolongados se deben utilizar medios de cultivo y técnicas especificas (lisis-centrifugación) y/o métodos serológicos para su identificación.
Además de las técnicas serológicas y de los hemocultivos, el cultivo de vegetaciones 1 valvulares procedentes de la cirugía cardíaca o de una embolia periférica también pueden contribuir al aislamiento del agente causal.
Endocarditis infecciosa por microorganismos poco frecuentes
Coxiella burnetii
Es un bacilo gramnegativo, patógeno intracelular obligado, productor de la fiebre Q, con gran resistencia a la desecación y a los desinfectantes. Su distribución es universal, afecta al ganado (vacas, cabras y ovejas) y a animales domésticos. Se elimina por la leche, orina, heces y tejido placentario, donde se multiplica con rapidez. Se adquiere por inhalación, contacto o consumo de materiales contaminados. Supone un riesgo ocupacional para personal de laboratorio, pastores y veterinarios.
El cuadro clínico que produce es subagudo 35, de meses o incluso años de evolución, de fiebre y síndrome constitucional. Las vegetaciones que produce son de pequeño tamaño y se requiere la ecocardiografía transesofágica para su correcta visualización. La insuficiencia cardíaca y los fenómenos embólicos y de autoinmunidad son frecuentes. Típicamente afecta a pacientes con prótesis valvulares, valvulopatía previa o inmunodeprimidos.
El diagnóstico radica en la sospecha clínica ante un cuadro de EI con hemocultivos negativos y las técnicas serológicas son especialmente útiles. El diagnóstico de enfermedad se establece con un título de anticuerpos IgG ³ 1/800 y de IgA ³ 1/200. La serología se utiliza para monitorizar la evolución tras el tratamiento antibiótico, con un descenso progresivo de los títulos de anticuerpos hasta la curación (IgG < 1/200 y los IgA han desaparecido).
El tratamiento óptimo y la duración del mismo no están bien definidos, ya que se ha aislado el germen en las válvulas de pacientes tras varios años de tratamiento antibiótico. El régimen terapéutico más eficaz son las doxiciclinas con quinolonas durante un período prolongado, que oscila entre 1 y 3 años, con estricta vigilancia clínica y serológica. El tratamiento quirúrgico esta indicado sólo si se producen complicaciones hemodinámicas, manteniendo el tratamiento antibiótico para evitar la recidiva de la infección sobre el material protésico. El pronóstico es malo con elevada tasa de recidivas y una mortalidad superior al 20%.
Brucellae
Son bacilos gramnegativos intracelulares facultativos con requerimientos nutricionales específicos para su crecimiento. El microorganismo afecta a las glándulas mamarias de los animales infectados y se transmite por contacto directo o por consumo de productos lácteos contaminados no pasteurizados y por inhalación. Supone un riego profesional en ganaderos, veterinarios y personal de laboratorio. Es endémica en España, causando el 3-4% de las EI.
Afecta a pacientes con valvulopatía previa y produce vegetaciones grandes con tendencia a la formación de abscesos perivalvulares. El tratamiento antibiótico óptimo 35 y su duración no están bien establecidos, utilizándose una combinación de tres fármacos o más (doxiciclina, rifampicina, cotrimoxazol y estreptomicina) durante 6-8 semanas. En la mayoría de los casos requiere tratamiento quirúrgico complementario, ya que es un microorganismo muy destructivo en la fase aguda. Tras el recambio valvular, el tratamiento antibiótico debe ser prolongado, y algunos autores 14 recomiendan prolongarlo hasta 10 meses.
Candida y Aspergillus
Es poco frecuente, y supone el 2% de todos los casos de EI 35. Suele asociarse con la presencia de prótesis valvulares, catéteres centrales i.v., inmunodepresión y adicción a drogas por vía parenteral, generalmente en el contexto de una infección diseminada. Típicamente producen grandes vegetaciones que con gran frecuencia embolizan (33-83%) en las arterias periféricas
El tratamiento es controvertido 2; el más utilizado es anfotericina B con o sin fluocitosina durante unas 6 semanas, para continuar con fluconazol oral durante varios meses. En general requieren tratamiento quirúrgico complementario.
Legionella
La adquisición es habitualmente nosocomial 32 en el período perioperatorio y las cepas aisladas suelen ser idénticas a las presentes en el agua del hospital. Los pacientes presentan un cuadro subagudo de fiebre y síndrome constitucional. Las vegetaciones son de pequeño tamaño y rara vez embolizan. Requieren tratamiento antibiótico prolongado 14, 6-17 meses con doxiciclina o eritromicina que se monitoriza con la evolución de la titulación de anticuerpos específicos. El tratamiento quirúrgico es necesario con frecuencia por complicaciones hemodinámicas.
INDICACIONES DE CIRUGÍA EN LA ENDOCARDITIS INFECCIOSA (TABLA 15)
El tratamiento quirúrgico ha supuesto un gran avance en la mejoría del pronóstico de determinadas formas de endocarditis 34,36. Sin embargo, la decisión de intervenir o no a pacientes con endocarditis infecciosa en fase de actividad de la enfermedad debe ser siempre meditada, teniendo en cuenta la situación clínica global del paciente y sus posibilidades reales de supervivencia. El espectro clínico de la enfermedad está cambiando y los enfermos con endocarditis son cada vez más ancianos y tienen otras enfermedades que pueden hacer las indicaciones de cirugía especialmente difíciles. En cuanto al tipo de intervención a realizar se habla de un menor riesgo de reinfección si se implantan bioprótesis u homoinjertos 37, pero ello no está probado y en la mayoría de centros se utilizan prótesis mecánicas con excelentes resultados 38. El papel de las técnicas de reparación valvular también está siendo evaluado 39:
1. Insuficiencia cardíaca. La indicación principal de la cirugía en la fase activa de la infección es la insuficiencia cardíaca secundaria a lesión valvular provocada por la endocarditis 34,36. Salvo en presencia de contraindicaciones o riesgo mayor, el desarrollo de cualquier grado de insuficiencia exige un tratamiento médico adecuado, estabilización clínica, si ello es posible, e indicación quirúrgica. Las endocarditis con más riesgo de presentar esta complicación son las aórticas con regurgitaciones agudas y severas, y las endocarditis protésicas con dehiscencias importantes o más raramente con obstrucciones protésicas secundarias a vegetaciones. La necesidad de cirugía por insuficiencia cardíaca es menos frecuente en las endocarditis mitrales por microorganismos poco agresivos y en la endocarditis derecha del adicto a drogas.
2. Prótesis valvulares. Se debe ser más agresivo en la indicación quirúrgica de las EI sobre prótesis, sobre todo en las formas precoces y en todas aquellas producidas por microorganismos distintos a los estreptococos sensibles a la penicilina. En la mayoría de estos casos suele estar indicada la cirugía ya que la infección comporta habitualmente disfunción de las prótesis y afectación periprotésica grave, con abscesos perianulares 40.
3. Persistencia de cuadro séptico. Otras indicaciones son menos frecuentes y por lo general permiten tomar la decisión de intervenir tras unos días de tratamiento antibiótico y con un carácter menos urgente. La persistencia del cuadro séptico, pasados más de 7 días con tratamiento antibiótico correcto, es una indicación de cirugía una vez se excluyen razonablemente otras causas de fiebre, como serían la existencia de abscesos extracardíacos o la hipersensibilidad a los antibióticos.
4. La endocarditis debidas a microorganismos para los que no se dispone de antibióticos eficaces constituyen también una indicación de cirugía. En este grupo debemos incluir a las endocarditis fúngicas 41, las endocarditis por gérmenes agresivos e inhabituales como los gramnegativos (p. ej., Pseudomonas o enterobacterias) y probablemente se debe plantear la cirugía en las endocarditis estafilocócicas si éstas no responden inmediatamente al tratamiento antibiótico y siempre si se trata de prótesis 42.
5. La documentación de abscesos perivalvulares, por lo general periprotésicos y acompañados de disfunción protésica importante, o la documentación de otras posibles complicaciones intracardíacas, como fístulas, constituyen también una clara indicación de cirugía 43.
6. La existencia de embolismos de repetición, con persistencia de las imágenes de vegetaciones, puede hacer aconsejable la cirugía. Por el contrario, la única documentación de vegetaciones, aunque sean móviles y grandes, no constituye una indicación quirúrgica.
La endocarditis infecciosa (EI) es una enfermedad inflamatoria, exudativa y proliferativa del endocardio, que afecta más frecuentemente a las valvas, producida por gran variedad de microorganismos. Las lesiones más frecuentes son las verrugas o vegetaciones que se forman y crecen a través de la colonización por gérmenes de agregados de fibrina y plaquetas, el denominado trombo fibrinoplaquetario. En la gran mayoría de los casos, estos fenómenos se originan a partir de pequeñas lesiones del endotelio causadas por alteraciones hemodinámicas o presencia de material extraño intracavitario (prótesis, etc.).
Bouillaud empleó los términos de endocardio y endocarditis en 1835, pero fue Osler, desde 1835, quien estudió ampliamente la enfermedad. En 1940 fue tratado el primer paciente con penicilina, y desde entonces se han ido produciendo mejoras en los aspectos clínicos, microbiológicos, diagnósticos y terapéuticos, con mejoría del pronóstico de la enfermedad. La mortalidad, en la fase activa de la EI sobre válvula nativa, es del 12%, con una supervivencia del 81% a los 10 años. En la EI protésica tardía, la mortalidad es inferior al 5% si está causada por estreptococos, y puede ser del 50% si son estafilococos 1. En conjunto, las EI de peor pronóstico son las causadas por gérmenes como los citados estafilococos, hongos, Coxiella burnetii y las protésicas precoces.
PROFILAXIS ANTIBIÓTICA DE LA ENDOCARDITIS INFECCIOSA
Dado que determinados procedimientos diagnóstico-terapéuticos se acompañan de bacteriemia y teniendo en cuenta el especial riesgo que presentan algunas lesiones cardiovasculares a la colonización del germen sobre las mismas, la utilización de agentes antimicrobianos como medida profiláctica para la prevención de endocarditis es una práctica recomendada en la actualidad 2.
En cualquier caso, todo protocolo de profilaxis antimicrobiana de endocarditis debe considerar: el riesgo que la enfermedad cardiovascular de base supone para contraer la enfermedad, el riesgo de bacteriemia que el procedimiento conlleva, los potenciales efectos secundarios del tratamiento a instaurar y la valoración del cociente riesgo/beneficio de dicho tratamiento 3.
No disponemos, hasta el momento, de estudios controlados y aleatorizados que permitan concluir que durante los procedimientos que conllevan una bacteriemia en los pacientes con lesiones cardiovasculares el tratamiento profiláctico con antibiótico asegure una protección frente a la endocarditis. En este sentido, uno de los estudios más amplios realizados hasta el momento demostró que sólo un 6% de los casos de endocarditis podrían haberse prevenido 4.
Por el contrario, otro estudio realizado en pacientes con prótesis valvular que fueron sometidos a extracciones dentales o procedimientos quirúrgicos, y por ello con un riesgo alto de endocarditis bacteriana, demuestra con resultados estadísticamente significativos que los pacientes con tratamiento antibiótico profiláctico, tienen una incidencia menor de endocarditis cuando se comparan con aquellos en los que no se utilizó dicha protección 5. Por ello, y pese a los resultados en ocasiones no superponibles, la morbilidad y mortalidad que conlleva la endocarditis bacteriana así como otras razones de orden médico-legal, justifican que el consenso general sea el del empleo de profilaxis en los pacientes en los que la enfermedad cardíaca, junto con el procedimiento a emplear, comporte un riesgo significativo 6.
Bacteriemia y endocarditis: patogenia
Se ha demostrado una relación entre determinados procedimientos dentales, quirúrgicos y terapéuticos con el hallazgo de bacteriemia causada por microorganismos comúnmente asociados a endocarditis y atribuibles al procedimiento en cuestión. En la tabla 1 se enumeran los procedimientos en los que hay que considerar la necesidad o no de profilaxis, en función, como se explicará, de la cardiopatía existente.
Sin embargo, estas recomendaciones clásicas se han puesto en duda recientemente tras la publicación por Strom et al de un estudio de casos y controles en el que se incluyen 273 casos con endocarditis infecciosa diagnosticados en 54 hospitales y sus correspondientes controles 7. En este estudio, cuyos resultados apoyan los de otros trabajos previos, se concluye que los pacientes con endocarditis, a pesar de tener en una proporción mucho más elevada una cardiopatía predisponente previa (el 38 frente al 6% de los controles), se habían realizado procedimientos dentales en los 3 meses previos con una frecuencia similar a la de los controles (el 16,8% frente al 14,3%), con lo que la odds ratio era de 1,2 (0,7-1,9); es decir, que la realización de un procedimiento dental no representaba un riesgo significativo para el desarrollo de endocarditis, incluso en una población de mayor riesgo para ello. Sólo la extracción de una pieza dental y la cirugía gingival eran ligeramente más frecuentes en el grupo de pacientes con endocarditis que en los controles, pero con un número de casos muy reducido para poder extraer conclusiones tajantes. En un editorial sobre este trabajo, Durack 8 subraya que no se ha demostrado nunca la efectividad de la profilaxis antibiótica en humanos, y mucho menos la relación coste-beneficio, y que el trabajo citado añade más dudas todavía a la necesidad de estas normas de profilaxis. Es posible que en una próxima revisión de dichas pautas se rebajen las exigencias y recomendaciones, y que sólo se mantengan como situaciones de riesgo que necesitan profilaxis la extracción dental y la cirugía gingival (incluyendo la colocación de implantes), y algunas situaciones de riesgo, como las prótesis valvulares y la endocarditis previa. Sin embargo, hasta que estos cambios se produzcan se deben seguir las recomendaciones clásicas referidas en este capítulo (tablas 1 y 2).
Patologías cardíacas
Se considera indicado el tratamiento antibiótico cuando la enfermedad cardíaca subyacente y el procedimiento a emplear comportan un riesgo importante. O lo que es lo mismo, en aquellas enfermedades cardíacas consideradas de riesgo alto y moderado 9,10 (tabla 2), cuando coinciden con procedimientos diagnósticos o terapéuticos en los que se presume la bacteriemia de un germen con potencialidad de producir endocarditis. Por el contrario, y aunque la endocarditis puede aparecer en una persona sin lesión cardíaca previa, no se considera indicada la profilaxis en los pacientes cuya lesión vascular es considerada de bajo riesgo.
Por lo que respecta a la profilaxis en pacientes que son sometidos a la implantación de material protésico endovascular mediante técnicas percutáneas, no existen datos que justifiquen el empleo de dicha profilaxis.
La profilaxis en los casos de prolapso mitral continúa siendo motivo de controversia debido a su amplio espectro en las formas de presentación 9,11. En el momento actual se ha demostrado una relación positiva en el análisis del coste/beneficio de los pacientes con valvas muy engrosadas y con degeneración mixoide y/o la presencia de regurgitación mitral 12,13. En casos menores, el riesgo de endocarditis es similar al de la población normal 11.
Pautas de profilaxis
Con la finalidad de reducir la posibilidad de crear resistencias bacterianas se recomienda iniciar la profilaxis antibiótica inmediatamente antes del procedimiento y sin prolongarlo más de 6-8 h después del mismo, salvo en los casos en los que, por la existencia de una infección establecida, se haga necesario su tratamiento.
En las tablas 3 y 4 se especifican distintos regímenes antibióticos en función del órgano sobre el que se actúa y las circunstancias individuales del paciente.
Los pacientes que van a ser sometidos a cirugía cardíaca constituyen un grupo especial; en ellos debe realizarse una evaluación dental preparatoria completa. Debido a la elevada morbimortalidad de la endocarditis bacteriana en pacientes sometidos a implantes de material protésico intracardíaco o intravascular, se recomienda en ellos la profilaxis perioperatoria antibiótica.
Staphylococcus aureus, estafilococo coagulasa negativo y difteria son gérmenes asociados con la endocarditis durante cirugía cardíaca abierta. Por ello, en estos casos se recomienda el empleo de cefalosporinas u otro antimicrobiano, cuya elección estará en función con el patrón de susceptibilidad de cada centro hospitalario 3. El tratamiento debe ser iniciado inmediatamente antes de la cirugía, con valores intraoperatorios adecuados y mantenidos durante no más de 24 h en el curso postoperatorio.
EL ECOCARDIOGRAMA EN LA ENDOCARDITIS INFECCIOSA
El ecocardiograma tiene un papel muy importante en el diagnóstico y tratamiento de los pacientes con endocarditis infecciosa 14. En la actualidad, la presencia de vegetaciones, abscesos y seudoaneurismas, o la detección de una dehiscencia protésica o una regurgitación valvular de nueva aparición, representan un criterio diagnóstico mayor de endocarditis infecciosa. Estos hallazgos ecocardiográficos forman, junto con los hemocultivos, los pilares básicos en los que se asienta el diagnóstico clínico de endocarditis. Sin embargo, la utilidad de la ecocardiografía en los pacientes con endocarditis va más allá de un simple papel diagnóstico. Puede detectar la extensión perianular de la infección (abscesos, seudoaneurismas, fístulas) y otras complicaciones intracardíacas (rotura de cuerdas, derrame pericárdico, etc.), valorar la existencia y el grado de disfunción valvular, nativa o protésica, y su repercusión hemodinámica, estudiar los aspectos morfológicos y dinámicos de la vegetación y su relación con el embolismo, influir en la decisión de cuándo y cómo debe ser intervenido un paciente, efectuar una evaluación posquirúrgica del enfermo y, por último, proporcionar una idea sobre el pronóstico del paciente 15.
En todo paciente con sospecha de endocarditis se debe realizar un ecocardiograma. No es correcta la utilización rutinaria del ecocardiograma en todo paciente con fiebre. El ecocardiograma permite la visualización de las vegetaciones, que son la lesión fundamental de la endocarditis y constituyen un criterio diagnóstico mayor. Se trata de masas de morfología y márgenes irregulares con una densidad ecogénica parecida a la de los trombos, adheridas al anillo protésico o a las valvas y con un movimiento caótico independiente de las mismas. La sensibilidad de la ecocardiografía transtorácica en la detección de vegetaciones está en torno al 60%, porcentaje que depende fundamentalmente de la población estudiada y de la experiencia en la realización de la prueba. La alta resolución de las imágenes ecocardiográficas obtenidas con sondas transesofágicas aumenta las posibilidades diagnósticas de la ecocardiografía. La sensibilidad de la ecocardiografía transesofágica en la detección de vegetaciones oscila entre el 94 y el 100%. Por tanto, ante un cuadro clínico sugestivo, la negatividad de la exploración ecocardiográfica convencional obliga a la práctica de un ecocardiograma transesofágico, sobre todo en pacientes con prótesis valvulares o en sujetos con una ventana acústica transtorácica inadecuada 16.
Las vegetaciones pueden aumentar de tamaño si el tratamiento antibiótico no es efectivo, disminuir e incluso desaparecer. Es un hecho frecuente la persistencia de la vegetación después del tratamiento efectivo de un episodio de endocarditis 17. La detección de vegetaciones tras el tratamiento de la endocarditis no influye en el pronóstico del paciente. No está claro si el tamaño de las vegetaciones influye en la valoración pronóstica inicial; en cualquier caso, su papel en la indicación quirúrgica del paciente debe ser cuidadosamente individualizado y valorado en el contexto clínico general.
En la endocarditis protésica, el ecocardiograma transesofágico es superior al transtorácico por tres razones: es capaz de visualizar vegetaciones de pequeño tamaño, cuantificar mejor la insuficiencia protésica y periprotésica y detectar con más exactitud la presencia de complicaciones perianulares. La modalidad transesofágica es capaz de visualizar vegetaciones de pequeño tamaño; por el contrario, la ecocardiografía transtorácica sólo detecta el 25% de las vegetaciones menores de 5 mm y el 69% de las vegetaciones entre 6 y 10 mm. En presencia de una prótesis, sobre todo en posición mitral, el ecocardiograma transtorácico es claramente inferior, pues la atenuación, las reverberaciones y otros artefactos que producen las estructuras protésicas, en particular las mecánicas, en la aurícula izquierda impiden la visualización de las vegetaciones y la detección de chorros de regurgitación perivalvular, que si son de nueva aparición constituyen un criterio mayor de endocarditis. Hay que señalar, no obstante, que la regurgitación periprotésica no es específica de endocarditis. En las prótesis aórticas, el ecocardiograma transesofágico también es superior al transtorácico en la visualización de vegetaciones pero, además, también lo es en la detección de la extensión perivalvular de la infección (abscesos, seudoaneurismas y fístulas periaórticas y de la continuidad mitroaórtica) 18. Estas complicaciones son, al igual que las vegetaciones, un criterio mayor de endocarditis. En algunos casos de endocarditis protésica no se detectan vegetaciones y sí complicaciones perianulares de la endocarditis. El tamaño de la vegetación no es útil para predecir la extensión perianular de la infección. Ésta es más frecuente en la endocarditis aórtica y, sobre todo, en la endocarditis aórtica protésica precoz. Los seudoaneurismas son cavidades ecolucentes en contacto con la luz vascular y, por tanto, tienen flujo en su interior. El absceso es una cavidad cerrada, sin flujo en su interior y suele tener una densidad ecográfica inferior a la de las estructuras adyacentes. La sensibilidad y especificidad de la ecocardiografía transesofágica en la detección de estas complicaciones son muy altas, alrededor del 90% 18, y la exactitud diagnóstica de esta técnica es más elevada para el seudoaneurisma que para el absceso. Una perforación secundaria del seudoaneurisma o del absceso en otra cavidad provoca la formación de una fístula, siendo las más frecuentes con la aurícula izquierda; sin embargo, esta complicación es muy poco frecuente. En algunos pacientes con endocarditis protésica y afectación perianular se puede objetivar una dehiscencia parcial de la prótesis que, si es lo suficientemente extensa, puede ocasionar un movimiento protésico muy característico conocido como Òcabeceo protésicoÓ. La dehiscencia protésica es también un criterio mayor de endocarditis.
A pesar de que la modalidad ecográfica preferida para el estudio de las prótesis en la endocarditis es la transesofágica, la ecocardiografía convencional ofrece datos sobre la función ventricular y la hemodinámica valvular, de modo que su información es complementaria y puede servir de guía al estudio transesofágico. Por tanto, es aconsejable realizar un estudio ecográfico secuencial, primero transtorácico y después transesofágico.
El valor predictivo negativo de un ecocardiograma transesofágico en el diagnóstico de endocarditis es muy alto (95%), lo que significa que si no hay lesiones ecocardiográficas típicas de endocarditis en el estudio transesofágico es muy probable que el paciente no tenga esta enfermedad 19. Sin embargo, si la sospecha clínica es importante, sobre todo si el paciente es portador de una prótesis aórtica, no se puede descartar el diagnóstico de endocarditis y conviene repetir el estudio una días después.
En la actualidad, en la mayoría de centros en los que se dispone de ecocardiografía transesofágica se utiliza esta técnica en casi todos los pacientes con endocarditis. Sin embargo, no siempre es imprescindible. En pacientes con endocarditis sobre válvula nativa con un estudio transtorácico adecuado, sin insuficiencia cardíaca, buena respuesta al tratamiento antibiótico y sin imágenes sugerentes de complicaciones perivalvulares no es necesario recurrir a la vía transesofágica. En la endocarditis derecha, el ecocardiograma transesofágico no es superior al transtorácico, sobre todo en heroinómanos 20; la válvula tricúspide al ser una estructura anterior se estudia bien con el ecocardiograma transtorácico. Estos pacientes suelen ser jóvenes y delgados y, por tanto, tienen una ventana acústica adecuada y, además, las vegetaciones derechas son de mayor tamaño que las de las válvulas izquierdas. Estos hechos explican la suficiencia del ecocardiograma transtorácico en estos pacientes. Una excepción es la infección de los marcapasos y de otros catéteres intracavitarios: en estos casos el ecocardiograma transesofágico es de elección 21. Las indicaciones de la ecocardiografía transesofágica en la endocarditis infecciosa se señalan en la tabla 5.
CRITERIOS DIAGNÓSTICOS DE LA ENDOCARDITIS INFECCIOSA
El diagnóstico definitivo de la endocarditis infecciosa sólo puede realizarse con seguridad absoluta mediante la demostración del germen o de la histología específica en las vegetaciones o en material embólico, generalmente obtenidos a través del acto quirúrgico o de la necropsia. Sin embargo, y debido a la necesidad de alcanzar un diagnóstico lo más precoz posible, en la mayoría de los casos dicho diagnóstico se realiza sobre la base de la clínica del paciente. Las dificultades diagnósticas de la endocarditis infecciosa derivan de la gran variedad de manifestaciones clínicas con que puede presentarse la enfermedad, que pueden confundirse con otras enfermedades sistémicas. Por ello, un alto grado de sospecha es fundamental para su diagnóstico.
El diagnóstico es evidente en los pacientes que presentan todas o la mayoría de las manifestaciones clínicas clásicas: bacteriemia o fungemia, evidencia de valvulitis activa, fenómenos embólicos o fenómenos vasculares de origen inmunológico. Sin embargo, en muchos pacientes estos signos pueden estar ausentes 22, por lo que ha sido preciso establecer una serie de criterios diagnósticos que reúnan una sensibilidad y especificidad adecuadas. Es importante tener en cuenta que la ausencia de cualquiera de las manifestaciones clásicas de endocarditis no excluye su diagnóstico; es decir, puede existir una endocarditis infecciosa en pacientes sin gérmenes aislados en los cultivos, vegetaciones en el ecocardiograma, fenómenos embólicos o sin cardiopatía predisponente, por poner unos ejemplos.
Los datos y parámetros valorados en los criterios diagnósticos de endocarditis infecciosa son de tres tipos: clínicos, microbiológicos y ecocardiográficos. En 1981, Von Reyn et al propusieron unos criterios diagnósticos estrictos basados fundamentalmente en datos clínicos y microbiológicos 23, que son los que se han venido utilizando hasta la introducción más reciente, en 1994, por Durack et al, de los criterios de Duke 24. Von Reyn distinguía tres tipos de diagnóstico, con mayor o menor seguridad: diagnóstico de certeza, de probabilidad y de posibilidad. En la tabla 6 se reflejan los requerimientos necesarios para considerar como endocarditis un caso sospechoso; los datos diagnósticos más importantes son los microbiológicos (aislamiento del mismo germen en la mayoría de los hemocultivos obtenidos, 2 al menos), la existencia de una cardiopatía predisponente y algunos hallazgos clínicos (fiebre, fenómenos embólicos o vasculares, nuevos soplos).
Algunas limitaciones de estos criterios se han ido viendo con el paso de los años. En primer lugar, sólo en una minoría de los pacientes era posible establecer un diagnóstico de certeza. En segundo lugar, no se tenía en cuenta la aparición de nuevos factores predisponentes, como la adicción a drogas por vía parenteral. En tercer lugar, tampoco se establecía el valor de los hallazgos del ecocardiograma 14. Por tanto, la aplicación de estos criterios, aunque muy importante por sentar las bases del diagnóstico y tratamiento de la endocarditis infecciosa, presenta la limitación de que muchos casos de endocarditis podrían no ser diagnosticados como tales (sensibilidad reducida). Este problema parece haberse resuelto en gran parte con los nuevos criterios de Durack, que se especifican en la tabla 7 24. Esta clasificación establece un diagnóstico definitivo, basado no sólo en los criterios histomicrobiológicos (que corresponderían al diagnóstico de certeza de Von Reyn), sino también en criterios clínicos, microbiológicos y ecocardiográficos mayores o menores (tablas 7 y 8), y un diagnóstico de posibilidad (tabla 7). Así mismo, se establecen también criterios para descartar el diagnóstico de endocarditis (tabla 7).
Las ventajas de esta clasificación son la inclusión, entre los criterios diagnósticos, de la adicción a drogas por vía parenteral y los hallazgos del ecocardiograma, además de los clínicos y microbiológicos clásicos de Von Reyn (tabla 8) y, por tanto, la sensibilidad alcanzada es mayor sin haber perdido especificidad 14, así como el mayor porcentaje de casos con diagnóstico de certeza. Entre los hallazgos ecocardiográficos, sólo 3 se consideran criterios mayores: vegetaciones claras, abscesos perianulares o dehiscencia protésica nueva; otras alteraciones sugestivas pero distintas a estas 3 se consideran criterios menores. Entre los criterios menores se incluye también la evidencia serológica de infección activa por gérmenes que típicamente causan endocarditis (criterio también ausente en la clasificación de Von Reyn) 24. Diversos estudios, en los que se incluyen más de 1.700 pacientes, han confirmado la mayor sensibilidad de estos criterios respecto a los de Von Reyn 14 en todos los subgrupos de pacientes (distintas edades, endocarditis protésicas y nativas, adictos a drogas o no, etc.). El valor predictivo negativo de los criterios de Duke también es muy elevado; en un estudio reciente fue superior al 98% 25, lo que indica que cuando no se cumplen los criterios de endocarditis la probabilidad de que a pesar de todo se trate de una endocarditis es casi nula. La especificidad en otro estudio sobre 100 pacientes fue del 99%; sólo en un paciente en que existía otro diagnóstico alternativo se confirmó posteriormente la existencia de endocarditis 26.
Todos estos estudios indican que el diagnóstico de endocarditis infecciosa en la actualidad debe hacerse aplicando los criterios de Duke, que presentan una sensibilidad, especificidad y valor predictivo negativo muy elevados, superiores al 95% 14. Es posible que estos parámetros puedan mejorarse aún más, sobre todo la sensibilidad (para evitar falsos diagnósticos negativos), aumentando el número de criterios menores: evidencias serológicas específicas para algunos gérmenes, como Coxiella, Brucella o Bartonella27; datos analíticos, como aumento de la velocidad de sedimentación, proteína C reactiva o microhematuria; hallazgos clínicos, como esplenomegalia, etc. En un estudio reciente, la adición de estos criterios menores a los originales de Durack aumentó la sensibilidad en un 10%, sin que disminuyera la especificidad.
El importante papel que desempeñan los hallazgos de los ecocardiogramas transtorácico y transesofágico no se circunscribe sólo al diagnóstico de la endocarditis, sino que también aporta trascendentes implicaciones terapéuticas y de manejo. Otro aspecto a considerar es que la negatividad inicial de un estudio ecocardiográfico no excluye de forma absoluta el diagnóstico de endocarditis, por lo que pueden ser necesarios estudios seriados con un cierto intervalo de tiempo o por diferentes vías. En la figura 1 28 se propone un protocolo de actuación, basado en los datos clínicos y ecocardiográficos, en pacientes con sospecha de endocarditis infecciosa.
Fig. 1. Aportación del ecocardiograma al diagnóstico y manejo de la endocarditis infecciosa. ETT: ecocardiograma transtorácico; ETE: ecocardiograma transesofágico. *Sospecha clínica alta: bacteriemia persistente, cardiopatía predisponente. **Datos de alto riesgo: gérmenes virulentos, destrucción valvular o perivalvular, evolución clínica desfavorable.
TRATAMIENTO
Normas generales
El tratamiento de la EI se basa en la administración del antibiótico más adecuado, a la dosis necesaria y durante el tiempo suficiente para erradicar el germen responsable de las vegetaciones endocárdicas 29. Este tratamiento requiere en algunos casos ser complementado con cirugía cardíaca (infección persistente, extensión perivalvular de la infección, inestabilidad hemodinámica), siendo recomendable que las formas de mayor riesgo (endocarditis aórticas, endocarditis protésicas y las causadas por microorganismos virulentos) sean tratadas en medios hospitalarios que dispongan de cirugía cardíaca o de un drenaje rápido a un servicio de cirugía cardíaca.
Los antibióticos deben utilizarse a dosis altas y por vía intravenosa, excepto cuando no sea posible, durante un tiempo prolongado, de 4-6 semanas, para evitar las recidivas y erradicar los focos metastásicos. En la mayoría de los pacientes el tratamiento se inicia una vez conocido el germen responsable y el tratamiento se realiza según el antibiograma. Las pautas más habituales se describen en las tablas 9-12 30,31.
En determinadas circunstancias, el estado clínico del paciente requiere una actuación rápida (estado séptico, insuficiencia cardíaca con importante destrucción valvular), siendo necesario pautar un tratamiento antibiótico empírico, siempre tras la toma de al menos 3 hemocultivos. En la selección de la pauta antibiótica es necesario considerar los microorganismos causales más frecuentes tabla 13 29, su perfil clínico característico y sus peculiaridades epidemiológicas.
Las EI sobre válvula nativa con curso agudo generalmente son estafilocócicas y las de curso subagudo estreptocócicas. En la EI en pacientes con prótesis valvulares 32, se distinguen dos grupos: a) las precoces que se presentan en los primeros 12 meses tras la cirugía y sus gérmenes productores son de adquisición nosocomial, siendo Staphylococcus epidermidis el más frecuente, y b) las tardías, que tiene un espectro microbiológico similar a la EI sobre válvula nativa. Además, existen peculiaridades epidemiológicas que decantan la máxima probabilidad hacia un microorganismo concreto; así, en la EI en un paciente con neoplasia intestinal generalmente el germen responsable es Streptococcus bovis, y en las aparecidas tras manipulaciones obstétricas o genitourinarias el germen productor típico es el enterococo.
Una vez conocido el germen responsable, aislado de los hemocultivos, se optimizará el tratamiento antibiótico empírico utilizado (tabla 14). En la EI es necesaria una estrecha monitorización de la eficacia antibiótica 33 para el ajuste individualizado de la dosis y para conseguir la máxima eficacia terapéutica. Se utiliza la CMI (concentración mínima inhibitoria), que es la concentración mínima necesaria del antibiótico para matar in vitro al microorganismo causal de la infección, con el objetivo de asegurarse de que en el lugar de la infección se alcancen concentraciones superiores a la CMI en los intervalos entre las dosis del fármaco. Una alternativa es el PBS (poder bactericida del suero): a las 48 h de empezar el tratamiento se mezcla el suero del paciente extraído en el pico y en el valle de los antibióticos, se diluye y se inocula con el microorganismo causante de la infección. Para que el tratamiento sea eficaz se requiere como mínimo que el suero diluido 8 veces sea capaz de destruir la bacteria infectante (es muy útil con microorganismos multirresistentes o poco habituales). La EI con buena evolución con la pauta antibiótica prescrita al inicio no requieren esta monitorización tan especifica, que está especialmente indicada en los pacientes con evolución tórpida.
El estado clínico de los pacientes debe revisarse a diario 29-34, vigilando la posible aparición de signos de insuficiencia cardíaca, alteraciones del ritmo o conducción cardíaca, fenómenos embólicos o clínica neurológica. Debe, así mismo, vigilarse la posibilidad de que aparezcan efectos tóxicos de los antibióticos. La persistencia del cuadro febril o la aparición de fiebre durante el tratamiento plantea varias posibilidades diagnósticas que deben descartarse en cada caso: fiebre medicamentosa (en general asociada a eosinofilia), flebitis superficial en relación con la vía de administración del antibiótico, foco séptico extracardíaco o absceso intracardíaco.
Una vez finalizado el tratamiento antibiótico, debe procederse a realizar hemocultivos de control antes de asegurar la curación bacteriológica, siendo recomendable realizar el último hemocultivo a los 2 meses de completado el ciclo antibiótico, que es el período con mayor riesgo de recidiva. Si reaparece la infección, se tratará de nuevo médicamente y se planteará el recambio valvular si se trata de gérmenes de tratamiento difícil o muy virulentos.
La anticoagulación 34 está contraindicada como norma en los pacientes con EI ya que no previene los fenómenos embólicos e incrementa el riesgo de hemorragia cerebral por rotura de un aneurisma micótico o la conversión de un infarto isquémico en hemorrágico. Sin embargo, si la cardiopatía de base lo hace necesario, como ocurre en los pacientes portadores de prótesis valvulares, la anticoagulación debe mantenerse. En las fases iniciales del tratamiento, cuando el riesgo embolígeno es más alto, es prudente sustituir los dicumarínicos por heparina. Tras la aparición de una complicación neurológica la anticoagulación debe suspenderse transitoriamente.
Endocarditis con hemocultivos negativos
Actualmente los hemocultivos son negativos en el 5% de las EI diagnosticadas con criterios estrictos 14. Las causas implicadas son:
1. La más frecuente es el tratamiento antimicrobiano previo derivado de un diagnóstico incorrecto. Lógicamente la susceptibilidad del microorganismo y el tiempo del tratamiento antimicrobiano determinan la persistencia de los hemocultivos negativos. Si el tratamiento ha durado 2-3 días, los hemocultivos son negativos sólo los primeros días. Si se ha recibido un tratamiento antibiótico completo, los hemocultivos son negativos durante semanas. En estos pacientes debe diferirse el tratamiento antimicrobiano empírico durante 3-4 días y seriar los hemocultivos para detectar el microorganismo causal y realizar el tratamiento antimicrobiano óptimo, disminuyendo la morbimortalidad de la EI. Sin embargo, si el paciente tiene un aspecto séptico, insuficiencia cardíaca o existen datos ecocardiográficos de insuficiencia valvular progresiva se debe iniciar tratamiento antibiótico empírico; actualmente el más recomendado 2 es vancomicina, 15 mg/kg/12 h i.v. más gentamicina, 1 mg/kg/8 h i.m. o i.v.
2. La naturaleza del agente causal 33, que requiere para su correcto aislamiento técnicas microbiológicas especificas: a) la prolongación de los tiempos de incubación y el uso de medios especiales han permitido el aislamiento de bacterias del grupo HACEK ( Haemophilus spp., Actinobacillus actinomycetem comitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae), Brucella spp., Legionella spp. y Mycobacterium spp.; b) la utilización de técnicas serológicas específicas ha supuesto una importante ayuda para la identificación de determinados microorganismos ( Coxiella burnetii, Chlamydia psittaci, Chlamydia pneumoniae, Mycoplasma spp., Legionella pneumoniae, Brucella spp. y Bartonella spp.), y c) en pacientes con riesgo especial de sufrir endocarditis fúngica ( Candida spp., Aspergillus spp., Cephalosporium spp.) como consumidores de droga por vía parenteral o pacientes con tratamientos antimicrobianos prolongados se deben utilizar medios de cultivo y técnicas especificas (lisis-centrifugación) y/o métodos serológicos para su identificación.
Además de las técnicas serológicas y de los hemocultivos, el cultivo de vegetaciones 1 valvulares procedentes de la cirugía cardíaca o de una embolia periférica también pueden contribuir al aislamiento del agente causal.
Endocarditis infecciosa por microorganismos poco frecuentes
Coxiella burnetii
Es un bacilo gramnegativo, patógeno intracelular obligado, productor de la fiebre Q, con gran resistencia a la desecación y a los desinfectantes. Su distribución es universal, afecta al ganado (vacas, cabras y ovejas) y a animales domésticos. Se elimina por la leche, orina, heces y tejido placentario, donde se multiplica con rapidez. Se adquiere por inhalación, contacto o consumo de materiales contaminados. Supone un riesgo ocupacional para personal de laboratorio, pastores y veterinarios.
El cuadro clínico que produce es subagudo 35, de meses o incluso años de evolución, de fiebre y síndrome constitucional. Las vegetaciones que produce son de pequeño tamaño y se requiere la ecocardiografía transesofágica para su correcta visualización. La insuficiencia cardíaca y los fenómenos embólicos y de autoinmunidad son frecuentes. Típicamente afecta a pacientes con prótesis valvulares, valvulopatía previa o inmunodeprimidos.
El diagnóstico radica en la sospecha clínica ante un cuadro de EI con hemocultivos negativos y las técnicas serológicas son especialmente útiles. El diagnóstico de enfermedad se establece con un título de anticuerpos IgG ³ 1/800 y de IgA ³ 1/200. La serología se utiliza para monitorizar la evolución tras el tratamiento antibiótico, con un descenso progresivo de los títulos de anticuerpos hasta la curación (IgG < 1/200 y los IgA han desaparecido).
El tratamiento óptimo y la duración del mismo no están bien definidos, ya que se ha aislado el germen en las válvulas de pacientes tras varios años de tratamiento antibiótico. El régimen terapéutico más eficaz son las doxiciclinas con quinolonas durante un período prolongado, que oscila entre 1 y 3 años, con estricta vigilancia clínica y serológica. El tratamiento quirúrgico esta indicado sólo si se producen complicaciones hemodinámicas, manteniendo el tratamiento antibiótico para evitar la recidiva de la infección sobre el material protésico. El pronóstico es malo con elevada tasa de recidivas y una mortalidad superior al 20%.
Brucellae
Son bacilos gramnegativos intracelulares facultativos con requerimientos nutricionales específicos para su crecimiento. El microorganismo afecta a las glándulas mamarias de los animales infectados y se transmite por contacto directo o por consumo de productos lácteos contaminados no pasteurizados y por inhalación. Supone un riego profesional en ganaderos, veterinarios y personal de laboratorio. Es endémica en España, causando el 3-4% de las EI.
Afecta a pacientes con valvulopatía previa y produce vegetaciones grandes con tendencia a la formación de abscesos perivalvulares. El tratamiento antibiótico óptimo 35 y su duración no están bien establecidos, utilizándose una combinación de tres fármacos o más (doxiciclina, rifampicina, cotrimoxazol y estreptomicina) durante 6-8 semanas. En la mayoría de los casos requiere tratamiento quirúrgico complementario, ya que es un microorganismo muy destructivo en la fase aguda. Tras el recambio valvular, el tratamiento antibiótico debe ser prolongado, y algunos autores 14 recomiendan prolongarlo hasta 10 meses.
Candida y Aspergillus
Es poco frecuente, y supone el 2% de todos los casos de EI 35. Suele asociarse con la presencia de prótesis valvulares, catéteres centrales i.v., inmunodepresión y adicción a drogas por vía parenteral, generalmente en el contexto de una infección diseminada. Típicamente producen grandes vegetaciones que con gran frecuencia embolizan (33-83%) en las arterias periféricas
El tratamiento es controvertido 2; el más utilizado es anfotericina B con o sin fluocitosina durante unas 6 semanas, para continuar con fluconazol oral durante varios meses. En general requieren tratamiento quirúrgico complementario.
Legionella
La adquisición es habitualmente nosocomial 32 en el período perioperatorio y las cepas aisladas suelen ser idénticas a las presentes en el agua del hospital. Los pacientes presentan un cuadro subagudo de fiebre y síndrome constitucional. Las vegetaciones son de pequeño tamaño y rara vez embolizan. Requieren tratamiento antibiótico prolongado 14, 6-17 meses con doxiciclina o eritromicina que se monitoriza con la evolución de la titulación de anticuerpos específicos. El tratamiento quirúrgico es necesario con frecuencia por complicaciones hemodinámicas.
INDICACIONES DE CIRUGÍA EN LA ENDOCARDITIS INFECCIOSA (TABLA 15)
El tratamiento quirúrgico ha supuesto un gran avance en la mejoría del pronóstico de determinadas formas de endocarditis 34,36. Sin embargo, la decisión de intervenir o no a pacientes con endocarditis infecciosa en fase de actividad de la enfermedad debe ser siempre meditada, teniendo en cuenta la situación clínica global del paciente y sus posibilidades reales de supervivencia. El espectro clínico de la enfermedad está cambiando y los enfermos con endocarditis son cada vez más ancianos y tienen otras enfermedades que pueden hacer las indicaciones de cirugía especialmente difíciles. En cuanto al tipo de intervención a realizar se habla de un menor riesgo de reinfección si se implantan bioprótesis u homoinjertos 37, pero ello no está probado y en la mayoría de centros se utilizan prótesis mecánicas con excelentes resultados 38. El papel de las técnicas de reparación valvular también está siendo evaluado 39:
1. Insuficiencia cardíaca. La indicación principal de la cirugía en la fase activa de la infección es la insuficiencia cardíaca secundaria a lesión valvular provocada por la endocarditis 34,36. Salvo en presencia de contraindicaciones o riesgo mayor, el desarrollo de cualquier grado de insuficiencia exige un tratamiento médico adecuado, estabilización clínica, si ello es posible, e indicación quirúrgica. Las endocarditis con más riesgo de presentar esta complicación son las aórticas con regurgitaciones agudas y severas, y las endocarditis protésicas con dehiscencias importantes o más raramente con obstrucciones protésicas secundarias a vegetaciones. La necesidad de cirugía por insuficiencia cardíaca es menos frecuente en las endocarditis mitrales por microorganismos poco agresivos y en la endocarditis derecha del adicto a drogas.
2. Prótesis valvulares. Se debe ser más agresivo en la indicación quirúrgica de las EI sobre prótesis, sobre todo en las formas precoces y en todas aquellas producidas por microorganismos distintos a los estreptococos sensibles a la penicilina. En la mayoría de estos casos suele estar indicada la cirugía ya que la infección comporta habitualmente disfunción de las prótesis y afectación periprotésica grave, con abscesos perianulares 40.
3. Persistencia de cuadro séptico. Otras indicaciones son menos frecuentes y por lo general permiten tomar la decisión de intervenir tras unos días de tratamiento antibiótico y con un carácter menos urgente. La persistencia del cuadro séptico, pasados más de 7 días con tratamiento antibiótico correcto, es una indicación de cirugía una vez se excluyen razonablemente otras causas de fiebre, como serían la existencia de abscesos extracardíacos o la hipersensibilidad a los antibióticos.
4. La endocarditis debidas a microorganismos para los que no se dispone de antibióticos eficaces constituyen también una indicación de cirugía. En este grupo debemos incluir a las endocarditis fúngicas 41, las endocarditis por gérmenes agresivos e inhabituales como los gramnegativos (p. ej., Pseudomonas o enterobacterias) y probablemente se debe plantear la cirugía en las endocarditis estafilocócicas si éstas no responden inmediatamente al tratamiento antibiótico y siempre si se trata de prótesis 42.
5. La documentación de abscesos perivalvulares, por lo general periprotésicos y acompañados de disfunción protésica importante, o la documentación de otras posibles complicaciones intracardíacas, como fístulas, constituyen también una clara indicación de cirugía 43.
6. La existencia de embolismos de repetición, con persistencia de las imágenes de vegetaciones, puede hacer aconsejable la cirugía. Por el contrario, la única documentación de vegetaciones, aunque sean móviles y grandes, no constituye una indicación quirúrgica.
Bibliografía
[1]
Historia natural y pronóstico de la endocarditis infecciosa. Rev Esp Cardiol 1998; 51 (Supl 2): 40-43.
[2]
Prevention of bacterial endocarditis: recommendations by the American Heart Association. JAMA 1990; 264: 2919-2922.
[3]
Prevention of bacterial endocarditis: recommendations by the American Heat Association. JAMA 1997; 277: 1794-1801.
[4]
Efficacy of antibiotic prophylaxis for prevention of native valve endocarditis. Lancet 1992; 339: 135-139.
[5]
Contribution for choosing the optimal prophylaxis of bacterial endocarditis. Eur Heart J 1987; 8 (Supl): 379-381.
[6]
¿Se debe realizar profilaxis? ¿Es realmente efectiva? Riesgo de endocarditis tras cirugía cardíaca. Rev Esp Cardiol 1998; 51: 44-50.
[7]
Dental and cardiac risk factors for infective endocarditis. A population-based, case-control study. Ann Intern Med 1998; 129: 761-769.
[8]
Antibiotics for prevention of endocarditis during dentistry: time to scale back? Ann Intern Med 1998; 129: 829-831.
[9]
Risk factors for infective endocarditis. Infect Dis Clin North Am 1993; 7: 9-19.
[10]
Prevention of infective endocarditis. N Engl J Med 1995; 332: 38-44.
[11]
Mitral valve disease. Current Probl Cardiol 1993; 7: 423-478.
[12]
Cost-effectiveness of infective endocarditis prophylaxis for mitral valve prolapse with and without a mitral regurgitant murmur. Am J Cardiol 1994; 74: 1024-1029.
[13]
Mitral valve prolapse: causes, clinical manifestation, and management. Ann Intern Med 1989; 111: 305-317.
[14]
Diagnosis and management of infective endocarditis and its complications. Circulation 1998; 98: 2936-2948.
[15]
ACC/AHA guidelines for the clinical application of echocardiography: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Clinical Application of Echocardiography), developed in collaboration with the American Society of Echocardiography. Circulation 1997; 95: 1686-1744.
[16]
Diagnostic value of transesophageal compared with transthoracic echocardiography in infective endocarditis. J Am Coll Cardiol 1991; 18: 391-397.
[17]
Natural history of vegetations during successful medical treatment of endocarditis. Am Heart J 1994; 128: 1200-1209.
[18]
Improvement in the diagnosis of abscesses associated with endocarditis by transesophageal echocardiography. N Engl J Med 1991; 324: 795-800.
[19]
Implication of negative results on a monoplane transesophageal echocardiographic study in patients with suspected infective endocarditis. J Am Coll Cardiol 1993; 21: 216-221.
[20]
Transesophageal echocardiography in right side endocarditis. J Am Coll Cardiol 1993; 21: 1226-1230.
[21]
Usefulness of transesophageal endocardiography for diagnosis of infected transvenous permanent pacemakers. Circulation 1994; 89: 2684-2687.
[22]
Infective endocarditis. Clin Infect Dis 1993; 17: 313-320.
[23]
Infective endocarditis: an analysis based on strict case definitions. Ann Intern Med 1981; 94: 505-518.
[24]
New criteria for diagnosis of infective endocarditis: utilisation of specific echocardiographic findings. Duke Endocarditis Service. Am J Med 1994; 96: 200-209.
[25]
Negative predictive value of the Duke criteria for infective endocarditis. Am J Cardiol 1996; 77: 403-407.
[26]
The Duke criteria for diagnosing infective endocarditis are specific; analysis of 100 patients with acute fever of unknown origin. Clin Infect Dis 1996; 23: 298-302.
[27]
Modification of the diagnostic criteria proposed by the Duke Endocarditis Service to permit improved diagnosis of Q fever endocarditis. Am J Med 1996; 100: 629-633.
[28]
Criterios diagnósticos de endocarditis infecciosa de Von Reyn a Duke. Ecocardiografía transtorácica y transesofágica. Rev Esp Cardiol 1998; 51 (Supl 2): 29-38.
[29]
Profilaxis y manejo del paciente con endocarditis infecciosa. En: Normas de actuación clínica en cardiología. Madrid: Sociedad Española de Cardiología, 1996; 89-98.
[30]
J Am Coll Cardiol 1998; 32: 1486-1588.
[31]
Tratamiento de la endocarditis infecciosa sobre válvula nativa en pacientes no adictos a drogas por vía parenteral. Rev Esp Cardiol 1998; 51 (Supl 2): 51- 57.
[32]
Endocarditis protésica. Rev Esp Cardiol 1998; 51 (Supl 2): 58-63.
[33]
El control del laboratorio en el diagnóstico y tratamiento de la endocarditis infecciosa. Rev Esp Cardiol 1998; 51 (Supl 2): 22-28.
[34]
Infective endocarditis. En: Braunwald E, editor. Heart disease a text book of cardiovascular medicine. Filadelfia: WB Saunders Company, 1997; 1077-1105.
[35]
Endocarditis infecciosa por microorganismos poco frecuentes. Rev Esp Cardiol 1998; 51 (Supl 2): 79-86.
[36]
Surgical treatment of endocarditis. Prog Cardiovasc Dis 1997; 40: 239-264.
[37]
Homograft replacement of the mitral valve: graft selection, technique of implantation and results of forty-three patients. J Thorac Cardiovasc Surg 1996; 111: 367-378.
[38]
Operation for infective endocarditis: results after implantation of mechanical valves. Ann Thorac Surg 1998; 65: 359-364.
[39]
Mitral valve repair for bacterial endocarditis. J Thorac Cardiovasc Surg 1992; 103: 124-128.
[40]
Surgical treatment of prosthetic valve endocarditis. J Thorac Cardiovasc Surg 1996; 111: 198-207.
[41]
Fungal endocarditis. Eur Heart J 1995; 16 (Supl B): 84-89.
[42]
Staphylococcus aureus prosthetic valve endocarditis: optimal management and risk factors for death. Clin Infec Dis 1998; 26: 1302-1309.
[43]
Prosthetic valve endocarditis with ring abscesses: surgical management and long term results. J Thorac Cardiovasc Surg 1993; 105: 1106-1113.