Las enfermedades de las válvulas cardíacas, que siguen siendo una causa importante de morbimortalidad en todo el mundo, han sufrido cambios radicales desde hace 40 años, en que se implantaron las primeras prótesis. Estos cambios han sido propiciados por los avances científico-tecnológicos, pero también por la mejoría en las condiciones de vida de los países desarrollados. La disponibilidad de la penicilina para tratar las faringoamigdalitis estreptocócicas y un menor hacinamiento que el existente antaño han hecho de la fiebre reumática una rara entidad en los países desarrollados. Como contrapartida, han aparecido a lo largo de los años otras formas de afectación valvular. La etiología de algunas de estas valvulopatías (p. ej., la válvula mitral mixomatosa) sigue siendo desconocida; otras, como la estenosis valvular aórtica calcificada de tipo senil, parecen ser el tributo a pagar por el alargamiento en la expectativa de vida. Por lo que respecta al diagnóstico, la ecocardiografía se ha erigido en una poderosísima herramienta para visualizar los cambios anatómicos de las válvulas, interpretar los complejos trastornos hemodinámicos y valorar la repercusión sobre el ventrículo izquierdo. Además, la iteración de estas exploraciones incruentas ha permitido conocer mucho mejor la historia natural de las valvulopatías leves o moderadas y precisar más adecuadamente el momento idóneo de la intervención quirúrgica, sin esperar, en muchos casos, la aparición de sintomatología avanzada. Esto ha sido posible también por los grandes avances de la cirugía, que se pueden resumir en: a) la mejora de las técnicas de circulación extracorpórea y de la protección miocárdica; b) el perfeccionamiento de los sustitutos valvulares, tanto mecánicos como biológicos; c) la introducción de técnicas imaginativas para reparar las lesiones de la válvula mitral, y d) la utilización del eco transesofágico para valorar intraoperatoriamente la calidad de la reparación valvular. Paralelamente, la dilatación con catéter-balón de la válvula mitral estenótica ha surgido como alternativa a la comisurotomía mitral quirúrgica. Todos estos cambios, y otros muchos que no es posible referir en este resumen, hacen oportuno que revisemos el manejo actual del paciente portador de una valvulopatía.
Palabras clave
Valvulopatías
Cirugía de las válvulas cardíaca
Guías
INTRODUCCIÓN
En el último cuarto de siglo, la cardiología ha cambiado más que en toda la historia precedente. Estos cambios han afectado también, y de forma espectacular, a las enfermedades de las válvulas cardíacas; no sólo en lo que respecta al espectro etiológico, sino también en cuanto al manejo diagnóstico y terapéutico de los pacientes. Revisemos, siquiera brevemente, cómo ha evolucionado este panorama.
Cambios en la incidencia y el espectro etiológico
La fiebre reumática, al compás de la erradicación de la pobreza y el tratamiento antibiótico de las infecciones estreptocócicas, ha desaparecido prácticamente en todos los países desarrollados. Hoy día asistimos a los últimos coletazos de una enfermedad contraída 30 o 40 años antes. De hecho, en nuestro medio comienza a ser excepcional el descubrimiento de nuevos pacientes con secuelas valvulares reumáticas por debajo de los 40 años.
El otro cambio fundamental tiene que ver con la prolongación de la vida, que ha puesto en primer plano de la escena clínica una afección diferente: la estenosis aórtica valvular degenerativa del anciano. Al mismo tiempo, otras etiologías, como las degeneraciones mixoides, las secuelas de la endocarditis infecciosa, o las debidas a la enfermedad isquémica, han ido adquiriendo progresivamente un papel clínico relevante; entre otras razones por el mejor conocimiento que hemos ido adquiriendo de estas afecciones valvulares.
Aun con estos cambios en la incidencia, los enfermos con afecciones valvulares siguen ocupando buena parte de nuestro quehacer diario. En el último registro de la Sociedad Española de Cirugía Cardiovascular 1 se refiere que en 1997 fueron operados 6.024 enfermos, lo que supuso el 36% de todas la intervenciones con circulación extracorpórea realizadas en nuestro país. En realidad, puesto que no todos los centros están adscritos a este registro voluntario, la cifra estimada mediante estudios de mercado es algo superior (7.074 pacientes) 2. De este global, el 77% fueron operados de una sola válvula y el resto de dos o más. Entre los enfermos monovalvulares, predominó con mucho la enfermedad aórtica (62%) sobre la mitral (38%).
Los cambios en el manejo diagnóstico
Hace 30 años, el diagnóstico de las lesiones valvulares se asentaba sobre la anamnesis y la auscultación cardíaca, completadas por el ECG y la radiografía de tórax. El cateterismo cardíaco, considerado entonces como la piedra angular del diagnóstico, solía confirmar las observaciones de los clínicos avezados. Fue una época en que las correlaciones auscultación-cateterismo-cirugía enriquecieron una semiología que, en su mayor parte, procedía de las observaciones clínicopatológicas de los grandes maestros de finales del xix y principios del siglo que termina. Las habilidades diagnósticas de los clínicos reposaban, pues, sobre una auscultación cuidadosa que, en consecuencia, era parte muy importante de la formación cardiológica. El culmen de esta semiología se alcanzó con los registros gráficos de la auscultación (fonocardiografía) y de los movimientos de las arterias, venas o ápex cardíaco (mecanocardiografía). La fonomecanocardiografía, introducida en nuestro país primero por Pedro Zarco, y luego por los discípulos del mexicano Bernardo Fishleder, fue una herramienta de enseñanza formidable.
Todo este panorama cambió radicalmente con la irrupción de la ecocardiografía en los años setenta. Primero fue el modo M, más tarde la eco bidimensional, luego vino el Doppler, que pronto se acompañó de la codificación en color y, finalmente, el acceso trans-esofágico, que permite observar de forma privilegiada las estructuras cardíacas. Pasamos, así, de «oír» las válvulas cardíacas, a «verlas». Y no sólo a verlas, sino también a apreciar las alteraciones hemodinámicas que inducen y la repercusión sobre una estructura fundamental como es el ventrículo izquierdo. La posibilidad de realizar ecocardiogramas seriados ha permitido que se conozca mucho mejor la historia natural de algunas valvulopatías y, en consecuencia, definir con mayor precisión el momento idóneo para la intervención quirúrgica.
¿El enorme poder diagnóstico de la ecocardiografía quiere decir que debemos prescindir de nuestros métodos de evaluación tradicionales? Nuestra opinión es que en modo alguno. La historia clínica, en primer lugar, conserva toda su vigencia, pues sigue siendo una herramienta privilegiada para evaluar la repercusión funcional del vicio valvular y, sobre todo, la forma en que el enfermo siente y padece la enfermedad. También en este campo, el viejo aforismo de «no hay enfermedades sino enfermos», sigue siendo una realidad. Por lo que respecta a la auscultación, baste decir que su mantenimiento no es incompatible con el desarrollo; más aún, cualquier tipo de innovación tecnológica será mejor aprovechado si se asienta sobre las bases de la tradición. «Auscultar bien» debe seguir siendo una característica diferencial del cardiólogo, sea cual fuere el ámbito en el que desarrolla su actividad profesional.
La aparición de procedimientos terapéuticos no quirúrgicos
En el caso de la estenosis mitral, la valvuloplastia percutánea con catéter-balón es una modalidad terapéutica que ofrece resultados similares, si no mejores, que los de la comisurotomía quirúrgica. Que un paciente pueda salir del hospital en tan sólo 24-48 h, con un alivio fundamental de su estenosis, sin haber pasado por quirófano y sin habérsele abierto el tórax parece algo de brujería, si no fuese porque ahí están los resultados inmejorables del procedimiento. En otros casos, como en la estenosis valvular aórtica del anciano, las expectativas de los procedimientos intervencionistas, desgraciadamente, no han sido confirmadas. Estos avances «médicos» han propiciado, sin duda, un florecimiento de procedimientos quirúrgicos menos traumáticos cuyo potencial está aún por desarrollar.
El desarrollo de nuevos sustitutos valvulares y las técnicas de reparación
Alguno de nosotros aún recuerda con pavor los embolismos múltiples que, a pesar del tratamiento anticoagulante, sufrían los pacientes portadores de prótesis valvulares. Por fortuna, sin haberse resuelto del todo el problema, sí se ha minimizado enormemente con las nuevas prótesis mecánicas y un mejor control de la anticoagulación. Por lo que respecta a las prótesis biológicas, tal vez lo más llamativo haya sido el resurgimiento de la operación de Donald Ross, que ha superado con rigor el paso del tiempo. Avance incuestionable han sido las técnicas correctoras de la regurgitación mitral, que permiten una cirugía muy superior, en términos de morbimortalidad, a la de la sustitución valvular.
La gestación de esta guía
Poco antes de comenzar la redacción de esta guía sobre las enfermedades valvulares, aparecieron las elaboradas conjuntamente por el American College of Cardiology y la American Heart Association 3. Ha sido imposible sustraerse a la poderosa influencia de este manuscrito, cuya lectura es altamente recomendable para cualquier interesado en el problema de las enfermedades valvulares. No obstante lo dicho, hemos procurado recoger las numerosas aportaciones originales de la cardiología española; posiblemente sea éste el campo de la cardiología en el que más y mejores aportaciones de autores españoles se han sucedido a lo largo del tiempo. Baste citar, como botón de muestra, que una innovación quirúrgica española, publicada en nuestra Revista 4, se ha convertido en referencia clásica de la bibliografía valvular de ámbito mundial.
ESTENOSIS AÓRTICA
Etioanatomía
La estenosis valvular aórtica (EA) aislada, es decir, sin valvulopatía mitral acompañante, es más prevalente en los varones y tanto la etiología congénita como la degenerativa son más frecuentes que la afectación reumática 5.
Congénita
La válvula puede ser unicúspide, bicúspide y tricúspide. La primera puede originar obstrucción severa en la infancia y dar lugar a una evolución fatal dentro del primer año de vida. La bicúspide es la más frecuente; predomina en el varón y suele dar manifestaciones a los 40-50 años de edad. Esta malformación produce un flujo turbulento que lesiona las valvas, generando fibrosis y calcificación. En ocasiones puede ser asiento de una endocarditis que produzca, esencialmente, regurgitación. La tercera forma de malformación congénita es la producida por una válvula tricúspide cuyas sigmoideas, de distinto tamaño, presentan fusión comisural y tendencia a la fibrosis-calcificación.
Adquirida
Se puede subdividir en dos tipos: reumática y degenerativa. La primera se caracteriza por la fusión comisural, con fibrosis y calcificación tardías; además, se producen retracción y rigidez de los bordes de las cúspides con aparición de nódulos calcificados en ambas superficies. La consecuencia suele ser un orificio reducido y, a la vez, incontinente 6. Se suele acompañar de afectación de otras válvulas, especialmente la mitral.
La degenerativa es la causa más frecuente de EA en el adulto 7 y su incidencia va en aumento por el envejecimiento de la población, ya que parece originarse por los años de estrés normal sobre la válvula. La estenosis, sin fusión de comisuras, se produce por depósitos de calcio en las líneas de flexión de la base de las valvas; frecuentemente se acompaña de calcificación del anillo mitral y a veces de las arterias coronarias. La diabetes mellitus y la hipercolesterolemia son factores de riesgo para el desarrollo de esta lesión.
Existen otras causas más raras de EA, como la aterosclerótica, que afecta también a la aorta y a las arterias coronarias. Se puede observar en pacientes con hipercolesterolemia severa que, cuando es homocigótica, suele ocasionar síntomas en la infancia. También la enfermedad de Paget y la insuficiencia renal terminal están asociadas con el desarrollo de EA.
Graduación de la estenosis
La graduación en la severidad de la EA proviene de los cálculos del área valvular por cateterismo cardíaco, interpretados a la luz de los datos de historia natural obtenidos en el seguimiento de los pacientes 8 (tabla 1). El área se puede expresar en valores absolutos o, mejor, en forma de índice, al ser corregida por la superficie corporal. El empleo del índice es especialmente importante cuando se trata de pacientes con tallas y/o peso desproporcionados en uno u otro sentido.
El cálculo del orificio valvular aórtico por la fórmula de Gorlin y Gorlin exige la determinación del flujo valvular aórtico (gasto cardíaco/período de eyección) y del gradiente sistólico medio transvalvular. En la práctica hay una tendencia abusiva a prescindir del gasto cardíaco y evaluar la severidad de la EA atendiendo únicamente al gradiente transvalvular, considerándose que la EA es importante cuando el gradiente medio es >= 50 mmHg o el gradiente pico >= 60 mmHg. Este proceder puede inducir a importantes errores debido a la variabilidad del gasto cardíaco. Los valores de corte señalados son bastante específicos de EA severa (valor predictivo positivo del 90%); sin embargo, valores inferiores no descartan la severidad. Por ello, se aconseja medir el área valvular en todos los enfermos que tengan gradientes inferiores a los citados cuando se sospeche clínicamente que la EA puede ser importante 9. La fórmula de Gorlin y Gorlin tiene limitaciones que deben ser conocidas; tal vez la más importante sea la imposibilidad de realizar un cálculo adecuado cuando, en presencia de un flujo transvalvular bajo, el gradiente es pequeño. Hay que recordar que el área valvular estenótica está relacionada de forma inversa no con el gradiente medio, sino con la raíz cuadrada del mismo. Esto quiere decir que, en presencia del citado flujo transvalvular bajo, pequeños errores en la medida de las presiones pueden magnificar de forma extraordinaria los errores en el cálculo del área valvular 10.
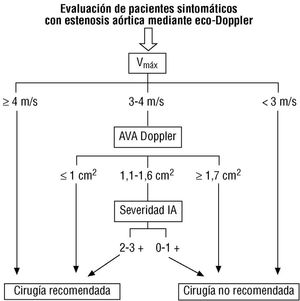
Por lo que respecta a la evaluación de la severidad mediante Doppler, debemos recordar que ninguna de las técnicas al uso mide directamente las presiones intravasculares. La fórmula que se utiliza para el cálculo del gradiente aórtico es una simplificación de la ecuación de Bernouilli en la que se eliminan numerosos factores. Aun así, la correlación con el gradiente hemodinámico es bastante buena, con un intervalo de confianza del 95% de ± 20 mmHg. Al gradiente calculado mediante Doppler hay que aplicarle las mismas consideraciones que al hemodinámico; por tanto, en la mayoría de los casos con gradiente «dudoso» habría que calcular el área por la ecuación de continuidad. En la práctica, el esquema propuesto por Otto y Pearlman 11 constituye un acercamiento diagnóstico razonable (fig. 1); se trata, en síntesis, de considerar: a) que los enfermos con una velocidad del chorro estenótico >= 4 m/s tienen una EA importante; b) que, por el contrario, los que tienen una velocidad <= 3 m/s tienen una EA poco importante, y c) que los que tienen una velocidad de 3-4 m/s deben ser individualizados mediante el cálculo del área valvular y la estimación de la regurgitación acompañante.
Fig. 1. Aproximación al diagnóstico de severidad de la estenosis aórtica sintomática mediante el empleo de la velocidad máxima (Vmáx) en el tracto de salida ventricular izquierdo. Si la velocidad es intermedia, conviene calcular el área valvular aórtica (AVA) por la ecuación de continuidad; si ésta se encuentra en un rango intermedio de severidad, conviene evaluar la severidad de la insuficiencia aórtica (IA) acompañante para tomar la decisión operatoria.
Estos parámetros hemodinámicos son muy importantes en la valoración de la gravedad de la EA; sin embargo, las manifestaciones clínicas de los pacientes son trascendentales a la hora de tomar decisiones terapéuticas. Hay que recordar, en este sentido, que algunos enfermos con EA severa se mantienen asintomáticos, mientras que otros con estenosis moderadas pueden tener síntomas que aconsejen la cirugía.
Fisiopatología
La obstrucción progresiva del ventrículo izquierdo produce un aumento del estrés parietal, señal para que se induzca un incremento en la replicación de sarcómeros, base de la hipertrofia concéntrica. Este mecanismo compensador es favorable en principio, puesto que reduce o normaliza el estrés parietal; de esta forma, la obstrucción es superada por el ventrículo izquierdo sin que éste se dilate, se reduzca el gasto cardíaco o se produzcan síntomas. Sin embargo, no siempre el grado de hipertrofia es adecuado para contrarrestar el estrés parietal; en estas circunstancias de hipertrofia inadecuada, el aumento del estrés parietal produce una poscarga muy elevada que termina deprimiendo la fracción de eyección. Así pues, la fracción de eyección en la EA puede estar reducida sin que ello signifique un déficit contráctil, sino simplemente una poscarga excesiva 12.
La elevación de la presión telediastólica que suele acompañar a la EA importante no significa necesariamente dilatación ni insuficiencia, sino que refleja la reducción de la distensibilidad de un ventrículo hipertrófico 13. Este fenómeno se acompaña de una vigorosa contracción de la aurícula, que da lugar a una onda a prominente en el registro de presión de aurícula izquierda y que no es sino una demostración de la importancia que tiene la contracción auricular para completar un buen llenado ventricular. Por eso, cuando se pierde la contribución atrial, como sucede en la fibrilación auricular, puede producirse un rápido deterioro en la situación clínica del paciente.
En fases avanzadas de la enfermedad empieza a disminuir el gasto cardíaco y, como consecuencia, el gradiente transvalvular, en tanto que aumentan las presiones de la aurícula izquierda, del capilar, de la arteria pulmonar y de las cavidades derechas. En esta etapa tardía de la evolución también puede aumentar el volumen diastólico ventricular, pero nunca de una forma tan marcada como sucede en la insuficiencia o en la doble lesión aórtica; siempre, aun en estos estadios avanzados, se conserva la característica de la sobrecarga de presión: incremento notable de la relación masa-volumen.
La hipertrofia ventricular, el aumento de la presión sistólica intraventricular y la prolongación de la eyección que acompañan a la EA grave aumentan el consumo de oxígeno miocárdico. Por ello, el flujo coronario, aunque en términos absolutos esté elevado, puede ser deficiente. Además, con frecuencia la perfusión miocárdica está interferida por la compresión de las arterias coronarias, a consecuencia de la elevada presión y la relativa reducción de la densidad de capilares miocárdicos. Se sabe también que la hipertrofia miocárdica, aun en ausencia de enfermedad coronaria, produce una limitación de la reserva vasodilatadora 14. Por otra parte, la elevación de la presión de llenado reduce el gradiente diastólico entre la aorta y el ventrículo; es decir, el gradiente de perfusión coronaria. Todo ello explica la aparición de angina con el esfuerzo en pacientes con EA grave y que los infartos puedan ser más extensos y con una mortalidad más elevada 15. En pacientes de edad avanzada, sobre todo en mujeres, se ha observado una excesiva hipertrofia parietal, superior a la requerida para contrarrestar la elevación de las presiones intracavitarias; como consecuencia, el estrés de pared es bajo, la fracción de eyección alta y el ventrículo puede parecerse al descrito en la miocardiopatía hipertrófica hipertensiva 16. Esta EA, con hipertrofia inapropiada y aumento de la contractilidad, se acompaña de un aumento de la aceleración del flujo intracavitario que se ha descrito como un marcador de mal pronóstico quirúrgico 17. Puede incluso ser la base para que se desarrolle un síndrome de bajo gasto postoperatorio por obstrucción dinámica subvalvular que, obviamente, no requiere de inotrópicos para su solución, sino de betabloqueadores 18,19.
Historia natural
La EA tiene un largo período de latencia en el que la morbimortalidad es muy baja. Los estudios seriados con cateterismo cardíaco y, más recientemente, con eco-Doppler han demostrado que, en algunos pacientes, el área valvular se reduce 0,1-0,3 cm 2 por año, mientras que el gradiente transvalvular aumenta unos 10-15 mmHg 20-23. Sin embargo, más de la mitad de los enfermos no demuestran cambios, o éstos son muy ligeros. La progresión de la EA degenerativa es más rápida que la congénita o la reumática 20, pero en realidad no puede predecirse la evolución en un determinado paciente. Por tanto, se requiere un seguimiento cuidadoso de todos los enfermos que en la evaluación inicial tienen un EA moderada.
Después de este largo período de latencia, la irrupción de síntomas marca un punto de inflexión en la historia natural. La aparición de angina de pecho, síncope o insuficiencia cardíaca cambia el pronóstico, pues la supervivencia no alcanza más de 2 o 3 años a partir de entonces 24,25. Por otra parte, en pacientes asintomáticos que tienen velocidades de flujo transvalvular aórtico >= 4 m/s, aparecen síntomas en un 38% de los mismos a los dos años de seguimiento 23.
Aunque es conocido que los enfermos con EA pueden presentar muerte súbita, ésta es muy rara en ausencia de síntomas y su incidencia se cifra en < 1% anual. Tres estudios prospectivos recientes han confirmado la rareza de la muerte súbita en pacientes asintomáticos. En el primero, con 51 pacientes asintomáticos seguidos durante 17 meses, sólo fallecieron 2 enfermos y en ambos casos habían aparecido síntomas previamente 26. En el segundo no se registró ningún episodio de muerte repentina, sin síntomas precedentes, en un grupo de 113 pacientes seguidos durante 20 meses 27. En el último, con 123 pacientes seguidos durante una media de 30 meses, tampoco se registraron muertes súbitas 23.
Manejo clínico de los pacientes
Evaluación inicial
El diagnóstico se realiza mediante el examen físico, junto con el apoyo del ECG y el ecocardiograma. Sin embargo, ninguno de estos métodos permite cuantificar la severidad de la estrechez. Hay que recordar, por otra parte, que la auscultación de un soplo sistólico eyectivo puede apreciarse con una válvula normal, con una engrosada pero poco estenótica, o con la que está francamente estrecha. En consecuencia, cada una de estas tres posibilidades debe identificarse de manera correcta. La EA importante tiene generalmente un soplo sistólico expulsivo rudo, acompañado de frémito, un pulso carotídeo retrasado y débil, un impulso apical sostenido y una reducción del componente aórtico del segundo ruido. Esta semiología puede tener numerosas excepciones; por ejemplo, en el anciano, el pulso tardus y parvus puede faltar debido a los cambios que sufre la pared arterial con la edad, o, más importante aún, el soplo eyectivo suele ser mínimo, incluso faltar, en la EA grave que se acompaña de bajo gasto cardíaco.
En los pacientes con signos de EA en la exploración física se debe realizar un ECG, una radiografía simple de tórax y un ecocardiograma. Esta última exploración es particularmente útil porque confirma la presencia de EA, define la morfología valvular, caracteriza la función del ventrículo izquierdo en respuesta a la sobrecarga de presión y descarta la existencia de otras valvulopatías (tabla 2). En la mayoría de los enfermos la gravedad de la lesión puede determinarse por Doppler, con la medida del gradiente transvalvular y el área valvular por la ecuación de continuidad. Se debe tener presente la posibilidad de infraestimar el gradiente si el haz de ultrasonidos tiene un ángulo > 30° en relación con la dirección del chorro de estenosis. En ocasiones se puede supraestimar si existe un anillo aórtico muy pequeño o un gasto cardíaco elevado. En pacientes con ecocardiogramas de calidad subóptima se ha utilizado la resonancia magnética nuclear para la valoración anatómica y funcional del ventrículo izquierdo y la severidad de la EA 28,29.
La utilidad de la prueba de esfuerzo convencional se ha cuestionado seriamente por el peligro que puede entrañar y la escasa exactitud que tiene para predecir enfermedad coronaria. En realidad, su realización está contraindicada en los paciente sintomáticos. Si se realiza en los asintomáticos, por supuesto bajo una supervisión experta y una monitorización estricta, pueden identificarse pacientes con capacidad de ejercicio limitada o incluso provocarse síntomas que no eran patentes en la anamnesis 30,31.
Seguimiento de los enfermos
El seguimiento depende de la severidad de la estenosis y de la presencia de otras enfermedades asociadas. Aunque no se ha definido una frecuencia determinada, en general se realiza una visita anual en aquellos con EA ligera y más frecuente si es moderada o severa. Se debe aconsejar a los pacientes que comuniquen a su médico la aparición de síntomas con el esfuerzo, como disnea, dolor torácico, mareos o síncopes. Como han demostrado varios estudios, la mayoría de los pacientes asintomáticos con EA severa desarrollan síntomas y, por tanto, requieren corrección quirúrgica en pocos años. Así, en un estudio de 113 pacientes con velocidades de flujo transvalvular aórtico >= 4 m/s, la incidencia de disnea, angina o síncope fue del 14% en el primer año y del 38% a los 2 años 27. En otra serie de 123 pacientes asintomáticos, la incidencia de síntomas fue del 38% a los 3 años de seguimiento y ascendía al 78% si la velocidad del flujo aórtico por Doppler era >= 4 m/s 23. De esto puede deducirse que los pacientes con EA severa requieren un seguimiento cercano para vigilar el desarrollo de síntomas.
Pruebas seriadas
Como hemos visto con anterioridad, la EA puede progresar a lo largo del tiempo. Esto ha ocasionado una tendencia a repetir anualmente el ecocardiograma en los enfermos afectados de EA. Sin embargo, el conocimiento actual sobre la historia natural y las indicaciones de cirugía no justifican la repetición compulsiva de esta exploración. En general, se considera apropiada la repetición anual en pacientes con EA severa, cada 2 años si es moderada y cada cinco si es ligera. También se justifica la repetición siempre que se produzcan cambios clínicos; por esta razón, una anamnesis detallada y el examen físico correspondiente son parte obligada de las evaluaciones periódicas.
Tratamiento médico
En realidad no existe un tratamiento médico específico para los pacientes con esta valvulopatía que están asintomáticos, y los que han desarrollado síntomas deben ser intervenidos quirúrgicamente. Como en las demás valvulopatías de origen reumático se requiere profilaxis de endocarditis infecciosa y prevención de brotes de fiebre reumática. Todos los fármacos vasoactivos destinados a tratar enfermedades concomitantes deben emplearse con cautela por la posibilidad de inducir cuadros sincopales con su uso.
Actividad física y ejercicio
Las recomendaciones en cuanto a la actividad física se basan en la severidad de la estenosis 32. No es necesario restringir la actividad física a los pacientes asintomáticos con EA ligera y pueden participar en deportes competitivos que requieran un alto grado de ejercicio muscular, tanto isotónico como isométrico. En cambio, si la EA es moderada no deben participar en este tipo de deportes, pero pueden realizar otro tipo de ejercicio con una evaluación previa mediante prueba de esfuerzo. A aquellos que padecen una EA importante se les debe limitar la actividad física a bajos niveles de ejercicio.
Indicaciones de cateterismo cardíaco
En líneas generales se plantea realizar un cateterismo cardíaco en dos circunstancias distintas, pero que pueden ser confluentes: a) clarificación del diagnós-tico de la lesión valvular, y b) identificación de una posible enfermedad coronaria (tabla 3). La primera circunstancia ocurre cuando la exploración por eco-Doppler es de calidad subóptima, existen discrepancias entre los datos clínicos y ecocardiográficos, o se sospecha malformación congénita asociada. La segunda eventualidad, es decir, la necesidad de coronariografía preoperatoria, será discutida en otro apartado.
Como hemos mencionado con anterioridad, el gradiente de presión a través de una válvula estenótica está relacionado con el orificio y el flujo valvular. Por esta razón, en situaciones de bajo gasto cardíaco puede obtenerse un gradiente bajo a pesar de que la estenosis sea grave; y a la inversa, un estado hiperdinámico cualquiera puede generar un gradiente elevado aunque la válvula sea poco estenótica. Por tanto, una valoración completa de la EA precisa: a) la medida del flujo transvalvular; b) la determinación del gradiente de presión transvalvular, y c) el cálculo del área efectiva de la válvula.
Los pacientes con EA grave, en situación de bajo gasto cardíaco por depresión severa de la fracción de eyección a consecuencia de una poscarga excesiva, tienen gradientes de presión reducidos (< 30 mmHg) y son difíciles de distinguir de aquellos con EA ligera o moderada cuya disfunción ventricular, de otro origen, no mejoraría tras la cirugía. En ambas situaciones, el bajo flujo y el reducido gradiente contribuyen a un cálculo poco exacto del área valvular 11 y se debe ser cauto a la hora de interpretar los resultados. Al menos en teoría, el cálculo del área por la ecuación de continuidad mediante Doppler es menos susceptible al bajo gasto, si bien no se ha confirmado en todas las situaciones clínicas. Se ha propuesto también el cálculo de la resistencia valvular, un índice que parece ser menos sensible que el área valvular a las variaciones de flujo 33.
En estos casos con gradiente ligero, fracción de eyección muy deprimida y bajo gasto se ha propuesto el estudio de los cambios direccionales tras la infusión de dobutamina para discernir la severidad de la EA 34,35. Con el aumento del gasto cardíaco que induce el estímulo inotrópico se incrementaría el área y disminuiría la resistencia valvular en los pacientes con EA no grave. Por el contrario, los enfermos con EA grave verían aumentar el gradiente, lo que facilitaría un cálculo más exacto del área valvular que estaría, al igual que el índice de resistencia valvular, en el rango de la severidad después de la infusión de dobutamina. En los enfermos en los que no se producen cambios claros, la duda sobre la severidad de la EA permanece y es necesario recurrir a datos indirectos (área valvular por eco transesofágico, grado de calcificación, etc.) para tomar una decisión apropiada que siempre tiene un alto grado de incertidumbre en estas circunstancias.
Indicaciones de recambio valvular aórtico
El único tratamiento efectivo de la EA grave del adulto es el recambio valvular aórtico 36. Los pacientes jóvenes pueden beneficiarse de la valvulotomía con catéter-balón (véase la sección correspondiente). Aunque no existe un acuerdo unánime sobre el momento óptimo de la intervención quirúrgica, se pueden elaborar unas pautas racionales de indicación para la mayoría de los casos con EA (tabla 4).
Pacientes sintomáticos
Los pacientes con disnea, angina o síncope manifiestan un alivio sintomático y tienen una mayor supervivencia tras la intervención 37-39. Por tanto, si no coexisten otras enfermedades graves, el recambio valvular aórtico está indicado en todos los pacientes sintomáticos. Los resultados pueden verse empañados por una disfunción ventricular preexistente. Debemos recordar, sin embargo, que en muchos pacientes la reducción de la fracción de eyección está ocasionada por una poscarga muy elevada y mejora claramente tras la supresión del obstáculo aórtico 40. Por el contrario, si la disfunción no está relacionada con una poscarga excesiva, la sustitución valvular no mejorará la función ventricular, pudiendo persistir los síntomas después de la intervención 41. Aun así, la supervivencia es mejor con la operación, salvo en los pacientes con disfunción ventricular grave mediada total o parcialmente por cardiopatía isquémica asociada 41. Como hemos comentado con anterioridad, la mayor dificultad en la indicación se plantea en los pacientes con gradiente bajo y disfunción ventricular grave, en los que se debe aclarar, hasta donde sea posible, la auténtica severidad del obstáculo valvular.
Pacientes asintomáticos
El manejo de los pacientes asintomáticos con EA severa es aún controvertido. El riesgo combinado de la cirugía y las complicaciones potenciales de una prótesis supera claramente los posibles efectos beneficiosos sobre la prevención de muerte súbita. Aun dejando al margen la morbimortalidad operatoria, hay que considerar una incidencia significativa de complicaciones (2-3% al año), incluyendo una mortalidad anual del 1% atribuible directamente a la prótesis 42-44. Por estas razones, la tendencia es evitar la operación mientras el paciente permanezca asintomático; ahora bien, esto exige que el enfermo permanezca en un programa de seguimiento regular especializado y que sea debidamente instruido en el reconocimiento precoz de síntomas que alerten sobre la necesidad de proceder a la intervención sin mayor dilación. A pesar de estas consideraciones, algunos autores propugnan la indicación quirúrgica en enfermos asintomáticos con alguna de estas características: respuesta anómala con el esfuerzo (hipotensión), disfunción ventricular, hipertrofia parietal muy marcada, taquicardia ventricular o estenosis muy severa (área < 0,6 cm 2). Cierto es, sin embargo, que difícilmente encontraremos a pacientes que, con alguno de estos rasgos, estén en realidad asintomáticos.
Pacientes que van a ser intervenidos de otra enfermedad cardíaca
A los pacientes que van a ser intervenidos de cirugía coronaria y tienen una EA severa, con o sin síntomas, se les debe sustituir la válvula aórtica en el mismo acto quirúrgico. Lo mismo sucede en aquellos que son intervenidos por una afección de la válvula mitral o de la raíz aórtica. Cuando la EA es tan sólo moderada (gradiente >= 30 mmHg) es también práctica común sustituir la válvula, si bien no hay suficiente evidencia que avale este proceder 45. Mayor controversia existe aún cuando la EA es sólo ligera.
Valvuloplastia aórtica con balón
La valvuloplastia percutánea con balón tiene un indudable lugar en el tratamiento de adolescentes y adultos jóvenes con EA, pero más limitado en la EA del adulto o del anciano. En estos últimos se consigue la reducción inmediata del gradiente transvalvular 46, pero el área posprocedimiento no suele sobrepasar 1 cm 2 . Además, puede haber complicaciones graves en más del 10% de casos 47,48 y aparece reestenosis a los 6-12 meses, con el consiguiente deterioro hemodinámico, en la mayoría de los enfermos 49-51. Por tanto, en la EA del adulto, la valvulotomía con balón no constituye una alternativa a la sustitución valvular 52,53. Su papel reside exclusivamente en el manejo provisional de pacientes muy sintomáticos que no pueden ser sometidos a recambio valvular. Por ejemplo, el procedimiento puede ser beneficioso, como puente a la cirugía, en enfermos con EA severa que se encuentran en insuficiencia cardíaca refractaria al tratamiento o en shock cardiogénico; la valvuloplastia, en estos casos, puede mejorar transitoriamente la grave situación clínica, permitiendo afrontar con mayores garantías de éxito la posterior sustitución valvular reglada.
No están bien establecidas otras indicaciones de valvuloplastia aórtica (tabla 5), como pueda ser el tratamiento paliativo en pacientes con enfermedades graves concomitantes que desaconsejan la sustitución valvular, o la de los pacientes con EA grave que requieren cirugía no cardíaca urgente 54.
Tratamiento médico en pacientes inoperables
La coexistencia de enfermedades potencialmente letales, o incluso las preferencias del propio paciente. pueden hacer inviable el tratamiento quirúrgico. En estas circunstancias, el tratamiento médico disponible para controlar los síntomas es limitado. Los pacientes con signos de franca insuficiencia cardíaca pueden mejorar con el tratamiento convencional. De todas formas, la reducción del volumen sanguíneo y, por ende, de la precarga ventricular ha de ser cautelosa, puesto que una reducción excesiva puede ocasionar un descenso marcado del gasto cardíaco y la presión arterial. Si la estenosis es grave, la utilización de un inhibidor de la enzima conversiva de la angiotensina (IECA) puede ser mal tolerada, ya que la reducción de las resistencias sistémicas no se acompaña del esperado aumento del volumen por latido. La digital se debe reservar para los enfermos con disminución de la función sistólica y para los que presentan fibrilación auricular. Ésta y otras arritmias supraventriculares hacen desaparecer la función de bomba auricular e incrementan la frecuencia ventricular, con la consiguiente disminución del período de llenado ventricular. Esta situación puede comportar un deterioro hemodinámico grave, que debe ser combatido con la restitución inmediata del ritmo sinusal mediante choque eléctrico. Si la cardioversión no es efectiva, no cabe más solución que el control de la frecuencia ventricular con digoxina o amiodarona.
Los betabloqueadores, al igual que otros fármacos con actividad inotrópica negativa, no deben utilizarse en pacientes con EA que se encuentran en insuficiencia cardíaca; sin embargo, si el síntoma predominante es la angina pueden ensayarse con cautela junto a los nitratos. No hay tratamiento médico específico para el síncope que no sea producido por una bradi o taqui-arritmia.
El problema especial de los pacientes ancianos
Debe considerarse el reemplazo valvular en todos los pacientes, aun en los de edad más avanzada, que tengan síntomas a causa de una EA. Esto es así porque las posibilidades de mejoría con el tratamiento médico y la valvuloplastia con balón son muy escasas; además, como hemos comentado previamente, el pronóstico vital es muy adverso una vez que aparecen los síntomas. Tal vez el objetivo de mejorar la supervivencia pueda perder relieve en los pacientes muy ancianos, pero debemos recordar que, hoy día, la esperanza de vida en nuestro país, a partir de los 65 años, se cifra en casi 16 años para el varón y 20 para la mujer 55. La cirugía es técnicamente posible a cualquier edad, pero la decisión de proceder a su aplicación depende de varios factores, entre los que cabe considerar la decisión del propio paciente y sus expectativas. Además de los efectos añadidos de la enfermedad coronaria y la mayor incidencia de accidente cerebrovascular perioperatorio, hay también otras circunstancias que son específicas de los pacientes de edad avanzada. Entre ellas, un tracto de salida ventricular estrecho y un anillo aórtico pequeño, especialmente presente en mujeres ancianas, pueden implicar sobremanera el acto quirúrgico, la calcificación profusa de la válvula, el anillo o la raíz aórtica, pueden precisar un desbridamiento amplio, el reemplazo de toda la raíz aórtica, o la utilización obligada de bypass femorofemoral.
Estas circunstancias, a las que se pueden añadir muchas otras, especialmente la comorbilidad asociada, hacen que la cirugía de sustitución valvular aórtica tenga una mayor morbimortalidad en el paciente anciano. No obstante, se pueden conseguir excelentes resultados en cuanto a supervivencia y calidad de vida 56-60 y la decisión de operar a un determinado paciente reposará sobre un análisis que tenga en cuenta la posibilidad de mejorar los síntomas y la supervivencia, por un lado, y la morbimortalidad operatoria por otro.
Seguimiento de los pacientes operados
El reemplazo valvular aórtico es en realidad un tratamiento paliativo en el que una válvula protésica, con todas sus posibles complicaciones, sustituye a la válvula nativa enferma 42. Como consecuencia, los pacientes portadores de prótesis valvulares requieren un seguimiento periódico. Dicho control, que se realizará anualmente en los pacientes sin complicaciones detectables, debe incluir la historia clínica y el examen físico. Las indicaciones de ecocardiografía se especifican en el apartado correspondiente a las prótesis valvulares.
INSUFICIENCIA AÓRTICA
Etiología
Las causas más comunes de insuficiencia aórtica (IA) son la dilatación idiopática de la aorta o ectasia anuloaórtica, la válvula bicúspide, la degeneración-calcificación de los velos, la enfermedad reumática, la endocarditis, la hipertensión sistémica, la degeneración mixomatosa, la disección de la aorta ascendente y el síndrome de Marfan.
Entre las menos comunes podemos citar las lesiones traumáticas, la espondilitis anquilopoyética, la artritis reumatoide, la osteogénesis imperfecta, la aortitis de células gigantes, los síndromes de Ehlers-Danlos, Hurler y Reiter, la estenosis subaórtica fija por lesión de chorro, la comunicación interventricular con prolapso de la válvula aórtica (síndrome de Laubry-Pezzi) o la lesión producida por fármacos anorexígenos 61-66. La lúes, que antiguamente era causa común de IA, se ha convertido en una rareza.
La mayoría de las lesiones citadas producen IA crónica con un curso clínico lento e insidioso. Sin embargo, lesiones producidas por la endocarditis infecciosa, la disección aórtica o los traumatismos torácicos producen IA aguda y severa, con un cuadro clínico rápidamente evolutivo, a veces catastrófico si no se reconoce y trata a su debido tiempo 3.
Insuficiencia aórtica aguda
Fisiopatología
En esta entidad, el volumen de sangre regurgitante debe ser manejado por un ventrículo izquierdo que no ha tenido tiempo de acostumbrarse a la nueva situación. Carece de los mecanismos adaptativos -dilatación ventricular y aumento de la distensibilidad- que ocurren en la IA crónica, los cuales permiten albergar al ventrículo un gran volumen de llenado sin que se eleve de forma sustancial la presión. Aquí, sin embargo, a poco que la regurgitación sea severa se produce una rápida elevación de la presión de llenado, que llega incluso a igualar la presión diastólica aórtica. La presión de este ventrículo -poco dilatado y con la distensibilidad habitual- se transmite a la aurícula izquierda y las venas pulmonares produciendo congestión pulmonar severa. La válvula mitral puede llegar a cerrarse precozmente, en plena diástole, tratando de impedir una mayor elevación de la presión en el capilar pulmonar. En contrapartida, el período de llenado se acorta y el ventrículo izquierdo, aunque sea hipercontráctil y haya taquicardia compensadora por la estimulación betaadrenérgica, se ve incapaz de generar todo el volumen por latido que sería necesario para mantener un gasto cardíaco adecuado, habida cuenta de la obligada regurgitación. Se cierra así un funesto círculo vicioso del que sólo se puede salir mediante la sustitución urgente de la válvula aórtica 3.
Diagnóstico
En el examen físico no se recogen los signos habituales de la IA, precisamente por las características fisiopatológicas descritas. El pulso arterial suele ser pequeño y rápido, la presión no tiene el clásico aumento diferencial y no es infrecuente la situación de shock. En los casos graves, la igualación de presiones entre la aorta y el ventrículo izquierdo hace que el soplo diastólico sea de baja frecuencia, corto y difícil de oír. El ECG suele poner de manifiesto taquicardia sinusal pero no signos de hipertrofia ventricular izquierda; en la radiografía de tórax pueden apreciarse signos de hipertensión venocapilar y edema pulmonar, pero la silueta cardíaca no está agrandada.
El ecocardiograma es la exploración por excelencia, ya que permite realizar una valoración anatómica y funcional completa. El cierre precoz de la válvula mitral y una disminución del tiempo de desacelaración del flujo mitral (< 150 m/s) son signos de regurgitación severa. El ecocardiograma transesofágico es especialmente útil cuando se sospecha una afección aórtica (disección aórtica, traumatismo torácico) o endocarditis 67-70. Habitualmente no es preciso realizar cateterismo antes de la intervención quirúrgica, exploración que, además, no está exenta de riesgo en estos enfermos tan inestables. Creemos que tampoco la coronariografía, a diferencia de lo expresado en otras guías 3, es necesaria salvo en circunstancias especiales. En el caso de sospecha de disección aórtica, otras técnicas de imagen, como la RM o la TAC pueden ser de utilidad 71.
Tratamiento
Los casos graves con hipotensión arterial y edema pulmonar pueden ser tratados con inotrópicos i.v., tipo dopamina o dobutamina, mientras se prepara la intervención quirúrgica para sustituir la válvula aórtica y/o reparar la aorta ascendente en el caso de disección. La intervención no debe demorarse y es la única solución, puesto que con el tratamiento médico, aunque sea intensivo, se corre el peligro de muerte por edema pulmonar, arritmia ventricular, disociación electromecánica o shock cardiogénico 3.
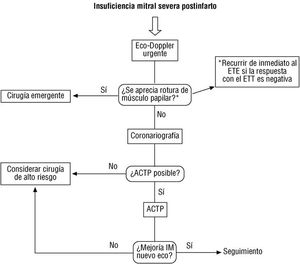
Los casos secundarios a endocarditis, con regurgitación moderada, deben tratarse médicamente en un hospital que disponga de cirugía cardíaca, debiendo conocer el equipo quirúrgico la existencia del paciente con el fin de estar preparado para una posible intervención emergente en caso de agravamiento. Ahora bien, si se detectan abscesos anulares o hay una resistencia probada a la terapia antibiótica, debe procederse a la cirugía 69 sin esperar a que la regurgitación se agrave.
Insuficiencia aórtica crónica
Fisiopatología
La IA crónica produce una sobrecarga combinada, de volumen y presión, sobre el ventrículo izquierdo 72,73. El incremento de volumen es consecuencia obligada del exceso de sangre que llega en diástole, al sumarse el flujo anterógrado de la aurícula y el retrógrado de la regurgitación. Se produce, pues, un aumento de la precarga que favorece la contractilidad (ley de Starling). Pero, simultáneamente, debido al gran volumen de sangre que se mueve durante la sístole y a la elevada presión que se alcanza, hay también elevación de la presión parietal (ley de Laplace) y, consiguientemente, una poscarga excesiva que puede deteriorar el rendimiento del ventrículo. La supresión de la poscarga explica que la fracción de eyección deprimida pueda mejorar después de la cirugía.
El aumento de la cavidad ventricular en la IA crónica se consigue mediante la realineación de las fibras miocárdicas que adicionan nuevos sarcómeros. Este tipo de hipertrofia, conocida como excéntrica, permite que los sarcómeros conserven sus propiedades funcionales, tanto en lo que se refiere al estiramiento (precarga) como a la capacidad contráctil. Durante mucho tiempo, el ventrículo posee lo que se conoce como reserva de precarga; esta propiedad permite, por una parte, acomodar incrementos progresivos del volumen de llenado sin que se eleve la presión diastólica final; por otra, que la fracción de eyección sea normal mientras el aumento de la poscarga no sea desmesurado. Gracias a este tipo de adaptación los pacientes con regurgitaciones voluminosas pueden estar asintomáticos durante largos períodos de tiempo 74,75.
El desarrollo de hipertrofia concéntrica trata de disminuir la presión parietal (ley de Laplace) y, por tanto, que la poscarga no se incremente; este mecanismo de adaptación, sin embargo, tiene sus límites y la poscarga, bien por incremento del volumen regurgitante o por otros factores añadidos de origen vascular, termi-na por aumentar, alterándose el equilibrio y disminuyendo el rendimiento ventricular, aunque la contractilidad miocárdica intrínseca esté preservada. Por otra parte, la hipertrofia concéntrica ocasiona una serie de fenómenos perjudiciales para la adaptación del ventrículo a la sobrecarga volumétrica: aumento de la rigidez ventricular, disminución de la distensibilidad y empeoramiento de la reserva coronaria 75-77. La consecuencia final de este proceso, que aún no es bien conocido en profundidad, puede ser el desarrollo insidioso de disfunción sistólica ventricular izquierda que finalmente se convierta en irreversible.
Historia natural
La mayoría de los estudios de seguimiento han identificado variables pronósticas derivadas de la sintomatología, el grado de dilatación ventricular y la función sistólica. En consecuencia, procede un análisis que tenga en cuenta estas grandes variables.
Enfermos asintomáticos con función ventricular izquierda normal. No hay muchos datos sobre la historia natural de los pacientes asintomáticos. En una recopilación de siete estudios 3, no del todo homogéneos, que incluye a 490 pacientes asintomáticos o paucisintomáticos seguidos durante un período medio de 6,4 años, la tasa de progresión hasta la aparición de síntomas o disfunción ventricular izquierda fue del 4,3% anual y la muerte súbita inferior al 0,2% anual. La aparición de disfunción ventricular izquierda sin síntomas fue del 1,3% al año; a pesar de esta baja probabilidad, hay que resaltar que más de la cuarta parte de los pacien-tes que murieron o empeoraron su función sistólica lo hicieron antes de la aparición de síntomas relevantes. Por esto es necesario monitorizar periódicamente la función ventricular izquierda y, a veces, vernos abocados a la toma de decisiones terapéuticas importantes antes de la aparición de síntomas 3. El estudio de Tornos et al 78, realizado en 101 pacientes asintomáticos con IA severa y fracción de eyección normal, seguidos durante una media de 4,6 años, es especialmente clarificador al respecto. En esta serie no hubo ninguna muerte, pero 14 enfermos necesitaron cirugía; en 8 casos porque desarrollaron síntomas, pero en los seis restantes debido a que se produjo disfunción ventricular asintomática. Además, en los pacientes que necesitaron cirugía se observó una dilatación progresiva del ventrículo izquierdo.
Las variables asociadas con el desarrollo de muerte, síntomas o disfunción ventricular son la edad, los parámetros que definen la dilatación ventricular, tanto diastólica como sistólica, y la progresión y velocidad con que se reduce la fracción de eyección 78,79. Esta última, tomada de forma aislada, no es un predictor independiente ya que, además de con la contractilidad, está relacionada con la carga ventricular y las resistencias periféricas. Bonow et al 79, en un estudio multivariado de seguimiento durante 8 años, encontraron que la edad, el valor absoluto de la dimensión telesistólica, su tasa de crecimiento y la disminución progresiva de la fracción de eyección fueron los principales determinantes de una evolución adversa. En dicho estudio, los pacientes con un diámetro telesistólico de más de 50 mm al comienzo del seguimiento tuvieron una probabilidad anual de muerte, síntomas y/o disfunción del ventrículo izquierdo del 19%; la probabilidad fue del 6% anual en los que tenían diámetros comprendidos entre 40 y 50 mm, y nula en los que el diámetro era inferior de 40 mm. El grupo de la Clínica Mayo, en un estudio reciente 80 subraya que la historia natural de los pacientes con IA severa (grado ecocardiográfico III o IV) tratados en la práctica clínica debe ser considerada con recelo ya que, en su experiencia, es peor que la de muchas de las series publicadas en la última década. Más de la mitad de los 246 pacientes estudiados estaban totalmente asintomáticos al comienzo del seguimiento; a pesar de ello, la mortalidad global a los 10 años de evolución y siguiendo tratamiento conservador fue significativamente mayor (34%) de la esperada (25%) en relación con la edad y el sexo. Además, hubo una alta morbilidad en lo que se refiere al desarrollo de insuficiencia cardíaca (el 47% a los 10 años) y necesidad de cirugía (el 62% a los 10 años). Los autores concluyen que los pacientes de alto riesgo identificados por este estudio tienen al menos una de las siguientes características: a) síntomas severos, aunque sean transitorios y abolidos por el tratamiento; b) síntomas ligeros (clase II); c) fracción de eyección < 55% o diámetro telesistólico >= 25 mm/m 2 aunque estén asintomáticos, y d) fibrilación auricular. En estos enfermos debe considerarse con prontitud la intervención quirúrgica. Por el contrario, los enfermos estrictamente asintomáticos, con fracción de eyección >= 55% y una dimensión telesistólica < 25 mm/m 2 forman el único subgrupo de bajo riesgo, con una mortalidad similar a la esperada. Aun así, estos enfermos pueden presentar algún episodio adverso como muerte súbita o disección aórtica, pero de momento no tenemos ningún predictor de estos accidentes.
Enfermos asintomáticos con depresión de la función ventricular izquierda. Los pocos estudios realizados ponen de manifiesto que la mayoría de los pacientes con disfunción ventricular tienen una tasa media de aparición de síntomas del 25% anual 81 y, por tanto, la mayoría de ellos necesitan ser operados por síntomas en los 2 o 3 años siguientes.
Enfermos sintomáticos. Los pacientes con síntomas tienen mal pronóstico con tratamiento conservador. Datos obtenidos en la época prequirúrgica demuestran una mortalidad superior al 10% anual en los enfermos con angina y de más del 20% en aquellos con insuficiencia cardíaca. Este mal pronóstico afecta incluso a los que tienen una función ventricular preservada 82.
Evaluación inicial
Examen físico. La auscultación de un soplo protodiastólico en el segundo y tercer espacios intercostales izquierdos, de alta frecuencia y con irradiación a lo largo del borde esternal, es diagnóstico de IA. El soplo, aun en casos con regurgitación importante, puede pasar desapercibido si no se busca intencionadamente; maniobras como la incorporación del enfermo hacia delante, a la vez que con la membrana se presiona la piel y se le pide al paciente que se mantenga en espiración forzada, pueden ser necesarias para su audición. Si el soplo se oye de preferencia a la derecha del esternón, hay que sospechar que la IA es causada por dilatación de la aorta 83. La presencia de un tercer ruido no implica disfunción ventricular, ya que puede deberse únicamente a la sobrecarga de volumen. El examen físico puede aportar datos sobre la severidad de la regurgitación; así, un latido apexiano desplazado, o una presión diferencial del pulso muy aumentada, suelen ser signos específicos de IA severa. El soplo de Austin-Flint es también característico de las regurgitaciones severas 84.
La ecografía-Doppler. El ECG nos permite valorar los signos de hipertrofia del ventrículo izquierdo y detectar las alteraciones del ritmo y/o la conducción; la radiografía de tórax, por su parte, aporta información sobre el tamaño de la silueta cardíaca, el grado de dilatación de la aorta y la repercusión pulmonar del fallo ventricular izquierdo si lo hubiese. En todo caso, la realización de un examen ecocardiográfico (tabla 6) es imprescindible para confirmar el diagnóstico, estudiar la causa de la IA y valorar la morfología de la válvula, el tamaño de la raíz aórtica y las características anatomofuncionales del ventrículo izquierdo 85-88.
El ecocardiograma permite realizar una valoración semicuantitativa del grado de IA, bien midiendo directamente el área y la anchura del chorro de regurgitación mediante Doppler color o, indirectamente, observando la pendiente de la velocidad del flujo diastólico, la intensidad de inversión de flujo en la aorta abdominal y la magnitud de la velocidad en el tracto de salida del ventrículo izquierdo 89. Es importante determinar las dimensiones y el espesor parietal del ventrículo izquierdo, así como el tamaño de la raíz de la aorta. La fracción de regurgitación se obtiene comparando el volumen por latido en la válvula aórtica con el de otra válvula cardíaca competente, pero se debe tener especial cuidado con la utilización de estos parámetros para la toma de decisiones clínicas, puesto que pueden ser motivo de grandes errores 90. El estrés de la pared puede ser calculado a partir de la presión arterial y los diámetros ecocardiográficos del ventrículo; se trata, sin embargo, de un parámetro difícil de reproducir, por lo que apenas se utiliza en la práctica.
Hay dos criterios, la severidad de la IA y los síntomas, sobre los que se basan muchas de las decisiones; en consecuencia, merece la pena que nos detengamos, aunque sea someramente, en su apreciación. Si el ecocardiograma es de buena calidad, el método semicuantitativo suele bastar para definir la severidad de la IA; conviene, no obstante, que el criterio de IA seve-ra vaya acompañado de un ventrículo izquierdo dilatado 91. Por otra parte, catalogar de asintomática una IA requiere la valoración funcional mediante una prueba de esfuerzo (tabla 7) si el paciente tiene hábitos sedentarios o los síntomas no son claros. La fracción de eyección, incluso en pacientes asintomáticos, puede disminuir durante el ejercicio; sin embargo, no se ha probado que este comportamiento tenga un valor in-dependiente de otros datos clínicos o ecocardiográficos 92-98.
Necesidad de otras pruebas si el ecocardiograma es de calidad insuficiente. En este supuesto, los pacientes deben ser estudiados por otros métodos no invasivos, como los radioisotópicos (tabla 8), que permiten la determinación de los volúmenes y la fracción de eyección del ventrículo izquierdo 94,98,99. Otra alternativa es realizar directamente un cateterismo cardíaco y una aortografía (tabla 9) con lo que, además de perfilar la función ventricular izquierda, podemos valorar semicuantitativamente la IA.
Tratamiento médico
La insuficiencia aórtica ligera o moderada, con buena función ventricular, no necesita tratamiento farmacológico. En la IA severa, tanto aguda como crónica, se han utilizado los vasodilatores arteriales (tabla 10).
El objetivo, en la IA crónica, es mejorar la historia natural de la enfermedad. El vasodilatador reduce el volumen regurgitante y aumenta el volumen por latido efectivo; esto se traduce en una disminución del volumen telediastólico, el estrés parietal y la poscarga, con el resultado final de una reducción en la masa del ventrículo y el mantenimiento de una buena función sistólica 100. En un estudio con seguimiento a 6 años se observó que los pacientes tratados con nifedipino tuvieron una tasa menor de reemplazo valvular y sobrevivieron todos los que fueron intervenidos, recuperando antes una mejor función ventricular 101,102. No está claro que los IECA tengan el mismo efecto, ya que estos pacientes, asintomáticos y con función ventricular conservada, suelen tener una tasa normal de renina plasmática y la actividad periférica de la ECA no parece estar aumentada 103,104.
El objetivo terapéutico es reducir la presión arterial sistólica, por lo que la dosis debe incrementarse hasta que se consiga el efecto deseado o se produzcan efectos adversos. Raramente, debido al elevado volumen por latido, se consigue una normalización de la presión arterial. En los casos con presión arterial normal no está indicado el tratamiento con vasodilatadores. En cualquier caso, una vez que aparecen los síntomas no debe demorarse la intervención quirúrgica; sólo aquellos pacientes que por una u otra razón no son candidatos a la cirugía deben mantener de forma indefinida el tratamiento farmacológico. Cuando se produce fracaso ventricular izquierdo por disfunción sistólica, el paciente se beneficia de las medidas terapéuticas habituales de la insuficiencia cardíaca. En este caso, deben evitarse vasodilatadores con efecto inotrópico negativo, como el nifedipino
En la IA aguda pueden utilizarse vasodilatadores de vida media corta para mejorar la situación clínica antes de la cirugía. El isoproterenol, por ejemplo, reduce las resistencias vasculares periféricas, con lo que disminuye el volumen regurgitante y aumenta el gasto cardíaco 105.
Actividad física
Los pacientes asintomáticos y con función ventricular normal pueden participar en cualquier forma de actividad física diaria, aunque debe evitarse el ejercicio físico isométrico 32. Antes de autorizar la participación en ejercicios atléticos conviene realizar una prueba de esfuerzo para comprobar la buena tolerancia al ejercicio. Son desconocidos los efectos a largo plazo del ejercicio extenuante en los pacientes asintomáticos.
Seguimiento periódico
El objetivo del seguimiento es detectar el comienzo de los síntomas y la aparición de disfunción ventricular izquierda. En ausencia de síntomas debe asegurarse la estabilidad de la IA crónica, especialmente si ésta es moderada o severa; si no se está seguro de esta situación, debe repetirse el examen físico y el ecocardiograma 2 o 3 meses más tarde, con objeto de descartar un curso subagudo de la regurgitación. Una vez que se ha establecido la cronicidad del proceso, la frecuencia del examen clínico periódico depende de factores como severidad de la insuficiencia, el grado de dilatación ventricular, el nivel de la función sistólica y los cambios progresivos previos en el tamaño o la función del ventrículo izquierdo. El seguimiento debe incluir historia clínica, examen físico y ecocardiograma. La radiografía de tórax y el ECG tienen menos valor, aunque pueden ser útiles en determinados grupos de pacientes, especialmente aquellos con manifestaciones clínicas.
Los enfermos asintomáticos con IA moderada, poca o ninguna dilatación ventricular izquierda y función sistólica normal deben ser evaluados anualmente, pero el ecocardiograma no es necesario más que cada 2-3 años 3. Aunque se ha observado una progresión de la IA hasta en un 30% de los casos seguidos a largo plazo 106, no suele ser abrupta y, por tanto, basta con los plazos de revisión citados.
En los enfermos asintomáticos con función sistólica normal pero insuficiencia severa y dilatación ventricular significativa (DD > 60 mm), la revisión debe efectuarse cada 6 meses. Además, requieren un ecocardiograma al menos cada 12 meses. Si la dilatación del ventrículo izquierdo es progresiva, el ecocardiograna debe hacerse cada 6 meses, puesto que estos pacientes tienen mayor probabilidad de desarrollar síntomas o disfunción ventricular izquierda 78,79. Si el ecocardiograma es de calidad subóptima o discordante con la evaluación clínica, se debe realizar una ventriculografía isotópica (tabla 8). En centros con experiencia, la resonancia nuclear magnética ha demostrado ser una excelente técnica para valorar la función ventricular y cuantificar la severidad de la regurgitación 107,108. La prueba de esfuerzo puede ser útil para valorar síntomas dudosos, capacidad funcional o cambios físicos que sugieran un empeoramiento; la realización rutinaria, sin embargo, no está aconsejada (tabla 7). Tampoco están indicados los estudios de función ventricular con el esfuerzo, ya que su significado, como se ha expuesto anteriormente, es cuestionable 3.
Los enfermos asintomáticos con mayor grado de dilatación (DTD > 70 mm o DTS > 50 mm) requieren un seguimiento más estrecho, puesto que son los que tienen un mayor riesgo (10-20% anual) de desarrollar síntomas o disfunción ventricular. En consecuencia, es razonable realizar una revisión, con ecocardiograma incluido, cada 4-6 meses.
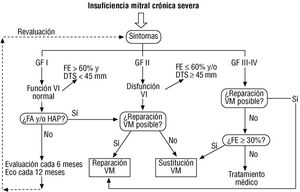
En los casos con afectación de la raíz aórtica está indicado el seguimiento periódico con ecocardiografía, ya que se debe adoptar la indicación quirúrgica, con independencia de la severidad de la regurgitación, la presencia de síntomas o la función ventricular, cuando la dilatación aórtica alcanza unas dimensiones que rondan los 50-55 mm de diámetro. En la figura 2 se esquematiza el manejo de los pacientes con IA crónica severa.
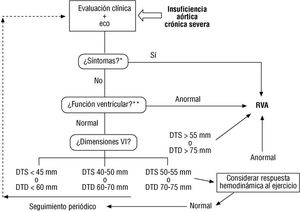
Fig. 2. Algoritmo de actuación en la regurgitación aórtica crónica severa, basado en los síntomas, la función ventricular izquierda y las dimensiones del ventrículo izquierdo. *Si la anamnesis es equívoca, puede ayudar el test de esfuerzo. **Si el eco es subóptimo o la función ventricular «limítrofe», conviene realizar una ventriculografía isotópica. Los síntomas se evalúan por la anamnesis y la función ventricular con el ecocardiograma. Los pacientes sintomáticos, con fracción de eyección anormal, o con dimensiones muy elevadas, deben ser operados. En los que tienen dimensiones «limítrofes» conviene estudiar la respuesta hemodinámica al ejercicio antes de tomar una decisión. Los que no tienen ninguna de estas características deben ser seguidos periódicamente, con una cadencia que depende de la estabilidad de la lesión y las dimensiones ventriculares. DTD: dimensión telediastólica; DTS: dimensión telesistólica; RVA: reemplazo valvular aórtico.
Indicaciones de cateterismo
No debe realizarse cateterismo, a menos que existan dudas sobre la severidad de la regurgitación o la función ventricular que no puedan ser resueltas con téc-nicas incruentas, o que se precise coronariografía 109 (tabla 9). En estos últimos pacientes, la coronariografía debe complementarse con aortografía y medidas hemodinámicas de la función ventricular izquierda. En los pacientes asintomáticos es poco común que se necesite el cateterismo para valorar la severidad de la IA. Puede plantearse su necesidad, de forma muy ocasional, para estudiar la respuesta durante el ejercicio en pacientes con IA severa y función sistólica normal, o casi normal, o en casos con un tamaño ventricular grande. La medida del gasto cardíaco mediante cateterismo derecho permite también identificar a algunos pacientes con anormalidades hemodinámicas severas que aconsejan la cirugía 3.
Indicaciones de la sustitución valvular aórtica
Los pacientes con IA ligera no son candidatos quirúrgicos y, si están sintomáticos, deben descartarse otros procesos patológicos como enfermedad coronaria, hipertensión arterial o miocardiopatía; si a pesar de ello se tienen dudas sobre la severidad de la regurgitación, los pacientes deben ser estudiados mediante angiografía y hemodinámica además de con los métodos no invasivos normales 109. La siguiente discusión sólo es aplicable a aquellos pacientes con IA severa (tabla 11).
Enfermos asintomáticos con función ventricular izquierda normal. Se acepta que deben ser operados aquellos pacientes asintomáticos con diámetros ventriculares izquierdos grandes (DD > 75 mm o DS > 55 mm), incluso aunque tengan una fracción de eyección normal. Algunos autores 80 prefieren corregir los diámetros por la superficie corporal e indican la cirugía cuando el DS >= 25 mm/m 2. Los pacientes con progresión de los diámetros ventriculares requieren un seguimiento cuidadoso, pero pueden estabilizarse durante largos períodos sin alcanzar el umbral señalado. La base de esta indicación reside en que la mayoría de los pacientes con diámetros ventriculares grandes terminan por desarrollar disfunción ventricular a causa del incremento de la poscarga; por tanto, los diámetros telediastólicos y/o telesistólicos que alcanzan el umbral anteriormente dicho pueden considerarse como equivalentes de una fracción de eyección deprimida 78,110. Razones adicionales para la intervención es que estos pacientes tienen riesgo de muerte súbita y que los resultados de la cirugía suelen ser excelentes 79,111-113, a diferencia de los que terminan desarrollando síntomas y/o disfunción ventricular, que presentan una mortalidad postoperatoria considerable 112. Aquellos que tengan diámetros próximos al umbral señalado deben ser revisados cada 4 o 6 meses, pero además es razonable recomendar la sustitución valvular aórtica en estos pacientes si hay evidencia de disminución de la tolerancia al ejercicio o una respuesta hemodinámica anormal al ejercicio como, por ejemplo, la elevación de la presión capilar pulmonar > 25 mmHg 3.
Se han identificado enfermos que pueden desarrollar disfunción ventricular izquierda con un menor grado de dilatación ventricular. Por ejemplo, a) los que tienen una larga historia de hipertensión arterial que reduce la distensibilidad del ventrículo y, por tanto, la capacidad de dilatación de la cavidad; b) los que tienen enfermedad coronaria asociada y presentan isquemia miocárdica que incrementa el estrés parietal y facilita una disfunción ventricular más precoz; c) los que tienen estenosis mitral concomitante que limita la dilatación ventricular izquierda 114, y d) las mujeres, que suelen desarrollar disfunción ventricular izquierda con menores diámetros ventriculares; este hecho, sin embargo, parece estar relacionado con la masa corporal, puesto que las diferencias desaparecen cuando los diámetros se corrigen por la superficie corporal 115.
Enfermos asintomáticos con depresión de la función ventricular izquierda. Se acepta que deben ser intervenidos aquellos con fracción de eyección en reposo inferior al 50% 78,79, aunque otros grupos 80 sitúan el umbral en el 55%. La fracción de eyección está sujeta a variaciones de diversa índole (método utilizado, operador, temporalidad, nivel de poscarga, etc.), por lo que debe ser validada clínicamente mediante al menos dos determinaciones consecutivas antes de establecer la indicación quirúrgica en exclusiva por esta razón 116,117. El comportamiento de la fracción de eyección durante el ejercicio está sujeto a numerosos factores, por lo que no suele usarse para el establecimiento de la indicación quirúrgica.
Enfermos sintomáticos. Deben ser intervenidos, aun cuando la fracción de eyección sea superior al 50%, aquellos que están en grado funcional III-IV de la NYHA (New York Heart Association), o en grado II a IV de la CHA (Asociación Canadiense del Corazón) si nos referimos a la angina. En los que tienen disnea de clase II puede ser difícil realizar una valoración sintomática, por lo que la prueba de esfuerzo puede ayudar a caracterizar mejor la capacidad funcional. Si el origen de los síntomas no está claro (enfermedades asociadas, bajo nivel de entrenamiento, ancianidad, etc.) y tampoco son lo suficientemente severos como para interferir con el régimen de vida normal del paciente, puede ser razonable mantener un período de observación. La aparición de disnea tiene implicaciones diferentes si ocurre en pacientes con claros signos de dilatación ventricular o disfunción ventricular que en aquellos con alteraciones más modestas; pero incluso en estos últimos, aunque no se hayan alcanzado los niveles de dilatación y depresión de la fracción de eyección anteriormente citados, debe ser aconsejada la cirugía si no se encuentran causas explicativas de la disnea y la regurgitación, caracterizada por los métodos habituales, es severa. También es aconsejable la sustitución valvular en los pacientes con arritmias ventriculares, ya que este fenómeno arrítmico suelen ser indicativo, o preludio, de disfunción ventricular 118.
Los pacientes sintomáticos con disfunción ventricular izquierda ligera o moderada (fracción de eyección entre el 25 y el 49%) deben ser operados 119. La sustitución valvular es especialmente beneficiosa en los pacientes con síntomas menos avanzados (grados II y III), sobre todo si existe evidencia de que la disfunción ventricular izquierda es de reciente aparición y/o la terapéutica intensiva con vasodilatadores, diuréticos y agentes inotrópicos resulta en una mejora sustancial de la hemodinámica y la función sistólica. Los pacientes en grado IV tienen peor supervivencia después de la cirugía y una menor probabilidad de recuperar la función sistólica; no obstante, la cirugía mejora sus condiciones de carga del ventrículo izquierdo y permite una mayor supervivencia 120,121. En el postoperatorio se debe continuar combatiendo la disfunción ventricular izquierda con el apropiado tratamiento farmacológico.
Los que tienen disfunción ventricular avanzada (fracción de eyección < 25%, con dimensiones telesistólicas superiores a los 60 mm) plantean un dilema terapéutico. Por una parte, la mortalidad operatoria es de un 10%; por otra, aunque algunos presentan una clara mejoría después de la cirugía, la mayoría desarrollan cambios irreversibles del miocardio que entorpecen las posibilidad de supervivencia tardía. Aun así, incluso en pacientes en grado IV se considera que la sustitución valvular es una mejor alternativa que el tratamiento médico aislado 112,122.
En conjunto, las indicaciones quirúrgicas están en expansión, a medida que aumenta la experiencia con los homoinjertos aórticos, autoinjertos pulmonares 123, válvulas biológicas, reparaciones valvulares aórticas 124,125 y cirugía mínimamente invasiva 126,127. Si estas técnicas demuestran que mejoran la supervivencia a largo plazo o disminuyen las complicaciones postoperatorias, es concebible que se reduzcan los umbrales para recomendar la intervención quirúrgica. Pero hasta que dispongamos de estos datos, las indicaciones deben ser similares a las citadas, independientemente de la técnica quirúrgica elegida.
Regurgitación secundaria a enfermedad de la raíz aórtica
Las enfermedades de la raíz de la aorta pueden ser causa de IA, tanto aguda como crónica. El tratamiento quirúrgico integral debe contemplar la sustitución, no sólo de la válvula, sino de toda la raíz y la aorta ascendente con el fin de prevenir las graves complicaciones que pueden surgir en la pared aórtica enferma 128-130. En ocasiones, la regurgitación valvular no es severa, pero la intervención quirúrgica está indicada porque la dilatación aórtica alcanza un diámetro >= 55 mm. Hay autores que sugieren que en los pacientes de alto riesgo, debido a una historia familiar de disección precoz (antes de los 40 años) o a un ensanchamiento rápido de la raíz aórtica (incremento de más de 5 mm en menos de un año), es prudente proceder a la intervención quirúrgica cuando el diámetro alcanza 50 mm o incluso menos 131,132. El tratamiento betabloqueador puede retardar la dilatación de la aorta y la aparición de complicaciones 133.
El problema especial de los ancianos
La gran mayoría de los pacientes ancianos con enfermedad aórtica tienen estenosis o una lesión combinada, siendo rara la IA pura. Los ancianos, en general, se adaptan peor a la IA; desarrollan síntomas y/o disfunción ventricular más precozmente y el resultado de la intervención suele ser menos brillante, con tasas de supervivencia peores que las de enfermos más jóvenes 134,135. Muchos ancianos, además, tienen enfermedad coronaria asociada que debe ser considerada en el momento de la evaluación de los síntomas, la disfunción ventricular y la indicación quirúrgica. El alivio de los síntomas, más que la prolongación de la supervivencia, debe ser el objetivo a alcanzar en los pacientes muy ancianos; en los que son más jóvenes y, por tanto, tienen aún una dilatada esperanza de vida, la aparición de disfunción ventricular izquierda, aunque no haya síntomas, indica la necesidad de proceder a la sustitución valvular.
Seguimiento de los pacientes operados
Antes del alta hospitalaria, o a las pocas semanas de la intervención en su defecto, se debe realizar un ecocardiograma que defina la situación basal postoperatoria con respecto al funcionamiento de la prótesis y del ventrículo izquierdo. En las primeras semanas después de la cirugía se producen pocos cambios en la fracción de eyección, que puede incluso empeorar debido a la reducción de la precarga, aunque más tarde se recupere parcialmente 136. La persistencia de disfunción, o el empeoramiento de la función sistólica después de la intervención, es un predictor de mala recuperación ulterior de la función ventricular. Por el contrario, la reducción del tamaño ventricular, que suele aparecer durante la primera o segunda semanas del postoperatorio, es un excelente predictor de la recuperación funcional del ventrículo 119,136-138.
El paciente debe ser valorado de nuevo a los 6 y 12 meses y posteriormente cada año si el curso clínico es normal. Si permanece asintomático, se ha conseguido una reducción apreciable del ventrículo y la función sistólica es normal, no son necesarios estudios ecocardiográficos seriados. Sin embargo, si a lo largo del seguimiento se aprecian nuevos soplos, se tienen dudas sobre el buen funcionamiento valvular o la función del ventrículo izquierdo, debe realizarse un nuevo estudio. Los pacientes con persistencia de dilatación ventricular en el ecocardiograma inicial no atribuible a disfunción protésica deben ser tratados como cualquier otro paciente con disfunción ventricular izquierda, sintomática o asintomática, incluyendo la administración de IECA. En estos pacientes, las necesidades clínicas dictarán la conveniencia de ulteriores estudios seriados.
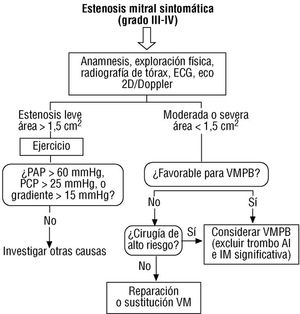
ESTENOSIS MITRAL
Anatomía y fisiopatología
El aparato valvular mitral consta de las valvas, las cuerdas tendinosas y los músculos papilares. Las valvas son dos, la anterior (o medial) y la posterior (o lateral). Cada valva tiene una porción basal o fija y una libre o móvil. La porción basal de la valva posterior se sujeta al miocardio ventricular izquierdo mediante tejido fibroso (lo que se denomina el «anillo mitral») y contacta con el endocardio de la aurícula izquierda. La valva anterior también se continúa con el endocardio auricular, pero se une firmemente con la raíz aórtica y con porciones de las cúspides izquierda y posterior de la válvula aórtica. Durante la sístole, los dos velos mitrales contactan a lo largo de sus respectivas líneas de cierre. Los dos ángulos en los que las valvas se acercan una a otra en su zona basal son las comisuras, la anterolateral y la posteromedial. La charnela sobre la que se mueven los velos es la sujeción basal; de esta forma, durante la diástole ventricular las dos valvas se mueven en dirección contraria y durante la sístole se acercan, hasta contactar una con otra, no sólo en las comisuras, sino a todo lo largo de la línea de contacto. Un solo músculo papilar, o un conjunto de músculos, yacen debajo de cada una de las comisuras y reciben el mismo nombre topográfico. Las cuerdas tendinosas se unen a los músculos papilares, por debajo, y a varias partes de la superficie ventricular de los velos mitrales por arriba. Generalmente las cuerdas no se unen al borde libre de las valvas sino a sus superficies ventriculares. Es importante recordar que cada conjunto de cuerdas (anterolateral y posteromedial) se une a la mitad de cada valva correspondiente a la comisura a la que pertenecen las cuerdas 139.
La estenosis mitral (EM) suele ser de naturaleza postinflamatoria, debida a una afectación reumática que termina por causar rigidez del tejido valvular, fusión comisural y acortamiento de las cuerdas tendinosas. La rigidez del tejido valvular puede ser resultado de: a) engrosamiento fibrótico intrínseco; b) calcificación secundaria de los velos fibróticos, y c) tensión en las valvas por las fuerzas opuestas de las cuerdas tendinosas acortadas. La calcificación del anillo mitral, afección prevalente en los ancianos, ocasionalmente puede producir EM; las estenosis congénitas son variadas, pero la válvula en «paracaídas», por la presencia de un solo músculo papilar en el que confluyen todas las cuerdas tendinosas, es la forma más común. El cor triatriatum tiene una fisiopatología muy similar a la de la EM.
El área del orifico valvular mitral es de 4-5 cm 2 y se precisa una reducción a valores inferiores a 2,5 cm 2 para que aparezcan consecuencias fisiopatológicas. La fundamental es el establecimiento de un gradiente de presión entre la aurícula izquierda y el ventrículo izquierdo. La magnitud del gradiente depende del área valvular mitral y el flujo diastólico por segundo; esto quiere decir que, para una misma restricción orificial, el gradiente será mayor cuanto más elevado sea el flujo absoluto (a lo largo de toda la diástole, como en los estados hipercinéticos) o relativo (es decir, por unidad tiempo, como sucede cuando hay taquicardia que acorta el período diastólico). La elevación de la presión auricular se transmite de forma retrógrada a las venas, capilares y arteriolas pulmonares. Todo esto causa congestión y trastornos en el intersticio pulmonar, además de hiperplasia e hipertrofia de las arteriolas pulmonares; en definitiva, hipertensión pulmonar. Esta hipertensión puede ser meramente pasiva, paralela al grado de obstrucción mitral, o tener un componente activo debido al aumento de las resistencias arteriolares pulmonares. Se acepta clásicamente que el incremento de las resistencias pulmonares, a diferencia de lo que ocurre en las cardiopatías congénitas que abocan a un síndrome de Eissenmenger, es de carácter funcional y, por tanto, reversible, una vez suprimido el obstáculo mitral 140. En consecuencia, de manera excepcional se contraindica un procedimiento terapéutico por la existencia de hipertensión pulmonar severa. Como hemos mencionado, las circunstancias que acortan la diástole (taquicardia), sobre todo si se acompañan de incremento del gasto cardíaco (ejercicio, embarazo, anemia, etc.), aumentan el gradiente y, por ende, la congestión pulmonar y los síntomas 3.
Historia natural
La enfermedad afecta particularmente a las mujeres y no es raro que los síntomas aparezcan coincidiendo con el embarazo. Si no es así, hacia la cuarta década el orificio mitral suele tener entre 1,5 y 2,5 cm 2, comenzando el paciente a tener disnea de esfuerzo. En los siguientes 10 años el área valvular se reduce a 1-1,5 cm 2 y la sintomatología se hace de medianos-pequeños esfuerzos. Ésta es una historia tipo, condicionada por la reducción progresiva del orificio mitral, pero que puede tener numerosas variantes; así, por ejemplo, hay estenosis mitrales severas en la adolescencia que, por fortuna, ya han desaparecido prácticamente de nuestro entorno 141; al contrario, puede haber estenosis triviales que apenas tengan cambios a lo largo del tiempo y permitan una vida plena. La calcificación comisural de las valvas es uno de los mecanismos que más frecuentemente agravan la obstrucción. En todo caso, el gradiente transmitral y el grado funcional, que suelen ir paralelos, condicionan el pronóstico; así, los pacientes en grado funcional III de la NYHA tienen una supervivencia del 38% a los 10 años, mientras que los que están en grado IV tan sólo viven un 15% de promedio a los 5 años. Afortunadamente, la cirugía ha cambiado de forma espectacular esta historia natural, por lo que se puede considerar histórica. Hoy día, la EM se ha convertido en una enfermedad lentamente progresiva, tradicionalmente disneizante y cuya historia natural se puede ver alterada por los descensos en fibrilación auricular y el embolismo periférico. La mortalidad en pacientes no tratados con cirugía es debida a insuficiencia cardíaca refractaria (60-70%), embolismo periférico (20-30%), embolismo pulmonar (10%) y cuadros infecciosos (1-5%) 3.
Evaluación diagnóstica
Los métodos tradicionales
El diagnóstico de la enfermedad se basa en la anamnesis, fundamental para establecer la repercusión funcional de la enfermedad, y en la auscultación que, en los casos típicos, en ritmo sinusal y con buena movilidad valvular, pone de manifiesto los componentes habituales de la obstrucción mitral: primer ruido fuerte, sístole libre, chasquido de apertura y retumbo diastólico con refuerzo presistólico. Esta semiología puede verse modificada, hasta el punto de hacerse silente, por numerosas circunstancias como fibrilación auricular, calcificación valvular, bajo gasto cardíaco, hipertensión pulmonar, regurgitación tricuspídea asociada, etc. El ECG típico, en los primeros estadios de la enfermedad, demuestra una onda P ancha y hendida; más tarde, conforme va aumentando el tamaño de la aurícula izquierda aparece, casi inexorablemente, fibrilación auricular. La radiografía de tórax puede presentar una rica semiología que tampoco es momento de revisar; sí conviene recordar que sigue siendo el mejor método para evaluar los cambios secundarios a la congestión pulmonar.
Ecocardiografía
El estudio ecocardiográfico (tabla 12) es obligado para confirmar el diagnóstico, evaluar la severidad hemodinámica y descartar la afectación de otras válvu-las 142,143. La severidad se estima midiendo el área valvular, aceptándose que estamos ante una estenosis severa cuando el orificio es <= 1 cm 2. Aunque existen numerosos métodos admitidos para el cálculo del orificio valvular (bidimensional, método de hemipresión, fórmula de la continuidad, isovelocidad proximal), determinadas circunstancias hacen que sea más adecuado utilizar uno u otro; en general, es aconsejable utilizar siempre dos de los métodos y que el valor obtenido sea concordante. El examen debe acompañarse del cálculo del gradiente mitral medio y del gradiente sistólico tricuspídeo, que permite estimar la presión sistólica de la arteria pulmonar. El estudio detallado de la morfología valvular -motilidad de los velos, engrosamiento/calcificación, estado de las comisuras y afectación del aparato subvalvular- es de suma importancia cuando se planea una valvuloplastia. De hecho, el índice que se elabora a partir de estos datos tiene una estrecha correlación con los resultados del procedimien-to 144. Lógicamente, cuando el estudio transtorácico sea de mala calidad estará indicado realizar un estudio transesofágico, con el fin de recoger toda la información antes mencionada (tabla 13). Se ha recomendado, además, como paso previo a la realización de una valvuloplastia, con el fin de descartar trombos en la aurícula y/u orejuela izquierda 145.
En pacientes con discrepancia entre los síntomas y la severidad de la estenosis en situación basal se puede realizar un ecocardiograma de estrés (habitualmente, esfuerzo en bicicleta o cinta rodante, pero también una perfusión de dobutamina a dosis crecientes) con el fin de documentar el comportamiento del gradiente transmitral y la presión arterial pulmonar. Incrementos significativos equivaldrían a repercusión hemodinámica importante de la lesión 146. Aunque esta aproximación es muy atractiva desde el punto de vista fisiopatológico, no está claro dónde debemos establecer el valor del gradiente medio que divida las respuestas normales de las patológicas; en este sentido, y a la luz de nuestra experiencia 147, los valores recomendados por el comité de expertos de la AHA/ACC 3 nos parecen excesivamente bajos.
Indicaciones de cateterismo
Los enfermos sintomáticos, sobre todo los que están en clase funcional III-IV, suelen tener un orificio muy reducido y la orientación terapéutica es clara: apertura, o sustitución en su caso, de la válvula estenótica. Sin embargo, hay circunstancias en que las cosas no son tan evidentes. Por ejemplo, hay más de un paciente con pocos síntomas en el que el ecocardiograma demuestra una clara reducción del orificio mitral (área < 1,5 cm 2). O, al contrario, que una sintomatología manifiesta no coincida con una EM cerrada. O, por último, que una enfermedad respiratoria asociada dificulte la interpretación de los síntomas. En estas circunstancias de discordancia clínico-ecocardiográfica, la valoración de la respuesta hemodinámica con el estrés, mediante Doppler o cateterismo, puede ayudar a la toma de decisiones.
Cuando existe discrepancia entre los datos recogidos por el estudio Doppler y el cuadro clínico de un paciente sintomático, se debe realizar un cateterismo derecho e izquierdo con ventriculografía izquierda para evaluar la posible regurgitación asociada 3 (tabla 14). El estudio manométrico basal, si no es suficientemente expresivo, puede ir seguido, como hemos comentado antes, de nuevas determinaciones tras la correspondiente maniobra estresante (ejercicio, dobutamina, etc.). Las indicaciones de coronariografía en los pacientes valvulares que van a ser sometidos a cirugía se discuten en otro apartado.
Tratamiento médico
Aunque la terapia fundamental de la EM importante sea el alivio de la obstrucción, la mayoría de los pacientes se benefician de algunas medidas farmacológicas, especialmente en lo que se refiere a la fibrilación auricular y su complicación fundamental: el embolismo sistémico.
Medidas generales
Es un hábito arraigado la recomendación de profilaxis de fiebre reumática en los pacientes menores de 25 años. Se suele hacer también profilaxis de endocarditis infecciosa aunque la EM es mucho menos proclive al asiento de gérmenes que las lesiones regurgitantes. También se suele aconsejar al paciente que no realice esfuerzos que provoquen disnea 32, así como que haga una dieta hiposódica. La digoxina, los betabloqueadores y algunos calcioantagonistas, como el verapamilo y el diltiazem, pueden ser útiles para controlar la frecuencia ventricular en caso de fibrilación auricular con respuesta rápida. Los diuréticos y los nitratos son útiles para combatir la congestión pulmonar y/o sistémica. La digoxina, por el contrario, no es de ninguna utilidad cuando el pacientes está en ritmo sinusal 148.
Tratamiento y prevención de la fibrilación auricular
Una proporción muy elevada de pacientes con EM presentará fibrilación auricular en el transcurso de su enfermedad. Su aparición conlleva un peor pronóstico, ya que facilita la aparición de insuficiencia cardíaca y de fenómenos embólicos. El tratamiento de un episodio agudo debe ir encaminado a controlar la frecuencia ventricular (digital, calcioantagonistas o betabloqueantes) y proporcionar una cobertura antitrombótica mediante anticoagulación completa con heparina sódica. La cardioversión eléctrica es muy útil para la conversión a ritmo sinusal; sin embargo, raramente la utilizaremos en la fase aguda puesto que es necesario, con el fin de evitar embolias, un mínimo de 3 semanas de buena anticoagulación antes del procedimiento. Podría proponerse, en este caso, un eco transesofágico y proceder a la cardioversión, sin anticoagulación previa (sólo heparina), si no se visualiza material trombótico intraauricular. Sin embargo, esta estrategia no está aún muy probada en este tipo de enfermos y, además, raramente se precisa una cardioversión aguda, puesto que con el control farmacológico de la frecuencia ventricular se logra una adecuada estabilidad hemodinámica. En cualquier caso, la restauración del ritmo sinusal debe ir seguida de otras 4 semanas de anticoagulación, período en el que se estima que persiste el riesgo de trombosis auricular por deficiencia en la actividad mecánica de la cámara. El riesgo de recaída es elevado y se cree que la utilización de fármacos antiarrítmicos ayuda a mantener el ritmo sinusal; no hay estudios que avalen con firmeza el medicamento de elección pero, en nuestro medio, la amiodarona a dosis de mantenimiento bajas es el que goza de mayor popularidad. Otros, debido a las complicaciones adversas de la amiodarona, podrían elegir el sotalol o incluso un fármaco de clase IC (propafenona, flecainida) que en estos pacientes, con función ventricular normal, no suele generar proarritmia.
Prevención del embolismo sistémico
Los pacientes en fibrilacion auricular, así como los que, aun manteniendo el ritmo sinusal, son más ancianos o cuentan con el antecedente de un embolismo previo, tienen mayor riesgo de embolismo. Se calcula que entre un 10-20% de estos pacientes tienen alguna embolia a lo largo de la evolución. Un tercio de los embolismos aparece en el primer mes desde que comenzó la arritmia y los otros dos tercios en el primer año. Especialmente elevado (15-40% episodios paciente/mes) es el riesgo de los enfermos en los que coexisten fibrilación auricular y embolismo previo. El riesgo, por el contrario, no está relacionado con la severidad de la estenosis, los síntomas o el tamaño de la auricula izquierda. Si no ha habido embolias previas y se mantiene el ritmo sinusal no está clara la indicación de la anticoagulación, incluso cuando existe mayor riesgo de embolismo (estenosis severa y auricula izquierda crecida) 3,149. En la tabla 15 se resumen las indicaciones del tratamiento anticoagulante.
Revisiones periódicas
Los pacientes con EM no severa (área >= 1 cm 2) y sin síntomas relevantes deben ser revisados anualmente. Además, han de ser instruidos para que se acorte el período de revisión en caso de que aparezcan síntomas o se acentúen los previos. Esta revisión debe incluir una anamnesis y exploración físicas detalladas, un estudio radiológico y un ECG, no siendo necesario de forma rutinaria la práctica de un ecocardiograma. Éste únicamente se debe realizar en los casos en los que haya una modificación significativa de los síntomas o signos clínicos, radiológicos o electrocardiográficos. En algunos pacientes, y en determinadas circunstancias, puede estar justificado realizar un eco de estrés para optimizar el manejo clínico. En pacientes con palpitaciones puede estar justificada la realización de un Holter con el fin de objetivar episodios paroxísticos de fibrilación auricular.
Aunque la medicación puede contribuir a mantener un grado funcional aceptable durante un tiempo sustancial, los procedimientos intervencionistas sobre la válvula enferma son los que, ciertamente, resuelven el problema de forma duradera.
Intervenciones sobre la válvula mitral estenótica
La comisurotomía o el reemplazamiento valvular han sido los tratamientos utilizados hasta la introducción de la valvuloplastia mitral percutánea con catéter-balón a mediados de los años ochenta (tabla 16). Esta técnica, cuando es aplicada por grupos experimentados, tiene el mismo índice de éxito que la comisurotomía quirúrgica 150. Sin embargo, es muy dependiente de la habilidad del operador, requiere una curva de aprendizaje que se cifra en 25 casos como primer operador, y un mantenimiento ulterior de al menos 10 procedimientos/año. Aunque hay diferentes técnicas, la más difundida es la de Inoue, que precisa cateterismo transeptal para el abordaje de la válvula mitral. El procedimiento se considera eficaz cuando el área valvular aumenta al menos un 50% con respecto al área prevalvuloplastia y no hay complicaciones mayores como muerte, taponamiento cardíaco, accidente cerebrovascular, infarto agudo de miocardio, compromiso vascular periférico con necesidad de cirugía, insuficiencia mitral severa o comunicacion interauricular significativa. Los mejores resultados se obtienen en válvulas con un tanteador ecocardiográfico < 8: éxito del 90-95%, baja frecuencia de complicaciones (< 2-3%) y mejoría mantenida a largo plazo en el 80-90% de los pacientes 151,152,152a. A medida que existe mayor calcificación y afectación del aparato subvalvular, el aumento del área es menor y se incrementa la probabilidad de complicaciones. Se consideran contraindicaciones para la valvuloplastia el embolismo periférico reciente, la evidencia de trombo en la aurícula izquierda, la insuficiencia mitral moderada-severa, la calcificacion mitral masiva, y el engrosamiento y fibrosis severos del aparato subvalvular 153. La reestenosis postquirúrgica es, sin embargo, una de las indicaciones habituales 154, siempre, naturalmente, que la válvula conserve una anatomía adecuada.
La mejoría obtenida con la valvuloplastia se explica por el aumento conseguido en el área mitral; sin embargo, hay algunos casos en los que, a pesar de haberse conseguido un área mitral aceptable, sin regurgitación residual, el beneficio clínico es menor del esperado. En estos casos, la falta de mejoría suele explicarse por la existencia de arritmias auriculares rá-pidas, hipertensión pulmonar severa, insuficiencia tricuspídea, valvulopatías asociadas o enfermedad pulmonar concomitante 153. Entre las complicaciones, merece especial mención el desarrollo de insuficiencia mitral significativa, que suele ocurrir por rotura de un velo, allá donde coexisten zonas valvulares finas con otras engrosadas, o cuando existe calcificación comisural asimétrica o afectación severa del aparato subvalvular 155. Más rara es la regurgitación severa por rotura de una cuerda tendinosa. Aunque la regurgitación mitral severa puede ser bien tolerada, más de la mitad de estos pacientes requieren una intervención quirúrgica, generalmente una sustitución valvular, en los meses que siguen a la valvuloplastia 156,157.
La mejoría inicial se mantiene a largo plazo en más de los dos tercios de los pacientes 158,159, estimándose que la tasa de reestenosis, no siempre asociada a deterioro clínico, es del 39% a los 7 años del procedimiento 159. Tampoco se ha observado la progresión de la regurgitación mitral 159. Se puede considerar, por tanto, que la valvuloplastia mitral percutánea es un procedimiento seguro y efectivo, que proporciona buenos resultados a corto y medio plazo en pacientes sintomáticos con una anatomía valvular favorable.
En los pacientes asintomáticos pero con una EM moderada-severa e hipertensión arterial pulmonar (basal o tras ejercicio), o en los sintomáticos con válvula no favorable pero de alto riesgo quirúrgico, es una alternativa terapéutica defendida por muchos autores. La aplicación de la técnica a otros subgrupos de pacientes goza de menor apoyo por parte de la comunidad científica.
Cuando la morfología de la válvula es favorable, pero la valvuloplastia percutánea no está accesible o no se puede realizar con las suficientes garantías, es lógico recurrir a la cirugía reparadora 160,161 (tabla 17). Existen también otra serie de circunstancias, recogidas en la tabla 16, que aconsejan utilizar la comisurotomía mitral con circulación extracorpórea en vez del procedimiento percutáneo. Hay, finalmente, casos en los que la anatomía valvular hace ineludible la implantación de una prótesis (tabla 18). En las figuras 3-5 se presentan algoritmos de actuación en la EM que, a partir de los síntomas del paciente, tratan de resumir los conceptos vertidos a lo largo del texto.
Problemas especiales
La anatomía valvular en el paciente anciano es generalmente más adversa, con mayor grado de calcificación de los velos y afectación del aparato subvalvular, aurícula izquierda más dilatada e hipertensión pulmonar. La tolerancia clínica suele ser menor y, siempre que la EM es significativa, se acompaña de un grado funcional elevado. Los enfermos mayores con frecuencia presentan comorbilidad asociada que eleva el riesgo quirúrgico; en consecuencia, siempre que se pueda se debe realizar un procedimiento percutáneo. El porcentaje de éxito es similar al que se obtiene en pacientes más jóvenes, aunque a expensas de una mayor tasa de complicaciones y de reestenosis 162. En caso de que la anatomía valvular desaconseje la valvuloplastia percutánea y el deterioro funcional sea severo, está indicada, pese al riesgo, la intervención quirúrgica. Los resultados de la operación, en lo que respecta a la calidad de vida, son lo suficientemente importantes como para afrontar el riesgo de la cirugía 163.
El manejo de la embarazada con EM será tratado en el apartado correspondiente. Baste decir, por el momento, que la valvuloplastia percutánea es la técnica terapéutica de elección 164 y que su realización exige extremar los cuidados para proteger al feto de la radiación, mediante el empleo de delantales protectores en el abdomen de la madre y la sustitución del control radiológico por el ecocardiográfico.
Seguimiento de los enfermos tras la apertura de la válvula mitral
La evaluación del resultado de una valvuloplastia no debe realizarse hasta que transcurran al menos tres días del procedimiento, ya que la velocimetría Doppler está muy alterada por el brusco cambio de distensibilidad de las cámaras cardíacas. El estudio ecocardiográfico debe dirigirse a objetivar el aumento del área valvular y la reducción del gradiente transmitral y de la presión sistólica de arteria pulmonar; además, hay que evaluar la continencia de la válvula y la integridad del tabique interauricular, descartando la presencia de cortocircuito izquierda-derecha significativo. La valoración de los pacientes con comisurotomía mitral es superponible en todo a la anterior, salvo en lo que respecta a la exploración del tabique interauricular. El pronóstico de los pacientes operados con éxito es bueno, estimándose una tasa de reestenosis del 40-50% a los 10-15 años del procedimiento y una necesidad de sustitución valvular del 22-43% a los 10 años 165,166. Esta evolución desfavorable puede ser detectada por la aparición de síntomas, que son los que dictan la conveniencia de repetir el examen ecocardiográfico.
PROLAPSO VALVULAR MITRAL
Características del síndrome
El prolapso valvular mitral (PVM) se define como el desplazamiento o deslizamiento de una o de ambas valvas mitrales, durante la sístole, hacia el interior de la aurícula izquierda, con o sin insuficiencia mitral (IM) acompañante. Es la forma más común de cardiopatía valvular en los países occidentales, encontrándose en un 2-6% de la población. La IM derivada de un PVM tiene unas características clínicas especiales cuando se la compara con otro tipo de regurgitaciones 167,168.
Desde un punto de vista anatomoetiológico, los prolapsos mitrales se pueden clasificar en primarios o secundarios 169. Los primeros no presentan más afección que la afectación valvular, y se reconocen los de causa familiar con herencia autosómica dominante 170, los aislados, los que ocurren en el síndrome de Marfan y los relacionados con otras enfermedades hereditarias del tejido conectivo. En los secundarios existe un proceso patológico definido que puede afectar a la válvula (enfermedad coronaria, enfermedad reumática), o circunstancias que condicionan un ventrículo izquierdo pequeño: miocardiopatía hipertrófica, comunicación interauricular, hipovolemia, anorexia nerviosa, etc. En general se abusa del diagnóstico de PVM, cajón de sastre en el que, a menudo y con poco criterio, se incluye a pacientes con anomalías auscultatorias o ecocardiográficas que son variantes de la normalidad.
En el PVM primario se produce un abombamiento intercordal debido a la redundancia de las valvas. El abombamiento es generalmente superior a los 4 mm e involucra al menos la mitad de la valva anterior y los dos tercios de la posterior. El hallazgo microscópico del PVM primario consiste en la proliferación de la capa esponjosa, delicado tejido conectivo mixomatoso que se sitúa entre la porción auricular de la valva (capa fina de colágeno y tejido elástico) y la ventricular o fibrosa (capa densa de colágeno que da soporte a la valva). Esta proliferación del tejido esponjoso causa interrupciones en la fibrosa, dando origen a los conocidos cambios secundarios del PVM primario: fibrosis y depósitos de fibrina en la superficie de las valvas, adelgazamiento y elongación de las cuerdas tendinosas y lesiones de fricción en el endocardio ventricular. Se ha formulado la hipótesis de que el PVM primario es consecuencia de una enfermedad del tejido conectivo por una embriogénesis imperfecta de la líneas celulares mesenquimatosas 171. También ha sido relacionado con disfunción del sistema nervioso autónomo, especialmente en los enfermos sintomáticos que pueden tener concentraciones plasmáticas elevadas de catecolaminas 172.
El PMV secundario no presenta esta proliferación mixomatosa de la esponjosa. Hay pacientes que después de un síndrome agudo coronario presentan un PVM inequívoco que antes no tenían 173. Por otra parte, estudios recientes indican que la regurgitación valvular causada por PVM pudiera ser el resultado de cambios postinflamatorios, incluidos aquellos producidos por la fiebre reumática 174,175. En los pacientes con miocardiopatia hipertrófica el PVM puede ser el resultado de una desproporción causada por una cavidad ventricular muy pequeña, de desalineamiento del músculo papilar, o de una combinación de ambas anomalías. En la rotura de cuerdas tendinosas puede presentarse PVM con valvas histológicamente normales debido a la falta de sujeción del velo correspondiente.
El prolapso de la válvula tricúspide tiene alteraciones histológicas similares y ocurre en el 40% de los pacientes con PVM 169. El prolapso de la válvula pulmonar o aórtica se encuentra en el 10 y el 2%, respectivamente, de los casos con PVM 167.
Historia natural y pronóstico
La mayoría de los pacientes con PVM tienen un excelente pronóstico 176,177. La aparición gradual de IM es la complicación más frecuente y suele aparecer en los pacientes con valvas más engrosadas, especialmente en varones con una edad superior a 45 años 176. La progresión de la IM origina cambios morfológicos y funcionales en las cavidades izquierdas que serán revisados en el capítulo de la IM crónica. La rotura de cuerdas tendinosas, bien espontánea, bien por endocarditis infecciosa, puede condicionar la aparición de una IM más abrupta y grave 177.
La muerte súbita es una complicación rara del PVM, pues se estima que ocurre en menos del del 2% de los casos seguidos a largo plazo 166,177. La causa más probable de este accidente son las arritmias ventriculares; esta afirmación se basa en el hallazgo de una mayor densidad de ectopia ventricular compleja en los pacientes que tuvieron muerte súbita 178. La incidencia más alta de muerte súbita, en todo caso infrecuente, se ha observado en las formas familiares de PVM , algunos de cuyos pacientes también presentan alargamiento del espacio QT 179.
Se ha señalado que el PVM es la primera causa predisponente de endocarditis infecciosa 167. Sin embargo, la incidencia absoluta es extremadamente baja, hasta el punto de ser muy controvertido el riesgo de endocarditis 180.
Los pacientes con IM severa pueden tener, como todo paciente con esta afección, accidentes embólicos ligados a la fibrilación y dilatación auricular izquierda. Además, hemos observado que en la superficie de las valvas mixomatosas pueden depositarse coágulos de fibrina que dan lugar a fenómenos embólicos 181-183. Varios estudios han referido una mayor incidencia de accidentes cerebrovasculares en pacientes con PVM menores de 45 años, en comparación con una población de edad similar y válvula mitral normal 182,183.
Evaluación y manejo del paciente asintomático
El diagnóstico suele hacerse fortuitamente en sujetos que son explorados por cualquier motivo. El examen físico es capital 167,169, puesto que la auscultación cuidadosa pone de relieve el signo princeps del diagnóstico: el clic mesosistólico, o no eyectivo, resultado acústico de una súbita tensión del aparato valvular en el momento del prolapso de las valvas hacia la aurícula durante la mesosístole. A menudo, el clic (o los clics, puesto que puede haber varios) va seguido de un soplo telesistólico apexiano que con frecuencia adquiere un carácter musical 184. Tanto el clic como el soplo pueden variar considerablemente, hasta desaparecer incluso, dependiendo del volumen y la contractilidad ventricular. Por eso se deben utilizar diversas maniobras que, disminuyendo el volumen ventricular (posición erecta) o, por el contrario, aumentándolo (posición de cuclillas), ponen de manifiesto el dinamismo de la auscultación 185.
El ECG, en la mayoría de los casos, suele ser normal. Puede haber cambios inespecíficos, como inversión de las ondas T, alteraciones en el segmento S-T, ondas U prominentes o alargamiento del intervalo Q-T. El Holter puede ser útil para documentar arritmias en pacientes con historia de palpitaciones, pero no está indicado como test rutinario en los enfermos asintomáticos. La mayoría de las arritmias detectadas no son peligrosas y hay pacientes que se quejan de palpitaciones durante el registro de Holter, sin que se encuentren trastornos del ritmo que las justifiquen.
La radiografía de tórax no aporta ningún hallazgo, salvo la demostración de diversas anomalías esqueléticas ( pectus excavatum, espalda recta, etc.) que pueden acompañar al PVM. A veces, especialmente en los adultos con síndrome de Marfan, puede observarse un anillo mitral calcificado.
La ecocardiografía es la técnica más adecuada para el diagnóstico de PVM. El diagnóstico se basa en la evidencia de un desplazamiento posterior, igual o mayor de 2 mm, de una o ambas valvas. Debido a la dificultad de visualizar las valvas en todo su contorno espacial, y a las tenues diferencias que existen entre el prolapso y la normalidad, no hay consenso absoluto sobre los criterios diagnósticos. Algunos autores exigen para el diagnóstico que el movimiento anormal vaya acompañado de una auscultación cardíaca típica o de cambios estructurales, como valvas engrosadas y redundantes, dilatación del anillo y elongación de las cuerdas tendinosas 167,186-188. La presencia de regurgitación, detectada mediante Doppler, hace prácticamente seguro el diagnóstico. El chorro suele ser excéntrico y de alta velocidad, quedando confinado a la telesístole en los casos típicos. La distribución espacial de esta turbulencia en la aurícula izquierda depende del velo afectado; si el que prolapsa es el posterior, la turbulencia se localiza en la zona más anterior de la aurícula; si es el anterior, el chorro se dirige hacia la zona posterior; por último, si la turbulencia se detecta en la zona media o se distribuye uniformemente, se debe sospechar que el prolapso afecta por igual a los dos velos 189.
Todos los pacientes con el diagnóstico clínico de PVM deben contar con una exploración ecocardiográfica en la valoración inicial (tabla 19), entre otras razones porque ciertas características, especialmente un marcado engrosamiento de la/s valva/s ( >= 5 mm), definen a una población con mayor riesgo de sufrir complicaciones evolutivas. Sin embargo, no son necesarios los estudios de seguimiento, a menos que empeo-ren los síntomas o haya evidencia auscultatoria de incremento en la regurgitación mitral. Por otra parte, no es recomendable la realización de ecocardiograma a sujetos con una auscultación dinámica negativa. La práctica contraria conduce al sobrediagnóstico del PVM y la creación de temores infundados.
Probablemente, la principal medida terapéutica sea la de tranquilizar al paciente, explicándole el buen pronóstico del PVM. En consecuencia, se le debe animar a que lleve una vida normal, incluyendo la práctica regular de ejercicio físico 167. La profilaxis de endocarditis infecciosa está recomendada para la mayoría de los pacientes con diagnóstico documentado de PVM (tabla 20). No hay acuerdo total para el uso de profilaxis en aquellos pacientes que tienen sólo clic sistólico, sin soplo añadido; no obstante, si hay engrosamiento de los velos en la ecografía se considera apropiada la prevención en las circunstancias con riesgo de bacteriemia 180.
Evaluación y manejo de los pacientes sintomáticos
Estos pacientes consultan por uno o más de los síntomas comunes en este síndrome: palpitaciones, dolor torácico atípico, disnea, fatigabilidad, ataques de pánico, etc. 167,169. Los episodios cerebrales isquémicos u oculares transitorios son otro motivo, en este caso más serio, de consulta.
El papel de la auscultación y la ecocardiografía en la evolución de los pacientes sintomáticos es el mismo que en los pacientes asintomáticos. Los criterios de profilaxis de endocarditis infecciosa son también iguales.
Los pacientes con palpitaciones, dolor torácico, ansiedad o fatigabilidad pueden beneficiarse de la terapia con betabloqueadores 190. En muchos casos, sin embargo, basta con el cese del uso de estimulantes como el alcohol, café o tabaco para que mejoren los síntomas. En los enfermos con episodios frecuente de palpitaciones se debe realizar un Holter por si existiesen arritmias que requiriesen terapia específica. Las indicaciones de estudio electrofisiológico son las mismas que para el resto de la población (muerte súbita abortada, síncopes recurrentes de causa desconocida y taquicardia ventricular sostenida).
Se recomienda aspirina (80 a 325 mg diarios) para los pacientes con episodios neurológicos focales, aunque estén en ritmo sinusal y no tengan trombos auriculares 191. Estos enfermos deben evitar el consumo de tabaco y los anticonceptivos orales. La anticoagulación a largo plazo se recomienda para los enfermos con ictus manifiesto, para los que tengan ataques transitorios mientras toman aspirina y para los que estén en fibrilación auricular y tengan más de 65 años, regurgitación mitral, hipertensión arterial o insuficiencia cardíaca 191 (tabla 21). Para los que tienen menos de 65 años y ninguna de las enfermedades citadas, basta con la aspirina, que también se recomienda en los enfermos con rasgos ecocardiográficos de alto riesgo (valvas con espesor > 5 mm).
La mayoría de los pacientes con PVM, especialmente los asintomáticos, pueden realizar una vida normal 167,169. Se debe restringir el deporte cuando hay un moderado crecimiento ventricular o disfunción del mismo, arritmias no controladas, intervalo Q-T prolongado, síncopes inexplicables, muerte súbita recuperada o raíz aórtica elongada 169. El embarazo no está contraindicado salvo en circunstancia excepcionales.
Los pacientes asintomáticos y sin regurgitación significativa deben ser evaluados clínicamente cada 3 o 5 años. No es necesario el seguimiento ecocardiográfico seriado, salvo en los pacientes con características ecocardiográficas de alto riesgo en la exploración inicial, que deben ser revisados anualmente. Se recomienda también repetir la ecografía en los que presentan cambios sintomáticos y/o auscultatorios sugestivos de regurgitación mitral progresiva. Los pacientes con datos de alto riesgo, incluidos los que tienen una IM moderada o severa, deben ser revisados anualmente.
Los enfermos que desarrollan regurgitación severa pueden precisar un cateterismo cardíaco si se planea intervención quirúrgica, con los mismos criterios que en los pacientes con otros tipos de IM; lo mismo sucede con la coronariografía. Ambas cuestiones serán consideradas en el próximo apartado.
Consideraciones quirúrgicas
Los pacientes con PVM pueden precisar cirugía en algún momento de su evolución si se desarrolla regurgitación severa por los cambios degenerativos o por la rotura de las cuerdas tendinosas 192. Estas válvulas, en manos experimentadas, son especialmente susceptibles de reparación, sobre todo si el velo posterior es el predominantemente afectado. Las indicaciones quirúrgicas, por lo general, son las mismas que en otras regurgitaciones mitrales de etiología no isquémica y serán revisadas en el próximo apartado.
INSUFICIENCIA MITRAL
Etiología
Cualquier anomalía de la anatomía o función del aparato mitral puede dar lugar a regurgitación, de tal forma que cuando ésta existe podemos aceptar que hay disfunción de uno o más de sus componentes: valvas, cuerdas tendinosas, anillo, músculos papilares o miocardio adyacente 168. Aunque en algunas series quirúrgicas antiguas la etiología reumática era la más frecuente, la degeneración mixomatosa se ha convertido en la causa más común (45%) en el mundo occidental, seguida de la reumática (40%), isquémica (10%), endocarditis (3%) y otras (2%). Como hemos comentado previamente, la válvula redundante o mixomatosa forma parte integral del síndrome de Barlow. En este caso, sin embargo, tratamos de un problema valvular aislado, sin ningún otro de los rasgos del síndrome. La debilidad estructural que presentan estas válvulas mixomatosas también afecta a las cuerdas, facilitando su rotura y, en consecuencia, dando lugar a IM aguda. La causa más común de IM isquémica es la disfunción del músculo papilar, aunque también pueden estar involucrados otros mecanismos, como la dilatación anular secundaria a disfunción ventricular, o la rotura del cuerpo o una de las cabezas del músculo papilar. La endocarditis infecciosa, tanto en fase aguda como una vez inactivada desde el punto de vista bacteriológico, puede dar lugar a regurgitación, ya sea por perforación de las valvas, por las vegetaciones que impiden un cierre adecuado, por la retracción de los velos en el proceso de cicatrización o por la rotura de cuerdas tendinosas 193. La calcificación del anillo mitral, la miocardiopatía hipertrófica, las enfermedades del colágeno, los traumatismos y afecciones congénitas como los defectos atrioventriculares, la hendidura mitral o la comunicación interauricular son otras causas bien conocidas de IM 194.
Insuficiencia mitral aguda
Fisiopatología
En la IM aguda, el flujo regurgitante se dirige a una aurícula izquierda poco preparada para hacer frente a este incremento súbito del volumen. En consecuencia, se produce un rápido aumento de la presión, que se transmite de forma retrógrada al capilar pulmonar, dando lugar a congestión severa; si las presiones pulmonares son suficientemente elevadas, aparecen signos de fracaso del ventrículo derecho. Como la aurícula presenta una baja impedancia con respecto al circuito sistémico, se produce una reducción de la postcarga ventricular, con disminución de la tensión parietal, incremento del acortamiento y mejora de los parámetros de eyección ventricular como la fracción de eyección y el volumen por latido. Debido al aumento del flujo durante la diástole, se incrementa el volumen telediástolico y, por ende (ley de Frank-Starling), el volumen de eyección, buena parte del cual es regurgitante. Así pues, si no está comprometida la función del ventrículo por una causa subyacente, como isquemia miocárdica o infarto, existe de hecho una mejoría en la eficiencia del bombeo, acentuada por el estado hiper-adrenérgico existente. Aun así, estos mecanismos de compensación son insuficientes y, en los casos graves, hay mala tolerancia hemodinámica, con una mezcla de congestión pulmonar severa e hipoperfusión periférica 195.
Diagnóstico
El cuadro clínico es de insuficiencia cardíaca aguda en un escenario que difiere según el agente etiológico. La semiología de IM puede ser muy pobre, con una palpación precordial anodina y un soplo no muy llamativo, lo que contrasta con los signos radiológicos de congestión pulmonar. El ECG suele demostrar ritmo sinusal, pudiendo haber signos específicos de la etiología subyacente, como puede ser un infarto de miocardio. De todas formas, lo que más valor tiene es la sospecha diagnóstica, tras de la cual se debe llevar a cabo un estudio ecocardiográfico urgente. El Doppler color nos proporciona rápidamente el diagnóstico, pero es obligado realizar un estudio detallado (véase más adelante) que permita cuantificar la severidad de la regurgitación, ponga de manifiesto la morfología valvular e ilustre sobre la función del ventrículo izquierdo 196. Si hay una sospecha fundada de enfermedad coronaria, se debe realizar una coronariografía previa a la reparación quirúrgica; en otro caso, se puede prescindir del estudio hemodinámico.
Tratamiento médico
Disminuir la congestión pulmonar e incrementar el gasto cardíaco deben ser los objetivos del tratamiento médico. La utilización de nitroprusiato o nitratos por vía intravenosa es la norma en los pacientes con la presión arterial normal, añadiendo inotropos (dobutamina) cuando existe hipotensión o bajo gasto; se puede precisar, incluso, la implantación de un sistema de contrapulsación aórtica como puente a la cirugía. El tratamiento antibiótico enérgico es imprescindible cuando la endocarditis infecciosa está detrás de la regurgitación.
Insuficiencia mitral crónica
Fisiopatología
En la IM crónica, la fracción regurgitante del volumen por latido determina el grado de crecimiento de la aurícula y el ventrículo izquierdos. La dilatación ventricular se acompaña de un aumento del grosor de la pared y de hipertrofia, que ayudan a mantener la función mecánica (hipertrofia excéntrica compensadora). También la aurícula se adapta al volumen regurgitante, dilatándose y aumentando su distensibilidad, lo que le permite tolerar un incremento del volumen sin apenas aumento de la presión; por esta razón, en esta fase inicial apenas hay síntomas de congestión pulmonar. La IM proporciona una vía de baja impedancia para la eyección ventricular izquierda; esto hace que disminuya su volumen telesistólico y el estrés parietal, manteniéndose los índices de función sistólica dentro de la normalidad o incluso algo aumentados. Esta normalidad de los índices eyectivos puede enmascarar la incipiente disfunción sistólica. Sin embargo, tras unos años de sobrecarga, los mecanismos compensatorios se agotan y, con el incremento de la disfunción contráctil, aumenta el volumen telesistólico y suben las presiones de llenado; como consecuencia, aumenta la congestión pulmonar y aparece disnea, pese a que la fracción de eyección se mantenga en cifras aceptables.
Diagnóstico
Una anamnesis cuidadosa permite establecer el comienzo de la disnea y la fatigabilidad en una enfermedad que, por otra parte, puede permanecer asintomática durante años. La palpación pone de manifiesto un latido apexiano hipercinético, desplazado hacia abajo y la izquierda. La auscultación se caracteriza por un soplo holosistólico, irradiado a axila, que con frecuencia va acompañado de un tercer ruido. La radiografía de tórax demuestra signos de dilatacion variable de las cavidades izquierdas y congestión pulmonar en los estadios más avanzados. En el ECG se aprecia un crecimiento auricular izquierdo e hipertrofia ventricular izquierda; con la evolución, la aparición de fibrilación auricular es la norma.
El ecocardiograma es una herramienta insustituible para la valoración de la enfermedad (tabla 22); no sólo confirma el diagnóstico sino que, además, es capaz casi siempre de determinar la etiología, cuantificar el grado de severidad y obtener los parámetros utilizados en el seguimiento del estado de la función ventricular 196. En la mayoría de los pacientes se pueden calcular el volumen y el orificio de regurgitación, método más sensible para determinar la severidad de la afección que el clásico cálculo del área del jet de regurgitación 197-199. De todas formas, recientemente se ha sugerido que para la graduación de la severidad es mejor calcular un índice compuesto por varios parámetros (penetración del chorro de regurgitación, área de la superficie proximal de isovelocidad, el carácter y la intensidad del registro espectral de Doppler continuo, la presión arterial pulmonar, el patrón de flujo en las venas pulmonares y el tamaño de la aurícula izquierda), que utilizar uno aislado 200. Como siempre que nos referimos a los ultrasonidos, la ventana transesofágica puede ser necesaria si la convencional no es óptima (tabla 23).
Seguimiento periódico
Los síntomas y el deterioro de la función ventricular son los principales marcadores desfavorables de la IM crónica. En consecuencia, la historia clínica, el examen físico y la ecocardiografía son los pilares de la evaluación periódica. Los pacientes asintomáticos, con regurgitación leve y ausencia de dilatación ventricular, disfunción sistólica o hipertensión arterial pulmonar, deben ser evaluados cada año. No es necesaria la realización de un ecocardiograma en todas las visitas, sino sólo cada dos o tres años, salvo que exista sospecha clínica de agravamiento de la regurgitación. Cuando la lesión es moderada se recomienda un estudio ecocardiográfico anual. En pacientes con anamnesis equívoca, la prueba de esfuerzo puede ayudar a establecer la capacidad funcional 3.
Si la regurgitación es severa, el seguimiento debe ser más estrecho, recomendándose realizar una evaluación clínica y un ecocardiograma cada seis meses. El déficit de la función sistólica (FE <= 60%) y la dilatación sistólica ventricular (diámetro telesistólico > 45 mm) son marcadores de un pobre pronóstico postoperatorio; estas cifras, pues, serán el objetivo a vigilar en los estudios ecocardiográficos seriados 201. En la figura 6 se presenta un algoritmo de actuación en los pacientes con IM crónica.
Fig. 6. Algoritmo de actuación en la insuficiencia mitral crónica severa, basado en el grado funcional, la función ventricular izquierda, la posible presencia de fibrilación auricular (FA) y/o hipertensión arterial pulmonar (HAP), la probabilidad de que la válvula mitral (VM) pueda ser reparada y el nivel de depresión de la fracción de eyección (FE) en los casos con grado funcional avanzado.
Actividad física
Las recomendaciones sobre el ejercicio físico exigen lógicamente una evaluación previa de la severidad de la lesión y de su repercusión sobre el tamaño y la función del ventrículo. El efecto del ejercicio sobre la IM se ha estudiado en un número limitado de pacientes; en general, estos estudios demuestran que el ejercicio apenas produce cambios: disminuye algo la fracción de regurgitación y se reduce ligeramente la fracción de eyección, salvo en los jóvenes asintomáticos 32. El ejercicio isométrico puede aumentar la regurgitación por el incremento de la presión arterial. También sabemos que si el ejercicio es crónico y excesivo, la sobrecarga de volumen continuada acabará produciendo un disminución de la contractilidad miocárdica, por lo que parece prudente restringir la actividad física de este tipo a pacientes con IM significativa y algún grado de dilatación ventricular. En el otro lado del espectro, los enfermos asintomáticos con ventrículo normal, en tamaño y función, pueden realizar cualquier tipo de deporte 32.
Tratamiento médico
Aunque de forma intuitiva el uso de vasodilatadores parecería útil en el tratamiento médico de la IM crónica de pacientes asintómaticos, lo cierto es que no hay ensayos clínicos que avalen esta terapia. Recordemos, por otra parte, que la poscarga es normal si la función ventricular está conservada; por ello, el uso de estos fármacos se limita al tratamiento de una eventual hipertensión arterial acompañante.
Si existe fibrilación auricular se deberá considerar el uso de los digitales, los antagonistas del calcio, tipo diltiazen o verapamilo, o los betabloqueadores con el fin de controlar la frecuencia ventricular. Es recomendable la anticoagulación crónica en los pacientes con fibrilación crónica o paroxística y en los que, aun conservando el ritmo sinusal, tienen una gran aurícula izquierda (> 55 mm por eco) o antecedentes embólicos 149. La IM reumática precisa profilaxis para las recidivas de fiebre reumática y todos los pacientes con IM crónica requieren un régimen apropiado de profilaxis antibiótica para todas las intervenciones o procedimientos con riesgo de bacteriemia 202,203. Si aparecen síntomas congestivos, la cirugía debe ser el tratamiento de elección pero, en caso de retraso o contraindicación, el uso de nitratos y diuréticos puede aliviar la sintomatología.
Indicaciones de cateterismo
La IM es la valvulopatía que más discrepancias presenta en la evaluación de la severidad cuando se comparan los métodos incruentos y la hemodinámica. Como quiera que el «patrón oro» de la regurgitación mitral es la ventriculografía con contraste, ésta deberá realizarse siempre que la cuantificación exacta de la regurgitación se considere crucial para decidir la cirugía (tabla 24); es decir, si el eco-Doppler demuestra severidad pero el resto de los hallazgos no son concordantes o, por el contrario, cuando la severidad ecocardiográfica es sólo moderada pero existen otros argumentos clínicos que abogan por la intervención 105. Además, la información obtenida en el curso del estudio hemodinámico, como la fracción de eyección, la dilatación ventricular o las presiones del círculo menor, proporciona datos muy sólidos para sentar la recomendación de cirugía.
La indicación de coronariografía (tabla 25) en los pacientes que van a ser intervenidos depende de la probabilidad de presentar enfermedad coronaria. En los pacientes jóvenes sin factores de riesgo es lógico evitar el estudio coronariográfico; en aquellos con cardiopatía isquémica conocida es imprescindible para conocer la severidad y extensión de las lesiones coronarias con vistas a una eventual revascularización. Entre estos dos extremos, parece prudente aconsejar la realización de coronariografía a todos los pacientes con una edad superior a los 60 años y a los que tengan dos o más factores de riesgo cardiovascular. En el apartado correspondiente a las relaciones entre enfermedades valvulares y enfermedad coronaria se desarrollan más ampliamente estos conceptos.
Indicaciones quirúrgicas
En la actualidad, la cirugía de la IM mitral se puede realizar de tres formas diferentes: reparación valvular, sustitución valvular con preservación total o parcial del aparato mitral y sustitución valvular con resección completa del aparato mitral 204-206. La cirugía reparadora evita, siempre que el paciente esté en ritmo sinusal, el riesgo de la anticoagulación crónica y los problemas inherentes a las válvulas artificiales. Además, al preservar toda la arquitectura mitral asegura una mejor función ventricular postoperatoria, que se traduce en una mayor supervivencia 207-209. Requiere, sin embargo, mayor destreza y experiencia quirúrgicas y no descarta la disfunción valvular postoperatoria. La sustitución valvular, sin resección del aparato mitral, tiene la ventaja de que asegura la competencia valvular, preserva la función ventricular y mejora la supervivencia cuando se compara con el recambio valvular con resección. De hecho, esta última técnica sólo se debe emplear cuando está afectado seriamente todo el aparato valvular, como sucede en algunas valvulopatías reumáticas. Aunque el recambio valvular es más sencillo para el cirujano, el inconveniente de la anticoagulación en las prótesis mecánicas y la degeneración progresiva en las biológicas son limitaciones conocidas de este procedimiento 207-209.
Indicación quirúrgica en pacientes sintomáticos con función ventricular izquierda normal
Los pacientes en grado funcional II a IV de la NYHA y con función ventricular conservada (FE > 60% y diámetro telesistólico < 45 mm) deben ser intervenidos, sobre todo si se les puede realizar una reparación valvular, ya que mejoran los síntomas, se preserva la función ventricular y se evitan los inconvenientes de las prótesis (tabla 26). Si la anatomía de la válvula o la experiencia del grupo quirúrgico no permiten llevar a cabo una reparación se debe realizar una sustitución valvular con mantenimiento del aparato subvalvular 210.
Indicación quirúrgica en pacientes con disfunción ventricular izquierda, asintomáticos o sintomáticos
El conocimiento de la historia natural de la enfermedad nos ha enseñado que la presencia de síntomas incapacitantes, el grado de disfunción ventricular, la etiología de la regurgitación y la técnica quirúrgica realizada son predictores importantes del pronóstico tras la intervención. Se admite que siempre que exista disfunción sistólica (FE < 60% y DTSVI > 45 mm) los pacientes deben ser intervenidos aunque estén asintomáticos. En los enfermos sintomáticos, el resultado de la operación es peor que en los asintomáticos; no obstante, se recomienda la intervención quirúrgica siempre que la fracción de eyección sea superior al 30%, especialmente si se puede realizar cirugía de reparación mitral 211.
Indicación quirúrgica en pacientes asintomáticos con función ventricular izquierda normal
Como se ha señalado recientemente 212, existen argumentos que aconsejan realizar la cirugía antes de que aparezcan síntomas o se deteriore la función ventricular. La disfunción ventricular progresa de forma silente, y a veces impredecible, a pesar de un seguimiento adecuado; por otra parte, los pacientes con síntomas severos presentan mayor mortalidad y sintomatología tras la intervención. Los pacientes con IM severa, tratados médicamente, incluso oligosintomáticos, presentan un significativa morbimortalidad. Frente a todos estos problemas, la cirugía reparadora ofrece una mortalidad muy baja y unos excelentes resultados en el seguimiento. En consecuencia, existe una corriente de opinión creciente que recomienda la cirugía reparadora precoz, siempre que se haga en centros experimentados y con resultados contrastados (mortalidad < 1%). Así, pacientes con IM severa reciente, habitualmente por rotura de cuerdas, aunque sea bien tolerada, aquellos con un episodio inaugural de fibrilación auricular, o incluso los que estando estrictamente asintomáticos tienen documentada una regurgitación severa, pueden ser operados en el marco técnico antes descrito.
Fibrilación auricular
Esta arritmia se presenta en cerca del 75% de los pacientes con IM significativa y se ha demostrado su asociación con una disminución de la supervivencia tras la cirugía. Su persistencia tras la operación obliga a prescribir anticoagulantes de forma crónica, con lo que desaparece uno de los principales beneficios de la cirugía reparadora. Una duración de la arritmia >= 1 año y un tamaño auricular >= 50 mm son predictores de persistencia de la fibrilación auricular tras la cirugía. Por eso parece razonable, como comentábamos con anterioridad, recomendar la operación en pacientes con IM severa que desarrollan fibrilación auricular ya que, además, la mayoría de ellos presentan cierto grado de limitación funcional 3.
Reparación frente a sustitución valvular
Aunque en sentido estricto la posibilidad de llevar a cabo una cirugía de reparación mitral, en lugar de recambio valvular, depende casi exclusivamente de la morfología de la lesión valvular, lo cierto es que, en la práctica, tan importante como esta última es la infraestructura quirúrgica. Ésta incluye no sólo la destreza y experiencia del cirujano, sino también otros factores, como la realización de un número suficiente de intervenciones que aseguren la curva de aprendizaje o la posibilidad de llevar a cabo un eco transesofágico intraoperatorio. La experiencia acumulada en los últimos años nos ha permitido aprender que la cirugía reparadora es más factible en los casos con prolapso del velo posterior y en la rotura de cuerdas destinadas al mismo que cuando la afectación es del velo anterior. Las posibilidades de reparación descienden aún más cuando la afectación valvular es de origen reumático o isquémico, o cuando la calcificación del anillo mitral es la enfermedad subyacente.
Insuficiencia mitral de origen isquémico
La IM asociada a la cardiopatía isquémica es de naturaleza diversa. Puede ser transitoria, como la que acompaña a un episodio fugaz de isquemia miocárdica, o permanente, aguda o crónica, de cuantía muy variable, cambiante en el tiempo según las condiciones de carga, el estado de la función ventricular y la intensidad de la isquemia miocárdica y, por último, reversible o irreversible aunque se haya logrado la reperfusión de la arteria responsable de la regurgitación. Todos estos factores deberían ser tenidos en cuenta a la hora de evaluar una posible indicación quirúrgica.
El mecanismo de regurgitación más frecuente es la disfunción del músculo papilar por isquemia o fibrosis, combinada generalmente con anomalía contráctil de la zona parietal adyacente y/o dilatación del ánulo mitral, en especial si coexiste aneurisma ventricular o disfunción ventricular generalizada. La regurgitación no suele ser muy severa, pero en ocasiones contribuye de manera fundamental al cuadro de insuficiencia cardíaca. En ese caso conviene distinguir dos eventualidades: a) el infarto causante es antiguo y presumiblemente hay fibrosis cicatrizal, y b) el infarto es reciente y puede haber viabilidad miocárdica. En el primer caso la intervención quirúrgica, si la regurgitación es grave, constituye la única opción. Tradicionalmente, la mortalidad quirúrgica de esta condición ha sido muy elevada 213 pero con la reciente introducción de métodos reparadores 214 o la sustitución con preservación cordal 215 se comunican resultados más esperanzadores.
La regurgitación severa por disfunción papilar que aparece en el infarto agudo tiene un grave pronóstico. Para algunos autores 216, la cirugía no mejora el pronóstico y la reperfusión tampoco parece que restaure la competencia valvular. Para otros puede haber una oportunidad de que la angioplastia del vaso causante mejore la función del músculo papilar, restaure la competencia valvular y saque al paciente del grave trance 217,218. Cuando la regurgitación es secundaria a la dilatación del ánulo, como sucede en la miocardiopatía isquémica, no está indicada, obviamente, la cirugía mitral aunque sí pudiera estarlo la revascularización si hubiese evidencia de viabilidad miocárdica.
Cuando existe daño estructural por rotura de músculo papilar, la indicación quirúrgica es clara puesto que, aunque la mortalidad operatoria siga siendo elevada, es la única forma de rescatar al paciente de una situación dramática; además, los resultados a medio plazo suelen ser excelentes, ya que con frecuencia el infarto causante es limitado 219. La ecocardiografía es una herramienta fundamental para establecer el mecanismo de la regurgitación mitral en los pacientes isquémicos 220 y debe servir de guía para el establecimiento de una estrategia terapéutica racional. La distinción entre daño estructural y daño funcional es esencial, entre otras razones porque los resultados de la cirugía, sea cual sea la técnica operatoria (reemplazo frente a reparación valvular) son mucho mejores en los casos con daño estructural 221. Los pacientes con disfunción del músculo papilar suelen presentar un movimiento restringido de la valva afecta, con desplazamiento apical de la línea de coaptación y chorro de regurgitación central o ligeramente posterior; estos enfermos tienen una elevada mortalidad quirúrgica y mal pronóstico a largo plazo y, si la regurgitación mitral ocurre en el seno de un episodio isquémico agudo, debería intentarse una angioplastia del vaso causante. Los que tienen rotura de la cabeza de un músculo papilar presentan un movimiento exagerado, con prolapso, valva suelta e incluso material valvular y subvalvular dentro de la aurícula izquierda durante la sístole; el chorro de regurgitación suele ir en dirección opuesta al de la valva afectada; estos enfermos necesitan cirugía y el pronóstico tardío suele ser bueno. Si la distinción entre daño funcional y estructural no es posible mediante eco transtorácico se debe recurrir sin dilación a uno transesofágico para dilucidar con exactitud el mecanismo de la regurgitación que guíe la estrategia terapéutica. En la figura 7 se presenta un algoritmo de actuación frente a este problema de la IM severa postinfarto.
Fig. 7. Algoritmo de actuación en la insuficiencia mitral severa postinfarto, basado en la presencia o ausencia de daño estructural y la posibilidad de realizar angioplastia (ACTP); en el último supuesto, si el vaso responsable de la disfunción papilar es accesible al procedimiento. ETE: eco transesofágico; ETT: eco transtorácico. Resto de leyendas como en la figura 2.
En general, la cirugía mitral en la cardiopatía isquémica tiene una elevada morbimortalidad, casi prohibitiva en los casos con fracción de eyección muy deprimida. En estas circunstancias, la operación debe ser contemplada únicamente si la regurgitación es severa y la reparación mitral va a ser acompañada de una revascularización miocárdica amplia, con la esperanza fundada de mejorar la función ventricular global 160,193,195.
El problema especial de los ancianos
La calcificación del anillo mitral (CAM) es un proceso degenerativo que aparece con frecuencia en los ancianos, más frecuentemente del sexo femenino. En un estudio de 553 pacientes octogenarios, la frecuencia de CAM alcanzó el 59% 219. Es preciso que la calcificación sea al menos moderada para que se produzca una IM significativa. El mecanismo de la regurgitación se debe a la imposibilidad de disminuir el diámetro anular durante la sístole y/o a la extensión de la calcificación a la valva anterior, lo que produce una distorsión y falta de coaptación del velo posterior. En la CAM grave es común la fibrilación auricular y otras anomalías asociadas, como la EA o los trastornos de conducción 220.
La IM crónica severa por degeneración mixoide es una patología relativamente frecuente en los pacientes de edad avanzada; por ejemplo, en una serie quirúrgica de esta enfermedad, el 40% de los enfermos tenían más de 75 años 221. La presentación clínica suele ser como la de los pacientes jóvenes: un cuadro de edema pulmonar en relación con rotura de cuerdas, o clínica de progresión lenta con disfunción ventricular progresiva. El manejo es similar al convencional: cirugía expeditiva en la IM aguda y reparación en la IM crónica severa, sintomática u oligosintomática, en la que los resultados son muy aceptables en lo que respecta a mortalidad operatoria y pronóstico tardío 161.
En este grupo de edad también es común la IM de origen isquémico, ya que la prevalencia de infarto de miocardio es alta. Como se ha comentado previamente, la IM no debida a rotura de alguna estructura tiene un pronóstico sombrío y un manejo quirúrgico difícil. Otro tipo de regurgitaciones que pueden aparecer en la edad tardía son las secundarias a endocarditis infecciosa, ya que hasta una cuarta parte de los enfermos con endocarditis, especialmente en lo que se refiere a infecciones nosocomiales, tienen más de 60 años 222.
Seguimiento de los pacientes operados
La cirugía de la IM crónica se acompaña de una mejoría clínica, la reducción de la dilatación ventricular y la regresión de la hipertrofia. Sin embargo, un número importante de pacientes presentan en el postoperatorio una disminución de la fracción de eyección debido al aumento de la poscarga, que condiciona la reparación valvular al ser eliminada la vía de baja resistencia. A esto puede ir asociado un daño miocárdico intrínseco al acto quirúrgico. La reducción de la fracción de eyección es más acentuada cuanto menor fuere la cifra preoperatoria. Así, los enfermos con fracción de eyección superior al 60% apenas presentan variaciones; por el contrario, aquellos con fracción de eyección preoperatoria inferior al 50% tendrán disfunción sistólica significativa en una tasa que oscila entre el 50 y el 75% 223.
Por tanto, en la revisión, además de una evaluación clínica, radiológica y electrocardiográfica, se precisa un estudio ecocardiográfico que permita definir el tamaño y la función del ventrículo izquierdo, además de evaluar el resultado de la reparación mitral o, en su caso, del funcionamiento del sustituto valvular. El primer control debe hacerse antes del alta del paciente o, en su defecto, a las pocas semanas de la intervención. En los enfermos con disfunción ventricular se debe repetir el ecocardiograma transcurridas unas 6-12 semanas de la intervención, con el fin de optimizar la terapia farmacológica según el curso de la disfunción. En general se considera que, pasados 6 meses de la cirugía, es excepcional una mejoría de la función sistólica. A partir de entonces, el seguimiento se individualizará según el estado clínico de los pacientes, la existencia de regurgitación residual, el nivel de la función ventricular y el tipo de cirugía realizada 152.
VALVULOPATÍAS TRICUSPÍDEAS
Etioanatomía
La insuficiencia tricuspídea (IT) se presenta muchas veces sobre una válvula que no tiene afectación anatómica. Esto ocurre en situaciones en las que la presión sistólica y/o diastólica del ventrículo derecho están elevadas 227-229. Como consecuencia, se dilatan las cavidades derechas y el anillo tricuspídeo, que va perdiendo de forma progresiva su función esfinteriana. Ejemplos de hipertensión sistólica del ventrículo derecho son la estenosis mitral, la estenosis de la válvula pulmonar y todas las múltiples causas de hipertensión arterial pulmonar. La hipertensión diastólica se desarrolla en cualquier enfermedad que afecte al funcionamiento del ventrículo izquierdo y que, finalmente, conduzca a fallo del derecho, por ejemplo, por citar sólo causas muy comunes, la miocardiopatía dilatada y la disfunción ventricular isquémica. Incluso el síndrome de alto gasto cardíaco que genera el hipertiroidismo puede expresarse con una semiología predominante de IT 230.
Las alteraciones anatómicas de la válvula tricúspide que conducen a la IT pueden ser de etiología muy variada 227-229: reumática, endocarditis infecciosa, síndrome carcinoide 231, artritis reumatoide, posradiación, traumatismo directo sobre la válvula, uso de fármacos anorexígenos, síndrome de Marfan, prolapso de la válvula, disfunción isquémica de los músculos papilares y enfermedades congénitas, como el síndrome de Ebstein o la válvula hendida como parte de una malformación del canal AV.
La estenosis tricuspídea (ET) es habitualmente de origen reumático 227,228. Las vegetaciones voluminosas, así como las masas en la aurícula derecha, pueden producir obstrucción tricuspídea. Otras causas raras son las anomalías congénitas, el síndrome carcinoide, las enfermedades de Fabry y de Wipple y la terapia con metisergida.
Diagnóstico
La ET puede ser sospechada por la presencia de una onda a gigante y la ralentización del descenso y en el pulso yugular. En la auscultación se puede apreciar un chasquido de apertura tricuspídea y un retumbo de llenado, con acentuación del componente presistólico si el paciente conserva el ritmo sinusal 232. Una característica fundamental, que se puede perder con la insuficiencia cardíaca avanzada, es que la semiología acústica aumenta en los primeros ciclos que siguen a la inspiración (signo de Rivero-Carballo). Como la causa más común de ET es la fiebre reumática, suele existir semiología asociada correspondiente a afectación de la válvula mitral y/o aórtica.
La IT se puede sospechar por la aparición de una onda v prominente en el pulso yugular y la audición de un soplo regurgitante, de aumento inspiratorio, en la parte baja de la región paraesternal izquierda. Si la regurgitación es severa se produce un soplo de llenado y expansión sistólica hepática, que no debe confundirse con el latido de la aorta abdominal. En casos extremos se puede apreciar un seudoexoftalmos 233, pulsatilidad de venas varicosas 234, o danza en el cuello producida por una gran onda v, que no debe ser confundida con la danza carotídea de la IA. Si existe dilatación marcada del ventrículo derecho, el soplo de IT se hace apexiano y puede ser tomado como correspondiente a IM. Otra característica de la IT es que muchas veces aún no es fija e irreversible y su severidad varía considerablemente con las condiciones de pre y poscarga del ventrículo derecho.
El eco-Doppler valora de forma exquisita la estructura y el funcionalismo de la válvula tricúspide. Tan es así que puede detectar regurgitaciones triviales sin significación patológica 235. En los casos patológicos es necesario estimar la severidad de la IT 236, precisar si existe gradiente diastólico, medir el tamaño del anillo, apreciar la textura de los velos valvulares, la repercusión anatómica y funcional sobre las cavidades derechas y estimar el valor de la presión pulmonar 237.
Una idea muy difundida es que ante presiones sistólicas pulmonares >= 55 mmHg, la IT es de carácter funcional, es decir, sin afectación anatómica de la válvula. Por el contrario, presiones sistólicas pulmonares < 40 mmHg indicarían una anormalidad estructural del aparato valvular tricuspídeo. Este concepto tiene muchas salvedades y probablemente sea mejor estimar el carácter fijo o reversible de la IT en diferentes condiciones de carga y compensación cardíacas, así como utilizar la medida combinada de la presión arterial pulmonar sistólica, el área de los velos y la circunferencia del anillo tricuspídeo 228.
Manejo y tratamiento quirúrgico
La estrategia terapéutica viene determinada por el estado clínico del paciente y la etiología de la lesión valvular tricuspídea. Por ejemplo, si lo que tiene el enfermo es una EM severa con hipertensión pulmonar y dilatación ventricular derecha, cabe esperar una reducción sustancial del grado de IT tras la apertura de la válvula mitral y la consiguiente disminución de las presiones pulmonares 238,239. Hay, no obstante, la posibilidad de que la regurgitación haya adquirido un carácter irreversible al tiempo de la apertura mitral y que el resultado a largo plazo del procedimiento quede empañado por la presencia de IT residual importante 240.
Si se elige la cirugía como opción terapéutica para el tratamiento de la valvulopatía mitral o mitroaórtica acompañante, durante mucho tiempo ha existido la duda de si realizar anuloplastia sistemática de la válvula, ante cualquier grado de IT, o reservar el procedimiento para regurgitaciones más severas 241,242. Hasta cierto punto, esta controversia está desapareciendo desde la aplicación intraoperatoria del eco transesofágico, que permite precisar el grado de IT, una vez corregida la valvulopatía mitral, y valorar la eficacia de la anuloplastia tricuspídea 243. La reconstrucción de las cuerdas tendinosas puede ser intentada en algún caso en que se encuentren rotas por endocarditis infecciosa o por traumatismo torácico.
La valvulopastia con balón ha sido empleada para tratar la ET 244. Sin embargo está en desuso porque genera IT importante. La comisurotomía, seguida de anuloplastia, puede ser efectiva; sin embargo, cuando la válvula está muy afectada se hace necesaria su sustitución por una bioprótesis o por una válvula mecánica de bajo perfil 245. El reemplazo valvular tricuspídeo es una intervención con una elevada mortalidad (cerca del 40%), hecho atribuible a la mala situación clíni-ca de estos pacientes 245a. En general es preferible el uso de prótesis biológicas debido a la elevada tasa de complicaciones trombóticas de las prótesis mecánicas en posición tricuspídea 246. En los pacientes con defectos de la conducción asociados se recomienda la colocación de un electrodo epicárdico permanente, al tiempo de la cirugía, para evitar que con posterioridad nos veamos obligados a tener que pasar un cable transvenoso a través de la prótesis valvular.
POLIVALVULOPATÍAS
Introducción
Debido a las múltiples combinaciones que se pueden producir, tanto en lo que se refiere a la afectación anatómica de las diferentes válvulas como a la severidad hemodinámica que producen, es difícil establecer una guías específicas en este apartado. Cada caso debe ser evaluado individualmente y su manejo estará basado en el conocimiento del deterioro hemodinámico, la función del ventrículo izquierdo y el beneficio que se obtendría con el tratamiento médico y/o quirúrgico.
Lesión combinada de una válvula
Fisiopatología
Tanto en la doble lesión valvular aórtica como en la mitral, la fisiopatología dependerá de la lesión dominante. Por ejemplo, en el paciente con doble lesión aórtica con estenosis predominante, la fisiopatología y el manejo será similar al de una estenosis pura; sin embargo, si el componente regurgitante es más que ligero, se acelera la presentación de síntomas, ya que el aumento del volumen de llenado opera sobre un ventrículo hipertrófico con distensibilidad disminuida. En consecuencia, se elevarán con mayor facilidad las presiones de llenado, facilitando la aparición de congestión pulmonar. Puede ocurrir, pues, que aunque el grado de estenosis no sea lo suficientemente importante como para justificar una intervención quirúrgica, la adición de regurgitación produzca un compromiso hemodinámico que la aconseje. Hay que recordar, por otra parte, que una EA leve, combinada con IA severa, puede tener un gradiente transvalvular alto que refleje un volumen por latido elevado, más que una auténtica estenosis orificial 247.
En la doble lesión mitral con predominio de estenosis hay un volumen ventricular izquierdo normal. Si, por el contrario, predomina la regurgitación, se produce dilatación ventricular izquierda. Cuando predomina la insuficiencia sobre la estenosis, el gradiente, debido al alto flujo transvalvular, magnifica la severidad del componente estenótico.
Diagnóstico ecocardiográfico
La geometría de las cámaras cardíacas es importante para establecer la lesión dominante en las polivalvulopatías (estenosis frente a insuficiencia). Por ejemplo, un ventrículo izquierdo poco dilatado descarta una IA severa. El estudio mediante Doppler de las dobles lesiones debería proporcionar una estimación fidedigna del gradiente medio transvalvular; sin embargo, pueden existir discrepancias significativas entre el gradiente máximo encontrado en el Doppler y el gradiente pico hemodinámico. El área de la válvula mitral puede ser medida con precisión, usando el tiempo de hemipresión en la doble lesión mitral. La medición del área valvular aórtica mediante la determinación del gasto cardíaco por el método de Fick o termodilución puede ser errónea en presencia de regurgitación. El cálculo del área con eco-Doppler, utilizando la ecuación de continuidad, puede también estar afectado por el hiperaflujo orificial 248, aunque en menor grado que con la hemodinámica. En todo caso, la naturaleza compleja de las dobles lesiones valvulares hace que en ocasiones sea necesario un estudio hemodinámico adicional.
Cateterismo cardíaco
El cateterismo se emplea siempre que existe discordancia entre los datos clínicos y los obtenidos por las exploraciones no invasivas. Una eventualidad relativamente frecuente es que la doble lesión tenga apariencia de moderada en situación de reposo y que, sin embargo, se induzcan alteraciones hemodinámicas severas con el ejercicio 249. Esto es debido a que la lesión no dominante exacerba durante el estrés la fisiopatología de la dominante. Por ejemplo, una doble lesión mitral puede presentar en reposo un gradiente transvalvular de 5 mmHg, un área de 1,5 cm 2 y una regurgitación de grado 2/4, con una presión capilar pulmonar media de 15 mmHg. El ejercicio, sin embargo, puede provocar un incremento espectacular de la presión capilar pulmonar, que explica los síntomas del paciente y sugiere la necesidad de intervención quirúrgica.
La estimación del área valvular requiere la determinación del flujo total y el gradiente transvalvular. La adición de regurgitación a una lesión predominantemente estenótica hace que la determinación del gasto cardíaco por los métodos tradicionales subestime el flujo valvular total, compuesto del anterógrado (el medido por Fick o termodilución) más el regurgitante. Para obviar esta limitación se podría calcular el flujo diastólico derivado de los volúmenes ventriculares angiográficos 250, pero este método no se ha impuesto en la práctica. El cateterismo, pues, se emplea sobre todo para estudiar los cambios de presiones que induce el ejercicio, o cualquier otro tipo de estrés, en los pacientes de decisión difícil.
Manejo
No es posible establecer unos criterios rígidos para el tratamiento de las dobles lesiones sobre válvula única. En general, los criterios son los mismos que para las lesiones puras, dependiendo del factor predominante. En consecuencia, nos remitimos a los desarrollados en cada uno de los diferentes apartados.
Estenosis mitral e insuficiencia aórtica
Fisiopatología
En esta combinación la IA es habitualmente moderada y predomina la fisiopatología de EM. La determinación del área mitral por el tiempo de hemipresión puede ser imprecisa en presencia de IA significativa. En ocasiones, la IA es más que moderada, pero su semiología queda enmascarada porque la restricción de flujo causada por la EM limita el impacto del volumen regurgitante sobre el ventrículo 251.
Manejo
Generalmente se toma la decisión según los síntomas producidos por la EM que suele ser la lesión dominante. En estas circunstancias se plantea el dilema de qué hacer con la válvula aórtica. La siguiente orientación puede ser razonable: a) dejar la IA a su evolución natural si la EM se puede solucionar mediante valvuloplastia con balón, y b) sustituir con liberalidad la válvula aórtica si la mitral necesita también ser cambiada por una prótesis. Sin embargo, este último proceder ha sido revisado recientemente, llegándose a la conclusión de que las lesiones aórticas ligeras no deben ser tratadas de manera profiláctica en el momento de la cirugía mitral, puesto que sólo en raras ocasiones se necesita reemplazar con posterioridad la válvula aórtica 252.
Estenosis mitral e insuficiencia tricuspídea
Fisiopatología
Cuando coexisten una IT con una EM, cierto grado de hipertensión pulmonar está habitualmente presente. Por tanto, puede producirse una mejoría de la IT cuando se corrige la EM y la presión pulmonar desciende 238,239. Desafortunadamente, como hemos comentado con anterioridad, la evolución posvalvuloplastia mitral de los enfermos con IT significativa no es tan favorable como la del resto de los pacientes 240.
Diagnóstico
Una vez que se sospecha la presencia de IT en el examen clínico, debe ser evaluada en todos sus extremos, anatómicos y funcionales, mediante ecografía. Al mismo tiempo, los datos deben ser enmarcados dentro del contexto que proporcionen la EM y la hipertensión arterial pulmonar que, obviamente, puede ser estimada en todos los casos.
Manejo.
Salvo que la IT sea severa, debe llevarse a cabo una valvuloplastia con balón, confiando en que con la regresión de la hipertensión pulmonar desaparezca la IT 239. Si la IT es severa, con marcada semiología de congestión sistémica, y/o la anatomía de la mitral es desfavorable para valvuloplastia, lo mejor será intervenir al paciente y reparar la válvula con alguna de las técnicas al uso 253.
Insuficiencia mitral e insuficiencia aórtica
Fisiopatología
Como hemos comentado con anterioridad, la IM y la IA son dos entidades de fisiopatología muy diferente y con valoración distinta en el momento adecuado para la intervención quirúrgica. La aproximación más adecuada es determinar la lesión dominante y tratar de acuerdo con las normas elaboradas para la misma. En todo caso, conviene recordar que la IA induce hipertensión discreta que puede exacerbar la IM.
Diagnóstico y tratamiento.
La ecocardiografía-Doppler es fundamental para evaluar la severidad respectiva de las regurgitaciones, la etioanatomía de las mismas y la repercusión sobre el ventrículo izquierdo, la aurícula del mismo lado y la presión de la arteria pulmonar. La indicación quirúrgica se debe realizar siguiendo las normas establecidas para la lesión dominante; en todo caso, ambas válvulas necesitan actuación quirúrgica, siendo preferible la reparación, si ello fuese posible, en el caso de la mitral.
Estenosis mitral y estenosis aórtica
Fisiopatología
La combinación de enfermedad estenótica es casi siempre secundaria a enfermedad reumática cardíaca. La obstrucción del flujo de la válvula mitral diminuye también el flujo en la válvula aórtica. En consecuencia, a menudo existe el problema de evaluar la severidad del obstáculo aórtico.
Diagnóstico y tratamiento
Con frecuencia, aunque los síntomas dominantes sean los de la EM, predomina la semiología de EA y la estrechez de la válvula mitral puede pasar desapercibida hasta que se realiza ecocardiografía. Esta exploración es básica para determinar el grado de estenosis y la anatomía bivalvular, así como la repercusión sobre las cavidades izquierda y el círculo menor. Si después del estudio nos parece que la EA es poco importante y que la válvula mitral reúne condiciones apropiadas para valvuloplastia con balón, este procedimiento debe intentarse en primer lugar. La válvula aórtica debe ser evaluada de nuevo tras la valvuloplastia mitral.
Estenosis aórtica e insuficiencia mitral
Fisiopatología
Esta combinación lesional está a menudo producida por la fiebre reumática. Sin embargo, la EA y el prolapso de la válvula mitral pueden presentarse asociados en pacientes jóvenes, como pueden hacerlo la EA y la IM degenerativas en la vejez. Si la EA es severa puede empeorar la regurgitación mitral. Por su parte, la IM puede causar ciertos problemas: a) dificultad en la estimación de la severidad de la EA debido a reducción del flujo anterógrado; b) enmascaramiento de la disfunción ventricular incipiente causada por la EA, debido al incremento de la fracción de eyección en la IM, y c) aparición de fibrilación auricular, con la consiguiente pérdida de la sístole auricular que empeora el llenado de un ventrículo hipertrófico y, por ende, reduce el gasto cardíaco.
Diagnóstico y tratamiento
La exploración ecocardiográfica es capital para evaluar la severidad respectiva de las lesiones, su repercusión sobre las cavidades izquierdas y el nivel de la presión arterial pulmonar. Hay que prestar especial atención a la morfología de la válvula mitral en este tipo de asociación. Si ambas lesiones son severas, se debería llevar a cabo el reemplazo de ambas válvulas, o mejor aún, la reparación de la válvula mitral si fuese posible. Sin embargo, en pacientes con EA severa y grado menor de IM, ésta puede mejorar espectacularmente tras el reemplazamiento aórtico, sobre todo cuando la morfología de la válvula mitral es normal. La ecocardiografía transesofágica intraoperatoria y, si fuera necesario, la inspección visual de la válvula mitral, deben realizarse en el momento del reemplazo valvular aórtico para determinar si una cirugía adicional sobre la mitral pudiera ser beneficiosa.
En pacientes con EA leve-moderada e IM severa, en los que la cirugía se indica por esta última, es difícil decidir el comportamiento. Si el gradiente transaórtico medio es >= 30 mmHg se debe sustituir la válvula aórtica. En pacientes con gradientes transaórticos menos severos, hay que recordar que la disminución del flujo anterógrado, a causa de la regurgitación mitral, puede estar minimizando su cuantía. En este caso, la decisión puede ser aún más difícil de tomar, pudiendo ayudar datos colaterales como el aspecto ecocardiográfico de la válvula aórtica o su grado de apertura; finalmente, puede ser la inspección visual intraoperatoria la que determine la necesidad de sustituir la válvula aórtica.
AFECTACIONES VALVULARES POCO COMUNES
Además de las valvulopatías comunes, existen otras afecciones valvulares relacionadas con enfermedades sistémicas, administración de fármacos o toxinas. El tratamiento de estos procesos debe ir dirigido a la enfermedad primaria y la lesión valvular debe ser tratada de acuerdo con la alteración fisiopatológica que produce y en concordancia con los planteamientos establecidos para los procesos valvulares comunes.
Alteraciones valvulares por fármacos anorexígenos
La fenfluramina (Ponderal ®), y su forma dextrógira racémica, la dexfenfluramina (Dipondal ®), son fár-macos que actúan produciendo un aumento de la liberación de serotonina e inhibición de sus receptores. Ambos mecanismos provocan un incremento de la concentración plasmática y tisular de serotonina. En verano de 1997, investigadores de la Clínica Mayo y del Centro Médico Meritcare en Fargo describieron 24 casos de pacientes obesos que habían recibido una combinación de fenfluoramina y fentermina y presentaban regurgitación y alteraciones morfológicas de diferentes válvula cardíacas 254. Todos tenían IA y/o IM y la mitad de ellos, además, IT. En 8 pacientes había hipertensión pulmonar asociada. Cinco enfermos fueron operados y el estudio histopatológico de las válvulas extirpadas puso de manifiesto placas de fibrosis, con rigidez y engrosamientos de valvas y cuerdas. Estos hallazgos eran similares a las alteraciones descritas en los síndromes carcinoide y ergotamínico. Posteriormente se describieron más casos que habían tomado dexfenfluramina y fentermina, así como fenfluramina o dexfenfluramina solas. En revisiones ecocardiográficas de los pacientes tratados con estos fármacos se encontró una incidencia del 29 al 36% de afectación valvular 255. Debido a ello, este tipo de medicación fue retirada del mercado en septiembre de 1997. Posteriormente, en estudios más controlados, se han comunicado tasas de afectación valvular que oscilan entre menos del 1% hasta el 26%, diferencias que se atribuyen a las distintas metodologías de estudio empleadas 256-259. Desconocemos si en nuestro país se ha realizado algún estudio sobre la prevalencia de este fenómeno.
Parece ser que la probabilidad de afectación valvular significativa depende de la duración de la exposición al agente anorexígeno; sin embargo, la historia natural de esta afección es desconocida y se requiere una mayor investigación clínica. A pesar de ello, ya se han definido recomendaciones para el tratamiento de estos pacientes 260,261 (tabla 28):
1. Cualquier persona que reciba este tipo de tratamiento, con independencia del tiempo de exposición, debe someterse a un examen cardiovascular que incluya historia clínica y examen físico con el objeto de detectar síntomas o signos cardiopulmonares.
2. En caso de que exista algún síntoma o signo sugestivo de enfermedad valvular, debe realizarse estudio ecocardiográfico. Por desconocerse la historia natural del síndrome y la posible predisposición a la endocarditis, se ha aconsejado también su realización en los pacientes que, aun sin semiología, vayan a ser sometidos a un procedimiento con riesgo de bacteriemia. No obstante, se sugiere limitar el estudio ecocardiográfico a los enfermos con semiología y, eventualmente, a grandes obesos en los que la auscultación sea difícil.
3. A causa de la alta prevalencia de regurgitaciones triviales se exige para el diagnóstico, además de la exposición al fármaco, que la IA sea al menos ligera y la IM moderada 260,261. Como se desconoce la historia natural de estas lesiones, se recomienda la realización de exámenes clínicos periódicos cada 6 u 8 meses 3.
Síndrome carcinoide y ergotamina. Síndrome posradioterápico
El síndrome carcinoide es el conjunto de manifestaciones clínicas que acompañan la presencia del tumor carcinoide. Los síntomas son debidos a la producción tumoral de aminas vasoactivas (serotonina), cininas e indoles 262,263 y se expresan por diarrea, crisis de rubor y labilidad de la presión arterial. Las lesiones cardíacas de los carcinoides digestivos, los más comunes, ocurren en el lado derecho del corazón y sólo cuando existen metástasis hepáticas 264. Esto sugiere que la sustancia tóxica para el corazón es inactivada por el paso hepático. Lesiones similares ocurren en el lado izquierdo del corazón cuando existe un cortocircuito derecha-izquierda, o el tumor asienta en el pulmón. Las lesiones consisten en placas fibrosas en el endocardio parietal o valvular que producen deformación y disfunción de la válvula 265. Histológicamente están constituidas por células musculares lisas, inmersas en una estroma mucopolisacárido ácida y fibras colágenas que son probablemente consecuencia de la curación de lesiones endocárdicas. La afectación valvular más frecuente es la IT, seguida de la estenosis pulmonar o de ambas 266. La progresión de las lesiones no parece estar influida por los antagonistas de la serotonina. En algunos pacientes pueden existir signos de gasto cardíaco elevado por disminución de las resistencias periféricas y también episodios de espasmo coronario debidos a las aminas vasoactivas. A pesar de ser maligno, el tumor crece lentamente y puede producir la muerte más por insuficiencia cardíaca que por la tumoración en sí. En el tratamiento médico se han usado los análogos de la somastatina y el octeótrido, que también tiene utilidad diagnóstica 267,268. Debido a la clínica de insuficiencia cardíaca, está indicada la sustitución valvular tricuspídea y/o la valvulotomía pulmonar. Pueden emplearse prótesis mecánicas o biológicas, pero no los homoinjertos, que pueden ser afectados por la enfermedad carcinoide 269.
La ergotamina es un alcaloide que ha sido utilizado principalmente en el tratamiento de la cefalea migrañosa. Provoca constricción de los vasos sanguíneos periféricos, en especial de las extremidades inferiores. También puede producir espasmo arterial coronario en algunos pacientes y, de manera excepcional, su uso crónico se ha asociado con fibrosis valvular mitral y aórtica 270-272.
La radiación del mediastino puede afectar al pericardio, miocardio, endocardio, vasos y tejido de conducción del corazón 273-275. La afectación de estas estructuras se manifiesta tardíamente, meses o años después de la exposición. La afectación pericárdica puede ser crónica y recidivante. En el miocardio se produce fibrosis con alteración de la función diastólica y sistólica 276. La valvulopatía es infrecuente y las válvulas más afectadas son la mitral y la aórtica 277-279. También puede producir arteriopatía coronaria prematura, incluso 10 o más años después de la radioterapia. En cuanto al tejido de conducción, es especialmente frecuente el bloqueo completo de rama derecha y más raramente el bloqueo completo 273,280.
Conectivopatías
Cualquier estructura cardiovascular puede resultar afectada en las enfermedades del tejido conectivo 281. En el lupus eritematoso, la afectación endocárdica se caracteriza por lesiones verrugosas implantadas en las superficies valvulares, aunque también pueden encontrarse en los bordes libres de las valvas, las comisuras, los anillos valvulares y las cuerdas tendinosas. La frecuencia de afectación valvular es elevada cuando se explora a los pacientes con ecografía 282-284; sin embargo, lesiones clínicamente significativas se encuentran sólo en un 20% de los casos 302. Las lesiones valvulares del lupus están íntimamente ligadas a la presencia de anticuerpos antifosfolípido 283,284 y la mayoría de ellas suelen ser regurgitantes, aunque también las hay estenóticas. A veces, las lesiones son importantes y requieren intervención quirúrgica. En la serie prospectiva de Galve et al, esto ocurrió en un 8% de los casos 282. Como subrayan estos autores, la valvulopatía lúpica, a diferencia de lo que manifiestan los textos clásicos, no es únicamente una afección anecdótica, reconocible en exclusiva por los patólogos en los estudios autópsicos, sino que posee un protagonismo clínico evidente, que ha ido haciéndose más preeminente a medida que los procedimientos terapéuticos han prolongado la supervivencia de estos pacientes 281.
Aunque las manifestaciones clínicas más habituales en el síndrome antifosfolípido primario son las derivadas de las trombosis en venas y arterias, también pueden estar comprometidas las válvulas cardíacas 285,286. En el estudio de Galve et al 286 se encontró una elevada frecuencia (36%) de lesiones valvulares. Dichas lesiones asientan sobre las válvulas mitral y aórtica, y consisten en engrosamientos localizados que producen regurgitación. En ocasiones, la afectación valvular puede ser severa y exigir la sustitución por una pró-tesis 286.
Las denominadas espondiloartritis seronegativas (espondiloartritis anquilopoyética, enfermedad de Reiter, artritis psoriásica y artritis asociadas a las enfermedades intestinales inflamatorias) pueden, asimismo, producir afectación valvular. La más característica de todas ellas es la IA, que se produce en la espondiloartritis anquilopoyética a consecuencia de un proceso inflamatorio esclerosante que afecta también a la aorta 287. Cuando la IA es severa, se hace obligado el reemplazo valvular que, generalmente, va acompañado de sustitución de la aorta ascendente enferma 288. En la policondritis recurrente, una enfermedad rara que cursa con brotes y remisiones sucesivas que afectan a los cartílagos, sobre todo el auricular y nasal, hay afectación valvular en un 25% de los casos. Las lesiones consisten en dilatación progresiva del anillo mitral y/o aórtico, que producen regurgitación y pueden llegar a ser aneurismáticos, necesitando la reparación quirúr-gica 289.
Enfermedades miocárdicas
La IM, por dilatación anular y desalineación del aparato subvalvular, es muy frecuente en todas las enfermedades que producen disfunción sistólica del aparato ventricular izquierdo. Generalmente, la regurgitación es poco importante, aunque hay casos con IM severa para los que se ha propuesto la cirugía reparadora 290. Otra gran causa de regurgitación es la isquemia miocárdica, tanto aguda como crónica 291. La mayoría de las veces se trata de una regurgitación funcional por necrosis o isquemia severa de un músculo papilar y la zona miocárdica adyacente; otras veces es, simplemente, producto de la dilatación de un ventrículo disfuncionante. Los casos más graves, sin embargo, se producen cuando, a consecuencia de la necrosis miocárdica, se rompe un músculo papilar o una de sus cabezas 219. El manejo de la regurgitación severa de origen isquémico se ha discutido previamente.
La IM es muy frecuente en la miocardiopatía hipertrófica y se cree debida al movimiento sistólico anterior de la válvula mitral; el efecto Venturi, producido por la alta velocidad de la corriente sanguínea en el tracto de salida del ventrículo izquierdo, arrastra a la valva anterior, impidiendo un cierre correcto. Pero también se han encontrado alteraciones morfológicas de la válvula y prolapso mitral que pueden explicar la presencia de insuficiencia 292. La IM secundaria al movimiento sistólico anterior de la válvula mitral mejora con tratamiento médico, estimulación secuencial de las aurículas y los ventrículos 293,294 y miomectomía; sin embargo, la que es producida por alteraciones estructurales de las valvas, elongación o rotura de cuerdas, tiene que corregirse mediante sustitución valvular o cirugía reparadora 295.
VALVULOPATÍAS Y EMBARAZO
Cambios fisiológicos en el embarazo
Durante el embarazo, el volumen sanguíneo circulante aumenta alrededor de un 50%, lo que se acompaña de un incremento del gasto cardíaco, que es máximo entre la segunda mitad del segundo trimestre y durante el tercer trimestre. El incremento del gasto cardíaco se hace a expensas de un incremento del volumen por latido y de la frecuencia cardíaca, 10 a 20 latidos por minuto por encima de lo habitual. A causa de la incorporación del lecho uterino a la circulación general, y el efecto de las hormonas endógenas, disminuyen las resistencias periféricas y aumenta la presión del pulso. En la posición de decúbito supino, el útero grávido puede comprimir la vena cava inferior, produciendo un descenso brusco de la precarga que se manifiesta como hipotensión, debilidad y mareo, que desaparecen cambiando la posición a decúbito lateral 296. Durante el parto existe un brusco incremento del gasto cardíaco asociado a la ansiedad y el dolor. Las contracciones uterinas pueden producir un marcado incremento de la presión arterial, tanto sistólica como diastólica. Después del parto se produce un incremento inicial de la precarga, ocasionado por la autotransfusión de la sangre uterina a la circulación sistémica y a la descompresión de la vena cava inferior. También el embarazo se asocia con una situación de hipercoagulabilidad, ya que disminuye la actividad de la proteína S y aumenta la estasis y la compresión venosa 297. Los estrógenos interfieren con el depósito de colágeno en la capa media de la aorta y de las grandes arterias y, además, la elastasa circulante puede romper las laminillas elásticas y debilitar la capa media. Este debilitamiento de la pared vascular puede predisponer a la disección, con o sin enfermedad del tejido conectivo subyacente 131.
Examen físico
Durante el embarazo son evidentes el aumento de la frecuencia cardíaca en reposo y la marcada presión del pulso. La presión venosa suele estar ligeramente elevada en relación con las mujeres no embarazadas 3. La glándula tiroidea puede estar aumentada en ausencia de hipertiroidismo clínico. Los volúmenes pulmonares pueden estar disminuidos a causa de la elevación de los diafragmas. El impulso apexiano es hipercinético y el primer ruido puede estar aumentado y desdoblado. El segundo ruido está fisiológicamente desdobla-do, aunque más ampliamente e incluso fijo en el último período del embarazo. Es común la auscultación de un tercer ruido y de un soplo sistólico grado 1-2 en el borde esternal superior izquierdo 298. Puede oírse un soplo continuo venoso en el cuello y arterial mamario. El soplo venoso del cuello se aprecia mejor en la fosa supraclavicular derecha y puede desaparecer con el movimiento de la cabeza hacia ese lado, o bien mediante la compresión sobre la vena yugular del mismo lado. El soplo mamario es sistólico o continuo y se oye sobre las mamas ingurgitadas; es de baja frecuencia y puede desaparecer si se ejerce presión con la membrana del fonendoscopio. Se oye mejor en decúbito supino, desaparece al adoptar la posición erguida y aparece en los últimos estadios del embarazo o en el puerperio. Los soplos diastólicos son raros. El aumento del gasto cardíaco puede acentuar la semiología acústica de las estenosis valvulares, mientras que los soplos regurgitantes pueden atenuarse por la disminución de las resistencias vasculares sistémicas 298,299.
Ecocardiografía
El empleo de ultrasonidos durante el embarazo no produce ningún riesgo sobre la madre o el feto. Se suele encontrar un ligero agrandamiento de las cámaras cardíacas y el Doppler puede demostrar una ligera insuficiencia de la válvula pulmonar y de las válvulas auriculoventriculares en ausencia de cambios estructurales. Estas alteraciones pueden derivar del agrandamiento de los ventrículos y de la dilatación del anillo valvular. Es importante tener en cuenta todos estos datos con objeto de valorar adecuadamente a los pacientes con alteraciones valvulares 300.
Manejo general
Toda paciente portadora de una enfermedad cardíaca debe tener información cumplida de los diferentes métodos anticonceptivos y del riesgo que, tanto para ella como para el feto, puede entrañar la gestación. El consejo personalizado requiere la colaboración multidisciplinaria del obstetra y del cardiólogo, especialmente en las enfermas de alto riesgo.
Los cambios inducidos por el embarazo son mal tolerados en varios procesos como las cardiopatías cianóticas, el síndrome de Eisenmenger y la hipertensión pulmonar severa; por lo tanto, debe evitarse el embarazo en estas situaciones 3. Lesiones valvulares, como la EA, la IA del síndrome de Marfan, las que tienen un grado funcional de la NYHA superior a II, hipertensión pulmonar o disfunción ventricular izquierda, así como las prótesis mecánicas que requieren anticoagulación, sufren un elevado riesgo durante el embarazo. Sin embargo, en el resto de las cardiopatías el embarazo puede ser superarse con un relativo bajo riesgo.
Muchos de los pacientes valvulares pueden ser tratados durante el embarazo, parto y puerperio con medidas conservadoras que controlen el volumen intravascular y las condiciones de sobrecarga. Intervenciones simples, como el reposo en cama o evitar la posición de supino, son importantes. Siempre que sea posible, las lesiones valvulares severas deben ser corregidas antes del embarazo y, hasta donde se pueda, se deben evitar los fármacos en general 3.
Lesiones específicas
Estenosis mitral
Es la valvulopatía más común en las jóvenes embarazadas. Estas pacientes deben recibir profilaxis con penicilina durante el embarazo para evitar recidivas de fiebre reumática. Las enfermas con estenosis ligera o moderada pueden ser tratadas con diuréticos y betabloqueadores. Los diuréticos son útiles para aliviar la congestión venosa pulmonar y sistémica, pero debe evitarse la depleción intensa que pueda provocar hipoperfusión placentaria. Los betabloqueadores se emplean para evitar la taquicardia y optimizar el llenado diastólico. Aunque se han utilizado durante mucho tiempo los betabloqueadores no selectivos, como el propranolol, en la actualidad se recomienda usar los cardioselectivos, como el metoprolol o atenolol, para prevenir el efecto perjudicial del bloqueo en la actividad del miometrio. En las pacientes sintomáticas con EM severa debe ser considerada la corrección de la obstrucción antes del embarazo, especialmente si la válvula puede ser abierta mediante valvuloplastia con balón. Si durante el embarazo la enferma está en grado funcional avanzado, con síntomas incontrolables, debe realizarse valvuloplastia guiada por ecografía o, en su defecto, restringiendo el tiempo de fluoroscopia y protegiendo la pelvis y el abdomen. Los resultados comunicados, aunque en series muy limitadas, son excelentes 301,302. En el pasado, la valvulotomía quirúrgica cerrada fue una buena opción que aún se sigue empleando en países en vía de desarrollo 303.
Insuficiencia mitral
El prolapso mitral es la causa más común de insuficiencia en las mujeres embarazadas. Los hallazgos físicos del prolapso pueden estar atenuados por los cambios fisiológicos del embarazo, en especial por el incremento del volumen sanguíneo y la reducción de las resistencias periféricas. La IM debe ser tratada médicamente, aunque en raras ocasiones, a causa de la rotura de cuerdas tendinosas, sucede un empeoramiento brusco y la cirugía es inexorable. El tratamiento incluye diuréticos si existe congestión pulmonar, y vasodilatadores si hay una tensión arterial elevada. En caso de tensión arterial normal o baja no deben ser utilizados. Los inhibidores de la ECA no deben utilizarse por los múltiples efectos adversos sobre el feto, y es preferible la utilización de la hidralazina, que ha mostrado su seguridad. Cuando se requiere cirugía, es preferible la reparación a la sustitución protésica para evitar los problemas derivados de la anticoagulación.
Estenosis aórtica
La causa más común de EA en las mujeres embarazadas es la válvula bicúspide congénita. En las pacientes con obstrucciones ligeras o moderadas y función sistólica ventricular izquierda normal, el tratamiento es conservador. En las enfermas con obstrucción más severa (gradiente medio > 50 mmHg) y síntomas se debe retrasar el embarazo hasta que se corrija la lesión aórtica. En los raros casos en que el diagnóstico se hace durante el embarazo, sobre todo si ha habido insuficiencia cardíaca o síncope, debe valorarse la realización de valvuloplastia o cirugía antes del parto. Ambos procedimientos entrañan riesgo, tanto para la madre como para el feto, aunque han sido comunicados resultados con éxito 304,305. Existe una asociación de válvula bicúspide y necrosis quística de la media aórtica que puede predisponer a la disección aórtica espontánea durante el tercer trimestre del embarazo.
Insuficiencia aórtica
Puede ser tratada con diuréticos, aislados o en combinación con vasodilatadores 306. Las mujeres sintomáticas con signos de insuficiencia cardíaca izquierda deben ser vigiladas estrechamente en lo que respecta al volumen intravascular y la presión arterial. La cirugía durante el embarazo debe considerarse en los casos con insuficiencia cardíaca refractaria. Las enfermas menos sintomáticas, aunque tengan criterios de operabilidad en relación con las dimensiones y/o la función sistólica del ventrículo, deben esperar a que finalice el embarazo para ser operadas.
Estenosis pulmonar
Aunque puede presentarse aislada, frecuentemente se asocia a otras lesiones congénitas complejas. En general, las pacientes con cardiopatías congénitas cianóticas toleran peor el estrés del embarazo que las que tienen lesiones acianóticas. La estenosis pulmonar aislada no suele constituir un impedimento para un embarazo normal y, llegado el caso, puede ser resuelta mediante valvulotomía percutánea guiada por ecocardiografía para evitar las radiaciones 3.
Enfermedad valvular tricuspídea
Puede ser congénita (anomalía de Ebstein, atresia tricuspídea) o adquirida (endocarditis, degeneración mixoide, tumor carcinoide). La IT aislada no plantea problemas significativos durante el embarazo, aunque debe tenerse mayor cuidado del habitual para evitar la hipoperfusión placentaria inducida por diuréticos 3.
Síndrome de Marfan
Es una alteración hereditaria del tejido conectivo que surge por anormalidades en el gen de la fibrilina del cromosoma 15. Se transmite de forma autosómica dominante y se manifiesta clínicamente por alteraciones oculares, esqueléticas o cardiovasculares. La rotura y la disección de la aorta son las complicaciones más temibles que pueden surgir durante el embarazo 307,308. La disección puede iniciarse en cualquier punto de la aorta, aunque el sitio más común es la porción ascendente. Las enfermas con una raíz aórtica superior a 4 cm de diámetro tienen un riesgo especialmente alto, aunque unas medidas normales no son garantía contra una complicación catastrófica. El agrandamiento de la raíz aórtica puede estar acompañado de IA y/o de prolapso mitral con regurgitación. Cualquier mujer con síndrome de Marfan que contemple quedarse embarazada debe ser explorada previamente con ecocardiografía, al objeto de medir la raíz aórtica. Los agrandamientos mayores de 5 cm deben ser corregidos quirúrgicamente mediante sustitución con un tubo valvulado y reimplantación de las arterias coronarias. Hay autores que recomiendan interrumpir el embarazo y realizar la subsiguiente corrección quirúrgica si se descubre durante el mismo una raíz aórtica mayor de 5 cm, especialmente si los estudios seriados demuestran que el ensanchamiento es progresivo. La disección o la rotura de la aorta ocurren sobre todo durante el tercer trimestre del embarazo o en el curso del parto. Durante este último debe suministrarse una analgesia adecuada y prevenir cambios bruscos de la presión arterial; se debe valorar, igualmente, la posibilidad de realizar cesárea, que permite un control hemodinámico más adecuado. También se recomienda el betabloqueo profiláctico a lo largo del embarazo, puesto que este tra-tamiento ha demostrado el enlentecimiento de la dilatación aórtica y la reducción de complicaciones cardiovasculares en adolescentes y adultos 133. Debe señalarse, por último, que las pacientes con síndrome de Marfan sin alteraciones cardiovasculares identificables en el examen clínico y ecocardiográfico pueden cursar un embarazo y parto completamente normales.
Profilaxis de endocarditis
La profilaxis rutinaria no es aconsejable, a menos que exista la posibilidad de complicaciones sépticas durante el parto o en la cesárea. Algunos autores consideran apropiado realizar profilaxis en las pacientes de alto riesgo: portadoras de prótesis valvular, antecedentes de endocarditis previa, cardiopatía congénita compleja o fístulas sistémico-pulmonares de origen quirúrgico 202.
Cirugía valvular durante el embarazo
La indicación de cirugía en las mujeres embarazadas es una decisión compleja y difícil. Incluso en condiciones ideales, que incluyen técnicas de bypass con altas velocidades de flujo y perfusión caliente, hay una alta incidencia de sufrimiento fetal, retraso del crecimiento o aborto 309,310. Siempre es preferible, salvo que sea ineludible, retrasar la cirugía hasta después del parto, o al menos hasta que el feto sea viable y se pueda realizar una cesárea como parte integral del procedimiento quirúrgico 311,312. La cirugía debe realizarse en las enfermas con síntomas refractarios al tratamiento médico, especialmente si cursan con un síndrome de bajo gasto. Las lesiones mitrales deben ser, de preferencia, reparadas; si el reemplazo valvular es ineludible, la elección del sustituto valvular plantea un dilema. Las bioprótesis degeneran más rápidamente en las personas jóvenes, y esta degeneración se acelera durante el embarazo 313. Aunque las bioprótesis no requieren anticoagulación a largo plazo, exponen a los individuos jóvenes al riesgo del fracaso valvular y la consiguiente necesidad de reintervención. Las válvulas mecánicas, aunque más duraderas, obligan a una anticoagulación durante los meses siguientes de embarazo. En la enfermedad valvular aórtica debe ser considerada la implantación de homoinjertos o autoinjertos pulmonares.
Anticoagulación
Todas las mujeres en edad fértil, portadoras de prótesis valvulares mecánicas, deberían saber que si se produce un embarazo tienen que seguir con anticoagulación y que este tratamiento entraña peligro, tanto para ella como para el feto. Hay quienes, por esta razón, desaconsejan formalmente la implantación de prótesis mecánicas en mujeres fértiles. Por desgracia, tanto con los dicumarínicos como con la heparina hay un riesgo significativo de hemorragia o trombosis 3. La incidencia de fenómenos tromboembólicos, a pesar de unos controles adecuados de anticoagulación, se cifra en un 4-14% 314. No existen estudios prospectivos y aleatorizados que permitan enunciar una actitud terapéutica idónea; ésta, más bien, está fundada sobre una buena dosis de empirismo.
Dicumarínicos
Estos fármacos cruzan la barrera placentaria y se han asociado con un incremento del aborto espontáneo, prematuridad y feto muerto al nacimiento. Los fabricantes consideran que su uso durante el embarazo está estrictamente contraindicado, en virtud de su asociación con la embriopatía fetal. La incidencia de embriopatía por warfarina es difícil de precisar, aunque una estimación razonable del riesgo lo sitúa entre el 5-10%. El riesgo es dosis dependiente y más alto si la exposición se hace en el período que va de la sexta a la duodécima semanas de embarazo. La hemorragia cerebral del feto es una complicación clásica, especialmente si el parto es distócico y se necesita la evacuación con fórceps 315.
Heparina
La heparina no cruza la placenta y se considera segura para el feto 316. La administración a largo plazo produce abscesos estériles, osteoporosis que puede dar lugar a pequeñas fracturas, trombocitopenia y hemorragia materna. Aunque la heparina fue considerada inicialmente como el tratamiento de elección, la experiencia posterior ha demostrado que pueden ocurrir complicaciones tromboembólicas, incluyendo la trombosis fatal de la prótesis. En mujeres embarazadas tratadas con heparina subcutánea, esta complicación puede presentarse en 12-24% de los casos 317. Estos estudios se han criticado porque estaban hechos con prótesis antiguas, más trombogénicas, dosis inadecuadas de heparina y vigilancia hematológica poco estricta.
La elección del anticoagulante debe ser hecha teniendo en cuenta la preferencia materna, una vez que haya comprendido los riesgo que para ella y el feto entraña el tratamiento 318,319.
Muchas mujeres considerarán que el riesgo de embriopatía fetal es inaceptable y, por tanto, no estarán dispuestas a tomar dicumarínicos durante el primer trimestre del embarazo o incluso a todo lo largo del mismo; pero si se inclinan por la heparina, deben conocer los peligros de hemorragia y de trombosis protésica. Las heparinas de bajo peso molecular ofrecen ventajas sobre la heparina no fraccionada, como la fácil administración, la mayor biodisponibilidad, el no precisar una vigilancia del laboratorio y la baja incidencia de trombocitopenia y osteoporosis. Aunque han sido usadas en el tratamiento de trombosis venosas profundas durante el embarazo, no hay suficiente experiencia sobre su uso en las embarazadas portadoras de prótesis mecánicas 318. En enfermas de alto riesgo trombótico se ha recomendado la adición de bajas dosis de heparina o aspirina a los dicumarínicos 320. El dipiridamol no debe ser utilizado como agente antiplaquetario por sus efectos adversos sobre el feto. Ni los dicumarínicos ni la heparina están contraindicados en el posparto y en la lactancia 321.
VALVULOPATÍAS EN LOS ADOLESCENTES Y ADULTOS JÓVENES
En muchas cardiopatías congénitas la afectación valvular forma parte de una anomalía compleja. El manejo de estas malformaciones no es el objeto de este apartado que tratará exclusivamente de las valvulopatías aisladas en adolescentes y adultos jóvenes.
Estenosis aórtica
La causa más frecuente de EA en este tramo de edad es la válvula bicúspide. Aunque la prevalencia de válvula aórtica bicúspide es muy elevada (el 2% de todos los nacimientos), sólo 1 de cada 50 niños tendrá obstrucción o regurgitación valvular significativa al llegar a la adolescencia. La progresión de la enfermedad en estas edades es algo diferente a la EA adquirida del adulto. La tercera parte de los niños evaluados en la primera infancia (entre 2 y 11 años) tienen un incremento del gradiente en un período de 4 a 8 años, probablemente porque el crecimiento del anillo y las valvas es inapropiado; sin embargo, el incremento de la obstrucción es muy ligero en los evaluados a partir de los 12 años. En todo caso, la probabilidad de progresión es superior en los que tienen mayores gradientes iniciales. Así, en el curso de 20 años, sólo el 20% de los pacientes con gradiente pico < 25 mmHg requieren algún tipo de intervención. Por el contrario, los que tienen un gradiente inicial > 50 mmHg pueden padecer arritmias, muerte súbita u otros episodios como endocarditis infecciosa, insuficiencia cardíaca, síncope, angina, infarto de miocardio, ictus o implantación de marcapasos, con una frecuencia aproximada de 1,2% por año 322. En este estudio, basado en 370 pacientes seguidos a razón de 8.000 pacientes-año, la incidencia de muerte súbita fue del 0,3% anual. La severidad de la obstrucción en los que fallecieron no pudo determinarse y, por tanto, no pudo identificarse un subgrupo de alto riesgo.
El diagnóstico de EA se realiza mediante la exploración física y la estimación de su severidad por ECG y ecocardiografía-Doppler, requiriendo cateterismo cardíaco sólo aquellos casos de discrepancia entre la evaluación clínica y los datos instrumentales. La prueba de esfuerzo puede ser útil en los pacientes que tengan intención de realizar ejercicios atléticos (tabla 31).
La valvulotomía con balón es una opción terapéutica eficaz en este grupo de edad 323-329, en contraste, como se ha comentado con anterioridad, con la EA del adulto mayor. Es difícil establecer una edad de corte y, hasta disponer de más información, la recomendación de valvulotomía con balón debe limitarse a los adolescentes y adultos jóvenes en los primeros años de la segunda década de vida, aunque algunos adultos no tan jóvenes, con válvulas aún no profusamente calcificadas, pueden beneficiarse de este procedimiento. La mínima morbimortalidad de este tratamiento, junto con sus buenos resultados a largo plazo, hacen que las indicaciones sean más liberales que en los adultos, para quienes una intervención representa, generalmente, la sustitución valvular. Aunque todavía no disponemos de datos definitivos, puede asumirse que la reducción del gradiente implica disminuir el bajo riesgo de muerte súbita 330, así como la extensión de la fibrosis miocárdica que se ha podido observar en niños y adolescentes fa-llecidos y que tenían evidencia de alteraciones de la repolarización en el ECG. En consecuencia, deben considerarse para cateterismo y posible valvulotomía con balón los niños y adolescentes con gradientes determinados por Doppler >= 70-80 mmHg (velocidad pico > 4,2 m/s), los que presentan alteraciones de la repolarización (inversión de la onda T o depresión del segmento ST) y los que desarrollan síntomas (tabla 31). El gradiente debe confirmarse en el cateterismo antes de la dilatación, que será razonable realizar si aquel es > 60 mmHg. También serán candidatos a valvulotomía con balón los pacientes con gradientes inferiores (50-70 mmHg por eco-Doppler) que quieran realizar deportes de competición o mujeres que deseen quedar embarazadas. En la mayoría de centros esta técnica ha desplazado a la valvulotomía quirúrgica, que de cualquier modo sigue siendo una alternativa válida si no se dispone de hemodinámica intervencionista con experiencia. Si la dilatación con balón es inefectiva, o existe insuficiencia aórtica importante, se hará necesario el recambio valvular. La sustitución de la válvula aórtica con un autoinjerto de válvula pulmonar y la colocación de un homoinjerto de válvula pulmonar o aórtica en el lugar de la pulmonar nativa, intervención de Donald Ross 331, va ganando adeptos 332,333 ya que se consigue una buena hemodinámica, los resultados a largo plazo son excelente 39,334 y tiene la ventaja de no requerir anticoagulación, circunstancia de especial relevancia en adolescentes, adultos jóvenes y mujeres en edad fértil.
Insuficiencia aórtica
Las indicaciones de intervención en este grupo de población con válvula aórtica bicúspide e insuficiencia o doble lesión aórtica son similares a las de los adultos (tabla 11). En la tabla 32 se especifican estas indicaciones, adaptadas al grupo de edad que venimos tratando.
Insuficiencia mitral
La IM congénita aislada es rara. En pacientes pediátricos lo más frecuente es la hendidura de la valva anterior en el seno de un defecto del septo atrioventricular. En los jóvenes puede ser secundaria a prolapso valvular en enfermedades del tejido conectivo, alteraciones metabólicas o enfermedades de depósito. También puede ser consecuencia de enfermedades inflamatorias como la fiebre reumática, la endocarditis o la enfermedad de Kawasaki, o secundaria a disfunción del músculo papilar necrótico cuando la arteria coronaria izquierda nace de la pulmonar.
La fisiopatología, diagnóstico y tratamiento son como en el adulto. Por tanto, se debe recurrir al tratamiento quirúrgico en circunstancias parecidas a las que se especifican en la tabla 26 (tabla 33). No está de más insistir, especialmente en este grupo de edad, en que la reparación valvular es un procedimiento muy superior, en todos los órdenes, a la sustitución protésica y que debe realizarse siempre que sea posible.
Estenosis mitral
En los países occidentales, la EM, en la infancia y en los jóvenes, es de etiología congénita en la inmensa mayoría de los casos. En cambio, en las zonas geográficas menos desarrolladas es más probable que su origen sea reumático. La EM congénita se puede asociar a varias malformaciones cardíacas de las cavidades izquierdas, así como a la coartación de aorta. Sus manifestaciones clínicas, ECG y radiológicas son similares a las de la EM del adulto. La ecocardiografía es muy útil en la evaluación del aparato valvular mitral y de los músculos papilares y proporciona información acerca de las posibilidades de éxito en su reparación. La información obtenida en el examen transtorácico es habitualmente suficiente, pero en ocasiones puede necesitarse la vía transesofágica.
El tratamiento médico tiene escasa utilidad en estos pacientes, pero es importante prevenir y tratar com-plicaciones como las infecciones pulmonares, la endocarditis y la fibrilación auricular. El tratamiento quirúrgico de la EM congénita ha mejorado desde la introducción de la ecocardiografía transesofágica, que permite una visualización completa de la válvula y de su función (tabla 34). En los pacientes con válvula en «paracaídas», la fenestración de las cuerdas fusionadas puede aumentar el área efectiva y mejorar los síntomas; a veces es necesario el recambio valvular, que puede ser problemático cuando hay anillo hipoplásico que requiere una técnica quirúrgica de ampliación. La valvuloplastia de la EM congénita se ha intentado recientemente con escaso éxito 335. Ésta es una de las técnicas de cateterismo terapéutico más difíciles y peligrosas, por lo que sólo debe realizarse en centros con personal que posea reconocida experiencia.
Valvulopatía tricuspídea
La mayoría de las enfermedades de la válvula tricúspide, en la infancia y la adolescencia, son congénitas; de ellas, la anomalía de Ebstein es con mucho la más frecuente. En los jóvenes, la afectación valvular adquirida es excepcional y generalmente consecuencia de una traumatismo torácico o endocarditis infecciosa por drogadicción a la heroína. Es excepcional que el chorro de alta velocidad de una comunicación interventricular pequeña incida sobre la valva septal de la tricúspide y produzca cambios degenerativos que conduzcan a IT significativa.
En la anomalía de Ebstein puede haber distintos grados de afectación de las valvas y, por tanto, de IT. Suele acompañarse de un foramen oval permeable y, cuando la IT es importante, se eleva la presión auricular derecha por encima de la izquierda y se produce un cortocircuito derecha-izquierda, con la consiguiente hipoxemia. También son frecuentes los haces de conducción anómalos, que pueden dar lugar a taquicardias paroxísticas supraventriculares en el 25% de los casos. Aunque la enfermedad puede cursar sin síntomas, no son infrecuentes la cianosis y la disnea de esfuerzo. La disfunción ventricular derecha se acompaña de signos de insuficiencia cardíaca congestiva, con exacerbaciones provocadas por las taquiarritmias supraventriculares. Las recomendaciones de evaluación en estos pacientes quedan recogidas en la tabla 35.
La historia natural de la anomalía de Ebstein es variable. De los casos diagnosticados en el período perinatal, sobreviven el 61% a los 10 años 336. En un estudio que incluyó a pacientes diagnosticados después de dicho período, la probabilidad de supervivencia fue del 50% a los 47 años de edad 337. Los predictores de mal pronóstico fueron la clase funcional III o IV de la NYHA, un índice cardiotorácico > 65% y la fibrilación auricular. Sin embargo, los pacientes que alcanzan la adolescencia y la edad adulta suelen tener buen pronóstico.
La reparación de la malformación puede realizarse cuando la valva anterior no está pegada al septo interventricular y puede desplazarse a su situación normal, completándose el procedimiento con plicatura de la porción ventricular atrializada. Si la válvula no es reparable se procede al recambio por una prótesis biológica o mecánica. Las anomalías asociadas, como la comunicación interauricular o el haz anómalo, se corregirán también en el mismo acto quirúrgico, si bien este último puede hacerse mediante procedimiento electrofisiológico. En la tabla 36 se recogen las indicaciones de cirugía en esta malformación.
Estenosis pulmonar
Fisiopatología
La válvula pulmonar no resulta afectada por enfermedades adquiridas, por lo que la estenosis pulmonar (EP) es prácticamente siempre congénita. La fusión de sus valvas produce una morfología valvular característica, en forma de cono o cúpula dirigida hacia el tronco de la arteria pulmonar. En algunos casos, la EP está ocasionada, no por fusión de las valvas, sino porque éstas están engrosadas, displásicas, y con movilidad muy reducida 338.
La EP, incluso severa, no suele originar síntomas en los niños y adolescentes. En los adultos con EP importante pueden aparecer disnea y fatigabilidad por la imposibilidad de aumentar el gasto cardíaco con el ejercicio. Por el mismo mecanismo pueden ocurrir mareos o síncopes de esfuerzo, pero la muerte súbita es muy rara. Los neonatos con EP crítica, así como los adultos con EP grave evolucionada, sí que pueden presentar IT e insuficiencia cardíaca derecha.
Si la distensibilidad ventricular derecha, a causa de la hipertrofia reactiva, está disminuida, se eleva la presión de la aurícula derecha; en estas circunstancia, si el foramen oval es permeable se puede producir cortocircuito derecha-izquierda y embolia paradójica.
Diagnóstico
El diagnóstico clínico de EP es sencillo y la severidad puede determinarse habitualmente con precisión por ecocardiografía bidimensional y Doppler. El cateterismo cardíaco raramente es necesario (tabla 37).
Historia natural
El curso clínico de la EP en niños y adultos jóvenes es bien conocido, a partir de los estudios sobre la historia natural de los defectos cardíacos congénitos 339,340. En estos estudios, iniciados a mitad de los años sesenta, se siguieron 564 enfermos con EP que fueron clasificados en cuatro grupos: a) EP trivial (gradiente pico < 25 mmHg); b) EP ligera (gradiente entre 25 y 49 mmHg); c) EP moderada (gradiente entre 50 y 79 mmHg), y d) EP severa (gradiente >= 80 mmHg). La mayoría de los 261 pacientes tratados médicamente (46% del total) tenían una obstrucción trivial, ligera o moderada y no hubo ninguna muerte, cianosis o insuficiencia cardíaca congestiva. A lo largo de 22 años de seguimiento, sólo el 20% requirieron valvotomía por incremento del gradiente o aparición de síntomas. La mayoría de los casos con aumento del gradiente fueron seleccionados entre niños menores de 2 años o pacientes que tenían un gradiente inicial > 40 mmHg. Fuera de estas dos circunstancias, la probabilidad de que el gradiente aumentase más de 20 mmHg a lo largo de los años fue tan sólo del 4%. Por lo que respecta a los pacientes operados (la mayoría de ellos con obstrucción severa o moderada), sólo ocurrió un fallecimiento entre 245 enfermos seguidos a largo plazo. En el seguimiento, el gradiente se había reducido a valores insignificantes en más del 90% de los casos y tan sólo un 4% de los operados necesitaron una nueva intervención. En conjunto, la supervivencia a los 25 años fue del 96%, la misma que la del grupo control. Es digno de resaltar también que el 96% de los pacientes que tenían un gradiente transpulmonar < 25 mmHg permanecieron libres de cirugía al cabo de los 25 años. La endocarditis infecciosa fue un acontecimiento excepcional: sólo un caso en 18 años de seguimiento medio; esto cuestiona la necesidad de profilaxis en esta enfermedad.
Tratamiento
Hoy día, la valvuloplastia con balón 341,342 ha sustituido a la valvulotomía qurúrgica que, como hemos visto, tan excelentes resultados dio en el pasado. En la ta-bla 38 se especifican las indicaciones actuales de la valvuloplastia en la EP. Los casos con hipoplasia del anillo o displasia de la válvula 343, como el síndrome de Noonan, constituyen excepciones para el procedimiento, puesto que requieren cirugía. Los resultados a largo plazo de la valvuloplastia aún no están disponibles, pero los obtenidos a un seguimiento de 10 años 344 sugieren que serán muy similares a los de la cirugía.
En pacientes con estenosis valvular importante y de larga evolución, la hipertrofia infundibular puede causar obstrucción cuando la válvula se abre después de la dilatación, si bien ésta regresa con el tiempo sin requerir tratamiento. Se ha sugerido el tratamiento con betabloqueadores como solución transitoria a dicha complicación, pero no hay suficiente evidencia de su efectividad.
Insuficiencia pulmonar
Es una cardiopatía congénita infrecuente que puede observarse en la denominada dilatación idiopática de la arteria pulmonar; la insuficiencia pulmonar ligera también puede ser un hallazgo normal de la ecocardiografía-Doppler. Es, asimismo, el resultado casi inevitable del tratamiento de la EP, ya sea quirúrgico o con valvuloplastia. El 87% de los pacientes que fueron operados en el primer estudio sobre la historia natural de los defectos cardíacos congénitos 339 presentaban regurgitación pulmonar en el examen con eco-Doppler realizado en el segundo estudio 340. Sin embargo, la regurgitación era trivial en la gran mayoría de los casos y tan sólo un 9% de los mismos tenían signos de disfunción ventricular derecha atribuibles a la insuficiencia de la válvula pulmonar.
La insuficiencia valvular pulmonar es casi la norma después de la corrección completa de una tetralogía de Fallot. La mayoría de niños y jóvenes adultos intervenidos a finales de los años cincuenta y durante la década de los sesenta, continúan bien a los 35 años de seguimiento 345. Sin embargo, un pequeño número desarrollaron dilatación ventricular derecha con disfunción sistólica y la consiguiente insuficiencia cardíaca. Estos pacientes tienen mayor incidencia de arritmias ventriculares y muerte súbita en el seguimiento. Su tratamiento estriba en el recambio valvular por un homoinjerto, pero aún no hay suficiente experiencia para recomendar este procedimiento de forma generalizada.
ENFERMEDAD CORONARIA EN LOS PACIENTES CON VALVULOPATÍAS
La presencia de enfermedad arterial coronaria (EAC) significativa en pacientes con enfermedad valvular es un hecho relativamente frecuente. Sin embargo, las estrategias de diagnóstico y tratamiento óptimos no están bien definidas. Las sugerencias, a este respecto, se basan en la experiencia de pequeñas series de pacientes operados simultáneamente de las dos afecciones y en inferencias derivadas de los amplios estudios aleatorizados sobre el tratamiento quirúrgico de la EAC.
Desde el punto de vista clínico, el problema se puede enjuiciar de la siguiente forma. De una parte, al menos desde el punto de vista teórico, ningún paciente valvular debería acudir al quirófano sin que se hubiese explorado el árbol coronario, puesto que la eventual presencia de EAC significativa podría empañar los resultados de la intervención valvular, tanto a corto como a largo plazo. Sin embargo, actuar de esta forma iría en contra de la eficiencia, puesto que la gran mayoría de los enfermos sometidos a coronariografía tendrían unas coronarias normales; este aspecto adquiere aún más relieve en una época en la que la gran mayoría de los enfermos con valvulopatías pueden ser perfectamente caracterizados mediante un estudio no invasivo 91. Así pues, para tratar de alcanzar un equilibrio que conjugue eficiencia con seguridad para el paciente deberemos establecer unos criterios que nos guíen en términos de probabilidad.
Probabilidad de padecer enfermedad coronaria en las valvulopatías
En términos generales, la probabilidad de padecer EAC está en relación con: a) la prevalencia de la enfermedad en la población de estudio; b) la ausencia o presencia de dolor torácico y las características clínicas del mismo; c) la edad; d) el sexo, y e) la existencia o no de factores de riesgo cardiovascular 346,347.
La prevalencia de EAC en las series estudiadas en España oscila entre el 10,7 y el 20,3%, dependiendo de la edad media de los pacientes y, posiblemente, de su origen geográfico 348-354. En todo caso, es muy inferior a la referida en los EE.UU. y en los países escandinavos, donde oscila entre el 30 y el 50% 355-358. Por lo que respecta a la presencia de angina, la especificidad es mucho menor que en la población general 359,360, puesto que la valvulopatía, especialmente la EA, puede producir isquemia miocárdica por mecanismos diferentes de los de la obstrucción coronaria 361. Aun así, la presencia de angina, respecto de los enfermos que no presentan dolor torácico, triplica por término medio la probabilidad de padecer EAC significativa: el 35 frente al 14% en la serie de Muñoz San José et al 353 y el 24 frente al 7% en la de Gómez Doblas et al 354. Por lo que respecta a la edad, sigue siendo en nuestro medio un factor predictor significativo de EAC, pero a niveles mucho más elevados que los que han sido sugeridos por los autores anglosajones. En las dos últimas series españolas publicadas, el punto de corte significativo para la edad se sitúa en los 60 años para los varones y en los 65 para las mujeres 353 en una de ellas, y en los 65 años para ambos sexos en la otra 354. En cuanto a la presencia de factores de riesgo, la probabilidad es acumulativa, llegando al 45% cuando se suman 3 o más 353. Estas cifras contrastan con las recomendadas en la última guía del American College of Cardiology y la American Heart Association, que sitúan el corte de edad en los 35 años para los varones y para cualquier edad en las mujeres posmenopáusicas 3. La conclusión final de los dos estudios españoles más re-cientes es que la probabilidad de padecer EAC significativa en los pacientes sin angina ni factores de riesgo y con edad inferior a los 60 años es muy baja (> 5%) y no justifica la realización de coronariografía 353,354.
La prevalencia de EAC es menor en los enfermos afectos de IA y de EM que en los que padecen una EA 362,363. En ambos casos se debe a la menor edad de la población, pero puede haber otros factores que hagan más intensa la relación de la EAC con la EA que con otras valvulopatías. Por lo que respecta a la IM, su relación con la EAC es similar, con la salvedad importante, a recordar en todo momento, de que la última puede ser causa de la primera. Hay que citar, por último, otras dos circunstancias en las cuales se suscita la posibilidad de EAC. Una de ellas es la presencia de disfunción ventricular izquierda. Ya hemos comentado previamente cómo cualquier valvulopatía, en especial las regurgitaciones crónicas, puede generar disfunción ventricular; sin embargo, la EAC puede ser un factor coadyuvante que conviene descartar antes de la operación, sobre todo en los pacientes con el punto de corte de edad antes señalado. La segunda es la existencia de antecedentes documentados de infarto de miocardio; en este caso, sea cual fuese la edad, es preceptivo realizar una coronariografía para verificar la extensión de la EAC y la conveniencia de revascularización asociada.
Diagnóstico de enfermedad coronaria en presencia de valvulopatía
El ECG de los pacientes con valvulopatías tiene con frecuencia alteraciones del segmento ST, debidas a dilatación-hipertrofia ventricular o a bloqueos de rama, que reducen su utilidad para el diagnóstico de EAC, tanto en reposo como durante el esfuerzo. De igual forma, las anomalías de la motilidad segmentaria y de la perfusión miocárdica, tanto en reposo como provocadas por el ejercicio o los fármacos, son marcadores inespecíficos de EAC en pacientes con valvulopatías y dilatación o hipertrofia del VI 364,365. Hay, por tanto, poco lugar para la indicación de estudios de perfusión miocárdica, salvo en los pacientes con valvulopatías ligeras que no afectan a la arquitectura ventricular. Por todo ello, es evidente que la coronariografía constituye el único método diagnóstico fiable para descartar la presencia de EAC en el enfermo valvular 109. En la tabla 40 se exponen las indicaciones para la realización de esta exploración en los enfermos valvulares.
Tratamiento concomitante de la enfermedad coronaria y la valvulopatía aórtica
En España, durante 1997 se realizaron 3.466 intervenciones aisladas sobre la válvula aórtica, de la cuales el 17,5% llevaron asociada cirugía de revascularización miocárdica 1. Por lo que respecta a las mitrales, las cifras fueron de 1.947 y un 11,3%, respectivamente (tabla 41). Estas tasas de revascularización asociada a la cirugía valvular son inferiores al 33% que se cita en la bibliografía estadounidense 3 y, probablemente, lo único que reflejan es la menor prevalencia de la EAC en nuestro país.
Existe la posibilidad de que la cirugía de revascularización miocárdica, asociada a la sustitución valvular aórtica, no afecte a la mortalidad operatoria, en comparación con el reemplazo aislado 366,367. Este aserto, probablemente no se puede generalizar; en la tabla 41 se puede apreciar cómo la mortalidad de la cirugía combinada, al menos en el global de nuestro país, tiene una mortalidad significativamente más elevada que la sustitución aislada, tanto en lo que se refiere a la válvula aórtica como a la mitral. Es muy posible que los 5-6 puntos de diferencia porcentual en la mortalidad se recuperen a largo plazo mediante la mejor supervivencia que se obtiene con la revascularización completa 368-372. No hay, de todas formas, ningún estudio prospectivo y aleatorizado que proporcione una respuesta a esta pregunta: ¿es mejor, respecto a la supervivencia, proceder a la sustitución aislada de la válvula aórtica en los pacientes sin angina (menor mortalidad teórica), o se precisa revascularizar todas las lesiones coronarias encontradas en la coronariografía preoperatoria (teórica mejor supervivencia a largo plazo)? De todas formas, la tendencia universal es la de revascularizar de forma sistemática todas las lesiones coronarias posibles en el momento de la operación. Una alternativa no explorada, pero que tiene una evidente base racional, sería revascularizar mediante angioplastia- stent en el momento de la coronariografía para, posteriormente, realizar la sustitución valvular.
Como hemos comentado con anterioridad, existe la situación contraria: el paciente que necesita revascularización miocárdica y que, además, tiene una EA. En estas circunstancias, no hay duda de que la válvula debe ser sustituida, con independencia de que el paciente presente o no síntomas, cuando la obstrucción es severa (tabla 42). Cuando la EA es moderada, no hay unanimidad en la indicación de sustitución 45, aunque la tendencia es proceder a la misma, habida cuenta de la tendencia a la progresión de la obstrucción y el riesgo que entraña una segunda intervención para reemplazar la válvula aórtica. Más controvertida es aún la sustitución valvular cuando la EA es sólo ligera.
Manejo de la valvulopatía mitral asociada a enfermedad coronaria
Como se ha comentado en la sección correspondiente, la asociación de IM y EAC es muy frecuente. Cuando la IM es ligera, la sintomatología isquémica es la que dicta la necesidad de cirugía revascularizadora y la válvula no se repara ni se sustituye, a no ser que la ecocardiografía intraoperatoria indique mayor grado de IM del esperado. Cuando la IM es más severa se debe abordar la válvula mitral, teniendo en cuenta todas las consideraciones vertidas en la sección correspondiente. Cuando la etiología de la lesión valvular mitral no es isquémica, las normas de actuación son las mismas que se han referido para la valvulopatía aórtica.
PRÓTESIS VALVULARES
Tipos de prótesis
Las prótesis son dispositivos diseñados para sustituir las válvulas cardíacas nativas, manteniendo el flujo unidireccional normal del corazón. Hay dos grandes grupos de prótesis: las mecánicas, en las que el objetivo se consigue mediante la utilización de material rígido, y las biológicas, que son válvulas obtenidas de cadáveres humanos o animales, o que están confeccionadas con algún tipo de tejido animal.
Prótesis mecánicas
En este tipo, la obturación del orificio valvular se consigue mediante un dispositivo oclusor, construido con aleación de materiales muy resistentes a la fatiga. Esto garantiza su durabilidad a largo plazo, siendo excepcionales los fallos estructurales. Sin embargo, a pesar de los constantes cambios introducidos en los materiales y en el diseño, son estructuras trombogénicas, lo que obliga a mantener una anticoagulación permanente. Existen diferentes tipos de prótesis mecánicas, según la configuración del mecanismo oclusor.
Prótesis de bola. Tiene un oclusor esférico, plástico o metálico, que se desplaza dentro de una jaula metálica. El modelo más popular, la prótesis de Starr-Edwards con bola de polímero de silicona y jaula de estelita, fue la válvula artificial más utilizada durante casi dos décadas. La excelente durabilidad demostrada a la largo de 30 años ha hecho que siga siendo implantada por algunos grupos 373. Sin embargo, su alto perfil facilita las interferencias con las estructuras ventriculares vecinas y el flujo excéntrico condiciona una hemodinámica subóptima y mayor trombogenicidad.
Prótesis monodisco. El dispositivo oclusor es un disco metálico circular que se desplaza dentro de una carcasa cilíndrica, labrada de una sola pieza, de diferentes metales o aleaciones de metales (acero, titanio, carbón pirolítico, etc.). Estos discos suelen tener un núcleo de un material muy resistente, generalmente grafito, al que se impregna de algún agente radioopaco, como el tungsteno, y que se recubre con una capa de carbón pirolítico, material muy poco trombogénico. El disco es retenido dentro de la carcasa gracias a los salientes o pivotes de ésta, lo que permite su excursión entre las posiciones de máxima apertura y oclusión. El desplazamiento del disco, por rotación y desplazamiento en el sentido de la corriente, permite un flujo casi central a través de dos aperturas desiguales.
Prótesis de doble disco. El dispositivo oclusor está constituido por dos discos semicirculares de carbón pirolítico, bien puro o, generalmente, dispuesto sobre un núcleo de grafito. Estos hemidiscos, que pueden ser planos o arqueados, permanecen unidos a la carcasa mediante algún sistema articular, habitualmente excavado en ella, que sirve para retenerlos y limitar sus desplazamientos. En la mayoría de los modelos, el desplazamiento va acompañado de rotación; como consecuencia, en la posición de máxima apertura existen tres orificios para el paso de la sangre, dos mayores, dispuestos periféricamente, y uno menor o central entre ambos hemidiscos. En las prótesis con discos arqueados los tres orificios son prácticamente del mismo tamaño. Todos los modelos permiten un cierto flujo regurgitante cuando los discos se encuentran cerrados, lo que tiene la ventaja de disminuir la estasis sanguínea y permitir el lavado del sistema de articulación. Este concepto ha permitido diseñar prótesis de muy bajo perfil, con excelente hemodinámica y muy baja trombogenicidad. Por todo ello, la prótesis de doble disco se han convertido en el sustituto valvular más utilizado en nuestros días.
Prótesis biológicas
Existe una gran variedad de ellas, en función de varios aspectos: a) que se trate de verdaderas válvulas cardíacas o de dispositivos elaborados con otros tejidos biológicos, como el pericardio, a los que se dota de una configuración similar a la de las válvulas semilunares; b) que se obtengan del propio paciente (autoinjertos), de cadáveres humanos (homo o aloinjertos) o de otras especies (hetero o xenoinjertos), y c) que el tejido venga montado en un soporte, más o menos rígido, y tenga un anillo de sutura similar al de las prótesis mecánicas (prótesis soportadas), o carezca del mismo (prótesis no soportadas o stentless), de modo que al implantarlas se deba respetar la configuración anatómica. La principal ventaja de las bioprótesis es la baja trombogenicidad, lo que permite su utilización sin anticoagulación.
Autoinjertos. El único que se realiza es la transposición de la válvula pulmonar a la posición aórtica, reemplazando la primera con un homo o heteroinjerto aórtico o, preferiblemente, pulmonar. Esta intervención, descrita hace más de 30 años por Donald Ross, ha ganado considerable popularidad en la última década debido a su contrastada durabilidad y excelente hemodinámica 39,127,331-334,374. Por estas razones, constituye una alternativa muy atractiva para el tratamiento de las lesiones aórticas en enfermos menores de 40 años. No obstante, es una intervención técnicamente compleja que implica un mayor riesgo quirúrgico, por lo que debe ser realizada por equipos experimentados. Aunque permite evitar la anticoagulación durante muchos años, tiene la limitación de la durabilidad de los injertos, sobre todo el pulmonar, a muy largo plazo.
Bioprótesis de pericardio autólogo. Recientemente se ha desarrollado un tipo de bioprótesis que se manufactura en la misma intervención, montando el pericardio del propio paciente sobre un soporte parecido al de los heteroinjertos 375. De esta manera se pretende aumentar la durabilidad de la válvula, aprovechando la ventaja del tejido autólogo, sin que la técnica de implantación sea tan complicada como la de los homoinjertos. Sin embargo, la experiencia con esta prótesis es todavía limitada y los resultados a largo plazo son desconocidos.
Homoinjertos. Son válvulas humanas obtenidas de cadáveres y conservadas frescas en un medio antibiótico o criopreservadas. Aunque la experiencia con las válvulas ventrículo-arteriales, especialmente la aórtica, se remonta a principios de los años sesenta, se utilizan con poca frecuencia. Los homoinjertos aórticos proporcionan una hemodinámica inmejorable, no precisan anticoagulación y tienen una incidencia muy baja de complicaciones 376. Estas características los hacen una alternativa muy atractiva para el paciente joven. Pueden utilizarse de manera aislada o para remplazar la raíz aórtica entera, y resultan especialmente ventajosos en los pacientes con endocarditis infecciosa activa y con importante destrucción tisular en la región valvular aórtica. El principal inconveniente es su menor disponibilidad y el mayor riesgo quirúrgico por la complejidad técnica que entraña su implantación. Para paliar este inconveniente, existen en el mercado homoinjertos criopreservados. También se han utilizado homoinjertos aórticos montados en soportes similares a los de los heteroinjertos, con el fin de facilitar su implantación, e incluso homoinjertos de las válvulas atrioventriculares para la sustitución mitral o tricus-pídea.
Heteroinjertos porcinos. Son las bioprótesis más utilizadas. Se trata de válvulas aórticas porcinas montadas sobre diferentes tipos de soporte que mantienen la configuración espacial de las cúspides aórticas, al tiempo que les confieren cierta elasticidad para disminuir el estrés mecánico. Suelen incorporar un anillo de sutura que permite su implantación, tanto en posición ventrículo-arterial como atrioventricular. En los heteroinjertos de última generación, el tejido valvular es tratado con glutaraldehído a baja o nula presión para esterilizarlo y estabilizar sus componentes, así como con diferentes sustancias antimineralizantes que retardan el proceso de calcificación. El principal inconveniente de los heteroinjertos porcinos es su limitada durabilidad debido a la degeneración tisular, que ocurre sobre todo cuando se colocan en posición mitral a pacientes menores de 60-65 años; a esto hay que añadir las peores características hemodinámicas de las prótesis con tamaño pequeño. En un intento de mejorar la hemodinámica y alargar la duración disminuyendo el estrés mecánico se han introducido a lo largo de la última década los heteroinjertos porcinos sin soporte o stentless. Los datos disponible confirman la ventajosa hemodinámica de estas válvulas en posición aórtica, sin que su duración se vea comprometida 377. Aunque se han propuesto modelos similares para la sustitución de las válvulas atrioventriculares, su anatomía más compleja hace que los resultados sean menos predecibles.
Heteroinjertos de pericardio bovino. Son prótesis construidas a partir de pericardio bovino, recortado de forma que imita la disposición de las cúspides de las válvulas semilunares. Se tratan también con glutaraldehído y se montan sobre un soporte similar al de los heteroinjertos porcinos. Estas prótesis permiten una apertura más amplia de las cúspides que la de los heteroinjertos y garantizan un mejor comportamiento hemodinámico en los tamaños pequeños. Los modelos actuales, como la prótesis de pericardio de Carpentier, han corregido los defectos que se detectaron en diseños anteriores y garantizan una durabilidad comparable a la de los heteroinjertos porcinos.
Complicaciones potenciales de los pacientes con prótesis valvulares
La implantación de una válvula artificial permite mejorar la calidad y esperanza de vida de un número importante de pacientes y se puede considerar un tratamiento de rutina en la cardiopatía valvular avanzada. Sin embargo, los portadores de prótesis se hacen acreedores de una nueva enfermedad, derivada de las potenciales complicaciones protésicas. Las que aparecen en el postoperatorio inmediato se suelen asociar a la técnica quirúrgica, mientras que las que aparecen tardíamente están más en relación con la disfunción protésica, problemas con el tratamiento anticoagulante o infección. Con respecto a la mortalidad hospitalaria, los últimos datos disponibles en nuestro país indican que la sustitución valvular aórtica aislada tiene una tasa del 7%, la mitral un 8% y la doble y triple sustitución, un 10,4 y un 10,5%, respectivamente 1.
Tipos de complicaciones
Disfunción protésica intrínseca. Esta complicación, también conocida como fallo estructural primario de la prótesis, se debe al desgaste y rotura del material en las prótesis mecánicas y a la degeneración y calcificación de los velos en las prótesis biológicas.
En las primeras prótesis mecánicas de jaula y bola, la bola de silicona podía llegar a romperse (al hincharse por la infiltración lipídica) y embolizar sus fragmentos. También se pudo comprobar, en las prótesis de jaula y disco, disfunción por deterioro del disco de plástico. En el momento actual se considera una rareza el fallo estructural primario de una prótesis mecánica, con excepción de la prótesis cóncavo-convexa de Björk-Shiley, que se retiró del mercado en 1986 a causa de los frecuentes casos con fractura del soporte que provocaba la migración embólica del disco y la consiguiente regurgitación masiva.
En las válvulas biológicas, el fallo estructural primario es la causa mas frecuente de disfunción y se debe a cambios degenerativos de los velos. La esclerosis y calcificación progresivas provocan engrosamiento y pérdida de movilidad de las valvas, generando estenosis, mientras que las roturas y desgarros producen insuficiencia. El deterioro estructural está en relación con el tipo de prótesis (los homoinjertos duran más que los heteroinjertos), la edad del receptor (los niños y adolescentes presentan calcificación precoz), la posición de la prótesis (varios estudios, aunque no todos, han demostrado que la mitral dura menos que la aórtica) y circunstancias diversas (insuficiencia renal, embarazo). La degeneración empieza a hacerse significativa a partir de los 5 años y, con el transcurso del tiempo, la tasa de fallos se hace exponencial; a pesar de ello, a los 12 años podemos encontrar más del 50% de las bioprótesis porcinas libres de fallo estructural. Se estima que la reoperación por fallo de la válvula bioprotésica tiene una mortalidad del 25-30%, significativamente más alta que el recambio de una válvula nativa 378,379.
Disfunción protésica extrínseca. Se refiere a la disfunción que ocurre por causas ajenas a la propia válvula. La más común es la fuga perivalvular producida por una separación entre el anillo de la prótesis y el de la válvula sustituida. Se debe a una técnica quirúrgica deficiente o a la mala calidad del anillo receptor. Generalmente aparece en los primeros días o semanas de la operación y constituye una de las causas más frecuentes de reoperación durante el primer año. Puede ser desde ligera hasta severa y ocurre igualmente en prótesis mecánicas que biológicas. Dentro de este grupo, también hay que considerar el atrapamiento por pannus o sutura, la obstrucción extrínseca (por sutura o restos de tejido no escindido), el tamaño inapropiado de la prótesis y la anemia hemolítica clínicamente importante 378,379.
Trombosis de la prótesis. La trombosis es una complicacion poco frecuente (0-1,5% al año en las prótesis mecánicas aórticas y 0,5-4% en las mitrales) pero muy grave ya que, con frecuencia, termina en reoperación o muerte. El mecanismo suele ser la formación de un trombo que interrumpe el movimiento de la bola, del disco único o de uno de los dos discos. La trombosis se puede ver favorecida por la proliferación de tejido anular ( pannus) que, a su vez, coadyuva en el mecanismo obstructivo. El riesgo trombótico aumenta en las prótesis de bola enjaulada, en las colocadas en posición mitral, en los pacientes que llevan dos o más prótesis y en los que siguen un tratamiento anticoagulante inadecuado 378,379.
Endocarditis protésica. Cualquier infección que afecta a una prótesis valvular o a una válvula nativa reconstruida entra dentro de este concepto. La morbilidad asociada con la infección activa, como la trombosis valvular, la embolia o la dehiscencia paravalvular, se incluye en esta categoría 380. Se calcula que alrededor de un 1-4% de las prótesis se infectarán a lo largo de la vida del paciente, y que la endocarditis protésica constituye el 15-20% del total de endocarditis de un hospital terciario 381. La incidencia es del 3% en los 12 primeros meses y del 4-6% a partir de los dos años. En general, se considera que si la presentación tiene lugar en las 8 primeras semanas tras la cirugía, la causa es-tá en relación con un dispositivo contaminado durante la operación o con la infección postoperatoria de la herida, siendo el estafilococo o un germen gramnegativo los agentes responsables más frecuentes. Cuando aparece después de dos meses y, sobre todo, transcurrido el año de la intervención, el germen infectante más frecuente es el estreptococo y la presentación clínica es similar a la de la endocarditis sobre válvula nativa. Los principales factores de riesgo son haber sufrido endocarditis previas y ser portador de varias prótesis; el riesgo, por otra parte, es similar en las prótesis mecánicas y en las biológicas 378,379,381.
Insuficiencia cardíaca con prótesis normofuncionante. Aunque el reflejo clínico, ante un paciente portador de prótesis valvular en insuficiencia cardíaca, deba ser descartar una disfunción protésica, con mucha frecuencia los síntomas están causados por un mecanismo ajeno a la válvula implantada. Entre las numerosas causas que se pueden citar en este apartado, figuran las siguientes: a) progresión de una lesión valvular que, por no ser severa, se dejó sin corregir en su momento y ha evolucionado con el transcurso de los años; algo similar puede decirse del enfermo que en su día fue sometido a sustitución valvular aórtica y comisurotomía mitral y que ahora, al cabo de los años, tiene reestenosis mitral; b) persistencia de hipertensión arterial pulmonar que no ha regresado suficientemente tras la cirugía mitral y que puede ocasionar insuficiencia cardíaca derecha refractaria; este hallazgo no es excepcional pues, aunque siempre se ha considerado que la hipertensión pulmonar que acompaña a las valvulopatías mitrales es reversible, tal vez no sea del todo cierto, especialmente en pacientes añosos con largo tiempo de evolución. En todo caso, la hipertensión arterial pulmonar severa toma su tiempo en bajar y puede provocar un postoperatorio sumamente tórpido, que se alargue incluso durante semanas o meses; c) la disfunción sistólica del ventrículo izquierdo es la causa no protésica más frecuente de insuficiencia cardíaca postoperatoria; como hemos comentado en los apartados correspondientes, la IA y la IM son las valvulopatías que con más frecuencia conducen a la disfunción ventricular irreversible; como factores coadyuvantes se pueden añadir complicaciones surgidas durante la intervención, como infarto perioperatorio, deficiente protección miocárdica, etc.; d) a veces, la indicación de reparar una IT no está clara, prefiriéndose mantener una actitud conservadora en la esperanza de que la reducción del ventrículo derecho y el anillo tricuspídeo alivie la regurgitación. En el curso de los años, la disfunción protésica, la progresión de una lesión nativa, la hipertensión arterial pulmonar residual o la disfuncion ventricular pueden hacer reaparecer los signos de IT. También es relativamente frecuente observar la re-aparición tardía de IT sin ninguno de los factores antes citados; algo así como una IT primaria que, por causas desconocidas (¿disfunción anular progresiva?), reaparece al cabo de unos años de buena evolución clínica, y e) raramente, los síntomas congestivos pueden deberse al desarrollo de una pericarditis constrictiva. Los problemas pericárdicos, especialmente los derrames loculados que comprimen las cavidades derechas, sí son motivo relativamente frecuente de empeoramiento en los primeros días/semanas del postoperatorio.
Tromboembolismo sistémico. Esta categoría incluye cualquier déficit neurológico nuevo, permanente o transitorio, focal o global (excluyendo las hemorragias) o cualquier embolia arterial periférica, a menos que se demuestre que es consecuencia de otra causa, por ejemplo, infecciosa. La incidencia del tromboembolismo protésico puede llegar hasta casi un 6% pacientes-año, siendo el riesgo mayor en los enfermos con prótesis mecánicas que no siguen tratamiento anticoagulante (un 4% pacientes-año) y en los que sólo toman un agente antiplaquetario (2% pacientes-año) que en los que siguen tratamiento dicumarínico regular (1% pacientes-año). El riesgo también aumenta en pacientes mayores de 70 años y cuando hay fibrilación auricular o disfunción ventricular. La probabilidad de tromboembolismo es similar en los pacientes con válvulas mecánicas adecuadamente anticoaguladas y en las bioprótesis 378,379; obviamente, los pacientes portadores de una bioprótesis que están en fibrilación auricular también deben ser anticoagulados.
Accidente hemorrágico. Se define como cualquier episodio de hemorragia interna o externa que produce muerte, ictus, operación u hospitalización, o requiere transfusión, en pacientes que están recibiendo anticoagulantes o fármacos antiplaquetarios. La incidencia de hemorragias en las prótesis mecánicas, mitrales y aórticas oscila entre el 0,5-4% pacientes-año, aunque hay algunos estudios que elevan la tasa al 6-7%. La frecuencia de hemorragia se incrementa cuando se asocia aspirina al tratamiento dicumarínico, sobre todo si la dosis es superior a 75-100 mg 378,379.
Resultados de los principales estudios de prótesis valvulares
Numerosos estudios clínicos han informado sobre la historia natural de los diferentes tipos de prótesis, incluyendo mortalidad inicial y tardía, así como la probabilidad de presentar fallo estructural, fenómenos tromboembólicos, hemorragias y endocarditis. Estos trabajos tienen diversas limitaciones: no son aleatorizados, las poblaciones de estudio son de características distintas, la complicaciones son definidas de forma diferentes, etc. No permiten, por tanto, hacer una comparación real entre las diferentes prótesis. Se han publicado dos estudios que sirven para comparar las prótesis mecánicas con las biológicas: el ensayo de las válvulas cardíacas de Edimburgo 382 y el estudio cooperativo sobre la valvulopatía de la Administración de Veteranos 44. En el estudio escocés se comparó la prótesis de Björk-Shiley con dos porcinas (Hancock y Carpentier Edwards) en un seguimiento de 12 años, encontrándose que las prótesis mecánicas tenían una mejor supervivencia (el 72 frente al 52%), si bien estas diferencias no llegaron a ser significativas y, además, venían empañadas por la mayor tasa de hemorragias en las primeras. La supervivencia sin reoperación fue significativamente mayor en las mecánicas que en las porcinas, tanto en lo referente a la resustitución valvular mitral (el 74 frente al 42%) como la aórtica (el 75 frente al 55%). El estudio de los Veteranos, con un seguimiento de 11 años, puso de manifiesto una tasa de supervivencia similar para la prótesis de Björk-Shiley y los dos modelos de válvula porcina que se estudiaron. Las complicaciones fueron muy distintas en ambos grupos; mientras que en el primero el problema más frecuente fueron las hemorragias ligadas al tratamiento anticoagulante, en el segundo predominaron los fallos estructurales de la válvula, especialmente a partir del quinto año de evolución.
Manejo de los enfermos con prótesis valvulares
Profilaxis de endocarditis infecciosa
Aunque no está del todo claro el beneficio real, se recomienda que todos los pacientes con prótesis valvular hagan prevención de endocarditis infecciosa. En nuestro medio, Bouza et al 202 han sugerido unas pautas y, recientemente, la American Heart Association ha publicado sus guías de prevención 203.
Profilaxis de fiebre reumática
La fiebre reumática se ha convertido en una rareza. A pesar de ello y puesto que la mayoría de estos enfermos tuvieron carditis en su día, se recomienda seguir profilaxis, al menos durante 10 años después del brote inicial o hasta que el paciente cumpla los 40 años 384.
Terapia antitrombótica
Todos los pacientes con prótesis valvular, excepto los portadores de un homoinjerto, precisan de una terapéutica anticoagulante (tabla 43). La duración e intensidad del tratamiento depende fundamentalmente del tipo de prótesis implantada y de la presencia de factores de riesgo tromboembólicos, como fibrilación auricular, embolismo previo, disfunción sistólica del ventículo izquierdo, humo o trombos en la aurícula izquierda. Los dicumarínicos son los fármacos empleados de forma casi universal, aunque en circunstancias especiales (p. ej., durante el primer trimestre de la gestación) también se utiliza la heparina. Los antiagregantes han sido utilizados como coadyuvantes, especialmente la aspirina a bajas dosis y el dipiridamol. El INR debe mantenerse en niveles estables, ya que las oscilaciones en el nivel de anticoagulación pueden ser más trombogénicas que la ausencia de tratamiento 385.
Prótesis mecánicas. Unos valores de INR entre 2 y 3,5 son adecuados para la mayoría de las prótesis modernas. Índices superiores a 3,5 se recomiendan para determinados modelos, dos o más prótesis, o cuando existen factores de riesgo de tromboembolismo asociados. Cuando el INR > 4, los pacientes de edad superior a los 70 años presentan un riesgo hemorrágico elevado. La adición de dosis bajas de aspirina (80-100 mg) disminuye el riesgo tromboembólico, pero aumenta claramente el de hemorragia.
Prótesis biológicas. La anticoagulación durante los primeros tres meses es la norma, ya que en este período la incidencia de tromboembolismo es elevada. Pasado este tiempo, se recomienda seguir sólo con anti-agregantes o sin tratamiento antitrombótico alguno. En las bioprótesis aórticas se ha empleado con buenos resultados la antiagregación aislada con aspirina o ticlopidina. En caso de fibrilación auricular o prótesis mitral con factores de riesgo (aurícula izquierda dilatada, disfunción sistólica severa, embolismo previo) se recomienda la anticoagulación.
Accidentes embólicos durante una terapia antitrombótica adecuada. En este supuesto, se aconsejan las siguientes medidas: a) incrementar la dosis de anticoagulante hasta alcanzar un INR de 2,5-3,5 (si el previo era de 2-3) o de 3,5-4,5 (si el previo era de 2,5-3,5); b) añadir aspirina a dosis de 80-100 mg o incrementar la dosis de aspirina, si es que ya la tomaba el paciente, lo que conlleva un riesgo serio de hemorragia, o añadir ticlopidina al régimen de anticoagulación, y c) si el paciente tomaba solamente aspirina, se aconseja iniciar terapia con el dicumarínico hasta conseguir un INR de 2 a 3.
Terapia antitrombótica en pacientes que precisan un cateterismo cardíaco. Los anticoagulantes orales deben suspenderse 72 h antes, con el fin de que el INR sea < 1,5 cuando se realice el procedimiento. Tras el mismo, se comenzará de nuevo con la medicación, que debe ser acompañada de heparina, en caso de que el paciente presente factores de riesgo, hasta pasados 3-4 días, en que se habrá alcanzado el efecto terapéutico del dicumarínico.
Diagnóstico de las disfunciones protésicas
Obstrucción protésica. La presentación es muy variable, oscilando desde sutiles hallazgos clinicoecocardiográficos hasta un cuadro de edema pulmonar y shock. La presencia de un soplo holosistólico mitral u holodiastólico aórtico sugieren la presencia de disfunción valvular. Cuando se sospecha una trombosis de la válvula, es obligatorio realizar un ecocardiograma, preferentemente transesofágico 386, para evidenciar el movimiento disminuido del disco (la fluoroscopia puede ser incluso más útil), el aumento del gradiente, la regurgitación valvular y el tamaño y localización del material trombótico. En las prótesis biológicas es más común que la obstrucción sea debida a degeneración de los velos; el diagnóstico, en este caso, se realiza por estudios seriados con Doppler, que demuestran un incremento progresivo del gradiente y la disminución paralela del orificio valvular efectivo.
Regurgitación protésica. La presentación clínica puede ser aguda, por desgarro de un velo en una prótesis biológica 387, o por dehiscencia de la sutura; en ambos casos, la infección puede ser el sustrato que origine la regurgitación. Mucho menos frecuente es que la causa sea una trombosis que, como hemos comentado con anterioridad, suele producir obstrucción. Cuando el curso clínico es más crónico, la regurgitación suele ser consecuencia de una fuga perivalvular más pequeña, que aumenta con el tiempo, o de la retracción progresiva de los velos de una bioprótesis. En todos los casos, el estudio con eco-Doppler es definitivo, pues permite objetivar la regurgitación, evaluar el mecanismo y establecer de forma semicuantitativa su severidad 388. En las prótesis mitrales suele ser indispensable la aproximación transesofágica.
Infección protésica. El diagnóstico de endocarditis infecciosa en los portadores de prótesis se basa en los mismos principios que cuando la infección afecta a una válvula nativa. Desde un punto de vista práctico, estamos obligados a descartar la infección valvular siempre que exista fiebre sin una causa definida. La realización de hemocultivos y la práctica de un eco-Doppler son esenciales para confirmar el diagnóstico. En esta afección, la realización del eco transtorácico se debe completar, en la mayoría de los casos, con un eco transesofágico. Esta exploración es mucho más sensible y específica, ya que permite explorar áreas ciegas para el eco convencional, detectar vegetaciones de menor tamaño y objetivar complicaciones, como abscesos y fístulas, con mayor facilidad 389,390. Es importante insistir en que puede ser necesario realizar el estudio ecocardiográfico en más de una ocasión, debido al carácter evolutivo de la endocarditis.
Calendario de visitas periódicas
Primera visita postoperatoria
Se recomienda realizarla entre la cuarta y la sexta semanas de la intervención y debe comprender una revisión clínica completa, incluyendo anamnesis y exploración física dirigidas, ECG, radiografía de tórax y analítica (hemograma, creatinina, electrólitos e INR si fuera necesario). Tras la intervención es imprescindible disponer de un estudio eco-Doppler que permita evaluar el resultado de la cirugía, disponer de los datos basales de la prótesis implantada, evaluar el tamaño y la función del ventrículo izquierdo, objetivar la reducción de la hipertensión pulmonar, si existía previamente, y documentar la ausencia de derrame pericárdico. En muchos centros se realiza el ecocardiograma antes del alta hospitalaria, por lo que no es necesario repetirlo en esta primera visita, salvo que exista disfunción sistólica previa, cuya evolución conviene vigilar de cerca.
Seguimiento en enfermos sin complicaciones
La frecuencia de las revisiones depende de la existencia de lesiones valvulares residuales, el estado de la función ventricular y el grado de hipertensión pulmonar (tabla 44). En la situación óptima de ausencia de lesiones residuales, función ventricular normal y normotensión o ligera hipertensión pulmonar, una evaluación anual parece razonable. En este contexto, no es necesario realizar estudios ecocardiográficos rutinarios a los portadores de prótesis mecánicas, salvo que presenten síntomas o hallazgos exploratorios nuevos en el examen físico. En los pacientes con bioprótesis se recomienda un estudio ecocardiográfico anual, a partir del quinto año en las mitrales y del octavo en las aórticas, aunque no existan síntomas ni signos físicos de disfunción protésica; esta recomendación se debe a que, a partir de las fechas señaladas, se acelera el proceso de degeneración valvular. En caso de apreciarse regurgitación, se debe acortar la cadencia de exploraciones; por ejemplo, cada 3-6 meses, dependiendo de la severidad de la regurgitación.
Seguimiento de enfermos con complicaciones
La persistencia o aparición de síntomas en un paciente intervenido requiere un detallado estudio que permita determinar con exactitud la causa de los mismos. Además de una evaluación clínica completa que incluya un eco-Doppler, puede ser necesario realizar un eco transesofágico para detectar una fuga perivalvular significativa, o una resonancia para apreciar un pericardio engrosado, o incluso un cateterismo para documentar un patrón de constricción pericárdica.
Tratamiento de las complicaciones protésicas
Trombosis protésica
Si el cuadro clínico es poco importante, el tratamiento se inicia con heparina, que suele ser eficaz si el trombo es menor de 5 mm y no produce obstrucción. Cuando la trombosis protésica produce síntomas severos, el paciente debe ser intervenido de urgencia. La trombólisis puede ser una alternativa, pero es ineficaz en el 16-18% de los casos y se acompaña de complicaciones graves, como ictus, embolismo sistémico, sangrado importante y recidiva del cuadro trombótico en un 3-20% de los casos 391. Debería limitarse, por tanto, a los pacientes en los que la cirugía no se puede realizar o es de muy alto riesgo. También puede ser una alternativa cuando los síntomas no sean tan graves ni la situación hemodinámica tan crítica.
Endocarditis infecciosa
El tratamiento exige la identificación del germen causal y una pauta antibiótica adecuada, tanto en dosis como en duración, que no debe ser inferior a 6 semanas. Si el paciente se encuentra estable, se puede demorar la instauración del tratamiento hasta que se identifique el germen responsable 392; por el contrario, si el cuadro es agudo se comienza de inmediato con un régimen que cubra Staphylococcus aureus, generalmente mediante la asociación de vancomicina y un aminoglucósido. En caso de hemocultivo negativo se recurre a añadir rifampicina al régimen anterior. Dado el bajo índice de curación que se obtiene con antibioterapia exclusiva, hay una tendencia creciente a considerar más adecuado un enfoque médico-quirúrgico, con el que se obtienen más curaciones 381. Esta norma terapéutica es especialmente aplicable a los casos con endocarditis temprana. Existe riesgo de recidiva infecciosa tras la operación, que puede llegar hasta el 15% de los casos intervenidos, pero esto no debe ser obs-táculo para una indicación quirúrgica bien fundada (tabla 45). Problema aparte son las infecciones protésicas de los enfermos adictos a drogas parenterales, cuyo riesgo de recidiva es muy elevado.
Recambio protésico
Generalmente se requiere por disfunción valvular, intrínseca o extrínseca, por dehiscencia de sutura o por infección. Pero también puede ser necesario por tromboembolismo recurrente, hemólisis intravascular severa, hemorragias de repetición importantes debidas al tratamiento anticoagulante, trombosis no obstructiva o, simplemente, desproporción entre el tamaño de la prótesis y la superficie corporal del paciente. Si el enfermo se encuentra en situación clínica estable y sin infección protésica, la operación tiene un riesgo similar al de la sustitución primitiva. Si el paciente está grave debido a disfunción protésica hay una clara indicación quirúrgica, aunque a expensas de un riego elevado. Cuando la situación clínica no es tan apremiante, la decisión se debe basar en el conocimiento de la historia natural de las prótesis, además de otros factores como la repercusión sobre la función ventricular, otras lesiones valvulares nativas, hemólisis acompañante, etc.
Criterios para la selección del tipo de prótesis
El sustituto valvular idóneo debería tener un rendimiento hemodinámico óptimo, no ser afectado por daño estructural (como sucede con las prótesis biológicas), no producir tromboembolismo (como sucede con las mecánicas) y, en consecuencia, no necesitar tratamiento anticoagulante, que induce hemorragias y empeora la calidad de vida de los pacientes.
Como se ha indicado previamente, los estudios clínicos no permiten establecer si existe un tipo de prótesis mejor que otro; son, pues, las características del paciente las que nos inclinarán a utilizar el sustituto más adecuado 393. Como recomendación general es siempre mejor la reparación valvular que la implantación de una prótesis 207-209, lo que se va consiguiendo a nivel mitral en un número creciente de enfermos, merced a un mayor adiestramiento de los cirujanos en las técnicas de reparación.
La mayor ventaja de las prótesis mecánicas es su durabilidad, debido a la práctica ausencia de fallo estructural primario; su peor inconveniente es la necesidad de seguir tratamiento anticoagulante de por vida. En consecuencia, siempre que haya circunstancias asociadas que aconsejen el tratamiento dicumarínico (fibrilación auricular crónica, disfunción ventricular severa, válvula mecánica previa), la balanza se inclinará claramente del lado de la prótesis mecánica.
Las bioprótesis estarán indicadas cuando no se pueda o no se quieran tomar anticoagulantes (gestación, deportes de riesgo, actividad física importante), en pacientes muy jóvenes (menores de 20 años) o en los enfermos con escasa esperanza de vida. También, y siempre que no existan factores de riesgo tromboembólico, en pacientes mayores de 65 años que precisen un recambio aórtico, dado que en este grupo de edad la tasa de fallo estructural primario en las bioprótesis porcinas es menor del 10% a los 10 años. Si lo que se va a implantar es una prótesis mitral, el umbral se suele elevar a los 70 años 394. De todas formas, la indicación de bioprótesis porcina en los enfermos mayores es un arma de doble filo, puesto que con frecuencia el paciente sobrevive más tiempo del esperado, introduciéndose en el período del fallo estructural primario; en consecuencia, nos podemos ver abocados a una nueva intervención en un paciente que ahora sí tiene una avanzada edad para la cirugía 163.
En definitiva, para una elección acertada del tipo de prótesis a utilizar deberemos tener en cuenta los siguientes aspectos: a) la edad del paciente y las expectativas de vida relacionadas con potenciales enfermedades concomitantes; b) la presencia de procesos patológicos que, en sí mismos, supongan una indicación para la anticoagulación permanente; c) la presencia de circunstancias que supongan una contraindicación para la anticoagulación o que impidan el cumplimiento adecuado del tratamiento; d) la posibilidad de embarazo en las mujeres en edad fértil; e) la presencia de circunstancias que puedan conducir a un deterioro acelerado de las bioprótesis, como la edad juvenil, la insuficiencia renal o la posición de implantación, y f) la causa que motivó la disfunción tardía de una prótesis implantada previamente (p. ej., trombosis de una prótesis mecánica o degeneración tisular de una bioprótesis).
En todo caso, el paciente debe recibir una información detallada, aplicada a sus circunstancias particulares, sobre las ventajas e inconvenientes de cada uno de los tipos de prótesis; después de esta información aclaratoria deben tenerse en cuenta sus preferencias a la hora de la elección del sustituto valvular. En las tablas 46 y 47 se recogen las recomendaciones recientemente publicadas por el grupo de trabajo para el manejo de los pacientes con valvulopatías del American College of Cardiology y la American Heart Association 3.
Fig. 3. Algoritmo de actuación en la estenosis mitral asintomática, basado en la determinación del área valvular mitral (AVM), la posibilidad de realizar valvuloplastia mitral percutánea con balón (VMPB), la presencia de hipertensión pulmonar significativa y la respuesta hemodinámica al ejercicio. AI: aurícula izquierda; IM: insuficiencia mitral; PAP: presión arterial pulmonar; PCP: presión capilar pulmonar.
Fig. 4. Algoritmo de actuación en la estenosis mitral poco sintomática, basado en criterios similares a los del supuesto anterior. Leyendas como en la figura 3.
Fig. 5. Algoritmo de actuación en la estenosis mitral muy sintomática, basado en criterios similares a los de los supuestos anteriores a los que se añaden el riesgo quirúrgico; si éste es elevado, se debe intentar la valvuloplastia con balón aunque la anatomía valvular no sea del todo favorable. VM: válvula mitral; resto de leyendas como en la figura 3.
En el último cuarto de siglo, la cardiología ha cambiado más que en toda la historia precedente. Estos cambios han afectado también, y de forma espectacular, a las enfermedades de las válvulas cardíacas; no sólo en lo que respecta al espectro etiológico, sino también en cuanto al manejo diagnóstico y terapéutico de los pacientes. Revisemos, siquiera brevemente, cómo ha evolucionado este panorama.
Cambios en la incidencia y el espectro etiológico
La fiebre reumática, al compás de la erradicación de la pobreza y el tratamiento antibiótico de las infecciones estreptocócicas, ha desaparecido prácticamente en todos los países desarrollados. Hoy día asistimos a los últimos coletazos de una enfermedad contraída 30 o 40 años antes. De hecho, en nuestro medio comienza a ser excepcional el descubrimiento de nuevos pacientes con secuelas valvulares reumáticas por debajo de los 40 años.
El otro cambio fundamental tiene que ver con la prolongación de la vida, que ha puesto en primer plano de la escena clínica una afección diferente: la estenosis aórtica valvular degenerativa del anciano. Al mismo tiempo, otras etiologías, como las degeneraciones mixoides, las secuelas de la endocarditis infecciosa, o las debidas a la enfermedad isquémica, han ido adquiriendo progresivamente un papel clínico relevante; entre otras razones por el mejor conocimiento que hemos ido adquiriendo de estas afecciones valvulares.
Aun con estos cambios en la incidencia, los enfermos con afecciones valvulares siguen ocupando buena parte de nuestro quehacer diario. En el último registro de la Sociedad Española de Cirugía Cardiovascular 1 se refiere que en 1997 fueron operados 6.024 enfermos, lo que supuso el 36% de todas la intervenciones con circulación extracorpórea realizadas en nuestro país. En realidad, puesto que no todos los centros están adscritos a este registro voluntario, la cifra estimada mediante estudios de mercado es algo superior (7.074 pacientes) 2. De este global, el 77% fueron operados de una sola válvula y el resto de dos o más. Entre los enfermos monovalvulares, predominó con mucho la enfermedad aórtica (62%) sobre la mitral (38%).
Los cambios en el manejo diagnóstico
Hace 30 años, el diagnóstico de las lesiones valvulares se asentaba sobre la anamnesis y la auscultación cardíaca, completadas por el ECG y la radiografía de tórax. El cateterismo cardíaco, considerado entonces como la piedra angular del diagnóstico, solía confirmar las observaciones de los clínicos avezados. Fue una época en que las correlaciones auscultación-cateterismo-cirugía enriquecieron una semiología que, en su mayor parte, procedía de las observaciones clínicopatológicas de los grandes maestros de finales del xix y principios del siglo que termina. Las habilidades diagnósticas de los clínicos reposaban, pues, sobre una auscultación cuidadosa que, en consecuencia, era parte muy importante de la formación cardiológica. El culmen de esta semiología se alcanzó con los registros gráficos de la auscultación (fonocardiografía) y de los movimientos de las arterias, venas o ápex cardíaco (mecanocardiografía). La fonomecanocardiografía, introducida en nuestro país primero por Pedro Zarco, y luego por los discípulos del mexicano Bernardo Fishleder, fue una herramienta de enseñanza formidable.
Todo este panorama cambió radicalmente con la irrupción de la ecocardiografía en los años setenta. Primero fue el modo M, más tarde la eco bidimensional, luego vino el Doppler, que pronto se acompañó de la codificación en color y, finalmente, el acceso trans-esofágico, que permite observar de forma privilegiada las estructuras cardíacas. Pasamos, así, de «oír» las válvulas cardíacas, a «verlas». Y no sólo a verlas, sino también a apreciar las alteraciones hemodinámicas que inducen y la repercusión sobre una estructura fundamental como es el ventrículo izquierdo. La posibilidad de realizar ecocardiogramas seriados ha permitido que se conozca mucho mejor la historia natural de algunas valvulopatías y, en consecuencia, definir con mayor precisión el momento idóneo para la intervención quirúrgica.
¿El enorme poder diagnóstico de la ecocardiografía quiere decir que debemos prescindir de nuestros métodos de evaluación tradicionales? Nuestra opinión es que en modo alguno. La historia clínica, en primer lugar, conserva toda su vigencia, pues sigue siendo una herramienta privilegiada para evaluar la repercusión funcional del vicio valvular y, sobre todo, la forma en que el enfermo siente y padece la enfermedad. También en este campo, el viejo aforismo de «no hay enfermedades sino enfermos», sigue siendo una realidad. Por lo que respecta a la auscultación, baste decir que su mantenimiento no es incompatible con el desarrollo; más aún, cualquier tipo de innovación tecnológica será mejor aprovechado si se asienta sobre las bases de la tradición. «Auscultar bien» debe seguir siendo una característica diferencial del cardiólogo, sea cual fuere el ámbito en el que desarrolla su actividad profesional.
La aparición de procedimientos terapéuticos no quirúrgicos
En el caso de la estenosis mitral, la valvuloplastia percutánea con catéter-balón es una modalidad terapéutica que ofrece resultados similares, si no mejores, que los de la comisurotomía quirúrgica. Que un paciente pueda salir del hospital en tan sólo 24-48 h, con un alivio fundamental de su estenosis, sin haber pasado por quirófano y sin habérsele abierto el tórax parece algo de brujería, si no fuese porque ahí están los resultados inmejorables del procedimiento. En otros casos, como en la estenosis valvular aórtica del anciano, las expectativas de los procedimientos intervencionistas, desgraciadamente, no han sido confirmadas. Estos avances «médicos» han propiciado, sin duda, un florecimiento de procedimientos quirúrgicos menos traumáticos cuyo potencial está aún por desarrollar.
El desarrollo de nuevos sustitutos valvulares y las técnicas de reparación
Alguno de nosotros aún recuerda con pavor los embolismos múltiples que, a pesar del tratamiento anticoagulante, sufrían los pacientes portadores de prótesis valvulares. Por fortuna, sin haberse resuelto del todo el problema, sí se ha minimizado enormemente con las nuevas prótesis mecánicas y un mejor control de la anticoagulación. Por lo que respecta a las prótesis biológicas, tal vez lo más llamativo haya sido el resurgimiento de la operación de Donald Ross, que ha superado con rigor el paso del tiempo. Avance incuestionable han sido las técnicas correctoras de la regurgitación mitral, que permiten una cirugía muy superior, en términos de morbimortalidad, a la de la sustitución valvular.
La gestación de esta guía
Poco antes de comenzar la redacción de esta guía sobre las enfermedades valvulares, aparecieron las elaboradas conjuntamente por el American College of Cardiology y la American Heart Association 3. Ha sido imposible sustraerse a la poderosa influencia de este manuscrito, cuya lectura es altamente recomendable para cualquier interesado en el problema de las enfermedades valvulares. No obstante lo dicho, hemos procurado recoger las numerosas aportaciones originales de la cardiología española; posiblemente sea éste el campo de la cardiología en el que más y mejores aportaciones de autores españoles se han sucedido a lo largo del tiempo. Baste citar, como botón de muestra, que una innovación quirúrgica española, publicada en nuestra Revista 4, se ha convertido en referencia clásica de la bibliografía valvular de ámbito mundial.
ESTENOSIS AÓRTICA
Etioanatomía
La estenosis valvular aórtica (EA) aislada, es decir, sin valvulopatía mitral acompañante, es más prevalente en los varones y tanto la etiología congénita como la degenerativa son más frecuentes que la afectación reumática 5.
Congénita
La válvula puede ser unicúspide, bicúspide y tricúspide. La primera puede originar obstrucción severa en la infancia y dar lugar a una evolución fatal dentro del primer año de vida. La bicúspide es la más frecuente; predomina en el varón y suele dar manifestaciones a los 40-50 años de edad. Esta malformación produce un flujo turbulento que lesiona las valvas, generando fibrosis y calcificación. En ocasiones puede ser asiento de una endocarditis que produzca, esencialmente, regurgitación. La tercera forma de malformación congénita es la producida por una válvula tricúspide cuyas sigmoideas, de distinto tamaño, presentan fusión comisural y tendencia a la fibrosis-calcificación.
Adquirida
Se puede subdividir en dos tipos: reumática y degenerativa. La primera se caracteriza por la fusión comisural, con fibrosis y calcificación tardías; además, se producen retracción y rigidez de los bordes de las cúspides con aparición de nódulos calcificados en ambas superficies. La consecuencia suele ser un orificio reducido y, a la vez, incontinente 6. Se suele acompañar de afectación de otras válvulas, especialmente la mitral.
La degenerativa es la causa más frecuente de EA en el adulto 7 y su incidencia va en aumento por el envejecimiento de la población, ya que parece originarse por los años de estrés normal sobre la válvula. La estenosis, sin fusión de comisuras, se produce por depósitos de calcio en las líneas de flexión de la base de las valvas; frecuentemente se acompaña de calcificación del anillo mitral y a veces de las arterias coronarias. La diabetes mellitus y la hipercolesterolemia son factores de riesgo para el desarrollo de esta lesión.
Existen otras causas más raras de EA, como la aterosclerótica, que afecta también a la aorta y a las arterias coronarias. Se puede observar en pacientes con hipercolesterolemia severa que, cuando es homocigótica, suele ocasionar síntomas en la infancia. También la enfermedad de Paget y la insuficiencia renal terminal están asociadas con el desarrollo de EA.
Graduación de la estenosis
La graduación en la severidad de la EA proviene de los cálculos del área valvular por cateterismo cardíaco, interpretados a la luz de los datos de historia natural obtenidos en el seguimiento de los pacientes 8 (tabla 1). El área se puede expresar en valores absolutos o, mejor, en forma de índice, al ser corregida por la superficie corporal. El empleo del índice es especialmente importante cuando se trata de pacientes con tallas y/o peso desproporcionados en uno u otro sentido.
El cálculo del orificio valvular aórtico por la fórmula de Gorlin y Gorlin exige la determinación del flujo valvular aórtico (gasto cardíaco/período de eyección) y del gradiente sistólico medio transvalvular. En la práctica hay una tendencia abusiva a prescindir del gasto cardíaco y evaluar la severidad de la EA atendiendo únicamente al gradiente transvalvular, considerándose que la EA es importante cuando el gradiente medio es >= 50 mmHg o el gradiente pico >= 60 mmHg. Este proceder puede inducir a importantes errores debido a la variabilidad del gasto cardíaco. Los valores de corte señalados son bastante específicos de EA severa (valor predictivo positivo del 90%); sin embargo, valores inferiores no descartan la severidad. Por ello, se aconseja medir el área valvular en todos los enfermos que tengan gradientes inferiores a los citados cuando se sospeche clínicamente que la EA puede ser importante 9. La fórmula de Gorlin y Gorlin tiene limitaciones que deben ser conocidas; tal vez la más importante sea la imposibilidad de realizar un cálculo adecuado cuando, en presencia de un flujo transvalvular bajo, el gradiente es pequeño. Hay que recordar que el área valvular estenótica está relacionada de forma inversa no con el gradiente medio, sino con la raíz cuadrada del mismo. Esto quiere decir que, en presencia del citado flujo transvalvular bajo, pequeños errores en la medida de las presiones pueden magnificar de forma extraordinaria los errores en el cálculo del área valvular 10.
Por lo que respecta a la evaluación de la severidad mediante Doppler, debemos recordar que ninguna de las técnicas al uso mide directamente las presiones intravasculares. La fórmula que se utiliza para el cálculo del gradiente aórtico es una simplificación de la ecuación de Bernouilli en la que se eliminan numerosos factores. Aun así, la correlación con el gradiente hemodinámico es bastante buena, con un intervalo de confianza del 95% de ± 20 mmHg. Al gradiente calculado mediante Doppler hay que aplicarle las mismas consideraciones que al hemodinámico; por tanto, en la mayoría de los casos con gradiente «dudoso» habría que calcular el área por la ecuación de continuidad. En la práctica, el esquema propuesto por Otto y Pearlman 11 constituye un acercamiento diagnóstico razonable (fig. 1); se trata, en síntesis, de considerar: a) que los enfermos con una velocidad del chorro estenótico >= 4 m/s tienen una EA importante; b) que, por el contrario, los que tienen una velocidad <= 3 m/s tienen una EA poco importante, y c) que los que tienen una velocidad de 3-4 m/s deben ser individualizados mediante el cálculo del área valvular y la estimación de la regurgitación acompañante.
Fig. 1. Aproximación al diagnóstico de severidad de la estenosis aórtica sintomática mediante el empleo de la velocidad máxima (Vmáx) en el tracto de salida ventricular izquierdo. Si la velocidad es intermedia, conviene calcular el área valvular aórtica (AVA) por la ecuación de continuidad; si ésta se encuentra en un rango intermedio de severidad, conviene evaluar la severidad de la insuficiencia aórtica (IA) acompañante para tomar la decisión operatoria.
Estos parámetros hemodinámicos son muy importantes en la valoración de la gravedad de la EA; sin embargo, las manifestaciones clínicas de los pacientes son trascendentales a la hora de tomar decisiones terapéuticas. Hay que recordar, en este sentido, que algunos enfermos con EA severa se mantienen asintomáticos, mientras que otros con estenosis moderadas pueden tener síntomas que aconsejen la cirugía.
Fisiopatología
La obstrucción progresiva del ventrículo izquierdo produce un aumento del estrés parietal, señal para que se induzca un incremento en la replicación de sarcómeros, base de la hipertrofia concéntrica. Este mecanismo compensador es favorable en principio, puesto que reduce o normaliza el estrés parietal; de esta forma, la obstrucción es superada por el ventrículo izquierdo sin que éste se dilate, se reduzca el gasto cardíaco o se produzcan síntomas. Sin embargo, no siempre el grado de hipertrofia es adecuado para contrarrestar el estrés parietal; en estas circunstancias de hipertrofia inadecuada, el aumento del estrés parietal produce una poscarga muy elevada que termina deprimiendo la fracción de eyección. Así pues, la fracción de eyección en la EA puede estar reducida sin que ello signifique un déficit contráctil, sino simplemente una poscarga excesiva 12.
La elevación de la presión telediastólica que suele acompañar a la EA importante no significa necesariamente dilatación ni insuficiencia, sino que refleja la reducción de la distensibilidad de un ventrículo hipertrófico 13. Este fenómeno se acompaña de una vigorosa contracción de la aurícula, que da lugar a una onda a prominente en el registro de presión de aurícula izquierda y que no es sino una demostración de la importancia que tiene la contracción auricular para completar un buen llenado ventricular. Por eso, cuando se pierde la contribución atrial, como sucede en la fibrilación auricular, puede producirse un rápido deterioro en la situación clínica del paciente.
En fases avanzadas de la enfermedad empieza a disminuir el gasto cardíaco y, como consecuencia, el gradiente transvalvular, en tanto que aumentan las presiones de la aurícula izquierda, del capilar, de la arteria pulmonar y de las cavidades derechas. En esta etapa tardía de la evolución también puede aumentar el volumen diastólico ventricular, pero nunca de una forma tan marcada como sucede en la insuficiencia o en la doble lesión aórtica; siempre, aun en estos estadios avanzados, se conserva la característica de la sobrecarga de presión: incremento notable de la relación masa-volumen.
La hipertrofia ventricular, el aumento de la presión sistólica intraventricular y la prolongación de la eyección que acompañan a la EA grave aumentan el consumo de oxígeno miocárdico. Por ello, el flujo coronario, aunque en términos absolutos esté elevado, puede ser deficiente. Además, con frecuencia la perfusión miocárdica está interferida por la compresión de las arterias coronarias, a consecuencia de la elevada presión y la relativa reducción de la densidad de capilares miocárdicos. Se sabe también que la hipertrofia miocárdica, aun en ausencia de enfermedad coronaria, produce una limitación de la reserva vasodilatadora 14. Por otra parte, la elevación de la presión de llenado reduce el gradiente diastólico entre la aorta y el ventrículo; es decir, el gradiente de perfusión coronaria. Todo ello explica la aparición de angina con el esfuerzo en pacientes con EA grave y que los infartos puedan ser más extensos y con una mortalidad más elevada 15. En pacientes de edad avanzada, sobre todo en mujeres, se ha observado una excesiva hipertrofia parietal, superior a la requerida para contrarrestar la elevación de las presiones intracavitarias; como consecuencia, el estrés de pared es bajo, la fracción de eyección alta y el ventrículo puede parecerse al descrito en la miocardiopatía hipertrófica hipertensiva 16. Esta EA, con hipertrofia inapropiada y aumento de la contractilidad, se acompaña de un aumento de la aceleración del flujo intracavitario que se ha descrito como un marcador de mal pronóstico quirúrgico 17. Puede incluso ser la base para que se desarrolle un síndrome de bajo gasto postoperatorio por obstrucción dinámica subvalvular que, obviamente, no requiere de inotrópicos para su solución, sino de betabloqueadores 18,19.
Historia natural
La EA tiene un largo período de latencia en el que la morbimortalidad es muy baja. Los estudios seriados con cateterismo cardíaco y, más recientemente, con eco-Doppler han demostrado que, en algunos pacientes, el área valvular se reduce 0,1-0,3 cm 2 por año, mientras que el gradiente transvalvular aumenta unos 10-15 mmHg 20-23. Sin embargo, más de la mitad de los enfermos no demuestran cambios, o éstos son muy ligeros. La progresión de la EA degenerativa es más rápida que la congénita o la reumática 20, pero en realidad no puede predecirse la evolución en un determinado paciente. Por tanto, se requiere un seguimiento cuidadoso de todos los enfermos que en la evaluación inicial tienen un EA moderada.
Después de este largo período de latencia, la irrupción de síntomas marca un punto de inflexión en la historia natural. La aparición de angina de pecho, síncope o insuficiencia cardíaca cambia el pronóstico, pues la supervivencia no alcanza más de 2 o 3 años a partir de entonces 24,25. Por otra parte, en pacientes asintomáticos que tienen velocidades de flujo transvalvular aórtico >= 4 m/s, aparecen síntomas en un 38% de los mismos a los dos años de seguimiento 23.
Aunque es conocido que los enfermos con EA pueden presentar muerte súbita, ésta es muy rara en ausencia de síntomas y su incidencia se cifra en < 1% anual. Tres estudios prospectivos recientes han confirmado la rareza de la muerte súbita en pacientes asintomáticos. En el primero, con 51 pacientes asintomáticos seguidos durante 17 meses, sólo fallecieron 2 enfermos y en ambos casos habían aparecido síntomas previamente 26. En el segundo no se registró ningún episodio de muerte repentina, sin síntomas precedentes, en un grupo de 113 pacientes seguidos durante 20 meses 27. En el último, con 123 pacientes seguidos durante una media de 30 meses, tampoco se registraron muertes súbitas 23.
Manejo clínico de los pacientes
Evaluación inicial
El diagnóstico se realiza mediante el examen físico, junto con el apoyo del ECG y el ecocardiograma. Sin embargo, ninguno de estos métodos permite cuantificar la severidad de la estrechez. Hay que recordar, por otra parte, que la auscultación de un soplo sistólico eyectivo puede apreciarse con una válvula normal, con una engrosada pero poco estenótica, o con la que está francamente estrecha. En consecuencia, cada una de estas tres posibilidades debe identificarse de manera correcta. La EA importante tiene generalmente un soplo sistólico expulsivo rudo, acompañado de frémito, un pulso carotídeo retrasado y débil, un impulso apical sostenido y una reducción del componente aórtico del segundo ruido. Esta semiología puede tener numerosas excepciones; por ejemplo, en el anciano, el pulso tardus y parvus puede faltar debido a los cambios que sufre la pared arterial con la edad, o, más importante aún, el soplo eyectivo suele ser mínimo, incluso faltar, en la EA grave que se acompaña de bajo gasto cardíaco.
En los pacientes con signos de EA en la exploración física se debe realizar un ECG, una radiografía simple de tórax y un ecocardiograma. Esta última exploración es particularmente útil porque confirma la presencia de EA, define la morfología valvular, caracteriza la función del ventrículo izquierdo en respuesta a la sobrecarga de presión y descarta la existencia de otras valvulopatías (tabla 2). En la mayoría de los enfermos la gravedad de la lesión puede determinarse por Doppler, con la medida del gradiente transvalvular y el área valvular por la ecuación de continuidad. Se debe tener presente la posibilidad de infraestimar el gradiente si el haz de ultrasonidos tiene un ángulo > 30° en relación con la dirección del chorro de estenosis. En ocasiones se puede supraestimar si existe un anillo aórtico muy pequeño o un gasto cardíaco elevado. En pacientes con ecocardiogramas de calidad subóptima se ha utilizado la resonancia magnética nuclear para la valoración anatómica y funcional del ventrículo izquierdo y la severidad de la EA 28,29.
La utilidad de la prueba de esfuerzo convencional se ha cuestionado seriamente por el peligro que puede entrañar y la escasa exactitud que tiene para predecir enfermedad coronaria. En realidad, su realización está contraindicada en los paciente sintomáticos. Si se realiza en los asintomáticos, por supuesto bajo una supervisión experta y una monitorización estricta, pueden identificarse pacientes con capacidad de ejercicio limitada o incluso provocarse síntomas que no eran patentes en la anamnesis 30,31.
Seguimiento de los enfermos
El seguimiento depende de la severidad de la estenosis y de la presencia de otras enfermedades asociadas. Aunque no se ha definido una frecuencia determinada, en general se realiza una visita anual en aquellos con EA ligera y más frecuente si es moderada o severa. Se debe aconsejar a los pacientes que comuniquen a su médico la aparición de síntomas con el esfuerzo, como disnea, dolor torácico, mareos o síncopes. Como han demostrado varios estudios, la mayoría de los pacientes asintomáticos con EA severa desarrollan síntomas y, por tanto, requieren corrección quirúrgica en pocos años. Así, en un estudio de 113 pacientes con velocidades de flujo transvalvular aórtico >= 4 m/s, la incidencia de disnea, angina o síncope fue del 14% en el primer año y del 38% a los 2 años 27. En otra serie de 123 pacientes asintomáticos, la incidencia de síntomas fue del 38% a los 3 años de seguimiento y ascendía al 78% si la velocidad del flujo aórtico por Doppler era >= 4 m/s 23. De esto puede deducirse que los pacientes con EA severa requieren un seguimiento cercano para vigilar el desarrollo de síntomas.
Pruebas seriadas
Como hemos visto con anterioridad, la EA puede progresar a lo largo del tiempo. Esto ha ocasionado una tendencia a repetir anualmente el ecocardiograma en los enfermos afectados de EA. Sin embargo, el conocimiento actual sobre la historia natural y las indicaciones de cirugía no justifican la repetición compulsiva de esta exploración. En general, se considera apropiada la repetición anual en pacientes con EA severa, cada 2 años si es moderada y cada cinco si es ligera. También se justifica la repetición siempre que se produzcan cambios clínicos; por esta razón, una anamnesis detallada y el examen físico correspondiente son parte obligada de las evaluaciones periódicas.
Tratamiento médico
En realidad no existe un tratamiento médico específico para los pacientes con esta valvulopatía que están asintomáticos, y los que han desarrollado síntomas deben ser intervenidos quirúrgicamente. Como en las demás valvulopatías de origen reumático se requiere profilaxis de endocarditis infecciosa y prevención de brotes de fiebre reumática. Todos los fármacos vasoactivos destinados a tratar enfermedades concomitantes deben emplearse con cautela por la posibilidad de inducir cuadros sincopales con su uso.
Actividad física y ejercicio
Las recomendaciones en cuanto a la actividad física se basan en la severidad de la estenosis 32. No es necesario restringir la actividad física a los pacientes asintomáticos con EA ligera y pueden participar en deportes competitivos que requieran un alto grado de ejercicio muscular, tanto isotónico como isométrico. En cambio, si la EA es moderada no deben participar en este tipo de deportes, pero pueden realizar otro tipo de ejercicio con una evaluación previa mediante prueba de esfuerzo. A aquellos que padecen una EA importante se les debe limitar la actividad física a bajos niveles de ejercicio.
Indicaciones de cateterismo cardíaco
En líneas generales se plantea realizar un cateterismo cardíaco en dos circunstancias distintas, pero que pueden ser confluentes: a) clarificación del diagnós-tico de la lesión valvular, y b) identificación de una posible enfermedad coronaria (tabla 3). La primera circunstancia ocurre cuando la exploración por eco-Doppler es de calidad subóptima, existen discrepancias entre los datos clínicos y ecocardiográficos, o se sospecha malformación congénita asociada. La segunda eventualidad, es decir, la necesidad de coronariografía preoperatoria, será discutida en otro apartado.
Como hemos mencionado con anterioridad, el gradiente de presión a través de una válvula estenótica está relacionado con el orificio y el flujo valvular. Por esta razón, en situaciones de bajo gasto cardíaco puede obtenerse un gradiente bajo a pesar de que la estenosis sea grave; y a la inversa, un estado hiperdinámico cualquiera puede generar un gradiente elevado aunque la válvula sea poco estenótica. Por tanto, una valoración completa de la EA precisa: a) la medida del flujo transvalvular; b) la determinación del gradiente de presión transvalvular, y c) el cálculo del área efectiva de la válvula.
Los pacientes con EA grave, en situación de bajo gasto cardíaco por depresión severa de la fracción de eyección a consecuencia de una poscarga excesiva, tienen gradientes de presión reducidos (< 30 mmHg) y son difíciles de distinguir de aquellos con EA ligera o moderada cuya disfunción ventricular, de otro origen, no mejoraría tras la cirugía. En ambas situaciones, el bajo flujo y el reducido gradiente contribuyen a un cálculo poco exacto del área valvular 11 y se debe ser cauto a la hora de interpretar los resultados. Al menos en teoría, el cálculo del área por la ecuación de continuidad mediante Doppler es menos susceptible al bajo gasto, si bien no se ha confirmado en todas las situaciones clínicas. Se ha propuesto también el cálculo de la resistencia valvular, un índice que parece ser menos sensible que el área valvular a las variaciones de flujo 33.
En estos casos con gradiente ligero, fracción de eyección muy deprimida y bajo gasto se ha propuesto el estudio de los cambios direccionales tras la infusión de dobutamina para discernir la severidad de la EA 34,35. Con el aumento del gasto cardíaco que induce el estímulo inotrópico se incrementaría el área y disminuiría la resistencia valvular en los pacientes con EA no grave. Por el contrario, los enfermos con EA grave verían aumentar el gradiente, lo que facilitaría un cálculo más exacto del área valvular que estaría, al igual que el índice de resistencia valvular, en el rango de la severidad después de la infusión de dobutamina. En los enfermos en los que no se producen cambios claros, la duda sobre la severidad de la EA permanece y es necesario recurrir a datos indirectos (área valvular por eco transesofágico, grado de calcificación, etc.) para tomar una decisión apropiada que siempre tiene un alto grado de incertidumbre en estas circunstancias.
Indicaciones de recambio valvular aórtico
El único tratamiento efectivo de la EA grave del adulto es el recambio valvular aórtico 36. Los pacientes jóvenes pueden beneficiarse de la valvulotomía con catéter-balón (véase la sección correspondiente). Aunque no existe un acuerdo unánime sobre el momento óptimo de la intervención quirúrgica, se pueden elaborar unas pautas racionales de indicación para la mayoría de los casos con EA (tabla 4).
Pacientes sintomáticos
Los pacientes con disnea, angina o síncope manifiestan un alivio sintomático y tienen una mayor supervivencia tras la intervención 37-39. Por tanto, si no coexisten otras enfermedades graves, el recambio valvular aórtico está indicado en todos los pacientes sintomáticos. Los resultados pueden verse empañados por una disfunción ventricular preexistente. Debemos recordar, sin embargo, que en muchos pacientes la reducción de la fracción de eyección está ocasionada por una poscarga muy elevada y mejora claramente tras la supresión del obstáculo aórtico 40. Por el contrario, si la disfunción no está relacionada con una poscarga excesiva, la sustitución valvular no mejorará la función ventricular, pudiendo persistir los síntomas después de la intervención 41. Aun así, la supervivencia es mejor con la operación, salvo en los pacientes con disfunción ventricular grave mediada total o parcialmente por cardiopatía isquémica asociada 41. Como hemos comentado con anterioridad, la mayor dificultad en la indicación se plantea en los pacientes con gradiente bajo y disfunción ventricular grave, en los que se debe aclarar, hasta donde sea posible, la auténtica severidad del obstáculo valvular.
Pacientes asintomáticos
El manejo de los pacientes asintomáticos con EA severa es aún controvertido. El riesgo combinado de la cirugía y las complicaciones potenciales de una prótesis supera claramente los posibles efectos beneficiosos sobre la prevención de muerte súbita. Aun dejando al margen la morbimortalidad operatoria, hay que considerar una incidencia significativa de complicaciones (2-3% al año), incluyendo una mortalidad anual del 1% atribuible directamente a la prótesis 42-44. Por estas razones, la tendencia es evitar la operación mientras el paciente permanezca asintomático; ahora bien, esto exige que el enfermo permanezca en un programa de seguimiento regular especializado y que sea debidamente instruido en el reconocimiento precoz de síntomas que alerten sobre la necesidad de proceder a la intervención sin mayor dilación. A pesar de estas consideraciones, algunos autores propugnan la indicación quirúrgica en enfermos asintomáticos con alguna de estas características: respuesta anómala con el esfuerzo (hipotensión), disfunción ventricular, hipertrofia parietal muy marcada, taquicardia ventricular o estenosis muy severa (área < 0,6 cm 2). Cierto es, sin embargo, que difícilmente encontraremos a pacientes que, con alguno de estos rasgos, estén en realidad asintomáticos.
Pacientes que van a ser intervenidos de otra enfermedad cardíaca
A los pacientes que van a ser intervenidos de cirugía coronaria y tienen una EA severa, con o sin síntomas, se les debe sustituir la válvula aórtica en el mismo acto quirúrgico. Lo mismo sucede en aquellos que son intervenidos por una afección de la válvula mitral o de la raíz aórtica. Cuando la EA es tan sólo moderada (gradiente >= 30 mmHg) es también práctica común sustituir la válvula, si bien no hay suficiente evidencia que avale este proceder 45. Mayor controversia existe aún cuando la EA es sólo ligera.
Valvuloplastia aórtica con balón
La valvuloplastia percutánea con balón tiene un indudable lugar en el tratamiento de adolescentes y adultos jóvenes con EA, pero más limitado en la EA del adulto o del anciano. En estos últimos se consigue la reducción inmediata del gradiente transvalvular 46, pero el área posprocedimiento no suele sobrepasar 1 cm 2 . Además, puede haber complicaciones graves en más del 10% de casos 47,48 y aparece reestenosis a los 6-12 meses, con el consiguiente deterioro hemodinámico, en la mayoría de los enfermos 49-51. Por tanto, en la EA del adulto, la valvulotomía con balón no constituye una alternativa a la sustitución valvular 52,53. Su papel reside exclusivamente en el manejo provisional de pacientes muy sintomáticos que no pueden ser sometidos a recambio valvular. Por ejemplo, el procedimiento puede ser beneficioso, como puente a la cirugía, en enfermos con EA severa que se encuentran en insuficiencia cardíaca refractaria al tratamiento o en shock cardiogénico; la valvuloplastia, en estos casos, puede mejorar transitoriamente la grave situación clínica, permitiendo afrontar con mayores garantías de éxito la posterior sustitución valvular reglada.
No están bien establecidas otras indicaciones de valvuloplastia aórtica (tabla 5), como pueda ser el tratamiento paliativo en pacientes con enfermedades graves concomitantes que desaconsejan la sustitución valvular, o la de los pacientes con EA grave que requieren cirugía no cardíaca urgente 54.
Tratamiento médico en pacientes inoperables
La coexistencia de enfermedades potencialmente letales, o incluso las preferencias del propio paciente. pueden hacer inviable el tratamiento quirúrgico. En estas circunstancias, el tratamiento médico disponible para controlar los síntomas es limitado. Los pacientes con signos de franca insuficiencia cardíaca pueden mejorar con el tratamiento convencional. De todas formas, la reducción del volumen sanguíneo y, por ende, de la precarga ventricular ha de ser cautelosa, puesto que una reducción excesiva puede ocasionar un descenso marcado del gasto cardíaco y la presión arterial. Si la estenosis es grave, la utilización de un inhibidor de la enzima conversiva de la angiotensina (IECA) puede ser mal tolerada, ya que la reducción de las resistencias sistémicas no se acompaña del esperado aumento del volumen por latido. La digital se debe reservar para los enfermos con disminución de la función sistólica y para los que presentan fibrilación auricular. Ésta y otras arritmias supraventriculares hacen desaparecer la función de bomba auricular e incrementan la frecuencia ventricular, con la consiguiente disminución del período de llenado ventricular. Esta situación puede comportar un deterioro hemodinámico grave, que debe ser combatido con la restitución inmediata del ritmo sinusal mediante choque eléctrico. Si la cardioversión no es efectiva, no cabe más solución que el control de la frecuencia ventricular con digoxina o amiodarona.
Los betabloqueadores, al igual que otros fármacos con actividad inotrópica negativa, no deben utilizarse en pacientes con EA que se encuentran en insuficiencia cardíaca; sin embargo, si el síntoma predominante es la angina pueden ensayarse con cautela junto a los nitratos. No hay tratamiento médico específico para el síncope que no sea producido por una bradi o taqui-arritmia.
El problema especial de los pacientes ancianos
Debe considerarse el reemplazo valvular en todos los pacientes, aun en los de edad más avanzada, que tengan síntomas a causa de una EA. Esto es así porque las posibilidades de mejoría con el tratamiento médico y la valvuloplastia con balón son muy escasas; además, como hemos comentado previamente, el pronóstico vital es muy adverso una vez que aparecen los síntomas. Tal vez el objetivo de mejorar la supervivencia pueda perder relieve en los pacientes muy ancianos, pero debemos recordar que, hoy día, la esperanza de vida en nuestro país, a partir de los 65 años, se cifra en casi 16 años para el varón y 20 para la mujer 55. La cirugía es técnicamente posible a cualquier edad, pero la decisión de proceder a su aplicación depende de varios factores, entre los que cabe considerar la decisión del propio paciente y sus expectativas. Además de los efectos añadidos de la enfermedad coronaria y la mayor incidencia de accidente cerebrovascular perioperatorio, hay también otras circunstancias que son específicas de los pacientes de edad avanzada. Entre ellas, un tracto de salida ventricular estrecho y un anillo aórtico pequeño, especialmente presente en mujeres ancianas, pueden implicar sobremanera el acto quirúrgico, la calcificación profusa de la válvula, el anillo o la raíz aórtica, pueden precisar un desbridamiento amplio, el reemplazo de toda la raíz aórtica, o la utilización obligada de bypass femorofemoral.
Estas circunstancias, a las que se pueden añadir muchas otras, especialmente la comorbilidad asociada, hacen que la cirugía de sustitución valvular aórtica tenga una mayor morbimortalidad en el paciente anciano. No obstante, se pueden conseguir excelentes resultados en cuanto a supervivencia y calidad de vida 56-60 y la decisión de operar a un determinado paciente reposará sobre un análisis que tenga en cuenta la posibilidad de mejorar los síntomas y la supervivencia, por un lado, y la morbimortalidad operatoria por otro.
Seguimiento de los pacientes operados
El reemplazo valvular aórtico es en realidad un tratamiento paliativo en el que una válvula protésica, con todas sus posibles complicaciones, sustituye a la válvula nativa enferma 42. Como consecuencia, los pacientes portadores de prótesis valvulares requieren un seguimiento periódico. Dicho control, que se realizará anualmente en los pacientes sin complicaciones detectables, debe incluir la historia clínica y el examen físico. Las indicaciones de ecocardiografía se especifican en el apartado correspondiente a las prótesis valvulares.
INSUFICIENCIA AÓRTICA
Etiología
Las causas más comunes de insuficiencia aórtica (IA) son la dilatación idiopática de la aorta o ectasia anuloaórtica, la válvula bicúspide, la degeneración-calcificación de los velos, la enfermedad reumática, la endocarditis, la hipertensión sistémica, la degeneración mixomatosa, la disección de la aorta ascendente y el síndrome de Marfan.
Entre las menos comunes podemos citar las lesiones traumáticas, la espondilitis anquilopoyética, la artritis reumatoide, la osteogénesis imperfecta, la aortitis de células gigantes, los síndromes de Ehlers-Danlos, Hurler y Reiter, la estenosis subaórtica fija por lesión de chorro, la comunicación interventricular con prolapso de la válvula aórtica (síndrome de Laubry-Pezzi) o la lesión producida por fármacos anorexígenos 61-66. La lúes, que antiguamente era causa común de IA, se ha convertido en una rareza.
La mayoría de las lesiones citadas producen IA crónica con un curso clínico lento e insidioso. Sin embargo, lesiones producidas por la endocarditis infecciosa, la disección aórtica o los traumatismos torácicos producen IA aguda y severa, con un cuadro clínico rápidamente evolutivo, a veces catastrófico si no se reconoce y trata a su debido tiempo 3.
Insuficiencia aórtica aguda
Fisiopatología
En esta entidad, el volumen de sangre regurgitante debe ser manejado por un ventrículo izquierdo que no ha tenido tiempo de acostumbrarse a la nueva situación. Carece de los mecanismos adaptativos -dilatación ventricular y aumento de la distensibilidad- que ocurren en la IA crónica, los cuales permiten albergar al ventrículo un gran volumen de llenado sin que se eleve de forma sustancial la presión. Aquí, sin embargo, a poco que la regurgitación sea severa se produce una rápida elevación de la presión de llenado, que llega incluso a igualar la presión diastólica aórtica. La presión de este ventrículo -poco dilatado y con la distensibilidad habitual- se transmite a la aurícula izquierda y las venas pulmonares produciendo congestión pulmonar severa. La válvula mitral puede llegar a cerrarse precozmente, en plena diástole, tratando de impedir una mayor elevación de la presión en el capilar pulmonar. En contrapartida, el período de llenado se acorta y el ventrículo izquierdo, aunque sea hipercontráctil y haya taquicardia compensadora por la estimulación betaadrenérgica, se ve incapaz de generar todo el volumen por latido que sería necesario para mantener un gasto cardíaco adecuado, habida cuenta de la obligada regurgitación. Se cierra así un funesto círculo vicioso del que sólo se puede salir mediante la sustitución urgente de la válvula aórtica 3.
Diagnóstico
En el examen físico no se recogen los signos habituales de la IA, precisamente por las características fisiopatológicas descritas. El pulso arterial suele ser pequeño y rápido, la presión no tiene el clásico aumento diferencial y no es infrecuente la situación de shock. En los casos graves, la igualación de presiones entre la aorta y el ventrículo izquierdo hace que el soplo diastólico sea de baja frecuencia, corto y difícil de oír. El ECG suele poner de manifiesto taquicardia sinusal pero no signos de hipertrofia ventricular izquierda; en la radiografía de tórax pueden apreciarse signos de hipertensión venocapilar y edema pulmonar, pero la silueta cardíaca no está agrandada.
El ecocardiograma es la exploración por excelencia, ya que permite realizar una valoración anatómica y funcional completa. El cierre precoz de la válvula mitral y una disminución del tiempo de desacelaración del flujo mitral (< 150 m/s) son signos de regurgitación severa. El ecocardiograma transesofágico es especialmente útil cuando se sospecha una afección aórtica (disección aórtica, traumatismo torácico) o endocarditis 67-70. Habitualmente no es preciso realizar cateterismo antes de la intervención quirúrgica, exploración que, además, no está exenta de riesgo en estos enfermos tan inestables. Creemos que tampoco la coronariografía, a diferencia de lo expresado en otras guías 3, es necesaria salvo en circunstancias especiales. En el caso de sospecha de disección aórtica, otras técnicas de imagen, como la RM o la TAC pueden ser de utilidad 71.
Tratamiento
Los casos graves con hipotensión arterial y edema pulmonar pueden ser tratados con inotrópicos i.v., tipo dopamina o dobutamina, mientras se prepara la intervención quirúrgica para sustituir la válvula aórtica y/o reparar la aorta ascendente en el caso de disección. La intervención no debe demorarse y es la única solución, puesto que con el tratamiento médico, aunque sea intensivo, se corre el peligro de muerte por edema pulmonar, arritmia ventricular, disociación electromecánica o shock cardiogénico 3.
Los casos secundarios a endocarditis, con regurgitación moderada, deben tratarse médicamente en un hospital que disponga de cirugía cardíaca, debiendo conocer el equipo quirúrgico la existencia del paciente con el fin de estar preparado para una posible intervención emergente en caso de agravamiento. Ahora bien, si se detectan abscesos anulares o hay una resistencia probada a la terapia antibiótica, debe procederse a la cirugía 69 sin esperar a que la regurgitación se agrave.
Insuficiencia aórtica crónica
Fisiopatología
La IA crónica produce una sobrecarga combinada, de volumen y presión, sobre el ventrículo izquierdo 72,73. El incremento de volumen es consecuencia obligada del exceso de sangre que llega en diástole, al sumarse el flujo anterógrado de la aurícula y el retrógrado de la regurgitación. Se produce, pues, un aumento de la precarga que favorece la contractilidad (ley de Starling). Pero, simultáneamente, debido al gran volumen de sangre que se mueve durante la sístole y a la elevada presión que se alcanza, hay también elevación de la presión parietal (ley de Laplace) y, consiguientemente, una poscarga excesiva que puede deteriorar el rendimiento del ventrículo. La supresión de la poscarga explica que la fracción de eyección deprimida pueda mejorar después de la cirugía.
El aumento de la cavidad ventricular en la IA crónica se consigue mediante la realineación de las fibras miocárdicas que adicionan nuevos sarcómeros. Este tipo de hipertrofia, conocida como excéntrica, permite que los sarcómeros conserven sus propiedades funcionales, tanto en lo que se refiere al estiramiento (precarga) como a la capacidad contráctil. Durante mucho tiempo, el ventrículo posee lo que se conoce como reserva de precarga; esta propiedad permite, por una parte, acomodar incrementos progresivos del volumen de llenado sin que se eleve la presión diastólica final; por otra, que la fracción de eyección sea normal mientras el aumento de la poscarga no sea desmesurado. Gracias a este tipo de adaptación los pacientes con regurgitaciones voluminosas pueden estar asintomáticos durante largos períodos de tiempo 74,75.
El desarrollo de hipertrofia concéntrica trata de disminuir la presión parietal (ley de Laplace) y, por tanto, que la poscarga no se incremente; este mecanismo de adaptación, sin embargo, tiene sus límites y la poscarga, bien por incremento del volumen regurgitante o por otros factores añadidos de origen vascular, termi-na por aumentar, alterándose el equilibrio y disminuyendo el rendimiento ventricular, aunque la contractilidad miocárdica intrínseca esté preservada. Por otra parte, la hipertrofia concéntrica ocasiona una serie de fenómenos perjudiciales para la adaptación del ventrículo a la sobrecarga volumétrica: aumento de la rigidez ventricular, disminución de la distensibilidad y empeoramiento de la reserva coronaria 75-77. La consecuencia final de este proceso, que aún no es bien conocido en profundidad, puede ser el desarrollo insidioso de disfunción sistólica ventricular izquierda que finalmente se convierta en irreversible.
Historia natural
La mayoría de los estudios de seguimiento han identificado variables pronósticas derivadas de la sintomatología, el grado de dilatación ventricular y la función sistólica. En consecuencia, procede un análisis que tenga en cuenta estas grandes variables.
Enfermos asintomáticos con función ventricular izquierda normal. No hay muchos datos sobre la historia natural de los pacientes asintomáticos. En una recopilación de siete estudios 3, no del todo homogéneos, que incluye a 490 pacientes asintomáticos o paucisintomáticos seguidos durante un período medio de 6,4 años, la tasa de progresión hasta la aparición de síntomas o disfunción ventricular izquierda fue del 4,3% anual y la muerte súbita inferior al 0,2% anual. La aparición de disfunción ventricular izquierda sin síntomas fue del 1,3% al año; a pesar de esta baja probabilidad, hay que resaltar que más de la cuarta parte de los pacien-tes que murieron o empeoraron su función sistólica lo hicieron antes de la aparición de síntomas relevantes. Por esto es necesario monitorizar periódicamente la función ventricular izquierda y, a veces, vernos abocados a la toma de decisiones terapéuticas importantes antes de la aparición de síntomas 3. El estudio de Tornos et al 78, realizado en 101 pacientes asintomáticos con IA severa y fracción de eyección normal, seguidos durante una media de 4,6 años, es especialmente clarificador al respecto. En esta serie no hubo ninguna muerte, pero 14 enfermos necesitaron cirugía; en 8 casos porque desarrollaron síntomas, pero en los seis restantes debido a que se produjo disfunción ventricular asintomática. Además, en los pacientes que necesitaron cirugía se observó una dilatación progresiva del ventrículo izquierdo.
Las variables asociadas con el desarrollo de muerte, síntomas o disfunción ventricular son la edad, los parámetros que definen la dilatación ventricular, tanto diastólica como sistólica, y la progresión y velocidad con que se reduce la fracción de eyección 78,79. Esta última, tomada de forma aislada, no es un predictor independiente ya que, además de con la contractilidad, está relacionada con la carga ventricular y las resistencias periféricas. Bonow et al 79, en un estudio multivariado de seguimiento durante 8 años, encontraron que la edad, el valor absoluto de la dimensión telesistólica, su tasa de crecimiento y la disminución progresiva de la fracción de eyección fueron los principales determinantes de una evolución adversa. En dicho estudio, los pacientes con un diámetro telesistólico de más de 50 mm al comienzo del seguimiento tuvieron una probabilidad anual de muerte, síntomas y/o disfunción del ventrículo izquierdo del 19%; la probabilidad fue del 6% anual en los que tenían diámetros comprendidos entre 40 y 50 mm, y nula en los que el diámetro era inferior de 40 mm. El grupo de la Clínica Mayo, en un estudio reciente 80 subraya que la historia natural de los pacientes con IA severa (grado ecocardiográfico III o IV) tratados en la práctica clínica debe ser considerada con recelo ya que, en su experiencia, es peor que la de muchas de las series publicadas en la última década. Más de la mitad de los 246 pacientes estudiados estaban totalmente asintomáticos al comienzo del seguimiento; a pesar de ello, la mortalidad global a los 10 años de evolución y siguiendo tratamiento conservador fue significativamente mayor (34%) de la esperada (25%) en relación con la edad y el sexo. Además, hubo una alta morbilidad en lo que se refiere al desarrollo de insuficiencia cardíaca (el 47% a los 10 años) y necesidad de cirugía (el 62% a los 10 años). Los autores concluyen que los pacientes de alto riesgo identificados por este estudio tienen al menos una de las siguientes características: a) síntomas severos, aunque sean transitorios y abolidos por el tratamiento; b) síntomas ligeros (clase II); c) fracción de eyección < 55% o diámetro telesistólico >= 25 mm/m 2 aunque estén asintomáticos, y d) fibrilación auricular. En estos enfermos debe considerarse con prontitud la intervención quirúrgica. Por el contrario, los enfermos estrictamente asintomáticos, con fracción de eyección >= 55% y una dimensión telesistólica < 25 mm/m 2 forman el único subgrupo de bajo riesgo, con una mortalidad similar a la esperada. Aun así, estos enfermos pueden presentar algún episodio adverso como muerte súbita o disección aórtica, pero de momento no tenemos ningún predictor de estos accidentes.
Enfermos asintomáticos con depresión de la función ventricular izquierda. Los pocos estudios realizados ponen de manifiesto que la mayoría de los pacientes con disfunción ventricular tienen una tasa media de aparición de síntomas del 25% anual 81 y, por tanto, la mayoría de ellos necesitan ser operados por síntomas en los 2 o 3 años siguientes.
Enfermos sintomáticos. Los pacientes con síntomas tienen mal pronóstico con tratamiento conservador. Datos obtenidos en la época prequirúrgica demuestran una mortalidad superior al 10% anual en los enfermos con angina y de más del 20% en aquellos con insuficiencia cardíaca. Este mal pronóstico afecta incluso a los que tienen una función ventricular preservada 82.
Evaluación inicial
Examen físico. La auscultación de un soplo protodiastólico en el segundo y tercer espacios intercostales izquierdos, de alta frecuencia y con irradiación a lo largo del borde esternal, es diagnóstico de IA. El soplo, aun en casos con regurgitación importante, puede pasar desapercibido si no se busca intencionadamente; maniobras como la incorporación del enfermo hacia delante, a la vez que con la membrana se presiona la piel y se le pide al paciente que se mantenga en espiración forzada, pueden ser necesarias para su audición. Si el soplo se oye de preferencia a la derecha del esternón, hay que sospechar que la IA es causada por dilatación de la aorta 83. La presencia de un tercer ruido no implica disfunción ventricular, ya que puede deberse únicamente a la sobrecarga de volumen. El examen físico puede aportar datos sobre la severidad de la regurgitación; así, un latido apexiano desplazado, o una presión diferencial del pulso muy aumentada, suelen ser signos específicos de IA severa. El soplo de Austin-Flint es también característico de las regurgitaciones severas 84.
La ecografía-Doppler. El ECG nos permite valorar los signos de hipertrofia del ventrículo izquierdo y detectar las alteraciones del ritmo y/o la conducción; la radiografía de tórax, por su parte, aporta información sobre el tamaño de la silueta cardíaca, el grado de dilatación de la aorta y la repercusión pulmonar del fallo ventricular izquierdo si lo hubiese. En todo caso, la realización de un examen ecocardiográfico (tabla 6) es imprescindible para confirmar el diagnóstico, estudiar la causa de la IA y valorar la morfología de la válvula, el tamaño de la raíz aórtica y las características anatomofuncionales del ventrículo izquierdo 85-88.
El ecocardiograma permite realizar una valoración semicuantitativa del grado de IA, bien midiendo directamente el área y la anchura del chorro de regurgitación mediante Doppler color o, indirectamente, observando la pendiente de la velocidad del flujo diastólico, la intensidad de inversión de flujo en la aorta abdominal y la magnitud de la velocidad en el tracto de salida del ventrículo izquierdo 89. Es importante determinar las dimensiones y el espesor parietal del ventrículo izquierdo, así como el tamaño de la raíz de la aorta. La fracción de regurgitación se obtiene comparando el volumen por latido en la válvula aórtica con el de otra válvula cardíaca competente, pero se debe tener especial cuidado con la utilización de estos parámetros para la toma de decisiones clínicas, puesto que pueden ser motivo de grandes errores 90. El estrés de la pared puede ser calculado a partir de la presión arterial y los diámetros ecocardiográficos del ventrículo; se trata, sin embargo, de un parámetro difícil de reproducir, por lo que apenas se utiliza en la práctica.
Hay dos criterios, la severidad de la IA y los síntomas, sobre los que se basan muchas de las decisiones; en consecuencia, merece la pena que nos detengamos, aunque sea someramente, en su apreciación. Si el ecocardiograma es de buena calidad, el método semicuantitativo suele bastar para definir la severidad de la IA; conviene, no obstante, que el criterio de IA seve-ra vaya acompañado de un ventrículo izquierdo dilatado 91. Por otra parte, catalogar de asintomática una IA requiere la valoración funcional mediante una prueba de esfuerzo (tabla 7) si el paciente tiene hábitos sedentarios o los síntomas no son claros. La fracción de eyección, incluso en pacientes asintomáticos, puede disminuir durante el ejercicio; sin embargo, no se ha probado que este comportamiento tenga un valor in-dependiente de otros datos clínicos o ecocardiográficos 92-98.
Necesidad de otras pruebas si el ecocardiograma es de calidad insuficiente. En este supuesto, los pacientes deben ser estudiados por otros métodos no invasivos, como los radioisotópicos (tabla 8), que permiten la determinación de los volúmenes y la fracción de eyección del ventrículo izquierdo 94,98,99. Otra alternativa es realizar directamente un cateterismo cardíaco y una aortografía (tabla 9) con lo que, además de perfilar la función ventricular izquierda, podemos valorar semicuantitativamente la IA.
Tratamiento médico
La insuficiencia aórtica ligera o moderada, con buena función ventricular, no necesita tratamiento farmacológico. En la IA severa, tanto aguda como crónica, se han utilizado los vasodilatores arteriales (tabla 10).
El objetivo, en la IA crónica, es mejorar la historia natural de la enfermedad. El vasodilatador reduce el volumen regurgitante y aumenta el volumen por latido efectivo; esto se traduce en una disminución del volumen telediastólico, el estrés parietal y la poscarga, con el resultado final de una reducción en la masa del ventrículo y el mantenimiento de una buena función sistólica 100. En un estudio con seguimiento a 6 años se observó que los pacientes tratados con nifedipino tuvieron una tasa menor de reemplazo valvular y sobrevivieron todos los que fueron intervenidos, recuperando antes una mejor función ventricular 101,102. No está claro que los IECA tengan el mismo efecto, ya que estos pacientes, asintomáticos y con función ventricular conservada, suelen tener una tasa normal de renina plasmática y la actividad periférica de la ECA no parece estar aumentada 103,104.
El objetivo terapéutico es reducir la presión arterial sistólica, por lo que la dosis debe incrementarse hasta que se consiga el efecto deseado o se produzcan efectos adversos. Raramente, debido al elevado volumen por latido, se consigue una normalización de la presión arterial. En los casos con presión arterial normal no está indicado el tratamiento con vasodilatadores. En cualquier caso, una vez que aparecen los síntomas no debe demorarse la intervención quirúrgica; sólo aquellos pacientes que por una u otra razón no son candidatos a la cirugía deben mantener de forma indefinida el tratamiento farmacológico. Cuando se produce fracaso ventricular izquierdo por disfunción sistólica, el paciente se beneficia de las medidas terapéuticas habituales de la insuficiencia cardíaca. En este caso, deben evitarse vasodilatadores con efecto inotrópico negativo, como el nifedipino
En la IA aguda pueden utilizarse vasodilatadores de vida media corta para mejorar la situación clínica antes de la cirugía. El isoproterenol, por ejemplo, reduce las resistencias vasculares periféricas, con lo que disminuye el volumen regurgitante y aumenta el gasto cardíaco 105.
Actividad física
Los pacientes asintomáticos y con función ventricular normal pueden participar en cualquier forma de actividad física diaria, aunque debe evitarse el ejercicio físico isométrico 32. Antes de autorizar la participación en ejercicios atléticos conviene realizar una prueba de esfuerzo para comprobar la buena tolerancia al ejercicio. Son desconocidos los efectos a largo plazo del ejercicio extenuante en los pacientes asintomáticos.
Seguimiento periódico
El objetivo del seguimiento es detectar el comienzo de los síntomas y la aparición de disfunción ventricular izquierda. En ausencia de síntomas debe asegurarse la estabilidad de la IA crónica, especialmente si ésta es moderada o severa; si no se está seguro de esta situación, debe repetirse el examen físico y el ecocardiograma 2 o 3 meses más tarde, con objeto de descartar un curso subagudo de la regurgitación. Una vez que se ha establecido la cronicidad del proceso, la frecuencia del examen clínico periódico depende de factores como severidad de la insuficiencia, el grado de dilatación ventricular, el nivel de la función sistólica y los cambios progresivos previos en el tamaño o la función del ventrículo izquierdo. El seguimiento debe incluir historia clínica, examen físico y ecocardiograma. La radiografía de tórax y el ECG tienen menos valor, aunque pueden ser útiles en determinados grupos de pacientes, especialmente aquellos con manifestaciones clínicas.
Los enfermos asintomáticos con IA moderada, poca o ninguna dilatación ventricular izquierda y función sistólica normal deben ser evaluados anualmente, pero el ecocardiograma no es necesario más que cada 2-3 años 3. Aunque se ha observado una progresión de la IA hasta en un 30% de los casos seguidos a largo plazo 106, no suele ser abrupta y, por tanto, basta con los plazos de revisión citados.
En los enfermos asintomáticos con función sistólica normal pero insuficiencia severa y dilatación ventricular significativa (DD > 60 mm), la revisión debe efectuarse cada 6 meses. Además, requieren un ecocardiograma al menos cada 12 meses. Si la dilatación del ventrículo izquierdo es progresiva, el ecocardiograna debe hacerse cada 6 meses, puesto que estos pacientes tienen mayor probabilidad de desarrollar síntomas o disfunción ventricular izquierda 78,79. Si el ecocardiograma es de calidad subóptima o discordante con la evaluación clínica, se debe realizar una ventriculografía isotópica (tabla 8). En centros con experiencia, la resonancia nuclear magnética ha demostrado ser una excelente técnica para valorar la función ventricular y cuantificar la severidad de la regurgitación 107,108. La prueba de esfuerzo puede ser útil para valorar síntomas dudosos, capacidad funcional o cambios físicos que sugieran un empeoramiento; la realización rutinaria, sin embargo, no está aconsejada (tabla 7). Tampoco están indicados los estudios de función ventricular con el esfuerzo, ya que su significado, como se ha expuesto anteriormente, es cuestionable 3.
Los enfermos asintomáticos con mayor grado de dilatación (DTD > 70 mm o DTS > 50 mm) requieren un seguimiento más estrecho, puesto que son los que tienen un mayor riesgo (10-20% anual) de desarrollar síntomas o disfunción ventricular. En consecuencia, es razonable realizar una revisión, con ecocardiograma incluido, cada 4-6 meses.
En los casos con afectación de la raíz aórtica está indicado el seguimiento periódico con ecocardiografía, ya que se debe adoptar la indicación quirúrgica, con independencia de la severidad de la regurgitación, la presencia de síntomas o la función ventricular, cuando la dilatación aórtica alcanza unas dimensiones que rondan los 50-55 mm de diámetro. En la figura 2 se esquematiza el manejo de los pacientes con IA crónica severa.
Fig. 2. Algoritmo de actuación en la regurgitación aórtica crónica severa, basado en los síntomas, la función ventricular izquierda y las dimensiones del ventrículo izquierdo. *Si la anamnesis es equívoca, puede ayudar el test de esfuerzo. **Si el eco es subóptimo o la función ventricular «limítrofe», conviene realizar una ventriculografía isotópica. Los síntomas se evalúan por la anamnesis y la función ventricular con el ecocardiograma. Los pacientes sintomáticos, con fracción de eyección anormal, o con dimensiones muy elevadas, deben ser operados. En los que tienen dimensiones «limítrofes» conviene estudiar la respuesta hemodinámica al ejercicio antes de tomar una decisión. Los que no tienen ninguna de estas características deben ser seguidos periódicamente, con una cadencia que depende de la estabilidad de la lesión y las dimensiones ventriculares. DTD: dimensión telediastólica; DTS: dimensión telesistólica; RVA: reemplazo valvular aórtico.
Indicaciones de cateterismo
No debe realizarse cateterismo, a menos que existan dudas sobre la severidad de la regurgitación o la función ventricular que no puedan ser resueltas con téc-nicas incruentas, o que se precise coronariografía 109 (tabla 9). En estos últimos pacientes, la coronariografía debe complementarse con aortografía y medidas hemodinámicas de la función ventricular izquierda. En los pacientes asintomáticos es poco común que se necesite el cateterismo para valorar la severidad de la IA. Puede plantearse su necesidad, de forma muy ocasional, para estudiar la respuesta durante el ejercicio en pacientes con IA severa y función sistólica normal, o casi normal, o en casos con un tamaño ventricular grande. La medida del gasto cardíaco mediante cateterismo derecho permite también identificar a algunos pacientes con anormalidades hemodinámicas severas que aconsejan la cirugía 3.
Indicaciones de la sustitución valvular aórtica
Los pacientes con IA ligera no son candidatos quirúrgicos y, si están sintomáticos, deben descartarse otros procesos patológicos como enfermedad coronaria, hipertensión arterial o miocardiopatía; si a pesar de ello se tienen dudas sobre la severidad de la regurgitación, los pacientes deben ser estudiados mediante angiografía y hemodinámica además de con los métodos no invasivos normales 109. La siguiente discusión sólo es aplicable a aquellos pacientes con IA severa (tabla 11).
Enfermos asintomáticos con función ventricular izquierda normal. Se acepta que deben ser operados aquellos pacientes asintomáticos con diámetros ventriculares izquierdos grandes (DD > 75 mm o DS > 55 mm), incluso aunque tengan una fracción de eyección normal. Algunos autores 80 prefieren corregir los diámetros por la superficie corporal e indican la cirugía cuando el DS >= 25 mm/m 2. Los pacientes con progresión de los diámetros ventriculares requieren un seguimiento cuidadoso, pero pueden estabilizarse durante largos períodos sin alcanzar el umbral señalado. La base de esta indicación reside en que la mayoría de los pacientes con diámetros ventriculares grandes terminan por desarrollar disfunción ventricular a causa del incremento de la poscarga; por tanto, los diámetros telediastólicos y/o telesistólicos que alcanzan el umbral anteriormente dicho pueden considerarse como equivalentes de una fracción de eyección deprimida 78,110. Razones adicionales para la intervención es que estos pacientes tienen riesgo de muerte súbita y que los resultados de la cirugía suelen ser excelentes 79,111-113, a diferencia de los que terminan desarrollando síntomas y/o disfunción ventricular, que presentan una mortalidad postoperatoria considerable 112. Aquellos que tengan diámetros próximos al umbral señalado deben ser revisados cada 4 o 6 meses, pero además es razonable recomendar la sustitución valvular aórtica en estos pacientes si hay evidencia de disminución de la tolerancia al ejercicio o una respuesta hemodinámica anormal al ejercicio como, por ejemplo, la elevación de la presión capilar pulmonar > 25 mmHg 3.
Se han identificado enfermos que pueden desarrollar disfunción ventricular izquierda con un menor grado de dilatación ventricular. Por ejemplo, a) los que tienen una larga historia de hipertensión arterial que reduce la distensibilidad del ventrículo y, por tanto, la capacidad de dilatación de la cavidad; b) los que tienen enfermedad coronaria asociada y presentan isquemia miocárdica que incrementa el estrés parietal y facilita una disfunción ventricular más precoz; c) los que tienen estenosis mitral concomitante que limita la dilatación ventricular izquierda 114, y d) las mujeres, que suelen desarrollar disfunción ventricular izquierda con menores diámetros ventriculares; este hecho, sin embargo, parece estar relacionado con la masa corporal, puesto que las diferencias desaparecen cuando los diámetros se corrigen por la superficie corporal 115.
Enfermos asintomáticos con depresión de la función ventricular izquierda. Se acepta que deben ser intervenidos aquellos con fracción de eyección en reposo inferior al 50% 78,79, aunque otros grupos 80 sitúan el umbral en el 55%. La fracción de eyección está sujeta a variaciones de diversa índole (método utilizado, operador, temporalidad, nivel de poscarga, etc.), por lo que debe ser validada clínicamente mediante al menos dos determinaciones consecutivas antes de establecer la indicación quirúrgica en exclusiva por esta razón 116,117. El comportamiento de la fracción de eyección durante el ejercicio está sujeto a numerosos factores, por lo que no suele usarse para el establecimiento de la indicación quirúrgica.
Enfermos sintomáticos. Deben ser intervenidos, aun cuando la fracción de eyección sea superior al 50%, aquellos que están en grado funcional III-IV de la NYHA (New York Heart Association), o en grado II a IV de la CHA (Asociación Canadiense del Corazón) si nos referimos a la angina. En los que tienen disnea de clase II puede ser difícil realizar una valoración sintomática, por lo que la prueba de esfuerzo puede ayudar a caracterizar mejor la capacidad funcional. Si el origen de los síntomas no está claro (enfermedades asociadas, bajo nivel de entrenamiento, ancianidad, etc.) y tampoco son lo suficientemente severos como para interferir con el régimen de vida normal del paciente, puede ser razonable mantener un período de observación. La aparición de disnea tiene implicaciones diferentes si ocurre en pacientes con claros signos de dilatación ventricular o disfunción ventricular que en aquellos con alteraciones más modestas; pero incluso en estos últimos, aunque no se hayan alcanzado los niveles de dilatación y depresión de la fracción de eyección anteriormente citados, debe ser aconsejada la cirugía si no se encuentran causas explicativas de la disnea y la regurgitación, caracterizada por los métodos habituales, es severa. También es aconsejable la sustitución valvular en los pacientes con arritmias ventriculares, ya que este fenómeno arrítmico suelen ser indicativo, o preludio, de disfunción ventricular 118.
Los pacientes sintomáticos con disfunción ventricular izquierda ligera o moderada (fracción de eyección entre el 25 y el 49%) deben ser operados 119. La sustitución valvular es especialmente beneficiosa en los pacientes con síntomas menos avanzados (grados II y III), sobre todo si existe evidencia de que la disfunción ventricular izquierda es de reciente aparición y/o la terapéutica intensiva con vasodilatadores, diuréticos y agentes inotrópicos resulta en una mejora sustancial de la hemodinámica y la función sistólica. Los pacientes en grado IV tienen peor supervivencia después de la cirugía y una menor probabilidad de recuperar la función sistólica; no obstante, la cirugía mejora sus condiciones de carga del ventrículo izquierdo y permite una mayor supervivencia 120,121. En el postoperatorio se debe continuar combatiendo la disfunción ventricular izquierda con el apropiado tratamiento farmacológico.
Los que tienen disfunción ventricular avanzada (fracción de eyección < 25%, con dimensiones telesistólicas superiores a los 60 mm) plantean un dilema terapéutico. Por una parte, la mortalidad operatoria es de un 10%; por otra, aunque algunos presentan una clara mejoría después de la cirugía, la mayoría desarrollan cambios irreversibles del miocardio que entorpecen las posibilidad de supervivencia tardía. Aun así, incluso en pacientes en grado IV se considera que la sustitución valvular es una mejor alternativa que el tratamiento médico aislado 112,122.
En conjunto, las indicaciones quirúrgicas están en expansión, a medida que aumenta la experiencia con los homoinjertos aórticos, autoinjertos pulmonares 123, válvulas biológicas, reparaciones valvulares aórticas 124,125 y cirugía mínimamente invasiva 126,127. Si estas técnicas demuestran que mejoran la supervivencia a largo plazo o disminuyen las complicaciones postoperatorias, es concebible que se reduzcan los umbrales para recomendar la intervención quirúrgica. Pero hasta que dispongamos de estos datos, las indicaciones deben ser similares a las citadas, independientemente de la técnica quirúrgica elegida.
Regurgitación secundaria a enfermedad de la raíz aórtica
Las enfermedades de la raíz de la aorta pueden ser causa de IA, tanto aguda como crónica. El tratamiento quirúrgico integral debe contemplar la sustitución, no sólo de la válvula, sino de toda la raíz y la aorta ascendente con el fin de prevenir las graves complicaciones que pueden surgir en la pared aórtica enferma 128-130. En ocasiones, la regurgitación valvular no es severa, pero la intervención quirúrgica está indicada porque la dilatación aórtica alcanza un diámetro >= 55 mm. Hay autores que sugieren que en los pacientes de alto riesgo, debido a una historia familiar de disección precoz (antes de los 40 años) o a un ensanchamiento rápido de la raíz aórtica (incremento de más de 5 mm en menos de un año), es prudente proceder a la intervención quirúrgica cuando el diámetro alcanza 50 mm o incluso menos 131,132. El tratamiento betabloqueador puede retardar la dilatación de la aorta y la aparición de complicaciones 133.
El problema especial de los ancianos
La gran mayoría de los pacientes ancianos con enfermedad aórtica tienen estenosis o una lesión combinada, siendo rara la IA pura. Los ancianos, en general, se adaptan peor a la IA; desarrollan síntomas y/o disfunción ventricular más precozmente y el resultado de la intervención suele ser menos brillante, con tasas de supervivencia peores que las de enfermos más jóvenes 134,135. Muchos ancianos, además, tienen enfermedad coronaria asociada que debe ser considerada en el momento de la evaluación de los síntomas, la disfunción ventricular y la indicación quirúrgica. El alivio de los síntomas, más que la prolongación de la supervivencia, debe ser el objetivo a alcanzar en los pacientes muy ancianos; en los que son más jóvenes y, por tanto, tienen aún una dilatada esperanza de vida, la aparición de disfunción ventricular izquierda, aunque no haya síntomas, indica la necesidad de proceder a la sustitución valvular.
Seguimiento de los pacientes operados
Antes del alta hospitalaria, o a las pocas semanas de la intervención en su defecto, se debe realizar un ecocardiograma que defina la situación basal postoperatoria con respecto al funcionamiento de la prótesis y del ventrículo izquierdo. En las primeras semanas después de la cirugía se producen pocos cambios en la fracción de eyección, que puede incluso empeorar debido a la reducción de la precarga, aunque más tarde se recupere parcialmente 136. La persistencia de disfunción, o el empeoramiento de la función sistólica después de la intervención, es un predictor de mala recuperación ulterior de la función ventricular. Por el contrario, la reducción del tamaño ventricular, que suele aparecer durante la primera o segunda semanas del postoperatorio, es un excelente predictor de la recuperación funcional del ventrículo 119,136-138.
El paciente debe ser valorado de nuevo a los 6 y 12 meses y posteriormente cada año si el curso clínico es normal. Si permanece asintomático, se ha conseguido una reducción apreciable del ventrículo y la función sistólica es normal, no son necesarios estudios ecocardiográficos seriados. Sin embargo, si a lo largo del seguimiento se aprecian nuevos soplos, se tienen dudas sobre el buen funcionamiento valvular o la función del ventrículo izquierdo, debe realizarse un nuevo estudio. Los pacientes con persistencia de dilatación ventricular en el ecocardiograma inicial no atribuible a disfunción protésica deben ser tratados como cualquier otro paciente con disfunción ventricular izquierda, sintomática o asintomática, incluyendo la administración de IECA. En estos pacientes, las necesidades clínicas dictarán la conveniencia de ulteriores estudios seriados.
ESTENOSIS MITRAL
Anatomía y fisiopatología
El aparato valvular mitral consta de las valvas, las cuerdas tendinosas y los músculos papilares. Las valvas son dos, la anterior (o medial) y la posterior (o lateral). Cada valva tiene una porción basal o fija y una libre o móvil. La porción basal de la valva posterior se sujeta al miocardio ventricular izquierdo mediante tejido fibroso (lo que se denomina el «anillo mitral») y contacta con el endocardio de la aurícula izquierda. La valva anterior también se continúa con el endocardio auricular, pero se une firmemente con la raíz aórtica y con porciones de las cúspides izquierda y posterior de la válvula aórtica. Durante la sístole, los dos velos mitrales contactan a lo largo de sus respectivas líneas de cierre. Los dos ángulos en los que las valvas se acercan una a otra en su zona basal son las comisuras, la anterolateral y la posteromedial. La charnela sobre la que se mueven los velos es la sujeción basal; de esta forma, durante la diástole ventricular las dos valvas se mueven en dirección contraria y durante la sístole se acercan, hasta contactar una con otra, no sólo en las comisuras, sino a todo lo largo de la línea de contacto. Un solo músculo papilar, o un conjunto de músculos, yacen debajo de cada una de las comisuras y reciben el mismo nombre topográfico. Las cuerdas tendinosas se unen a los músculos papilares, por debajo, y a varias partes de la superficie ventricular de los velos mitrales por arriba. Generalmente las cuerdas no se unen al borde libre de las valvas sino a sus superficies ventriculares. Es importante recordar que cada conjunto de cuerdas (anterolateral y posteromedial) se une a la mitad de cada valva correspondiente a la comisura a la que pertenecen las cuerdas 139.
La estenosis mitral (EM) suele ser de naturaleza postinflamatoria, debida a una afectación reumática que termina por causar rigidez del tejido valvular, fusión comisural y acortamiento de las cuerdas tendinosas. La rigidez del tejido valvular puede ser resultado de: a) engrosamiento fibrótico intrínseco; b) calcificación secundaria de los velos fibróticos, y c) tensión en las valvas por las fuerzas opuestas de las cuerdas tendinosas acortadas. La calcificación del anillo mitral, afección prevalente en los ancianos, ocasionalmente puede producir EM; las estenosis congénitas son variadas, pero la válvula en «paracaídas», por la presencia de un solo músculo papilar en el que confluyen todas las cuerdas tendinosas, es la forma más común. El cor triatriatum tiene una fisiopatología muy similar a la de la EM.
El área del orifico valvular mitral es de 4-5 cm 2 y se precisa una reducción a valores inferiores a 2,5 cm 2 para que aparezcan consecuencias fisiopatológicas. La fundamental es el establecimiento de un gradiente de presión entre la aurícula izquierda y el ventrículo izquierdo. La magnitud del gradiente depende del área valvular mitral y el flujo diastólico por segundo; esto quiere decir que, para una misma restricción orificial, el gradiente será mayor cuanto más elevado sea el flujo absoluto (a lo largo de toda la diástole, como en los estados hipercinéticos) o relativo (es decir, por unidad tiempo, como sucede cuando hay taquicardia que acorta el período diastólico). La elevación de la presión auricular se transmite de forma retrógrada a las venas, capilares y arteriolas pulmonares. Todo esto causa congestión y trastornos en el intersticio pulmonar, además de hiperplasia e hipertrofia de las arteriolas pulmonares; en definitiva, hipertensión pulmonar. Esta hipertensión puede ser meramente pasiva, paralela al grado de obstrucción mitral, o tener un componente activo debido al aumento de las resistencias arteriolares pulmonares. Se acepta clásicamente que el incremento de las resistencias pulmonares, a diferencia de lo que ocurre en las cardiopatías congénitas que abocan a un síndrome de Eissenmenger, es de carácter funcional y, por tanto, reversible, una vez suprimido el obstáculo mitral 140. En consecuencia, de manera excepcional se contraindica un procedimiento terapéutico por la existencia de hipertensión pulmonar severa. Como hemos mencionado, las circunstancias que acortan la diástole (taquicardia), sobre todo si se acompañan de incremento del gasto cardíaco (ejercicio, embarazo, anemia, etc.), aumentan el gradiente y, por ende, la congestión pulmonar y los síntomas 3.
Historia natural
La enfermedad afecta particularmente a las mujeres y no es raro que los síntomas aparezcan coincidiendo con el embarazo. Si no es así, hacia la cuarta década el orificio mitral suele tener entre 1,5 y 2,5 cm 2, comenzando el paciente a tener disnea de esfuerzo. En los siguientes 10 años el área valvular se reduce a 1-1,5 cm 2 y la sintomatología se hace de medianos-pequeños esfuerzos. Ésta es una historia tipo, condicionada por la reducción progresiva del orificio mitral, pero que puede tener numerosas variantes; así, por ejemplo, hay estenosis mitrales severas en la adolescencia que, por fortuna, ya han desaparecido prácticamente de nuestro entorno 141; al contrario, puede haber estenosis triviales que apenas tengan cambios a lo largo del tiempo y permitan una vida plena. La calcificación comisural de las valvas es uno de los mecanismos que más frecuentemente agravan la obstrucción. En todo caso, el gradiente transmitral y el grado funcional, que suelen ir paralelos, condicionan el pronóstico; así, los pacientes en grado funcional III de la NYHA tienen una supervivencia del 38% a los 10 años, mientras que los que están en grado IV tan sólo viven un 15% de promedio a los 5 años. Afortunadamente, la cirugía ha cambiado de forma espectacular esta historia natural, por lo que se puede considerar histórica. Hoy día, la EM se ha convertido en una enfermedad lentamente progresiva, tradicionalmente disneizante y cuya historia natural se puede ver alterada por los descensos en fibrilación auricular y el embolismo periférico. La mortalidad en pacientes no tratados con cirugía es debida a insuficiencia cardíaca refractaria (60-70%), embolismo periférico (20-30%), embolismo pulmonar (10%) y cuadros infecciosos (1-5%) 3.
Evaluación diagnóstica
Los métodos tradicionales
El diagnóstico de la enfermedad se basa en la anamnesis, fundamental para establecer la repercusión funcional de la enfermedad, y en la auscultación que, en los casos típicos, en ritmo sinusal y con buena movilidad valvular, pone de manifiesto los componentes habituales de la obstrucción mitral: primer ruido fuerte, sístole libre, chasquido de apertura y retumbo diastólico con refuerzo presistólico. Esta semiología puede verse modificada, hasta el punto de hacerse silente, por numerosas circunstancias como fibrilación auricular, calcificación valvular, bajo gasto cardíaco, hipertensión pulmonar, regurgitación tricuspídea asociada, etc. El ECG típico, en los primeros estadios de la enfermedad, demuestra una onda P ancha y hendida; más tarde, conforme va aumentando el tamaño de la aurícula izquierda aparece, casi inexorablemente, fibrilación auricular. La radiografía de tórax puede presentar una rica semiología que tampoco es momento de revisar; sí conviene recordar que sigue siendo el mejor método para evaluar los cambios secundarios a la congestión pulmonar.
Ecocardiografía
El estudio ecocardiográfico (tabla 12) es obligado para confirmar el diagnóstico, evaluar la severidad hemodinámica y descartar la afectación de otras válvu-las 142,143. La severidad se estima midiendo el área valvular, aceptándose que estamos ante una estenosis severa cuando el orificio es <= 1 cm 2. Aunque existen numerosos métodos admitidos para el cálculo del orificio valvular (bidimensional, método de hemipresión, fórmula de la continuidad, isovelocidad proximal), determinadas circunstancias hacen que sea más adecuado utilizar uno u otro; en general, es aconsejable utilizar siempre dos de los métodos y que el valor obtenido sea concordante. El examen debe acompañarse del cálculo del gradiente mitral medio y del gradiente sistólico tricuspídeo, que permite estimar la presión sistólica de la arteria pulmonar. El estudio detallado de la morfología valvular -motilidad de los velos, engrosamiento/calcificación, estado de las comisuras y afectación del aparato subvalvular- es de suma importancia cuando se planea una valvuloplastia. De hecho, el índice que se elabora a partir de estos datos tiene una estrecha correlación con los resultados del procedimien-to 144. Lógicamente, cuando el estudio transtorácico sea de mala calidad estará indicado realizar un estudio transesofágico, con el fin de recoger toda la información antes mencionada (tabla 13). Se ha recomendado, además, como paso previo a la realización de una valvuloplastia, con el fin de descartar trombos en la aurícula y/u orejuela izquierda 145.
En pacientes con discrepancia entre los síntomas y la severidad de la estenosis en situación basal se puede realizar un ecocardiograma de estrés (habitualmente, esfuerzo en bicicleta o cinta rodante, pero también una perfusión de dobutamina a dosis crecientes) con el fin de documentar el comportamiento del gradiente transmitral y la presión arterial pulmonar. Incrementos significativos equivaldrían a repercusión hemodinámica importante de la lesión 146. Aunque esta aproximación es muy atractiva desde el punto de vista fisiopatológico, no está claro dónde debemos establecer el valor del gradiente medio que divida las respuestas normales de las patológicas; en este sentido, y a la luz de nuestra experiencia 147, los valores recomendados por el comité de expertos de la AHA/ACC 3 nos parecen excesivamente bajos.
Indicaciones de cateterismo
Los enfermos sintomáticos, sobre todo los que están en clase funcional III-IV, suelen tener un orificio muy reducido y la orientación terapéutica es clara: apertura, o sustitución en su caso, de la válvula estenótica. Sin embargo, hay circunstancias en que las cosas no son tan evidentes. Por ejemplo, hay más de un paciente con pocos síntomas en el que el ecocardiograma demuestra una clara reducción del orificio mitral (área < 1,5 cm 2). O, al contrario, que una sintomatología manifiesta no coincida con una EM cerrada. O, por último, que una enfermedad respiratoria asociada dificulte la interpretación de los síntomas. En estas circunstancias de discordancia clínico-ecocardiográfica, la valoración de la respuesta hemodinámica con el estrés, mediante Doppler o cateterismo, puede ayudar a la toma de decisiones.
Cuando existe discrepancia entre los datos recogidos por el estudio Doppler y el cuadro clínico de un paciente sintomático, se debe realizar un cateterismo derecho e izquierdo con ventriculografía izquierda para evaluar la posible regurgitación asociada 3 (tabla 14). El estudio manométrico basal, si no es suficientemente expresivo, puede ir seguido, como hemos comentado antes, de nuevas determinaciones tras la correspondiente maniobra estresante (ejercicio, dobutamina, etc.). Las indicaciones de coronariografía en los pacientes valvulares que van a ser sometidos a cirugía se discuten en otro apartado.
Tratamiento médico
Aunque la terapia fundamental de la EM importante sea el alivio de la obstrucción, la mayoría de los pacientes se benefician de algunas medidas farmacológicas, especialmente en lo que se refiere a la fibrilación auricular y su complicación fundamental: el embolismo sistémico.
Medidas generales
Es un hábito arraigado la recomendación de profilaxis de fiebre reumática en los pacientes menores de 25 años. Se suele hacer también profilaxis de endocarditis infecciosa aunque la EM es mucho menos proclive al asiento de gérmenes que las lesiones regurgitantes. También se suele aconsejar al paciente que no realice esfuerzos que provoquen disnea 32, así como que haga una dieta hiposódica. La digoxina, los betabloqueadores y algunos calcioantagonistas, como el verapamilo y el diltiazem, pueden ser útiles para controlar la frecuencia ventricular en caso de fibrilación auricular con respuesta rápida. Los diuréticos y los nitratos son útiles para combatir la congestión pulmonar y/o sistémica. La digoxina, por el contrario, no es de ninguna utilidad cuando el pacientes está en ritmo sinusal 148.
Tratamiento y prevención de la fibrilación auricular
Una proporción muy elevada de pacientes con EM presentará fibrilación auricular en el transcurso de su enfermedad. Su aparición conlleva un peor pronóstico, ya que facilita la aparición de insuficiencia cardíaca y de fenómenos embólicos. El tratamiento de un episodio agudo debe ir encaminado a controlar la frecuencia ventricular (digital, calcioantagonistas o betabloqueantes) y proporcionar una cobertura antitrombótica mediante anticoagulación completa con heparina sódica. La cardioversión eléctrica es muy útil para la conversión a ritmo sinusal; sin embargo, raramente la utilizaremos en la fase aguda puesto que es necesario, con el fin de evitar embolias, un mínimo de 3 semanas de buena anticoagulación antes del procedimiento. Podría proponerse, en este caso, un eco transesofágico y proceder a la cardioversión, sin anticoagulación previa (sólo heparina), si no se visualiza material trombótico intraauricular. Sin embargo, esta estrategia no está aún muy probada en este tipo de enfermos y, además, raramente se precisa una cardioversión aguda, puesto que con el control farmacológico de la frecuencia ventricular se logra una adecuada estabilidad hemodinámica. En cualquier caso, la restauración del ritmo sinusal debe ir seguida de otras 4 semanas de anticoagulación, período en el que se estima que persiste el riesgo de trombosis auricular por deficiencia en la actividad mecánica de la cámara. El riesgo de recaída es elevado y se cree que la utilización de fármacos antiarrítmicos ayuda a mantener el ritmo sinusal; no hay estudios que avalen con firmeza el medicamento de elección pero, en nuestro medio, la amiodarona a dosis de mantenimiento bajas es el que goza de mayor popularidad. Otros, debido a las complicaciones adversas de la amiodarona, podrían elegir el sotalol o incluso un fármaco de clase IC (propafenona, flecainida) que en estos pacientes, con función ventricular normal, no suele generar proarritmia.
Prevención del embolismo sistémico
Los pacientes en fibrilacion auricular, así como los que, aun manteniendo el ritmo sinusal, son más ancianos o cuentan con el antecedente de un embolismo previo, tienen mayor riesgo de embolismo. Se calcula que entre un 10-20% de estos pacientes tienen alguna embolia a lo largo de la evolución. Un tercio de los embolismos aparece en el primer mes desde que comenzó la arritmia y los otros dos tercios en el primer año. Especialmente elevado (15-40% episodios paciente/mes) es el riesgo de los enfermos en los que coexisten fibrilación auricular y embolismo previo. El riesgo, por el contrario, no está relacionado con la severidad de la estenosis, los síntomas o el tamaño de la auricula izquierda. Si no ha habido embolias previas y se mantiene el ritmo sinusal no está clara la indicación de la anticoagulación, incluso cuando existe mayor riesgo de embolismo (estenosis severa y auricula izquierda crecida) 3,149. En la tabla 15 se resumen las indicaciones del tratamiento anticoagulante.
Revisiones periódicas
Los pacientes con EM no severa (área >= 1 cm 2) y sin síntomas relevantes deben ser revisados anualmente. Además, han de ser instruidos para que se acorte el período de revisión en caso de que aparezcan síntomas o se acentúen los previos. Esta revisión debe incluir una anamnesis y exploración físicas detalladas, un estudio radiológico y un ECG, no siendo necesario de forma rutinaria la práctica de un ecocardiograma. Éste únicamente se debe realizar en los casos en los que haya una modificación significativa de los síntomas o signos clínicos, radiológicos o electrocardiográficos. En algunos pacientes, y en determinadas circunstancias, puede estar justificado realizar un eco de estrés para optimizar el manejo clínico. En pacientes con palpitaciones puede estar justificada la realización de un Holter con el fin de objetivar episodios paroxísticos de fibrilación auricular.
Aunque la medicación puede contribuir a mantener un grado funcional aceptable durante un tiempo sustancial, los procedimientos intervencionistas sobre la válvula enferma son los que, ciertamente, resuelven el problema de forma duradera.
Intervenciones sobre la válvula mitral estenótica
La comisurotomía o el reemplazamiento valvular han sido los tratamientos utilizados hasta la introducción de la valvuloplastia mitral percutánea con catéter-balón a mediados de los años ochenta (tabla 16). Esta técnica, cuando es aplicada por grupos experimentados, tiene el mismo índice de éxito que la comisurotomía quirúrgica 150. Sin embargo, es muy dependiente de la habilidad del operador, requiere una curva de aprendizaje que se cifra en 25 casos como primer operador, y un mantenimiento ulterior de al menos 10 procedimientos/año. Aunque hay diferentes técnicas, la más difundida es la de Inoue, que precisa cateterismo transeptal para el abordaje de la válvula mitral. El procedimiento se considera eficaz cuando el área valvular aumenta al menos un 50% con respecto al área prevalvuloplastia y no hay complicaciones mayores como muerte, taponamiento cardíaco, accidente cerebrovascular, infarto agudo de miocardio, compromiso vascular periférico con necesidad de cirugía, insuficiencia mitral severa o comunicacion interauricular significativa. Los mejores resultados se obtienen en válvulas con un tanteador ecocardiográfico < 8: éxito del 90-95%, baja frecuencia de complicaciones (< 2-3%) y mejoría mantenida a largo plazo en el 80-90% de los pacientes 151,152,152a. A medida que existe mayor calcificación y afectación del aparato subvalvular, el aumento del área es menor y se incrementa la probabilidad de complicaciones. Se consideran contraindicaciones para la valvuloplastia el embolismo periférico reciente, la evidencia de trombo en la aurícula izquierda, la insuficiencia mitral moderada-severa, la calcificacion mitral masiva, y el engrosamiento y fibrosis severos del aparato subvalvular 153. La reestenosis postquirúrgica es, sin embargo, una de las indicaciones habituales 154, siempre, naturalmente, que la válvula conserve una anatomía adecuada.
La mejoría obtenida con la valvuloplastia se explica por el aumento conseguido en el área mitral; sin embargo, hay algunos casos en los que, a pesar de haberse conseguido un área mitral aceptable, sin regurgitación residual, el beneficio clínico es menor del esperado. En estos casos, la falta de mejoría suele explicarse por la existencia de arritmias auriculares rá-pidas, hipertensión pulmonar severa, insuficiencia tricuspídea, valvulopatías asociadas o enfermedad pulmonar concomitante 153. Entre las complicaciones, merece especial mención el desarrollo de insuficiencia mitral significativa, que suele ocurrir por rotura de un velo, allá donde coexisten zonas valvulares finas con otras engrosadas, o cuando existe calcificación comisural asimétrica o afectación severa del aparato subvalvular 155. Más rara es la regurgitación severa por rotura de una cuerda tendinosa. Aunque la regurgitación mitral severa puede ser bien tolerada, más de la mitad de estos pacientes requieren una intervención quirúrgica, generalmente una sustitución valvular, en los meses que siguen a la valvuloplastia 156,157.
La mejoría inicial se mantiene a largo plazo en más de los dos tercios de los pacientes 158,159, estimándose que la tasa de reestenosis, no siempre asociada a deterioro clínico, es del 39% a los 7 años del procedimiento 159. Tampoco se ha observado la progresión de la regurgitación mitral 159. Se puede considerar, por tanto, que la valvuloplastia mitral percutánea es un procedimiento seguro y efectivo, que proporciona buenos resultados a corto y medio plazo en pacientes sintomáticos con una anatomía valvular favorable.
En los pacientes asintomáticos pero con una EM moderada-severa e hipertensión arterial pulmonar (basal o tras ejercicio), o en los sintomáticos con válvula no favorable pero de alto riesgo quirúrgico, es una alternativa terapéutica defendida por muchos autores. La aplicación de la técnica a otros subgrupos de pacientes goza de menor apoyo por parte de la comunidad científica.
Cuando la morfología de la válvula es favorable, pero la valvuloplastia percutánea no está accesible o no se puede realizar con las suficientes garantías, es lógico recurrir a la cirugía reparadora 160,161 (tabla 17). Existen también otra serie de circunstancias, recogidas en la tabla 16, que aconsejan utilizar la comisurotomía mitral con circulación extracorpórea en vez del procedimiento percutáneo. Hay, finalmente, casos en los que la anatomía valvular hace ineludible la implantación de una prótesis (tabla 18). En las figuras 3-5 se presentan algoritmos de actuación en la EM que, a partir de los síntomas del paciente, tratan de resumir los conceptos vertidos a lo largo del texto.
Problemas especiales
La anatomía valvular en el paciente anciano es generalmente más adversa, con mayor grado de calcificación de los velos y afectación del aparato subvalvular, aurícula izquierda más dilatada e hipertensión pulmonar. La tolerancia clínica suele ser menor y, siempre que la EM es significativa, se acompaña de un grado funcional elevado. Los enfermos mayores con frecuencia presentan comorbilidad asociada que eleva el riesgo quirúrgico; en consecuencia, siempre que se pueda se debe realizar un procedimiento percutáneo. El porcentaje de éxito es similar al que se obtiene en pacientes más jóvenes, aunque a expensas de una mayor tasa de complicaciones y de reestenosis 162. En caso de que la anatomía valvular desaconseje la valvuloplastia percutánea y el deterioro funcional sea severo, está indicada, pese al riesgo, la intervención quirúrgica. Los resultados de la operación, en lo que respecta a la calidad de vida, son lo suficientemente importantes como para afrontar el riesgo de la cirugía 163.
El manejo de la embarazada con EM será tratado en el apartado correspondiente. Baste decir, por el momento, que la valvuloplastia percutánea es la técnica terapéutica de elección 164 y que su realización exige extremar los cuidados para proteger al feto de la radiación, mediante el empleo de delantales protectores en el abdomen de la madre y la sustitución del control radiológico por el ecocardiográfico.
Seguimiento de los enfermos tras la apertura de la válvula mitral
La evaluación del resultado de una valvuloplastia no debe realizarse hasta que transcurran al menos tres días del procedimiento, ya que la velocimetría Doppler está muy alterada por el brusco cambio de distensibilidad de las cámaras cardíacas. El estudio ecocardiográfico debe dirigirse a objetivar el aumento del área valvular y la reducción del gradiente transmitral y de la presión sistólica de arteria pulmonar; además, hay que evaluar la continencia de la válvula y la integridad del tabique interauricular, descartando la presencia de cortocircuito izquierda-derecha significativo. La valoración de los pacientes con comisurotomía mitral es superponible en todo a la anterior, salvo en lo que respecta a la exploración del tabique interauricular. El pronóstico de los pacientes operados con éxito es bueno, estimándose una tasa de reestenosis del 40-50% a los 10-15 años del procedimiento y una necesidad de sustitución valvular del 22-43% a los 10 años 165,166. Esta evolución desfavorable puede ser detectada por la aparición de síntomas, que son los que dictan la conveniencia de repetir el examen ecocardiográfico.
PROLAPSO VALVULAR MITRAL
Características del síndrome
El prolapso valvular mitral (PVM) se define como el desplazamiento o deslizamiento de una o de ambas valvas mitrales, durante la sístole, hacia el interior de la aurícula izquierda, con o sin insuficiencia mitral (IM) acompañante. Es la forma más común de cardiopatía valvular en los países occidentales, encontrándose en un 2-6% de la población. La IM derivada de un PVM tiene unas características clínicas especiales cuando se la compara con otro tipo de regurgitaciones 167,168.
Desde un punto de vista anatomoetiológico, los prolapsos mitrales se pueden clasificar en primarios o secundarios 169. Los primeros no presentan más afección que la afectación valvular, y se reconocen los de causa familiar con herencia autosómica dominante 170, los aislados, los que ocurren en el síndrome de Marfan y los relacionados con otras enfermedades hereditarias del tejido conectivo. En los secundarios existe un proceso patológico definido que puede afectar a la válvula (enfermedad coronaria, enfermedad reumática), o circunstancias que condicionan un ventrículo izquierdo pequeño: miocardiopatía hipertrófica, comunicación interauricular, hipovolemia, anorexia nerviosa, etc. En general se abusa del diagnóstico de PVM, cajón de sastre en el que, a menudo y con poco criterio, se incluye a pacientes con anomalías auscultatorias o ecocardiográficas que son variantes de la normalidad.
En el PVM primario se produce un abombamiento intercordal debido a la redundancia de las valvas. El abombamiento es generalmente superior a los 4 mm e involucra al menos la mitad de la valva anterior y los dos tercios de la posterior. El hallazgo microscópico del PVM primario consiste en la proliferación de la capa esponjosa, delicado tejido conectivo mixomatoso que se sitúa entre la porción auricular de la valva (capa fina de colágeno y tejido elástico) y la ventricular o fibrosa (capa densa de colágeno que da soporte a la valva). Esta proliferación del tejido esponjoso causa interrupciones en la fibrosa, dando origen a los conocidos cambios secundarios del PVM primario: fibrosis y depósitos de fibrina en la superficie de las valvas, adelgazamiento y elongación de las cuerdas tendinosas y lesiones de fricción en el endocardio ventricular. Se ha formulado la hipótesis de que el PVM primario es consecuencia de una enfermedad del tejido conectivo por una embriogénesis imperfecta de la líneas celulares mesenquimatosas 171. También ha sido relacionado con disfunción del sistema nervioso autónomo, especialmente en los enfermos sintomáticos que pueden tener concentraciones plasmáticas elevadas de catecolaminas 172.
El PMV secundario no presenta esta proliferación mixomatosa de la esponjosa. Hay pacientes que después de un síndrome agudo coronario presentan un PVM inequívoco que antes no tenían 173. Por otra parte, estudios recientes indican que la regurgitación valvular causada por PVM pudiera ser el resultado de cambios postinflamatorios, incluidos aquellos producidos por la fiebre reumática 174,175. En los pacientes con miocardiopatia hipertrófica el PVM puede ser el resultado de una desproporción causada por una cavidad ventricular muy pequeña, de desalineamiento del músculo papilar, o de una combinación de ambas anomalías. En la rotura de cuerdas tendinosas puede presentarse PVM con valvas histológicamente normales debido a la falta de sujeción del velo correspondiente.
El prolapso de la válvula tricúspide tiene alteraciones histológicas similares y ocurre en el 40% de los pacientes con PVM 169. El prolapso de la válvula pulmonar o aórtica se encuentra en el 10 y el 2%, respectivamente, de los casos con PVM 167.
Historia natural y pronóstico
La mayoría de los pacientes con PVM tienen un excelente pronóstico 176,177. La aparición gradual de IM es la complicación más frecuente y suele aparecer en los pacientes con valvas más engrosadas, especialmente en varones con una edad superior a 45 años 176. La progresión de la IM origina cambios morfológicos y funcionales en las cavidades izquierdas que serán revisados en el capítulo de la IM crónica. La rotura de cuerdas tendinosas, bien espontánea, bien por endocarditis infecciosa, puede condicionar la aparición de una IM más abrupta y grave 177.
La muerte súbita es una complicación rara del PVM, pues se estima que ocurre en menos del del 2% de los casos seguidos a largo plazo 166,177. La causa más probable de este accidente son las arritmias ventriculares; esta afirmación se basa en el hallazgo de una mayor densidad de ectopia ventricular compleja en los pacientes que tuvieron muerte súbita 178. La incidencia más alta de muerte súbita, en todo caso infrecuente, se ha observado en las formas familiares de PVM , algunos de cuyos pacientes también presentan alargamiento del espacio QT 179.
Se ha señalado que el PVM es la primera causa predisponente de endocarditis infecciosa 167. Sin embargo, la incidencia absoluta es extremadamente baja, hasta el punto de ser muy controvertido el riesgo de endocarditis 180.
Los pacientes con IM severa pueden tener, como todo paciente con esta afección, accidentes embólicos ligados a la fibrilación y dilatación auricular izquierda. Además, hemos observado que en la superficie de las valvas mixomatosas pueden depositarse coágulos de fibrina que dan lugar a fenómenos embólicos 181-183. Varios estudios han referido una mayor incidencia de accidentes cerebrovasculares en pacientes con PVM menores de 45 años, en comparación con una población de edad similar y válvula mitral normal 182,183.
Evaluación y manejo del paciente asintomático
El diagnóstico suele hacerse fortuitamente en sujetos que son explorados por cualquier motivo. El examen físico es capital 167,169, puesto que la auscultación cuidadosa pone de relieve el signo princeps del diagnóstico: el clic mesosistólico, o no eyectivo, resultado acústico de una súbita tensión del aparato valvular en el momento del prolapso de las valvas hacia la aurícula durante la mesosístole. A menudo, el clic (o los clics, puesto que puede haber varios) va seguido de un soplo telesistólico apexiano que con frecuencia adquiere un carácter musical 184. Tanto el clic como el soplo pueden variar considerablemente, hasta desaparecer incluso, dependiendo del volumen y la contractilidad ventricular. Por eso se deben utilizar diversas maniobras que, disminuyendo el volumen ventricular (posición erecta) o, por el contrario, aumentándolo (posición de cuclillas), ponen de manifiesto el dinamismo de la auscultación 185.
El ECG, en la mayoría de los casos, suele ser normal. Puede haber cambios inespecíficos, como inversión de las ondas T, alteraciones en el segmento S-T, ondas U prominentes o alargamiento del intervalo Q-T. El Holter puede ser útil para documentar arritmias en pacientes con historia de palpitaciones, pero no está indicado como test rutinario en los enfermos asintomáticos. La mayoría de las arritmias detectadas no son peligrosas y hay pacientes que se quejan de palpitaciones durante el registro de Holter, sin que se encuentren trastornos del ritmo que las justifiquen.
La radiografía de tórax no aporta ningún hallazgo, salvo la demostración de diversas anomalías esqueléticas ( pectus excavatum, espalda recta, etc.) que pueden acompañar al PVM. A veces, especialmente en los adultos con síndrome de Marfan, puede observarse un anillo mitral calcificado.
La ecocardiografía es la técnica más adecuada para el diagnóstico de PVM. El diagnóstico se basa en la evidencia de un desplazamiento posterior, igual o mayor de 2 mm, de una o ambas valvas. Debido a la dificultad de visualizar las valvas en todo su contorno espacial, y a las tenues diferencias que existen entre el prolapso y la normalidad, no hay consenso absoluto sobre los criterios diagnósticos. Algunos autores exigen para el diagnóstico que el movimiento anormal vaya acompañado de una auscultación cardíaca típica o de cambios estructurales, como valvas engrosadas y redundantes, dilatación del anillo y elongación de las cuerdas tendinosas 167,186-188. La presencia de regurgitación, detectada mediante Doppler, hace prácticamente seguro el diagnóstico. El chorro suele ser excéntrico y de alta velocidad, quedando confinado a la telesístole en los casos típicos. La distribución espacial de esta turbulencia en la aurícula izquierda depende del velo afectado; si el que prolapsa es el posterior, la turbulencia se localiza en la zona más anterior de la aurícula; si es el anterior, el chorro se dirige hacia la zona posterior; por último, si la turbulencia se detecta en la zona media o se distribuye uniformemente, se debe sospechar que el prolapso afecta por igual a los dos velos 189.
Todos los pacientes con el diagnóstico clínico de PVM deben contar con una exploración ecocardiográfica en la valoración inicial (tabla 19), entre otras razones porque ciertas características, especialmente un marcado engrosamiento de la/s valva/s ( >= 5 mm), definen a una población con mayor riesgo de sufrir complicaciones evolutivas. Sin embargo, no son necesarios los estudios de seguimiento, a menos que empeo-ren los síntomas o haya evidencia auscultatoria de incremento en la regurgitación mitral. Por otra parte, no es recomendable la realización de ecocardiograma a sujetos con una auscultación dinámica negativa. La práctica contraria conduce al sobrediagnóstico del PVM y la creación de temores infundados.
Probablemente, la principal medida terapéutica sea la de tranquilizar al paciente, explicándole el buen pronóstico del PVM. En consecuencia, se le debe animar a que lleve una vida normal, incluyendo la práctica regular de ejercicio físico 167. La profilaxis de endocarditis infecciosa está recomendada para la mayoría de los pacientes con diagnóstico documentado de PVM (tabla 20). No hay acuerdo total para el uso de profilaxis en aquellos pacientes que tienen sólo clic sistólico, sin soplo añadido; no obstante, si hay engrosamiento de los velos en la ecografía se considera apropiada la prevención en las circunstancias con riesgo de bacteriemia 180.
Evaluación y manejo de los pacientes sintomáticos
Estos pacientes consultan por uno o más de los síntomas comunes en este síndrome: palpitaciones, dolor torácico atípico, disnea, fatigabilidad, ataques de pánico, etc. 167,169. Los episodios cerebrales isquémicos u oculares transitorios son otro motivo, en este caso más serio, de consulta.
El papel de la auscultación y la ecocardiografía en la evolución de los pacientes sintomáticos es el mismo que en los pacientes asintomáticos. Los criterios de profilaxis de endocarditis infecciosa son también iguales.
Los pacientes con palpitaciones, dolor torácico, ansiedad o fatigabilidad pueden beneficiarse de la terapia con betabloqueadores 190. En muchos casos, sin embargo, basta con el cese del uso de estimulantes como el alcohol, café o tabaco para que mejoren los síntomas. En los enfermos con episodios frecuente de palpitaciones se debe realizar un Holter por si existiesen arritmias que requiriesen terapia específica. Las indicaciones de estudio electrofisiológico son las mismas que para el resto de la población (muerte súbita abortada, síncopes recurrentes de causa desconocida y taquicardia ventricular sostenida).
Se recomienda aspirina (80 a 325 mg diarios) para los pacientes con episodios neurológicos focales, aunque estén en ritmo sinusal y no tengan trombos auriculares 191. Estos enfermos deben evitar el consumo de tabaco y los anticonceptivos orales. La anticoagulación a largo plazo se recomienda para los enfermos con ictus manifiesto, para los que tengan ataques transitorios mientras toman aspirina y para los que estén en fibrilación auricular y tengan más de 65 años, regurgitación mitral, hipertensión arterial o insuficiencia cardíaca 191 (tabla 21). Para los que tienen menos de 65 años y ninguna de las enfermedades citadas, basta con la aspirina, que también se recomienda en los enfermos con rasgos ecocardiográficos de alto riesgo (valvas con espesor > 5 mm).
La mayoría de los pacientes con PVM, especialmente los asintomáticos, pueden realizar una vida normal 167,169. Se debe restringir el deporte cuando hay un moderado crecimiento ventricular o disfunción del mismo, arritmias no controladas, intervalo Q-T prolongado, síncopes inexplicables, muerte súbita recuperada o raíz aórtica elongada 169. El embarazo no está contraindicado salvo en circunstancia excepcionales.
Los pacientes asintomáticos y sin regurgitación significativa deben ser evaluados clínicamente cada 3 o 5 años. No es necesario el seguimiento ecocardiográfico seriado, salvo en los pacientes con características ecocardiográficas de alto riesgo en la exploración inicial, que deben ser revisados anualmente. Se recomienda también repetir la ecografía en los que presentan cambios sintomáticos y/o auscultatorios sugestivos de regurgitación mitral progresiva. Los pacientes con datos de alto riesgo, incluidos los que tienen una IM moderada o severa, deben ser revisados anualmente.
Los enfermos que desarrollan regurgitación severa pueden precisar un cateterismo cardíaco si se planea intervención quirúrgica, con los mismos criterios que en los pacientes con otros tipos de IM; lo mismo sucede con la coronariografía. Ambas cuestiones serán consideradas en el próximo apartado.
Consideraciones quirúrgicas
Los pacientes con PVM pueden precisar cirugía en algún momento de su evolución si se desarrolla regurgitación severa por los cambios degenerativos o por la rotura de las cuerdas tendinosas 192. Estas válvulas, en manos experimentadas, son especialmente susceptibles de reparación, sobre todo si el velo posterior es el predominantemente afectado. Las indicaciones quirúrgicas, por lo general, son las mismas que en otras regurgitaciones mitrales de etiología no isquémica y serán revisadas en el próximo apartado.
INSUFICIENCIA MITRAL
Etiología
Cualquier anomalía de la anatomía o función del aparato mitral puede dar lugar a regurgitación, de tal forma que cuando ésta existe podemos aceptar que hay disfunción de uno o más de sus componentes: valvas, cuerdas tendinosas, anillo, músculos papilares o miocardio adyacente 168. Aunque en algunas series quirúrgicas antiguas la etiología reumática era la más frecuente, la degeneración mixomatosa se ha convertido en la causa más común (45%) en el mundo occidental, seguida de la reumática (40%), isquémica (10%), endocarditis (3%) y otras (2%). Como hemos comentado previamente, la válvula redundante o mixomatosa forma parte integral del síndrome de Barlow. En este caso, sin embargo, tratamos de un problema valvular aislado, sin ningún otro de los rasgos del síndrome. La debilidad estructural que presentan estas válvulas mixomatosas también afecta a las cuerdas, facilitando su rotura y, en consecuencia, dando lugar a IM aguda. La causa más común de IM isquémica es la disfunción del músculo papilar, aunque también pueden estar involucrados otros mecanismos, como la dilatación anular secundaria a disfunción ventricular, o la rotura del cuerpo o una de las cabezas del músculo papilar. La endocarditis infecciosa, tanto en fase aguda como una vez inactivada desde el punto de vista bacteriológico, puede dar lugar a regurgitación, ya sea por perforación de las valvas, por las vegetaciones que impiden un cierre adecuado, por la retracción de los velos en el proceso de cicatrización o por la rotura de cuerdas tendinosas 193. La calcificación del anillo mitral, la miocardiopatía hipertrófica, las enfermedades del colágeno, los traumatismos y afecciones congénitas como los defectos atrioventriculares, la hendidura mitral o la comunicación interauricular son otras causas bien conocidas de IM 194.
Insuficiencia mitral aguda
Fisiopatología
En la IM aguda, el flujo regurgitante se dirige a una aurícula izquierda poco preparada para hacer frente a este incremento súbito del volumen. En consecuencia, se produce un rápido aumento de la presión, que se transmite de forma retrógrada al capilar pulmonar, dando lugar a congestión severa; si las presiones pulmonares son suficientemente elevadas, aparecen signos de fracaso del ventrículo derecho. Como la aurícula presenta una baja impedancia con respecto al circuito sistémico, se produce una reducción de la postcarga ventricular, con disminución de la tensión parietal, incremento del acortamiento y mejora de los parámetros de eyección ventricular como la fracción de eyección y el volumen por latido. Debido al aumento del flujo durante la diástole, se incrementa el volumen telediástolico y, por ende (ley de Frank-Starling), el volumen de eyección, buena parte del cual es regurgitante. Así pues, si no está comprometida la función del ventrículo por una causa subyacente, como isquemia miocárdica o infarto, existe de hecho una mejoría en la eficiencia del bombeo, acentuada por el estado hiper-adrenérgico existente. Aun así, estos mecanismos de compensación son insuficientes y, en los casos graves, hay mala tolerancia hemodinámica, con una mezcla de congestión pulmonar severa e hipoperfusión periférica 195.
Diagnóstico
El cuadro clínico es de insuficiencia cardíaca aguda en un escenario que difiere según el agente etiológico. La semiología de IM puede ser muy pobre, con una palpación precordial anodina y un soplo no muy llamativo, lo que contrasta con los signos radiológicos de congestión pulmonar. El ECG suele demostrar ritmo sinusal, pudiendo haber signos específicos de la etiología subyacente, como puede ser un infarto de miocardio. De todas formas, lo que más valor tiene es la sospecha diagnóstica, tras de la cual se debe llevar a cabo un estudio ecocardiográfico urgente. El Doppler color nos proporciona rápidamente el diagnóstico, pero es obligado realizar un estudio detallado (véase más adelante) que permita cuantificar la severidad de la regurgitación, ponga de manifiesto la morfología valvular e ilustre sobre la función del ventrículo izquierdo 196. Si hay una sospecha fundada de enfermedad coronaria, se debe realizar una coronariografía previa a la reparación quirúrgica; en otro caso, se puede prescindir del estudio hemodinámico.
Tratamiento médico
Disminuir la congestión pulmonar e incrementar el gasto cardíaco deben ser los objetivos del tratamiento médico. La utilización de nitroprusiato o nitratos por vía intravenosa es la norma en los pacientes con la presión arterial normal, añadiendo inotropos (dobutamina) cuando existe hipotensión o bajo gasto; se puede precisar, incluso, la implantación de un sistema de contrapulsación aórtica como puente a la cirugía. El tratamiento antibiótico enérgico es imprescindible cuando la endocarditis infecciosa está detrás de la regurgitación.
Insuficiencia mitral crónica
Fisiopatología
En la IM crónica, la fracción regurgitante del volumen por latido determina el grado de crecimiento de la aurícula y el ventrículo izquierdos. La dilatación ventricular se acompaña de un aumento del grosor de la pared y de hipertrofia, que ayudan a mantener la función mecánica (hipertrofia excéntrica compensadora). También la aurícula se adapta al volumen regurgitante, dilatándose y aumentando su distensibilidad, lo que le permite tolerar un incremento del volumen sin apenas aumento de la presión; por esta razón, en esta fase inicial apenas hay síntomas de congestión pulmonar. La IM proporciona una vía de baja impedancia para la eyección ventricular izquierda; esto hace que disminuya su volumen telesistólico y el estrés parietal, manteniéndose los índices de función sistólica dentro de la normalidad o incluso algo aumentados. Esta normalidad de los índices eyectivos puede enmascarar la incipiente disfunción sistólica. Sin embargo, tras unos años de sobrecarga, los mecanismos compensatorios se agotan y, con el incremento de la disfunción contráctil, aumenta el volumen telesistólico y suben las presiones de llenado; como consecuencia, aumenta la congestión pulmonar y aparece disnea, pese a que la fracción de eyección se mantenga en cifras aceptables.
Diagnóstico
Una anamnesis cuidadosa permite establecer el comienzo de la disnea y la fatigabilidad en una enfermedad que, por otra parte, puede permanecer asintomática durante años. La palpación pone de manifiesto un latido apexiano hipercinético, desplazado hacia abajo y la izquierda. La auscultación se caracteriza por un soplo holosistólico, irradiado a axila, que con frecuencia va acompañado de un tercer ruido. La radiografía de tórax demuestra signos de dilatacion variable de las cavidades izquierdas y congestión pulmonar en los estadios más avanzados. En el ECG se aprecia un crecimiento auricular izquierdo e hipertrofia ventricular izquierda; con la evolución, la aparición de fibrilación auricular es la norma.
El ecocardiograma es una herramienta insustituible para la valoración de la enfermedad (tabla 22); no sólo confirma el diagnóstico sino que, además, es capaz casi siempre de determinar la etiología, cuantificar el grado de severidad y obtener los parámetros utilizados en el seguimiento del estado de la función ventricular 196. En la mayoría de los pacientes se pueden calcular el volumen y el orificio de regurgitación, método más sensible para determinar la severidad de la afección que el clásico cálculo del área del jet de regurgitación 197-199. De todas formas, recientemente se ha sugerido que para la graduación de la severidad es mejor calcular un índice compuesto por varios parámetros (penetración del chorro de regurgitación, área de la superficie proximal de isovelocidad, el carácter y la intensidad del registro espectral de Doppler continuo, la presión arterial pulmonar, el patrón de flujo en las venas pulmonares y el tamaño de la aurícula izquierda), que utilizar uno aislado 200. Como siempre que nos referimos a los ultrasonidos, la ventana transesofágica puede ser necesaria si la convencional no es óptima (tabla 23).
Seguimiento periódico
Los síntomas y el deterioro de la función ventricular son los principales marcadores desfavorables de la IM crónica. En consecuencia, la historia clínica, el examen físico y la ecocardiografía son los pilares de la evaluación periódica. Los pacientes asintomáticos, con regurgitación leve y ausencia de dilatación ventricular, disfunción sistólica o hipertensión arterial pulmonar, deben ser evaluados cada año. No es necesaria la realización de un ecocardiograma en todas las visitas, sino sólo cada dos o tres años, salvo que exista sospecha clínica de agravamiento de la regurgitación. Cuando la lesión es moderada se recomienda un estudio ecocardiográfico anual. En pacientes con anamnesis equívoca, la prueba de esfuerzo puede ayudar a establecer la capacidad funcional 3.
Si la regurgitación es severa, el seguimiento debe ser más estrecho, recomendándose realizar una evaluación clínica y un ecocardiograma cada seis meses. El déficit de la función sistólica (FE <= 60%) y la dilatación sistólica ventricular (diámetro telesistólico > 45 mm) son marcadores de un pobre pronóstico postoperatorio; estas cifras, pues, serán el objetivo a vigilar en los estudios ecocardiográficos seriados 201. En la figura 6 se presenta un algoritmo de actuación en los pacientes con IM crónica.
Fig. 6. Algoritmo de actuación en la insuficiencia mitral crónica severa, basado en el grado funcional, la función ventricular izquierda, la posible presencia de fibrilación auricular (FA) y/o hipertensión arterial pulmonar (HAP), la probabilidad de que la válvula mitral (VM) pueda ser reparada y el nivel de depresión de la fracción de eyección (FE) en los casos con grado funcional avanzado.
Actividad física
Las recomendaciones sobre el ejercicio físico exigen lógicamente una evaluación previa de la severidad de la lesión y de su repercusión sobre el tamaño y la función del ventrículo. El efecto del ejercicio sobre la IM se ha estudiado en un número limitado de pacientes; en general, estos estudios demuestran que el ejercicio apenas produce cambios: disminuye algo la fracción de regurgitación y se reduce ligeramente la fracción de eyección, salvo en los jóvenes asintomáticos 32. El ejercicio isométrico puede aumentar la regurgitación por el incremento de la presión arterial. También sabemos que si el ejercicio es crónico y excesivo, la sobrecarga de volumen continuada acabará produciendo un disminución de la contractilidad miocárdica, por lo que parece prudente restringir la actividad física de este tipo a pacientes con IM significativa y algún grado de dilatación ventricular. En el otro lado del espectro, los enfermos asintomáticos con ventrículo normal, en tamaño y función, pueden realizar cualquier tipo de deporte 32.
Tratamiento médico
Aunque de forma intuitiva el uso de vasodilatadores parecería útil en el tratamiento médico de la IM crónica de pacientes asintómaticos, lo cierto es que no hay ensayos clínicos que avalen esta terapia. Recordemos, por otra parte, que la poscarga es normal si la función ventricular está conservada; por ello, el uso de estos fármacos se limita al tratamiento de una eventual hipertensión arterial acompañante.
Si existe fibrilación auricular se deberá considerar el uso de los digitales, los antagonistas del calcio, tipo diltiazen o verapamilo, o los betabloqueadores con el fin de controlar la frecuencia ventricular. Es recomendable la anticoagulación crónica en los pacientes con fibrilación crónica o paroxística y en los que, aun conservando el ritmo sinusal, tienen una gran aurícula izquierda (> 55 mm por eco) o antecedentes embólicos 149. La IM reumática precisa profilaxis para las recidivas de fiebre reumática y todos los pacientes con IM crónica requieren un régimen apropiado de profilaxis antibiótica para todas las intervenciones o procedimientos con riesgo de bacteriemia 202,203. Si aparecen síntomas congestivos, la cirugía debe ser el tratamiento de elección pero, en caso de retraso o contraindicación, el uso de nitratos y diuréticos puede aliviar la sintomatología.
Indicaciones de cateterismo
La IM es la valvulopatía que más discrepancias presenta en la evaluación de la severidad cuando se comparan los métodos incruentos y la hemodinámica. Como quiera que el «patrón oro» de la regurgitación mitral es la ventriculografía con contraste, ésta deberá realizarse siempre que la cuantificación exacta de la regurgitación se considere crucial para decidir la cirugía (tabla 24); es decir, si el eco-Doppler demuestra severidad pero el resto de los hallazgos no son concordantes o, por el contrario, cuando la severidad ecocardiográfica es sólo moderada pero existen otros argumentos clínicos que abogan por la intervención 105. Además, la información obtenida en el curso del estudio hemodinámico, como la fracción de eyección, la dilatación ventricular o las presiones del círculo menor, proporciona datos muy sólidos para sentar la recomendación de cirugía.
La indicación de coronariografía (tabla 25) en los pacientes que van a ser intervenidos depende de la probabilidad de presentar enfermedad coronaria. En los pacientes jóvenes sin factores de riesgo es lógico evitar el estudio coronariográfico; en aquellos con cardiopatía isquémica conocida es imprescindible para conocer la severidad y extensión de las lesiones coronarias con vistas a una eventual revascularización. Entre estos dos extremos, parece prudente aconsejar la realización de coronariografía a todos los pacientes con una edad superior a los 60 años y a los que tengan dos o más factores de riesgo cardiovascular. En el apartado correspondiente a las relaciones entre enfermedades valvulares y enfermedad coronaria se desarrollan más ampliamente estos conceptos.
Indicaciones quirúrgicas
En la actualidad, la cirugía de la IM mitral se puede realizar de tres formas diferentes: reparación valvular, sustitución valvular con preservación total o parcial del aparato mitral y sustitución valvular con resección completa del aparato mitral 204-206. La cirugía reparadora evita, siempre que el paciente esté en ritmo sinusal, el riesgo de la anticoagulación crónica y los problemas inherentes a las válvulas artificiales. Además, al preservar toda la arquitectura mitral asegura una mejor función ventricular postoperatoria, que se traduce en una mayor supervivencia 207-209. Requiere, sin embargo, mayor destreza y experiencia quirúrgicas y no descarta la disfunción valvular postoperatoria. La sustitución valvular, sin resección del aparato mitral, tiene la ventaja de que asegura la competencia valvular, preserva la función ventricular y mejora la supervivencia cuando se compara con el recambio valvular con resección. De hecho, esta última técnica sólo se debe emplear cuando está afectado seriamente todo el aparato valvular, como sucede en algunas valvulopatías reumáticas. Aunque el recambio valvular es más sencillo para el cirujano, el inconveniente de la anticoagulación en las prótesis mecánicas y la degeneración progresiva en las biológicas son limitaciones conocidas de este procedimiento 207-209.
Indicación quirúrgica en pacientes sintomáticos con función ventricular izquierda normal
Los pacientes en grado funcional II a IV de la NYHA y con función ventricular conservada (FE > 60% y diámetro telesistólico < 45 mm) deben ser intervenidos, sobre todo si se les puede realizar una reparación valvular, ya que mejoran los síntomas, se preserva la función ventricular y se evitan los inconvenientes de las prótesis (tabla 26). Si la anatomía de la válvula o la experiencia del grupo quirúrgico no permiten llevar a cabo una reparación se debe realizar una sustitución valvular con mantenimiento del aparato subvalvular 210.
Indicación quirúrgica en pacientes con disfunción ventricular izquierda, asintomáticos o sintomáticos
El conocimiento de la historia natural de la enfermedad nos ha enseñado que la presencia de síntomas incapacitantes, el grado de disfunción ventricular, la etiología de la regurgitación y la técnica quirúrgica realizada son predictores importantes del pronóstico tras la intervención. Se admite que siempre que exista disfunción sistólica (FE < 60% y DTSVI > 45 mm) los pacientes deben ser intervenidos aunque estén asintomáticos. En los enfermos sintomáticos, el resultado de la operación es peor que en los asintomáticos; no obstante, se recomienda la intervención quirúrgica siempre que la fracción de eyección sea superior al 30%, especialmente si se puede realizar cirugía de reparación mitral 211.
Indicación quirúrgica en pacientes asintomáticos con función ventricular izquierda normal
Como se ha señalado recientemente 212, existen argumentos que aconsejan realizar la cirugía antes de que aparezcan síntomas o se deteriore la función ventricular. La disfunción ventricular progresa de forma silente, y a veces impredecible, a pesar de un seguimiento adecuado; por otra parte, los pacientes con síntomas severos presentan mayor mortalidad y sintomatología tras la intervención. Los pacientes con IM severa, tratados médicamente, incluso oligosintomáticos, presentan un significativa morbimortalidad. Frente a todos estos problemas, la cirugía reparadora ofrece una mortalidad muy baja y unos excelentes resultados en el seguimiento. En consecuencia, existe una corriente de opinión creciente que recomienda la cirugía reparadora precoz, siempre que se haga en centros experimentados y con resultados contrastados (mortalidad < 1%). Así, pacientes con IM severa reciente, habitualmente por rotura de cuerdas, aunque sea bien tolerada, aquellos con un episodio inaugural de fibrilación auricular, o incluso los que estando estrictamente asintomáticos tienen documentada una regurgitación severa, pueden ser operados en el marco técnico antes descrito.
Fibrilación auricular
Esta arritmia se presenta en cerca del 75% de los pacientes con IM significativa y se ha demostrado su asociación con una disminución de la supervivencia tras la cirugía. Su persistencia tras la operación obliga a prescribir anticoagulantes de forma crónica, con lo que desaparece uno de los principales beneficios de la cirugía reparadora. Una duración de la arritmia >= 1 año y un tamaño auricular >= 50 mm son predictores de persistencia de la fibrilación auricular tras la cirugía. Por eso parece razonable, como comentábamos con anterioridad, recomendar la operación en pacientes con IM severa que desarrollan fibrilación auricular ya que, además, la mayoría de ellos presentan cierto grado de limitación funcional 3.
Reparación frente a sustitución valvular
Aunque en sentido estricto la posibilidad de llevar a cabo una cirugía de reparación mitral, en lugar de recambio valvular, depende casi exclusivamente de la morfología de la lesión valvular, lo cierto es que, en la práctica, tan importante como esta última es la infraestructura quirúrgica. Ésta incluye no sólo la destreza y experiencia del cirujano, sino también otros factores, como la realización de un número suficiente de intervenciones que aseguren la curva de aprendizaje o la posibilidad de llevar a cabo un eco transesofágico intraoperatorio. La experiencia acumulada en los últimos años nos ha permitido aprender que la cirugía reparadora es más factible en los casos con prolapso del velo posterior y en la rotura de cuerdas destinadas al mismo que cuando la afectación es del velo anterior. Las posibilidades de reparación descienden aún más cuando la afectación valvular es de origen reumático o isquémico, o cuando la calcificación del anillo mitral es la enfermedad subyacente.
Insuficiencia mitral de origen isquémico
La IM asociada a la cardiopatía isquémica es de naturaleza diversa. Puede ser transitoria, como la que acompaña a un episodio fugaz de isquemia miocárdica, o permanente, aguda o crónica, de cuantía muy variable, cambiante en el tiempo según las condiciones de carga, el estado de la función ventricular y la intensidad de la isquemia miocárdica y, por último, reversible o irreversible aunque se haya logrado la reperfusión de la arteria responsable de la regurgitación. Todos estos factores deberían ser tenidos en cuenta a la hora de evaluar una posible indicación quirúrgica.
El mecanismo de regurgitación más frecuente es la disfunción del músculo papilar por isquemia o fibrosis, combinada generalmente con anomalía contráctil de la zona parietal adyacente y/o dilatación del ánulo mitral, en especial si coexiste aneurisma ventricular o disfunción ventricular generalizada. La regurgitación no suele ser muy severa, pero en ocasiones contribuye de manera fundamental al cuadro de insuficiencia cardíaca. En ese caso conviene distinguir dos eventualidades: a) el infarto causante es antiguo y presumiblemente hay fibrosis cicatrizal, y b) el infarto es reciente y puede haber viabilidad miocárdica. En el primer caso la intervención quirúrgica, si la regurgitación es grave, constituye la única opción. Tradicionalmente, la mortalidad quirúrgica de esta condición ha sido muy elevada 213 pero con la reciente introducción de métodos reparadores 214 o la sustitución con preservación cordal 215 se comunican resultados más esperanzadores.
La regurgitación severa por disfunción papilar que aparece en el infarto agudo tiene un grave pronóstico. Para algunos autores 216, la cirugía no mejora el pronóstico y la reperfusión tampoco parece que restaure la competencia valvular. Para otros puede haber una oportunidad de que la angioplastia del vaso causante mejore la función del músculo papilar, restaure la competencia valvular y saque al paciente del grave trance 217,218. Cuando la regurgitación es secundaria a la dilatación del ánulo, como sucede en la miocardiopatía isquémica, no está indicada, obviamente, la cirugía mitral aunque sí pudiera estarlo la revascularización si hubiese evidencia de viabilidad miocárdica.
Cuando existe daño estructural por rotura de músculo papilar, la indicación quirúrgica es clara puesto que, aunque la mortalidad operatoria siga siendo elevada, es la única forma de rescatar al paciente de una situación dramática; además, los resultados a medio plazo suelen ser excelentes, ya que con frecuencia el infarto causante es limitado 219. La ecocardiografía es una herramienta fundamental para establecer el mecanismo de la regurgitación mitral en los pacientes isquémicos 220 y debe servir de guía para el establecimiento de una estrategia terapéutica racional. La distinción entre daño estructural y daño funcional es esencial, entre otras razones porque los resultados de la cirugía, sea cual sea la técnica operatoria (reemplazo frente a reparación valvular) son mucho mejores en los casos con daño estructural 221. Los pacientes con disfunción del músculo papilar suelen presentar un movimiento restringido de la valva afecta, con desplazamiento apical de la línea de coaptación y chorro de regurgitación central o ligeramente posterior; estos enfermos tienen una elevada mortalidad quirúrgica y mal pronóstico a largo plazo y, si la regurgitación mitral ocurre en el seno de un episodio isquémico agudo, debería intentarse una angioplastia del vaso causante. Los que tienen rotura de la cabeza de un músculo papilar presentan un movimiento exagerado, con prolapso, valva suelta e incluso material valvular y subvalvular dentro de la aurícula izquierda durante la sístole; el chorro de regurgitación suele ir en dirección opuesta al de la valva afectada; estos enfermos necesitan cirugía y el pronóstico tardío suele ser bueno. Si la distinción entre daño funcional y estructural no es posible mediante eco transtorácico se debe recurrir sin dilación a uno transesofágico para dilucidar con exactitud el mecanismo de la regurgitación que guíe la estrategia terapéutica. En la figura 7 se presenta un algoritmo de actuación frente a este problema de la IM severa postinfarto.
Fig. 7. Algoritmo de actuación en la insuficiencia mitral severa postinfarto, basado en la presencia o ausencia de daño estructural y la posibilidad de realizar angioplastia (ACTP); en el último supuesto, si el vaso responsable de la disfunción papilar es accesible al procedimiento. ETE: eco transesofágico; ETT: eco transtorácico. Resto de leyendas como en la figura 2.
En general, la cirugía mitral en la cardiopatía isquémica tiene una elevada morbimortalidad, casi prohibitiva en los casos con fracción de eyección muy deprimida. En estas circunstancias, la operación debe ser contemplada únicamente si la regurgitación es severa y la reparación mitral va a ser acompañada de una revascularización miocárdica amplia, con la esperanza fundada de mejorar la función ventricular global 160,193,195.
El problema especial de los ancianos
La calcificación del anillo mitral (CAM) es un proceso degenerativo que aparece con frecuencia en los ancianos, más frecuentemente del sexo femenino. En un estudio de 553 pacientes octogenarios, la frecuencia de CAM alcanzó el 59% 219. Es preciso que la calcificación sea al menos moderada para que se produzca una IM significativa. El mecanismo de la regurgitación se debe a la imposibilidad de disminuir el diámetro anular durante la sístole y/o a la extensión de la calcificación a la valva anterior, lo que produce una distorsión y falta de coaptación del velo posterior. En la CAM grave es común la fibrilación auricular y otras anomalías asociadas, como la EA o los trastornos de conducción 220.
La IM crónica severa por degeneración mixoide es una patología relativamente frecuente en los pacientes de edad avanzada; por ejemplo, en una serie quirúrgica de esta enfermedad, el 40% de los enfermos tenían más de 75 años 221. La presentación clínica suele ser como la de los pacientes jóvenes: un cuadro de edema pulmonar en relación con rotura de cuerdas, o clínica de progresión lenta con disfunción ventricular progresiva. El manejo es similar al convencional: cirugía expeditiva en la IM aguda y reparación en la IM crónica severa, sintomática u oligosintomática, en la que los resultados son muy aceptables en lo que respecta a mortalidad operatoria y pronóstico tardío 161.
En este grupo de edad también es común la IM de origen isquémico, ya que la prevalencia de infarto de miocardio es alta. Como se ha comentado previamente, la IM no debida a rotura de alguna estructura tiene un pronóstico sombrío y un manejo quirúrgico difícil. Otro tipo de regurgitaciones que pueden aparecer en la edad tardía son las secundarias a endocarditis infecciosa, ya que hasta una cuarta parte de los enfermos con endocarditis, especialmente en lo que se refiere a infecciones nosocomiales, tienen más de 60 años 222.
Seguimiento de los pacientes operados
La cirugía de la IM crónica se acompaña de una mejoría clínica, la reducción de la dilatación ventricular y la regresión de la hipertrofia. Sin embargo, un número importante de pacientes presentan en el postoperatorio una disminución de la fracción de eyección debido al aumento de la poscarga, que condiciona la reparación valvular al ser eliminada la vía de baja resistencia. A esto puede ir asociado un daño miocárdico intrínseco al acto quirúrgico. La reducción de la fracción de eyección es más acentuada cuanto menor fuere la cifra preoperatoria. Así, los enfermos con fracción de eyección superior al 60% apenas presentan variaciones; por el contrario, aquellos con fracción de eyección preoperatoria inferior al 50% tendrán disfunción sistólica significativa en una tasa que oscila entre el 50 y el 75% 223.
Por tanto, en la revisión, además de una evaluación clínica, radiológica y electrocardiográfica, se precisa un estudio ecocardiográfico que permita definir el tamaño y la función del ventrículo izquierdo, además de evaluar el resultado de la reparación mitral o, en su caso, del funcionamiento del sustituto valvular. El primer control debe hacerse antes del alta del paciente o, en su defecto, a las pocas semanas de la intervención. En los enfermos con disfunción ventricular se debe repetir el ecocardiograma transcurridas unas 6-12 semanas de la intervención, con el fin de optimizar la terapia farmacológica según el curso de la disfunción. En general se considera que, pasados 6 meses de la cirugía, es excepcional una mejoría de la función sistólica. A partir de entonces, el seguimiento se individualizará según el estado clínico de los pacientes, la existencia de regurgitación residual, el nivel de la función ventricular y el tipo de cirugía realizada 152.
VALVULOPATÍAS TRICUSPÍDEAS
Etioanatomía
La insuficiencia tricuspídea (IT) se presenta muchas veces sobre una válvula que no tiene afectación anatómica. Esto ocurre en situaciones en las que la presión sistólica y/o diastólica del ventrículo derecho están elevadas 227-229. Como consecuencia, se dilatan las cavidades derechas y el anillo tricuspídeo, que va perdiendo de forma progresiva su función esfinteriana. Ejemplos de hipertensión sistólica del ventrículo derecho son la estenosis mitral, la estenosis de la válvula pulmonar y todas las múltiples causas de hipertensión arterial pulmonar. La hipertensión diastólica se desarrolla en cualquier enfermedad que afecte al funcionamiento del ventrículo izquierdo y que, finalmente, conduzca a fallo del derecho, por ejemplo, por citar sólo causas muy comunes, la miocardiopatía dilatada y la disfunción ventricular isquémica. Incluso el síndrome de alto gasto cardíaco que genera el hipertiroidismo puede expresarse con una semiología predominante de IT 230.
Las alteraciones anatómicas de la válvula tricúspide que conducen a la IT pueden ser de etiología muy variada 227-229: reumática, endocarditis infecciosa, síndrome carcinoide 231, artritis reumatoide, posradiación, traumatismo directo sobre la válvula, uso de fármacos anorexígenos, síndrome de Marfan, prolapso de la válvula, disfunción isquémica de los músculos papilares y enfermedades congénitas, como el síndrome de Ebstein o la válvula hendida como parte de una malformación del canal AV.
La estenosis tricuspídea (ET) es habitualmente de origen reumático 227,228. Las vegetaciones voluminosas, así como las masas en la aurícula derecha, pueden producir obstrucción tricuspídea. Otras causas raras son las anomalías congénitas, el síndrome carcinoide, las enfermedades de Fabry y de Wipple y la terapia con metisergida.
Diagnóstico
La ET puede ser sospechada por la presencia de una onda a gigante y la ralentización del descenso y en el pulso yugular. En la auscultación se puede apreciar un chasquido de apertura tricuspídea y un retumbo de llenado, con acentuación del componente presistólico si el paciente conserva el ritmo sinusal 232. Una característica fundamental, que se puede perder con la insuficiencia cardíaca avanzada, es que la semiología acústica aumenta en los primeros ciclos que siguen a la inspiración (signo de Rivero-Carballo). Como la causa más común de ET es la fiebre reumática, suele existir semiología asociada correspondiente a afectación de la válvula mitral y/o aórtica.
La IT se puede sospechar por la aparición de una onda v prominente en el pulso yugular y la audición de un soplo regurgitante, de aumento inspiratorio, en la parte baja de la región paraesternal izquierda. Si la regurgitación es severa se produce un soplo de llenado y expansión sistólica hepática, que no debe confundirse con el latido de la aorta abdominal. En casos extremos se puede apreciar un seudoexoftalmos 233, pulsatilidad de venas varicosas 234, o danza en el cuello producida por una gran onda v, que no debe ser confundida con la danza carotídea de la IA. Si existe dilatación marcada del ventrículo derecho, el soplo de IT se hace apexiano y puede ser tomado como correspondiente a IM. Otra característica de la IT es que muchas veces aún no es fija e irreversible y su severidad varía considerablemente con las condiciones de pre y poscarga del ventrículo derecho.
El eco-Doppler valora de forma exquisita la estructura y el funcionalismo de la válvula tricúspide. Tan es así que puede detectar regurgitaciones triviales sin significación patológica 235. En los casos patológicos es necesario estimar la severidad de la IT 236, precisar si existe gradiente diastólico, medir el tamaño del anillo, apreciar la textura de los velos valvulares, la repercusión anatómica y funcional sobre las cavidades derechas y estimar el valor de la presión pulmonar 237.
Una idea muy difundida es que ante presiones sistólicas pulmonares >= 55 mmHg, la IT es de carácter funcional, es decir, sin afectación anatómica de la válvula. Por el contrario, presiones sistólicas pulmonares < 40 mmHg indicarían una anormalidad estructural del aparato valvular tricuspídeo. Este concepto tiene muchas salvedades y probablemente sea mejor estimar el carácter fijo o reversible de la IT en diferentes condiciones de carga y compensación cardíacas, así como utilizar la medida combinada de la presión arterial pulmonar sistólica, el área de los velos y la circunferencia del anillo tricuspídeo 228.
Manejo y tratamiento quirúrgico
La estrategia terapéutica viene determinada por el estado clínico del paciente y la etiología de la lesión valvular tricuspídea. Por ejemplo, si lo que tiene el enfermo es una EM severa con hipertensión pulmonar y dilatación ventricular derecha, cabe esperar una reducción sustancial del grado de IT tras la apertura de la válvula mitral y la consiguiente disminución de las presiones pulmonares 238,239. Hay, no obstante, la posibilidad de que la regurgitación haya adquirido un carácter irreversible al tiempo de la apertura mitral y que el resultado a largo plazo del procedimiento quede empañado por la presencia de IT residual importante 240.
Si se elige la cirugía como opción terapéutica para el tratamiento de la valvulopatía mitral o mitroaórtica acompañante, durante mucho tiempo ha existido la duda de si realizar anuloplastia sistemática de la válvula, ante cualquier grado de IT, o reservar el procedimiento para regurgitaciones más severas 241,242. Hasta cierto punto, esta controversia está desapareciendo desde la aplicación intraoperatoria del eco transesofágico, que permite precisar el grado de IT, una vez corregida la valvulopatía mitral, y valorar la eficacia de la anuloplastia tricuspídea 243. La reconstrucción de las cuerdas tendinosas puede ser intentada en algún caso en que se encuentren rotas por endocarditis infecciosa o por traumatismo torácico.
La valvulopastia con balón ha sido empleada para tratar la ET 244. Sin embargo está en desuso porque genera IT importante. La comisurotomía, seguida de anuloplastia, puede ser efectiva; sin embargo, cuando la válvula está muy afectada se hace necesaria su sustitución por una bioprótesis o por una válvula mecánica de bajo perfil 245. El reemplazo valvular tricuspídeo es una intervención con una elevada mortalidad (cerca del 40%), hecho atribuible a la mala situación clíni-ca de estos pacientes 245a. En general es preferible el uso de prótesis biológicas debido a la elevada tasa de complicaciones trombóticas de las prótesis mecánicas en posición tricuspídea 246. En los pacientes con defectos de la conducción asociados se recomienda la colocación de un electrodo epicárdico permanente, al tiempo de la cirugía, para evitar que con posterioridad nos veamos obligados a tener que pasar un cable transvenoso a través de la prótesis valvular.
POLIVALVULOPATÍAS
Introducción
Debido a las múltiples combinaciones que se pueden producir, tanto en lo que se refiere a la afectación anatómica de las diferentes válvulas como a la severidad hemodinámica que producen, es difícil establecer una guías específicas en este apartado. Cada caso debe ser evaluado individualmente y su manejo estará basado en el conocimiento del deterioro hemodinámico, la función del ventrículo izquierdo y el beneficio que se obtendría con el tratamiento médico y/o quirúrgico.
Lesión combinada de una válvula
Fisiopatología
Tanto en la doble lesión valvular aórtica como en la mitral, la fisiopatología dependerá de la lesión dominante. Por ejemplo, en el paciente con doble lesión aórtica con estenosis predominante, la fisiopatología y el manejo será similar al de una estenosis pura; sin embargo, si el componente regurgitante es más que ligero, se acelera la presentación de síntomas, ya que el aumento del volumen de llenado opera sobre un ventrículo hipertrófico con distensibilidad disminuida. En consecuencia, se elevarán con mayor facilidad las presiones de llenado, facilitando la aparición de congestión pulmonar. Puede ocurrir, pues, que aunque el grado de estenosis no sea lo suficientemente importante como para justificar una intervención quirúrgica, la adición de regurgitación produzca un compromiso hemodinámico que la aconseje. Hay que recordar, por otra parte, que una EA leve, combinada con IA severa, puede tener un gradiente transvalvular alto que refleje un volumen por latido elevado, más que una auténtica estenosis orificial 247.
En la doble lesión mitral con predominio de estenosis hay un volumen ventricular izquierdo normal. Si, por el contrario, predomina la regurgitación, se produce dilatación ventricular izquierda. Cuando predomina la insuficiencia sobre la estenosis, el gradiente, debido al alto flujo transvalvular, magnifica la severidad del componente estenótico.
Diagnóstico ecocardiográfico
La geometría de las cámaras cardíacas es importante para establecer la lesión dominante en las polivalvulopatías (estenosis frente a insuficiencia). Por ejemplo, un ventrículo izquierdo poco dilatado descarta una IA severa. El estudio mediante Doppler de las dobles lesiones debería proporcionar una estimación fidedigna del gradiente medio transvalvular; sin embargo, pueden existir discrepancias significativas entre el gradiente máximo encontrado en el Doppler y el gradiente pico hemodinámico. El área de la válvula mitral puede ser medida con precisión, usando el tiempo de hemipresión en la doble lesión mitral. La medición del área valvular aórtica mediante la determinación del gasto cardíaco por el método de Fick o termodilución puede ser errónea en presencia de regurgitación. El cálculo del área con eco-Doppler, utilizando la ecuación de continuidad, puede también estar afectado por el hiperaflujo orificial 248, aunque en menor grado que con la hemodinámica. En todo caso, la naturaleza compleja de las dobles lesiones valvulares hace que en ocasiones sea necesario un estudio hemodinámico adicional.
Cateterismo cardíaco
El cateterismo se emplea siempre que existe discordancia entre los datos clínicos y los obtenidos por las exploraciones no invasivas. Una eventualidad relativamente frecuente es que la doble lesión tenga apariencia de moderada en situación de reposo y que, sin embargo, se induzcan alteraciones hemodinámicas severas con el ejercicio 249. Esto es debido a que la lesión no dominante exacerba durante el estrés la fisiopatología de la dominante. Por ejemplo, una doble lesión mitral puede presentar en reposo un gradiente transvalvular de 5 mmHg, un área de 1,5 cm 2 y una regurgitación de grado 2/4, con una presión capilar pulmonar media de 15 mmHg. El ejercicio, sin embargo, puede provocar un incremento espectacular de la presión capilar pulmonar, que explica los síntomas del paciente y sugiere la necesidad de intervención quirúrgica.
La estimación del área valvular requiere la determinación del flujo total y el gradiente transvalvular. La adición de regurgitación a una lesión predominantemente estenótica hace que la determinación del gasto cardíaco por los métodos tradicionales subestime el flujo valvular total, compuesto del anterógrado (el medido por Fick o termodilución) más el regurgitante. Para obviar esta limitación se podría calcular el flujo diastólico derivado de los volúmenes ventriculares angiográficos 250, pero este método no se ha impuesto en la práctica. El cateterismo, pues, se emplea sobre todo para estudiar los cambios de presiones que induce el ejercicio, o cualquier otro tipo de estrés, en los pacientes de decisión difícil.
Manejo
No es posible establecer unos criterios rígidos para el tratamiento de las dobles lesiones sobre válvula única. En general, los criterios son los mismos que para las lesiones puras, dependiendo del factor predominante. En consecuencia, nos remitimos a los desarrollados en cada uno de los diferentes apartados.
Estenosis mitral e insuficiencia aórtica
Fisiopatología
En esta combinación la IA es habitualmente moderada y predomina la fisiopatología de EM. La determinación del área mitral por el tiempo de hemipresión puede ser imprecisa en presencia de IA significativa. En ocasiones, la IA es más que moderada, pero su semiología queda enmascarada porque la restricción de flujo causada por la EM limita el impacto del volumen regurgitante sobre el ventrículo 251.
Manejo
Generalmente se toma la decisión según los síntomas producidos por la EM que suele ser la lesión dominante. En estas circunstancias se plantea el dilema de qué hacer con la válvula aórtica. La siguiente orientación puede ser razonable: a) dejar la IA a su evolución natural si la EM se puede solucionar mediante valvuloplastia con balón, y b) sustituir con liberalidad la válvula aórtica si la mitral necesita también ser cambiada por una prótesis. Sin embargo, este último proceder ha sido revisado recientemente, llegándose a la conclusión de que las lesiones aórticas ligeras no deben ser tratadas de manera profiláctica en el momento de la cirugía mitral, puesto que sólo en raras ocasiones se necesita reemplazar con posterioridad la válvula aórtica 252.
Estenosis mitral e insuficiencia tricuspídea
Fisiopatología
Cuando coexisten una IT con una EM, cierto grado de hipertensión pulmonar está habitualmente presente. Por tanto, puede producirse una mejoría de la IT cuando se corrige la EM y la presión pulmonar desciende 238,239. Desafortunadamente, como hemos comentado con anterioridad, la evolución posvalvuloplastia mitral de los enfermos con IT significativa no es tan favorable como la del resto de los pacientes 240.
Diagnóstico
Una vez que se sospecha la presencia de IT en el examen clínico, debe ser evaluada en todos sus extremos, anatómicos y funcionales, mediante ecografía. Al mismo tiempo, los datos deben ser enmarcados dentro del contexto que proporcionen la EM y la hipertensión arterial pulmonar que, obviamente, puede ser estimada en todos los casos.
Manejo.
Salvo que la IT sea severa, debe llevarse a cabo una valvuloplastia con balón, confiando en que con la regresión de la hipertensión pulmonar desaparezca la IT 239. Si la IT es severa, con marcada semiología de congestión sistémica, y/o la anatomía de la mitral es desfavorable para valvuloplastia, lo mejor será intervenir al paciente y reparar la válvula con alguna de las técnicas al uso 253.
Insuficiencia mitral e insuficiencia aórtica
Fisiopatología
Como hemos comentado con anterioridad, la IM y la IA son dos entidades de fisiopatología muy diferente y con valoración distinta en el momento adecuado para la intervención quirúrgica. La aproximación más adecuada es determinar la lesión dominante y tratar de acuerdo con las normas elaboradas para la misma. En todo caso, conviene recordar que la IA induce hipertensión discreta que puede exacerbar la IM.
Diagnóstico y tratamiento.
La ecocardiografía-Doppler es fundamental para evaluar la severidad respectiva de las regurgitaciones, la etioanatomía de las mismas y la repercusión sobre el ventrículo izquierdo, la aurícula del mismo lado y la presión de la arteria pulmonar. La indicación quirúrgica se debe realizar siguiendo las normas establecidas para la lesión dominante; en todo caso, ambas válvulas necesitan actuación quirúrgica, siendo preferible la reparación, si ello fuese posible, en el caso de la mitral.
Estenosis mitral y estenosis aórtica
Fisiopatología
La combinación de enfermedad estenótica es casi siempre secundaria a enfermedad reumática cardíaca. La obstrucción del flujo de la válvula mitral diminuye también el flujo en la válvula aórtica. En consecuencia, a menudo existe el problema de evaluar la severidad del obstáculo aórtico.
Diagnóstico y tratamiento
Con frecuencia, aunque los síntomas dominantes sean los de la EM, predomina la semiología de EA y la estrechez de la válvula mitral puede pasar desapercibida hasta que se realiza ecocardiografía. Esta exploración es básica para determinar el grado de estenosis y la anatomía bivalvular, así como la repercusión sobre las cavidades izquierda y el círculo menor. Si después del estudio nos parece que la EA es poco importante y que la válvula mitral reúne condiciones apropiadas para valvuloplastia con balón, este procedimiento debe intentarse en primer lugar. La válvula aórtica debe ser evaluada de nuevo tras la valvuloplastia mitral.
Estenosis aórtica e insuficiencia mitral
Fisiopatología
Esta combinación lesional está a menudo producida por la fiebre reumática. Sin embargo, la EA y el prolapso de la válvula mitral pueden presentarse asociados en pacientes jóvenes, como pueden hacerlo la EA y la IM degenerativas en la vejez. Si la EA es severa puede empeorar la regurgitación mitral. Por su parte, la IM puede causar ciertos problemas: a) dificultad en la estimación de la severidad de la EA debido a reducción del flujo anterógrado; b) enmascaramiento de la disfunción ventricular incipiente causada por la EA, debido al incremento de la fracción de eyección en la IM, y c) aparición de fibrilación auricular, con la consiguiente pérdida de la sístole auricular que empeora el llenado de un ventrículo hipertrófico y, por ende, reduce el gasto cardíaco.
Diagnóstico y tratamiento
La exploración ecocardiográfica es capital para evaluar la severidad respectiva de las lesiones, su repercusión sobre las cavidades izquierdas y el nivel de la presión arterial pulmonar. Hay que prestar especial atención a la morfología de la válvula mitral en este tipo de asociación. Si ambas lesiones son severas, se debería llevar a cabo el reemplazo de ambas válvulas, o mejor aún, la reparación de la válvula mitral si fuese posible. Sin embargo, en pacientes con EA severa y grado menor de IM, ésta puede mejorar espectacularmente tras el reemplazamiento aórtico, sobre todo cuando la morfología de la válvula mitral es normal. La ecocardiografía transesofágica intraoperatoria y, si fuera necesario, la inspección visual de la válvula mitral, deben realizarse en el momento del reemplazo valvular aórtico para determinar si una cirugía adicional sobre la mitral pudiera ser beneficiosa.
En pacientes con EA leve-moderada e IM severa, en los que la cirugía se indica por esta última, es difícil decidir el comportamiento. Si el gradiente transaórtico medio es >= 30 mmHg se debe sustituir la válvula aórtica. En pacientes con gradientes transaórticos menos severos, hay que recordar que la disminución del flujo anterógrado, a causa de la regurgitación mitral, puede estar minimizando su cuantía. En este caso, la decisión puede ser aún más difícil de tomar, pudiendo ayudar datos colaterales como el aspecto ecocardiográfico de la válvula aórtica o su grado de apertura; finalmente, puede ser la inspección visual intraoperatoria la que determine la necesidad de sustituir la válvula aórtica.
AFECTACIONES VALVULARES POCO COMUNES
Además de las valvulopatías comunes, existen otras afecciones valvulares relacionadas con enfermedades sistémicas, administración de fármacos o toxinas. El tratamiento de estos procesos debe ir dirigido a la enfermedad primaria y la lesión valvular debe ser tratada de acuerdo con la alteración fisiopatológica que produce y en concordancia con los planteamientos establecidos para los procesos valvulares comunes.
Alteraciones valvulares por fármacos anorexígenos
La fenfluramina (Ponderal ®), y su forma dextrógira racémica, la dexfenfluramina (Dipondal ®), son fár-macos que actúan produciendo un aumento de la liberación de serotonina e inhibición de sus receptores. Ambos mecanismos provocan un incremento de la concentración plasmática y tisular de serotonina. En verano de 1997, investigadores de la Clínica Mayo y del Centro Médico Meritcare en Fargo describieron 24 casos de pacientes obesos que habían recibido una combinación de fenfluoramina y fentermina y presentaban regurgitación y alteraciones morfológicas de diferentes válvula cardíacas 254. Todos tenían IA y/o IM y la mitad de ellos, además, IT. En 8 pacientes había hipertensión pulmonar asociada. Cinco enfermos fueron operados y el estudio histopatológico de las válvulas extirpadas puso de manifiesto placas de fibrosis, con rigidez y engrosamientos de valvas y cuerdas. Estos hallazgos eran similares a las alteraciones descritas en los síndromes carcinoide y ergotamínico. Posteriormente se describieron más casos que habían tomado dexfenfluramina y fentermina, así como fenfluramina o dexfenfluramina solas. En revisiones ecocardiográficas de los pacientes tratados con estos fármacos se encontró una incidencia del 29 al 36% de afectación valvular 255. Debido a ello, este tipo de medicación fue retirada del mercado en septiembre de 1997. Posteriormente, en estudios más controlados, se han comunicado tasas de afectación valvular que oscilan entre menos del 1% hasta el 26%, diferencias que se atribuyen a las distintas metodologías de estudio empleadas 256-259. Desconocemos si en nuestro país se ha realizado algún estudio sobre la prevalencia de este fenómeno.
Parece ser que la probabilidad de afectación valvular significativa depende de la duración de la exposición al agente anorexígeno; sin embargo, la historia natural de esta afección es desconocida y se requiere una mayor investigación clínica. A pesar de ello, ya se han definido recomendaciones para el tratamiento de estos pacientes 260,261 (tabla 28):
1. Cualquier persona que reciba este tipo de tratamiento, con independencia del tiempo de exposición, debe someterse a un examen cardiovascular que incluya historia clínica y examen físico con el objeto de detectar síntomas o signos cardiopulmonares.
2. En caso de que exista algún síntoma o signo sugestivo de enfermedad valvular, debe realizarse estudio ecocardiográfico. Por desconocerse la historia natural del síndrome y la posible predisposición a la endocarditis, se ha aconsejado también su realización en los pacientes que, aun sin semiología, vayan a ser sometidos a un procedimiento con riesgo de bacteriemia. No obstante, se sugiere limitar el estudio ecocardiográfico a los enfermos con semiología y, eventualmente, a grandes obesos en los que la auscultación sea difícil.
3. A causa de la alta prevalencia de regurgitaciones triviales se exige para el diagnóstico, además de la exposición al fármaco, que la IA sea al menos ligera y la IM moderada 260,261. Como se desconoce la historia natural de estas lesiones, se recomienda la realización de exámenes clínicos periódicos cada 6 u 8 meses 3.
Síndrome carcinoide y ergotamina. Síndrome posradioterápico
El síndrome carcinoide es el conjunto de manifestaciones clínicas que acompañan la presencia del tumor carcinoide. Los síntomas son debidos a la producción tumoral de aminas vasoactivas (serotonina), cininas e indoles 262,263 y se expresan por diarrea, crisis de rubor y labilidad de la presión arterial. Las lesiones cardíacas de los carcinoides digestivos, los más comunes, ocurren en el lado derecho del corazón y sólo cuando existen metástasis hepáticas 264. Esto sugiere que la sustancia tóxica para el corazón es inactivada por el paso hepático. Lesiones similares ocurren en el lado izquierdo del corazón cuando existe un cortocircuito derecha-izquierda, o el tumor asienta en el pulmón. Las lesiones consisten en placas fibrosas en el endocardio parietal o valvular que producen deformación y disfunción de la válvula 265. Histológicamente están constituidas por células musculares lisas, inmersas en una estroma mucopolisacárido ácida y fibras colágenas que son probablemente consecuencia de la curación de lesiones endocárdicas. La afectación valvular más frecuente es la IT, seguida de la estenosis pulmonar o de ambas 266. La progresión de las lesiones no parece estar influida por los antagonistas de la serotonina. En algunos pacientes pueden existir signos de gasto cardíaco elevado por disminución de las resistencias periféricas y también episodios de espasmo coronario debidos a las aminas vasoactivas. A pesar de ser maligno, el tumor crece lentamente y puede producir la muerte más por insuficiencia cardíaca que por la tumoración en sí. En el tratamiento médico se han usado los análogos de la somastatina y el octeótrido, que también tiene utilidad diagnóstica 267,268. Debido a la clínica de insuficiencia cardíaca, está indicada la sustitución valvular tricuspídea y/o la valvulotomía pulmonar. Pueden emplearse prótesis mecánicas o biológicas, pero no los homoinjertos, que pueden ser afectados por la enfermedad carcinoide 269.
La ergotamina es un alcaloide que ha sido utilizado principalmente en el tratamiento de la cefalea migrañosa. Provoca constricción de los vasos sanguíneos periféricos, en especial de las extremidades inferiores. También puede producir espasmo arterial coronario en algunos pacientes y, de manera excepcional, su uso crónico se ha asociado con fibrosis valvular mitral y aórtica 270-272.
La radiación del mediastino puede afectar al pericardio, miocardio, endocardio, vasos y tejido de conducción del corazón 273-275. La afectación de estas estructuras se manifiesta tardíamente, meses o años después de la exposición. La afectación pericárdica puede ser crónica y recidivante. En el miocardio se produce fibrosis con alteración de la función diastólica y sistólica 276. La valvulopatía es infrecuente y las válvulas más afectadas son la mitral y la aórtica 277-279. También puede producir arteriopatía coronaria prematura, incluso 10 o más años después de la radioterapia. En cuanto al tejido de conducción, es especialmente frecuente el bloqueo completo de rama derecha y más raramente el bloqueo completo 273,280.
Conectivopatías
Cualquier estructura cardiovascular puede resultar afectada en las enfermedades del tejido conectivo 281. En el lupus eritematoso, la afectación endocárdica se caracteriza por lesiones verrugosas implantadas en las superficies valvulares, aunque también pueden encontrarse en los bordes libres de las valvas, las comisuras, los anillos valvulares y las cuerdas tendinosas. La frecuencia de afectación valvular es elevada cuando se explora a los pacientes con ecografía 282-284; sin embargo, lesiones clínicamente significativas se encuentran sólo en un 20% de los casos 302. Las lesiones valvulares del lupus están íntimamente ligadas a la presencia de anticuerpos antifosfolípido 283,284 y la mayoría de ellas suelen ser regurgitantes, aunque también las hay estenóticas. A veces, las lesiones son importantes y requieren intervención quirúrgica. En la serie prospectiva de Galve et al, esto ocurrió en un 8% de los casos 282. Como subrayan estos autores, la valvulopatía lúpica, a diferencia de lo que manifiestan los textos clásicos, no es únicamente una afección anecdótica, reconocible en exclusiva por los patólogos en los estudios autópsicos, sino que posee un protagonismo clínico evidente, que ha ido haciéndose más preeminente a medida que los procedimientos terapéuticos han prolongado la supervivencia de estos pacientes 281.
Aunque las manifestaciones clínicas más habituales en el síndrome antifosfolípido primario son las derivadas de las trombosis en venas y arterias, también pueden estar comprometidas las válvulas cardíacas 285,286. En el estudio de Galve et al 286 se encontró una elevada frecuencia (36%) de lesiones valvulares. Dichas lesiones asientan sobre las válvulas mitral y aórtica, y consisten en engrosamientos localizados que producen regurgitación. En ocasiones, la afectación valvular puede ser severa y exigir la sustitución por una pró-tesis 286.
Las denominadas espondiloartritis seronegativas (espondiloartritis anquilopoyética, enfermedad de Reiter, artritis psoriásica y artritis asociadas a las enfermedades intestinales inflamatorias) pueden, asimismo, producir afectación valvular. La más característica de todas ellas es la IA, que se produce en la espondiloartritis anquilopoyética a consecuencia de un proceso inflamatorio esclerosante que afecta también a la aorta 287. Cuando la IA es severa, se hace obligado el reemplazo valvular que, generalmente, va acompañado de sustitución de la aorta ascendente enferma 288. En la policondritis recurrente, una enfermedad rara que cursa con brotes y remisiones sucesivas que afectan a los cartílagos, sobre todo el auricular y nasal, hay afectación valvular en un 25% de los casos. Las lesiones consisten en dilatación progresiva del anillo mitral y/o aórtico, que producen regurgitación y pueden llegar a ser aneurismáticos, necesitando la reparación quirúr-gica 289.
Enfermedades miocárdicas
La IM, por dilatación anular y desalineación del aparato subvalvular, es muy frecuente en todas las enfermedades que producen disfunción sistólica del aparato ventricular izquierdo. Generalmente, la regurgitación es poco importante, aunque hay casos con IM severa para los que se ha propuesto la cirugía reparadora 290. Otra gran causa de regurgitación es la isquemia miocárdica, tanto aguda como crónica 291. La mayoría de las veces se trata de una regurgitación funcional por necrosis o isquemia severa de un músculo papilar y la zona miocárdica adyacente; otras veces es, simplemente, producto de la dilatación de un ventrículo disfuncionante. Los casos más graves, sin embargo, se producen cuando, a consecuencia de la necrosis miocárdica, se rompe un músculo papilar o una de sus cabezas 219. El manejo de la regurgitación severa de origen isquémico se ha discutido previamente.
La IM es muy frecuente en la miocardiopatía hipertrófica y se cree debida al movimiento sistólico anterior de la válvula mitral; el efecto Venturi, producido por la alta velocidad de la corriente sanguínea en el tracto de salida del ventrículo izquierdo, arrastra a la valva anterior, impidiendo un cierre correcto. Pero también se han encontrado alteraciones morfológicas de la válvula y prolapso mitral que pueden explicar la presencia de insuficiencia 292. La IM secundaria al movimiento sistólico anterior de la válvula mitral mejora con tratamiento médico, estimulación secuencial de las aurículas y los ventrículos 293,294 y miomectomía; sin embargo, la que es producida por alteraciones estructurales de las valvas, elongación o rotura de cuerdas, tiene que corregirse mediante sustitución valvular o cirugía reparadora 295.
VALVULOPATÍAS Y EMBARAZO
Cambios fisiológicos en el embarazo
Durante el embarazo, el volumen sanguíneo circulante aumenta alrededor de un 50%, lo que se acompaña de un incremento del gasto cardíaco, que es máximo entre la segunda mitad del segundo trimestre y durante el tercer trimestre. El incremento del gasto cardíaco se hace a expensas de un incremento del volumen por latido y de la frecuencia cardíaca, 10 a 20 latidos por minuto por encima de lo habitual. A causa de la incorporación del lecho uterino a la circulación general, y el efecto de las hormonas endógenas, disminuyen las resistencias periféricas y aumenta la presión del pulso. En la posición de decúbito supino, el útero grávido puede comprimir la vena cava inferior, produciendo un descenso brusco de la precarga que se manifiesta como hipotensión, debilidad y mareo, que desaparecen cambiando la posición a decúbito lateral 296. Durante el parto existe un brusco incremento del gasto cardíaco asociado a la ansiedad y el dolor. Las contracciones uterinas pueden producir un marcado incremento de la presión arterial, tanto sistólica como diastólica. Después del parto se produce un incremento inicial de la precarga, ocasionado por la autotransfusión de la sangre uterina a la circulación sistémica y a la descompresión de la vena cava inferior. También el embarazo se asocia con una situación de hipercoagulabilidad, ya que disminuye la actividad de la proteína S y aumenta la estasis y la compresión venosa 297. Los estrógenos interfieren con el depósito de colágeno en la capa media de la aorta y de las grandes arterias y, además, la elastasa circulante puede romper las laminillas elásticas y debilitar la capa media. Este debilitamiento de la pared vascular puede predisponer a la disección, con o sin enfermedad del tejido conectivo subyacente 131.
Examen físico
Durante el embarazo son evidentes el aumento de la frecuencia cardíaca en reposo y la marcada presión del pulso. La presión venosa suele estar ligeramente elevada en relación con las mujeres no embarazadas 3. La glándula tiroidea puede estar aumentada en ausencia de hipertiroidismo clínico. Los volúmenes pulmonares pueden estar disminuidos a causa de la elevación de los diafragmas. El impulso apexiano es hipercinético y el primer ruido puede estar aumentado y desdoblado. El segundo ruido está fisiológicamente desdobla-do, aunque más ampliamente e incluso fijo en el último período del embarazo. Es común la auscultación de un tercer ruido y de un soplo sistólico grado 1-2 en el borde esternal superior izquierdo 298. Puede oírse un soplo continuo venoso en el cuello y arterial mamario. El soplo venoso del cuello se aprecia mejor en la fosa supraclavicular derecha y puede desaparecer con el movimiento de la cabeza hacia ese lado, o bien mediante la compresión sobre la vena yugular del mismo lado. El soplo mamario es sistólico o continuo y se oye sobre las mamas ingurgitadas; es de baja frecuencia y puede desaparecer si se ejerce presión con la membrana del fonendoscopio. Se oye mejor en decúbito supino, desaparece al adoptar la posición erguida y aparece en los últimos estadios del embarazo o en el puerperio. Los soplos diastólicos son raros. El aumento del gasto cardíaco puede acentuar la semiología acústica de las estenosis valvulares, mientras que los soplos regurgitantes pueden atenuarse por la disminución de las resistencias vasculares sistémicas 298,299.
Ecocardiografía
El empleo de ultrasonidos durante el embarazo no produce ningún riesgo sobre la madre o el feto. Se suele encontrar un ligero agrandamiento de las cámaras cardíacas y el Doppler puede demostrar una ligera insuficiencia de la válvula pulmonar y de las válvulas auriculoventriculares en ausencia de cambios estructurales. Estas alteraciones pueden derivar del agrandamiento de los ventrículos y de la dilatación del anillo valvular. Es importante tener en cuenta todos estos datos con objeto de valorar adecuadamente a los pacientes con alteraciones valvulares 300.
Manejo general
Toda paciente portadora de una enfermedad cardíaca debe tener información cumplida de los diferentes métodos anticonceptivos y del riesgo que, tanto para ella como para el feto, puede entrañar la gestación. El consejo personalizado requiere la colaboración multidisciplinaria del obstetra y del cardiólogo, especialmente en las enfermas de alto riesgo.
Los cambios inducidos por el embarazo son mal tolerados en varios procesos como las cardiopatías cianóticas, el síndrome de Eisenmenger y la hipertensión pulmonar severa; por lo tanto, debe evitarse el embarazo en estas situaciones 3. Lesiones valvulares, como la EA, la IA del síndrome de Marfan, las que tienen un grado funcional de la NYHA superior a II, hipertensión pulmonar o disfunción ventricular izquierda, así como las prótesis mecánicas que requieren anticoagulación, sufren un elevado riesgo durante el embarazo. Sin embargo, en el resto de las cardiopatías el embarazo puede ser superarse con un relativo bajo riesgo.
Muchos de los pacientes valvulares pueden ser tratados durante el embarazo, parto y puerperio con medidas conservadoras que controlen el volumen intravascular y las condiciones de sobrecarga. Intervenciones simples, como el reposo en cama o evitar la posición de supino, son importantes. Siempre que sea posible, las lesiones valvulares severas deben ser corregidas antes del embarazo y, hasta donde se pueda, se deben evitar los fármacos en general 3.
Lesiones específicas
Estenosis mitral
Es la valvulopatía más común en las jóvenes embarazadas. Estas pacientes deben recibir profilaxis con penicilina durante el embarazo para evitar recidivas de fiebre reumática. Las enfermas con estenosis ligera o moderada pueden ser tratadas con diuréticos y betabloqueadores. Los diuréticos son útiles para aliviar la congestión venosa pulmonar y sistémica, pero debe evitarse la depleción intensa que pueda provocar hipoperfusión placentaria. Los betabloqueadores se emplean para evitar la taquicardia y optimizar el llenado diastólico. Aunque se han utilizado durante mucho tiempo los betabloqueadores no selectivos, como el propranolol, en la actualidad se recomienda usar los cardioselectivos, como el metoprolol o atenolol, para prevenir el efecto perjudicial del bloqueo en la actividad del miometrio. En las pacientes sintomáticas con EM severa debe ser considerada la corrección de la obstrucción antes del embarazo, especialmente si la válvula puede ser abierta mediante valvuloplastia con balón. Si durante el embarazo la enferma está en grado funcional avanzado, con síntomas incontrolables, debe realizarse valvuloplastia guiada por ecografía o, en su defecto, restringiendo el tiempo de fluoroscopia y protegiendo la pelvis y el abdomen. Los resultados comunicados, aunque en series muy limitadas, son excelentes 301,302. En el pasado, la valvulotomía quirúrgica cerrada fue una buena opción que aún se sigue empleando en países en vía de desarrollo 303.
Insuficiencia mitral
El prolapso mitral es la causa más común de insuficiencia en las mujeres embarazadas. Los hallazgos físicos del prolapso pueden estar atenuados por los cambios fisiológicos del embarazo, en especial por el incremento del volumen sanguíneo y la reducción de las resistencias periféricas. La IM debe ser tratada médicamente, aunque en raras ocasiones, a causa de la rotura de cuerdas tendinosas, sucede un empeoramiento brusco y la cirugía es inexorable. El tratamiento incluye diuréticos si existe congestión pulmonar, y vasodilatadores si hay una tensión arterial elevada. En caso de tensión arterial normal o baja no deben ser utilizados. Los inhibidores de la ECA no deben utilizarse por los múltiples efectos adversos sobre el feto, y es preferible la utilización de la hidralazina, que ha mostrado su seguridad. Cuando se requiere cirugía, es preferible la reparación a la sustitución protésica para evitar los problemas derivados de la anticoagulación.
Estenosis aórtica
La causa más común de EA en las mujeres embarazadas es la válvula bicúspide congénita. En las pacientes con obstrucciones ligeras o moderadas y función sistólica ventricular izquierda normal, el tratamiento es conservador. En las enfermas con obstrucción más severa (gradiente medio > 50 mmHg) y síntomas se debe retrasar el embarazo hasta que se corrija la lesión aórtica. En los raros casos en que el diagnóstico se hace durante el embarazo, sobre todo si ha habido insuficiencia cardíaca o síncope, debe valorarse la realización de valvuloplastia o cirugía antes del parto. Ambos procedimientos entrañan riesgo, tanto para la madre como para el feto, aunque han sido comunicados resultados con éxito 304,305. Existe una asociación de válvula bicúspide y necrosis quística de la media aórtica que puede predisponer a la disección aórtica espontánea durante el tercer trimestre del embarazo.
Insuficiencia aórtica
Puede ser tratada con diuréticos, aislados o en combinación con vasodilatadores 306. Las mujeres sintomáticas con signos de insuficiencia cardíaca izquierda deben ser vigiladas estrechamente en lo que respecta al volumen intravascular y la presión arterial. La cirugía durante el embarazo debe considerarse en los casos con insuficiencia cardíaca refractaria. Las enfermas menos sintomáticas, aunque tengan criterios de operabilidad en relación con las dimensiones y/o la función sistólica del ventrículo, deben esperar a que finalice el embarazo para ser operadas.
Estenosis pulmonar
Aunque puede presentarse aislada, frecuentemente se asocia a otras lesiones congénitas complejas. En general, las pacientes con cardiopatías congénitas cianóticas toleran peor el estrés del embarazo que las que tienen lesiones acianóticas. La estenosis pulmonar aislada no suele constituir un impedimento para un embarazo normal y, llegado el caso, puede ser resuelta mediante valvulotomía percutánea guiada por ecocardiografía para evitar las radiaciones 3.
Enfermedad valvular tricuspídea
Puede ser congénita (anomalía de Ebstein, atresia tricuspídea) o adquirida (endocarditis, degeneración mixoide, tumor carcinoide). La IT aislada no plantea problemas significativos durante el embarazo, aunque debe tenerse mayor cuidado del habitual para evitar la hipoperfusión placentaria inducida por diuréticos 3.
Síndrome de Marfan
Es una alteración hereditaria del tejido conectivo que surge por anormalidades en el gen de la fibrilina del cromosoma 15. Se transmite de forma autosómica dominante y se manifiesta clínicamente por alteraciones oculares, esqueléticas o cardiovasculares. La rotura y la disección de la aorta son las complicaciones más temibles que pueden surgir durante el embarazo 307,308. La disección puede iniciarse en cualquier punto de la aorta, aunque el sitio más común es la porción ascendente. Las enfermas con una raíz aórtica superior a 4 cm de diámetro tienen un riesgo especialmente alto, aunque unas medidas normales no son garantía contra una complicación catastrófica. El agrandamiento de la raíz aórtica puede estar acompañado de IA y/o de prolapso mitral con regurgitación. Cualquier mujer con síndrome de Marfan que contemple quedarse embarazada debe ser explorada previamente con ecocardiografía, al objeto de medir la raíz aórtica. Los agrandamientos mayores de 5 cm deben ser corregidos quirúrgicamente mediante sustitución con un tubo valvulado y reimplantación de las arterias coronarias. Hay autores que recomiendan interrumpir el embarazo y realizar la subsiguiente corrección quirúrgica si se descubre durante el mismo una raíz aórtica mayor de 5 cm, especialmente si los estudios seriados demuestran que el ensanchamiento es progresivo. La disección o la rotura de la aorta ocurren sobre todo durante el tercer trimestre del embarazo o en el curso del parto. Durante este último debe suministrarse una analgesia adecuada y prevenir cambios bruscos de la presión arterial; se debe valorar, igualmente, la posibilidad de realizar cesárea, que permite un control hemodinámico más adecuado. También se recomienda el betabloqueo profiláctico a lo largo del embarazo, puesto que este tra-tamiento ha demostrado el enlentecimiento de la dilatación aórtica y la reducción de complicaciones cardiovasculares en adolescentes y adultos 133. Debe señalarse, por último, que las pacientes con síndrome de Marfan sin alteraciones cardiovasculares identificables en el examen clínico y ecocardiográfico pueden cursar un embarazo y parto completamente normales.
Profilaxis de endocarditis
La profilaxis rutinaria no es aconsejable, a menos que exista la posibilidad de complicaciones sépticas durante el parto o en la cesárea. Algunos autores consideran apropiado realizar profilaxis en las pacientes de alto riesgo: portadoras de prótesis valvular, antecedentes de endocarditis previa, cardiopatía congénita compleja o fístulas sistémico-pulmonares de origen quirúrgico 202.
Cirugía valvular durante el embarazo
La indicación de cirugía en las mujeres embarazadas es una decisión compleja y difícil. Incluso en condiciones ideales, que incluyen técnicas de bypass con altas velocidades de flujo y perfusión caliente, hay una alta incidencia de sufrimiento fetal, retraso del crecimiento o aborto 309,310. Siempre es preferible, salvo que sea ineludible, retrasar la cirugía hasta después del parto, o al menos hasta que el feto sea viable y se pueda realizar una cesárea como parte integral del procedimiento quirúrgico 311,312. La cirugía debe realizarse en las enfermas con síntomas refractarios al tratamiento médico, especialmente si cursan con un síndrome de bajo gasto. Las lesiones mitrales deben ser, de preferencia, reparadas; si el reemplazo valvular es ineludible, la elección del sustituto valvular plantea un dilema. Las bioprótesis degeneran más rápidamente en las personas jóvenes, y esta degeneración se acelera durante el embarazo 313. Aunque las bioprótesis no requieren anticoagulación a largo plazo, exponen a los individuos jóvenes al riesgo del fracaso valvular y la consiguiente necesidad de reintervención. Las válvulas mecánicas, aunque más duraderas, obligan a una anticoagulación durante los meses siguientes de embarazo. En la enfermedad valvular aórtica debe ser considerada la implantación de homoinjertos o autoinjertos pulmonares.
Anticoagulación
Todas las mujeres en edad fértil, portadoras de prótesis valvulares mecánicas, deberían saber que si se produce un embarazo tienen que seguir con anticoagulación y que este tratamiento entraña peligro, tanto para ella como para el feto. Hay quienes, por esta razón, desaconsejan formalmente la implantación de prótesis mecánicas en mujeres fértiles. Por desgracia, tanto con los dicumarínicos como con la heparina hay un riesgo significativo de hemorragia o trombosis 3. La incidencia de fenómenos tromboembólicos, a pesar de unos controles adecuados de anticoagulación, se cifra en un 4-14% 314. No existen estudios prospectivos y aleatorizados que permitan enunciar una actitud terapéutica idónea; ésta, más bien, está fundada sobre una buena dosis de empirismo.
Dicumarínicos
Estos fármacos cruzan la barrera placentaria y se han asociado con un incremento del aborto espontáneo, prematuridad y feto muerto al nacimiento. Los fabricantes consideran que su uso durante el embarazo está estrictamente contraindicado, en virtud de su asociación con la embriopatía fetal. La incidencia de embriopatía por warfarina es difícil de precisar, aunque una estimación razonable del riesgo lo sitúa entre el 5-10%. El riesgo es dosis dependiente y más alto si la exposición se hace en el período que va de la sexta a la duodécima semanas de embarazo. La hemorragia cerebral del feto es una complicación clásica, especialmente si el parto es distócico y se necesita la evacuación con fórceps 315.
Heparina
La heparina no cruza la placenta y se considera segura para el feto 316. La administración a largo plazo produce abscesos estériles, osteoporosis que puede dar lugar a pequeñas fracturas, trombocitopenia y hemorragia materna. Aunque la heparina fue considerada inicialmente como el tratamiento de elección, la experiencia posterior ha demostrado que pueden ocurrir complicaciones tromboembólicas, incluyendo la trombosis fatal de la prótesis. En mujeres embarazadas tratadas con heparina subcutánea, esta complicación puede presentarse en 12-24% de los casos 317. Estos estudios se han criticado porque estaban hechos con prótesis antiguas, más trombogénicas, dosis inadecuadas de heparina y vigilancia hematológica poco estricta.
La elección del anticoagulante debe ser hecha teniendo en cuenta la preferencia materna, una vez que haya comprendido los riesgo que para ella y el feto entraña el tratamiento 318,319.
Muchas mujeres considerarán que el riesgo de embriopatía fetal es inaceptable y, por tanto, no estarán dispuestas a tomar dicumarínicos durante el primer trimestre del embarazo o incluso a todo lo largo del mismo; pero si se inclinan por la heparina, deben conocer los peligros de hemorragia y de trombosis protésica. Las heparinas de bajo peso molecular ofrecen ventajas sobre la heparina no fraccionada, como la fácil administración, la mayor biodisponibilidad, el no precisar una vigilancia del laboratorio y la baja incidencia de trombocitopenia y osteoporosis. Aunque han sido usadas en el tratamiento de trombosis venosas profundas durante el embarazo, no hay suficiente experiencia sobre su uso en las embarazadas portadoras de prótesis mecánicas 318. En enfermas de alto riesgo trombótico se ha recomendado la adición de bajas dosis de heparina o aspirina a los dicumarínicos 320. El dipiridamol no debe ser utilizado como agente antiplaquetario por sus efectos adversos sobre el feto. Ni los dicumarínicos ni la heparina están contraindicados en el posparto y en la lactancia 321.
VALVULOPATÍAS EN LOS ADOLESCENTES Y ADULTOS JÓVENES
En muchas cardiopatías congénitas la afectación valvular forma parte de una anomalía compleja. El manejo de estas malformaciones no es el objeto de este apartado que tratará exclusivamente de las valvulopatías aisladas en adolescentes y adultos jóvenes.
Estenosis aórtica
La causa más frecuente de EA en este tramo de edad es la válvula bicúspide. Aunque la prevalencia de válvula aórtica bicúspide es muy elevada (el 2% de todos los nacimientos), sólo 1 de cada 50 niños tendrá obstrucción o regurgitación valvular significativa al llegar a la adolescencia. La progresión de la enfermedad en estas edades es algo diferente a la EA adquirida del adulto. La tercera parte de los niños evaluados en la primera infancia (entre 2 y 11 años) tienen un incremento del gradiente en un período de 4 a 8 años, probablemente porque el crecimiento del anillo y las valvas es inapropiado; sin embargo, el incremento de la obstrucción es muy ligero en los evaluados a partir de los 12 años. En todo caso, la probabilidad de progresión es superior en los que tienen mayores gradientes iniciales. Así, en el curso de 20 años, sólo el 20% de los pacientes con gradiente pico < 25 mmHg requieren algún tipo de intervención. Por el contrario, los que tienen un gradiente inicial > 50 mmHg pueden padecer arritmias, muerte súbita u otros episodios como endocarditis infecciosa, insuficiencia cardíaca, síncope, angina, infarto de miocardio, ictus o implantación de marcapasos, con una frecuencia aproximada de 1,2% por año 322. En este estudio, basado en 370 pacientes seguidos a razón de 8.000 pacientes-año, la incidencia de muerte súbita fue del 0,3% anual. La severidad de la obstrucción en los que fallecieron no pudo determinarse y, por tanto, no pudo identificarse un subgrupo de alto riesgo.
El diagnóstico de EA se realiza mediante la exploración física y la estimación de su severidad por ECG y ecocardiografía-Doppler, requiriendo cateterismo cardíaco sólo aquellos casos de discrepancia entre la evaluación clínica y los datos instrumentales. La prueba de esfuerzo puede ser útil en los pacientes que tengan intención de realizar ejercicios atléticos (tabla 31).
La valvulotomía con balón es una opción terapéutica eficaz en este grupo de edad 323-329, en contraste, como se ha comentado con anterioridad, con la EA del adulto mayor. Es difícil establecer una edad de corte y, hasta disponer de más información, la recomendación de valvulotomía con balón debe limitarse a los adolescentes y adultos jóvenes en los primeros años de la segunda década de vida, aunque algunos adultos no tan jóvenes, con válvulas aún no profusamente calcificadas, pueden beneficiarse de este procedimiento. La mínima morbimortalidad de este tratamiento, junto con sus buenos resultados a largo plazo, hacen que las indicaciones sean más liberales que en los adultos, para quienes una intervención representa, generalmente, la sustitución valvular. Aunque todavía no disponemos de datos definitivos, puede asumirse que la reducción del gradiente implica disminuir el bajo riesgo de muerte súbita 330, así como la extensión de la fibrosis miocárdica que se ha podido observar en niños y adolescentes fa-llecidos y que tenían evidencia de alteraciones de la repolarización en el ECG. En consecuencia, deben considerarse para cateterismo y posible valvulotomía con balón los niños y adolescentes con gradientes determinados por Doppler >= 70-80 mmHg (velocidad pico > 4,2 m/s), los que presentan alteraciones de la repolarización (inversión de la onda T o depresión del segmento ST) y los que desarrollan síntomas (tabla 31). El gradiente debe confirmarse en el cateterismo antes de la dilatación, que será razonable realizar si aquel es > 60 mmHg. También serán candidatos a valvulotomía con balón los pacientes con gradientes inferiores (50-70 mmHg por eco-Doppler) que quieran realizar deportes de competición o mujeres que deseen quedar embarazadas. En la mayoría de centros esta técnica ha desplazado a la valvulotomía quirúrgica, que de cualquier modo sigue siendo una alternativa válida si no se dispone de hemodinámica intervencionista con experiencia. Si la dilatación con balón es inefectiva, o existe insuficiencia aórtica importante, se hará necesario el recambio valvular. La sustitución de la válvula aórtica con un autoinjerto de válvula pulmonar y la colocación de un homoinjerto de válvula pulmonar o aórtica en el lugar de la pulmonar nativa, intervención de Donald Ross 331, va ganando adeptos 332,333 ya que se consigue una buena hemodinámica, los resultados a largo plazo son excelente 39,334 y tiene la ventaja de no requerir anticoagulación, circunstancia de especial relevancia en adolescentes, adultos jóvenes y mujeres en edad fértil.
Insuficiencia aórtica
Las indicaciones de intervención en este grupo de población con válvula aórtica bicúspide e insuficiencia o doble lesión aórtica son similares a las de los adultos (tabla 11). En la tabla 32 se especifican estas indicaciones, adaptadas al grupo de edad que venimos tratando.
Insuficiencia mitral
La IM congénita aislada es rara. En pacientes pediátricos lo más frecuente es la hendidura de la valva anterior en el seno de un defecto del septo atrioventricular. En los jóvenes puede ser secundaria a prolapso valvular en enfermedades del tejido conectivo, alteraciones metabólicas o enfermedades de depósito. También puede ser consecuencia de enfermedades inflamatorias como la fiebre reumática, la endocarditis o la enfermedad de Kawasaki, o secundaria a disfunción del músculo papilar necrótico cuando la arteria coronaria izquierda nace de la pulmonar.
La fisiopatología, diagnóstico y tratamiento son como en el adulto. Por tanto, se debe recurrir al tratamiento quirúrgico en circunstancias parecidas a las que se especifican en la tabla 26 (tabla 33). No está de más insistir, especialmente en este grupo de edad, en que la reparación valvular es un procedimiento muy superior, en todos los órdenes, a la sustitución protésica y que debe realizarse siempre que sea posible.
Estenosis mitral
En los países occidentales, la EM, en la infancia y en los jóvenes, es de etiología congénita en la inmensa mayoría de los casos. En cambio, en las zonas geográficas menos desarrolladas es más probable que su origen sea reumático. La EM congénita se puede asociar a varias malformaciones cardíacas de las cavidades izquierdas, así como a la coartación de aorta. Sus manifestaciones clínicas, ECG y radiológicas son similares a las de la EM del adulto. La ecocardiografía es muy útil en la evaluación del aparato valvular mitral y de los músculos papilares y proporciona información acerca de las posibilidades de éxito en su reparación. La información obtenida en el examen transtorácico es habitualmente suficiente, pero en ocasiones puede necesitarse la vía transesofágica.
El tratamiento médico tiene escasa utilidad en estos pacientes, pero es importante prevenir y tratar com-plicaciones como las infecciones pulmonares, la endocarditis y la fibrilación auricular. El tratamiento quirúrgico de la EM congénita ha mejorado desde la introducción de la ecocardiografía transesofágica, que permite una visualización completa de la válvula y de su función (tabla 34). En los pacientes con válvula en «paracaídas», la fenestración de las cuerdas fusionadas puede aumentar el área efectiva y mejorar los síntomas; a veces es necesario el recambio valvular, que puede ser problemático cuando hay anillo hipoplásico que requiere una técnica quirúrgica de ampliación. La valvuloplastia de la EM congénita se ha intentado recientemente con escaso éxito 335. Ésta es una de las técnicas de cateterismo terapéutico más difíciles y peligrosas, por lo que sólo debe realizarse en centros con personal que posea reconocida experiencia.
Valvulopatía tricuspídea
La mayoría de las enfermedades de la válvula tricúspide, en la infancia y la adolescencia, son congénitas; de ellas, la anomalía de Ebstein es con mucho la más frecuente. En los jóvenes, la afectación valvular adquirida es excepcional y generalmente consecuencia de una traumatismo torácico o endocarditis infecciosa por drogadicción a la heroína. Es excepcional que el chorro de alta velocidad de una comunicación interventricular pequeña incida sobre la valva septal de la tricúspide y produzca cambios degenerativos que conduzcan a IT significativa.
En la anomalía de Ebstein puede haber distintos grados de afectación de las valvas y, por tanto, de IT. Suele acompañarse de un foramen oval permeable y, cuando la IT es importante, se eleva la presión auricular derecha por encima de la izquierda y se produce un cortocircuito derecha-izquierda, con la consiguiente hipoxemia. También son frecuentes los haces de conducción anómalos, que pueden dar lugar a taquicardias paroxísticas supraventriculares en el 25% de los casos. Aunque la enfermedad puede cursar sin síntomas, no son infrecuentes la cianosis y la disnea de esfuerzo. La disfunción ventricular derecha se acompaña de signos de insuficiencia cardíaca congestiva, con exacerbaciones provocadas por las taquiarritmias supraventriculares. Las recomendaciones de evaluación en estos pacientes quedan recogidas en la tabla 35.
La historia natural de la anomalía de Ebstein es variable. De los casos diagnosticados en el período perinatal, sobreviven el 61% a los 10 años 336. En un estudio que incluyó a pacientes diagnosticados después de dicho período, la probabilidad de supervivencia fue del 50% a los 47 años de edad 337. Los predictores de mal pronóstico fueron la clase funcional III o IV de la NYHA, un índice cardiotorácico > 65% y la fibrilación auricular. Sin embargo, los pacientes que alcanzan la adolescencia y la edad adulta suelen tener buen pronóstico.
La reparación de la malformación puede realizarse cuando la valva anterior no está pegada al septo interventricular y puede desplazarse a su situación normal, completándose el procedimiento con plicatura de la porción ventricular atrializada. Si la válvula no es reparable se procede al recambio por una prótesis biológica o mecánica. Las anomalías asociadas, como la comunicación interauricular o el haz anómalo, se corregirán también en el mismo acto quirúrgico, si bien este último puede hacerse mediante procedimiento electrofisiológico. En la tabla 36 se recogen las indicaciones de cirugía en esta malformación.
Estenosis pulmonar
Fisiopatología
La válvula pulmonar no resulta afectada por enfermedades adquiridas, por lo que la estenosis pulmonar (EP) es prácticamente siempre congénita. La fusión de sus valvas produce una morfología valvular característica, en forma de cono o cúpula dirigida hacia el tronco de la arteria pulmonar. En algunos casos, la EP está ocasionada, no por fusión de las valvas, sino porque éstas están engrosadas, displásicas, y con movilidad muy reducida 338.
La EP, incluso severa, no suele originar síntomas en los niños y adolescentes. En los adultos con EP importante pueden aparecer disnea y fatigabilidad por la imposibilidad de aumentar el gasto cardíaco con el ejercicio. Por el mismo mecanismo pueden ocurrir mareos o síncopes de esfuerzo, pero la muerte súbita es muy rara. Los neonatos con EP crítica, así como los adultos con EP grave evolucionada, sí que pueden presentar IT e insuficiencia cardíaca derecha.
Si la distensibilidad ventricular derecha, a causa de la hipertrofia reactiva, está disminuida, se eleva la presión de la aurícula derecha; en estas circunstancia, si el foramen oval es permeable se puede producir cortocircuito derecha-izquierda y embolia paradójica.
Diagnóstico
El diagnóstico clínico de EP es sencillo y la severidad puede determinarse habitualmente con precisión por ecocardiografía bidimensional y Doppler. El cateterismo cardíaco raramente es necesario (tabla 37).
Historia natural
El curso clínico de la EP en niños y adultos jóvenes es bien conocido, a partir de los estudios sobre la historia natural de los defectos cardíacos congénitos 339,340. En estos estudios, iniciados a mitad de los años sesenta, se siguieron 564 enfermos con EP que fueron clasificados en cuatro grupos: a) EP trivial (gradiente pico < 25 mmHg); b) EP ligera (gradiente entre 25 y 49 mmHg); c) EP moderada (gradiente entre 50 y 79 mmHg), y d) EP severa (gradiente >= 80 mmHg). La mayoría de los 261 pacientes tratados médicamente (46% del total) tenían una obstrucción trivial, ligera o moderada y no hubo ninguna muerte, cianosis o insuficiencia cardíaca congestiva. A lo largo de 22 años de seguimiento, sólo el 20% requirieron valvotomía por incremento del gradiente o aparición de síntomas. La mayoría de los casos con aumento del gradiente fueron seleccionados entre niños menores de 2 años o pacientes que tenían un gradiente inicial > 40 mmHg. Fuera de estas dos circunstancias, la probabilidad de que el gradiente aumentase más de 20 mmHg a lo largo de los años fue tan sólo del 4%. Por lo que respecta a los pacientes operados (la mayoría de ellos con obstrucción severa o moderada), sólo ocurrió un fallecimiento entre 245 enfermos seguidos a largo plazo. En el seguimiento, el gradiente se había reducido a valores insignificantes en más del 90% de los casos y tan sólo un 4% de los operados necesitaron una nueva intervención. En conjunto, la supervivencia a los 25 años fue del 96%, la misma que la del grupo control. Es digno de resaltar también que el 96% de los pacientes que tenían un gradiente transpulmonar < 25 mmHg permanecieron libres de cirugía al cabo de los 25 años. La endocarditis infecciosa fue un acontecimiento excepcional: sólo un caso en 18 años de seguimiento medio; esto cuestiona la necesidad de profilaxis en esta enfermedad.
Tratamiento
Hoy día, la valvuloplastia con balón 341,342 ha sustituido a la valvulotomía qurúrgica que, como hemos visto, tan excelentes resultados dio en el pasado. En la ta-bla 38 se especifican las indicaciones actuales de la valvuloplastia en la EP. Los casos con hipoplasia del anillo o displasia de la válvula 343, como el síndrome de Noonan, constituyen excepciones para el procedimiento, puesto que requieren cirugía. Los resultados a largo plazo de la valvuloplastia aún no están disponibles, pero los obtenidos a un seguimiento de 10 años 344 sugieren que serán muy similares a los de la cirugía.
En pacientes con estenosis valvular importante y de larga evolución, la hipertrofia infundibular puede causar obstrucción cuando la válvula se abre después de la dilatación, si bien ésta regresa con el tiempo sin requerir tratamiento. Se ha sugerido el tratamiento con betabloqueadores como solución transitoria a dicha complicación, pero no hay suficiente evidencia de su efectividad.
Insuficiencia pulmonar
Es una cardiopatía congénita infrecuente que puede observarse en la denominada dilatación idiopática de la arteria pulmonar; la insuficiencia pulmonar ligera también puede ser un hallazgo normal de la ecocardiografía-Doppler. Es, asimismo, el resultado casi inevitable del tratamiento de la EP, ya sea quirúrgico o con valvuloplastia. El 87% de los pacientes que fueron operados en el primer estudio sobre la historia natural de los defectos cardíacos congénitos 339 presentaban regurgitación pulmonar en el examen con eco-Doppler realizado en el segundo estudio 340. Sin embargo, la regurgitación era trivial en la gran mayoría de los casos y tan sólo un 9% de los mismos tenían signos de disfunción ventricular derecha atribuibles a la insuficiencia de la válvula pulmonar.
La insuficiencia valvular pulmonar es casi la norma después de la corrección completa de una tetralogía de Fallot. La mayoría de niños y jóvenes adultos intervenidos a finales de los años cincuenta y durante la década de los sesenta, continúan bien a los 35 años de seguimiento 345. Sin embargo, un pequeño número desarrollaron dilatación ventricular derecha con disfunción sistólica y la consiguiente insuficiencia cardíaca. Estos pacientes tienen mayor incidencia de arritmias ventriculares y muerte súbita en el seguimiento. Su tratamiento estriba en el recambio valvular por un homoinjerto, pero aún no hay suficiente experiencia para recomendar este procedimiento de forma generalizada.
ENFERMEDAD CORONARIA EN LOS PACIENTES CON VALVULOPATÍAS
La presencia de enfermedad arterial coronaria (EAC) significativa en pacientes con enfermedad valvular es un hecho relativamente frecuente. Sin embargo, las estrategias de diagnóstico y tratamiento óptimos no están bien definidas. Las sugerencias, a este respecto, se basan en la experiencia de pequeñas series de pacientes operados simultáneamente de las dos afecciones y en inferencias derivadas de los amplios estudios aleatorizados sobre el tratamiento quirúrgico de la EAC.
Desde el punto de vista clínico, el problema se puede enjuiciar de la siguiente forma. De una parte, al menos desde el punto de vista teórico, ningún paciente valvular debería acudir al quirófano sin que se hubiese explorado el árbol coronario, puesto que la eventual presencia de EAC significativa podría empañar los resultados de la intervención valvular, tanto a corto como a largo plazo. Sin embargo, actuar de esta forma iría en contra de la eficiencia, puesto que la gran mayoría de los enfermos sometidos a coronariografía tendrían unas coronarias normales; este aspecto adquiere aún más relieve en una época en la que la gran mayoría de los enfermos con valvulopatías pueden ser perfectamente caracterizados mediante un estudio no invasivo 91. Así pues, para tratar de alcanzar un equilibrio que conjugue eficiencia con seguridad para el paciente deberemos establecer unos criterios que nos guíen en términos de probabilidad.
Probabilidad de padecer enfermedad coronaria en las valvulopatías
En términos generales, la probabilidad de padecer EAC está en relación con: a) la prevalencia de la enfermedad en la población de estudio; b) la ausencia o presencia de dolor torácico y las características clínicas del mismo; c) la edad; d) el sexo, y e) la existencia o no de factores de riesgo cardiovascular 346,347.
La prevalencia de EAC en las series estudiadas en España oscila entre el 10,7 y el 20,3%, dependiendo de la edad media de los pacientes y, posiblemente, de su origen geográfico 348-354. En todo caso, es muy inferior a la referida en los EE.UU. y en los países escandinavos, donde oscila entre el 30 y el 50% 355-358. Por lo que respecta a la presencia de angina, la especificidad es mucho menor que en la población general 359,360, puesto que la valvulopatía, especialmente la EA, puede producir isquemia miocárdica por mecanismos diferentes de los de la obstrucción coronaria 361. Aun así, la presencia de angina, respecto de los enfermos que no presentan dolor torácico, triplica por término medio la probabilidad de padecer EAC significativa: el 35 frente al 14% en la serie de Muñoz San José et al 353 y el 24 frente al 7% en la de Gómez Doblas et al 354. Por lo que respecta a la edad, sigue siendo en nuestro medio un factor predictor significativo de EAC, pero a niveles mucho más elevados que los que han sido sugeridos por los autores anglosajones. En las dos últimas series españolas publicadas, el punto de corte significativo para la edad se sitúa en los 60 años para los varones y en los 65 para las mujeres 353 en una de ellas, y en los 65 años para ambos sexos en la otra 354. En cuanto a la presencia de factores de riesgo, la probabilidad es acumulativa, llegando al 45% cuando se suman 3 o más 353. Estas cifras contrastan con las recomendadas en la última guía del American College of Cardiology y la American Heart Association, que sitúan el corte de edad en los 35 años para los varones y para cualquier edad en las mujeres posmenopáusicas 3. La conclusión final de los dos estudios españoles más re-cientes es que la probabilidad de padecer EAC significativa en los pacientes sin angina ni factores de riesgo y con edad inferior a los 60 años es muy baja (> 5%) y no justifica la realización de coronariografía 353,354.
La prevalencia de EAC es menor en los enfermos afectos de IA y de EM que en los que padecen una EA 362,363. En ambos casos se debe a la menor edad de la población, pero puede haber otros factores que hagan más intensa la relación de la EAC con la EA que con otras valvulopatías. Por lo que respecta a la IM, su relación con la EAC es similar, con la salvedad importante, a recordar en todo momento, de que la última puede ser causa de la primera. Hay que citar, por último, otras dos circunstancias en las cuales se suscita la posibilidad de EAC. Una de ellas es la presencia de disfunción ventricular izquierda. Ya hemos comentado previamente cómo cualquier valvulopatía, en especial las regurgitaciones crónicas, puede generar disfunción ventricular; sin embargo, la EAC puede ser un factor coadyuvante que conviene descartar antes de la operación, sobre todo en los pacientes con el punto de corte de edad antes señalado. La segunda es la existencia de antecedentes documentados de infarto de miocardio; en este caso, sea cual fuese la edad, es preceptivo realizar una coronariografía para verificar la extensión de la EAC y la conveniencia de revascularización asociada.
Diagnóstico de enfermedad coronaria en presencia de valvulopatía
El ECG de los pacientes con valvulopatías tiene con frecuencia alteraciones del segmento ST, debidas a dilatación-hipertrofia ventricular o a bloqueos de rama, que reducen su utilidad para el diagnóstico de EAC, tanto en reposo como durante el esfuerzo. De igual forma, las anomalías de la motilidad segmentaria y de la perfusión miocárdica, tanto en reposo como provocadas por el ejercicio o los fármacos, son marcadores inespecíficos de EAC en pacientes con valvulopatías y dilatación o hipertrofia del VI 364,365. Hay, por tanto, poco lugar para la indicación de estudios de perfusión miocárdica, salvo en los pacientes con valvulopatías ligeras que no afectan a la arquitectura ventricular. Por todo ello, es evidente que la coronariografía constituye el único método diagnóstico fiable para descartar la presencia de EAC en el enfermo valvular 109. En la tabla 40 se exponen las indicaciones para la realización de esta exploración en los enfermos valvulares.
Tratamiento concomitante de la enfermedad coronaria y la valvulopatía aórtica
En España, durante 1997 se realizaron 3.466 intervenciones aisladas sobre la válvula aórtica, de la cuales el 17,5% llevaron asociada cirugía de revascularización miocárdica 1. Por lo que respecta a las mitrales, las cifras fueron de 1.947 y un 11,3%, respectivamente (tabla 41). Estas tasas de revascularización asociada a la cirugía valvular son inferiores al 33% que se cita en la bibliografía estadounidense 3 y, probablemente, lo único que reflejan es la menor prevalencia de la EAC en nuestro país.
Existe la posibilidad de que la cirugía de revascularización miocárdica, asociada a la sustitución valvular aórtica, no afecte a la mortalidad operatoria, en comparación con el reemplazo aislado 366,367. Este aserto, probablemente no se puede generalizar; en la tabla 41 se puede apreciar cómo la mortalidad de la cirugía combinada, al menos en el global de nuestro país, tiene una mortalidad significativamente más elevada que la sustitución aislada, tanto en lo que se refiere a la válvula aórtica como a la mitral. Es muy posible que los 5-6 puntos de diferencia porcentual en la mortalidad se recuperen a largo plazo mediante la mejor supervivencia que se obtiene con la revascularización completa 368-372. No hay, de todas formas, ningún estudio prospectivo y aleatorizado que proporcione una respuesta a esta pregunta: ¿es mejor, respecto a la supervivencia, proceder a la sustitución aislada de la válvula aórtica en los pacientes sin angina (menor mortalidad teórica), o se precisa revascularizar todas las lesiones coronarias encontradas en la coronariografía preoperatoria (teórica mejor supervivencia a largo plazo)? De todas formas, la tendencia universal es la de revascularizar de forma sistemática todas las lesiones coronarias posibles en el momento de la operación. Una alternativa no explorada, pero que tiene una evidente base racional, sería revascularizar mediante angioplastia- stent en el momento de la coronariografía para, posteriormente, realizar la sustitución valvular.
Como hemos comentado con anterioridad, existe la situación contraria: el paciente que necesita revascularización miocárdica y que, además, tiene una EA. En estas circunstancias, no hay duda de que la válvula debe ser sustituida, con independencia de que el paciente presente o no síntomas, cuando la obstrucción es severa (tabla 42). Cuando la EA es moderada, no hay unanimidad en la indicación de sustitución 45, aunque la tendencia es proceder a la misma, habida cuenta de la tendencia a la progresión de la obstrucción y el riesgo que entraña una segunda intervención para reemplazar la válvula aórtica. Más controvertida es aún la sustitución valvular cuando la EA es sólo ligera.
Manejo de la valvulopatía mitral asociada a enfermedad coronaria
Como se ha comentado en la sección correspondiente, la asociación de IM y EAC es muy frecuente. Cuando la IM es ligera, la sintomatología isquémica es la que dicta la necesidad de cirugía revascularizadora y la válvula no se repara ni se sustituye, a no ser que la ecocardiografía intraoperatoria indique mayor grado de IM del esperado. Cuando la IM es más severa se debe abordar la válvula mitral, teniendo en cuenta todas las consideraciones vertidas en la sección correspondiente. Cuando la etiología de la lesión valvular mitral no es isquémica, las normas de actuación son las mismas que se han referido para la valvulopatía aórtica.
PRÓTESIS VALVULARES
Tipos de prótesis
Las prótesis son dispositivos diseñados para sustituir las válvulas cardíacas nativas, manteniendo el flujo unidireccional normal del corazón. Hay dos grandes grupos de prótesis: las mecánicas, en las que el objetivo se consigue mediante la utilización de material rígido, y las biológicas, que son válvulas obtenidas de cadáveres humanos o animales, o que están confeccionadas con algún tipo de tejido animal.
Prótesis mecánicas
En este tipo, la obturación del orificio valvular se consigue mediante un dispositivo oclusor, construido con aleación de materiales muy resistentes a la fatiga. Esto garantiza su durabilidad a largo plazo, siendo excepcionales los fallos estructurales. Sin embargo, a pesar de los constantes cambios introducidos en los materiales y en el diseño, son estructuras trombogénicas, lo que obliga a mantener una anticoagulación permanente. Existen diferentes tipos de prótesis mecánicas, según la configuración del mecanismo oclusor.
Prótesis de bola. Tiene un oclusor esférico, plástico o metálico, que se desplaza dentro de una jaula metálica. El modelo más popular, la prótesis de Starr-Edwards con bola de polímero de silicona y jaula de estelita, fue la válvula artificial más utilizada durante casi dos décadas. La excelente durabilidad demostrada a la largo de 30 años ha hecho que siga siendo implantada por algunos grupos 373. Sin embargo, su alto perfil facilita las interferencias con las estructuras ventriculares vecinas y el flujo excéntrico condiciona una hemodinámica subóptima y mayor trombogenicidad.
Prótesis monodisco. El dispositivo oclusor es un disco metálico circular que se desplaza dentro de una carcasa cilíndrica, labrada de una sola pieza, de diferentes metales o aleaciones de metales (acero, titanio, carbón pirolítico, etc.). Estos discos suelen tener un núcleo de un material muy resistente, generalmente grafito, al que se impregna de algún agente radioopaco, como el tungsteno, y que se recubre con una capa de carbón pirolítico, material muy poco trombogénico. El disco es retenido dentro de la carcasa gracias a los salientes o pivotes de ésta, lo que permite su excursión entre las posiciones de máxima apertura y oclusión. El desplazamiento del disco, por rotación y desplazamiento en el sentido de la corriente, permite un flujo casi central a través de dos aperturas desiguales.
Prótesis de doble disco. El dispositivo oclusor está constituido por dos discos semicirculares de carbón pirolítico, bien puro o, generalmente, dispuesto sobre un núcleo de grafito. Estos hemidiscos, que pueden ser planos o arqueados, permanecen unidos a la carcasa mediante algún sistema articular, habitualmente excavado en ella, que sirve para retenerlos y limitar sus desplazamientos. En la mayoría de los modelos, el desplazamiento va acompañado de rotación; como consecuencia, en la posición de máxima apertura existen tres orificios para el paso de la sangre, dos mayores, dispuestos periféricamente, y uno menor o central entre ambos hemidiscos. En las prótesis con discos arqueados los tres orificios son prácticamente del mismo tamaño. Todos los modelos permiten un cierto flujo regurgitante cuando los discos se encuentran cerrados, lo que tiene la ventaja de disminuir la estasis sanguínea y permitir el lavado del sistema de articulación. Este concepto ha permitido diseñar prótesis de muy bajo perfil, con excelente hemodinámica y muy baja trombogenicidad. Por todo ello, la prótesis de doble disco se han convertido en el sustituto valvular más utilizado en nuestros días.
Prótesis biológicas
Existe una gran variedad de ellas, en función de varios aspectos: a) que se trate de verdaderas válvulas cardíacas o de dispositivos elaborados con otros tejidos biológicos, como el pericardio, a los que se dota de una configuración similar a la de las válvulas semilunares; b) que se obtengan del propio paciente (autoinjertos), de cadáveres humanos (homo o aloinjertos) o de otras especies (hetero o xenoinjertos), y c) que el tejido venga montado en un soporte, más o menos rígido, y tenga un anillo de sutura similar al de las prótesis mecánicas (prótesis soportadas), o carezca del mismo (prótesis no soportadas o stentless), de modo que al implantarlas se deba respetar la configuración anatómica. La principal ventaja de las bioprótesis es la baja trombogenicidad, lo que permite su utilización sin anticoagulación.
Autoinjertos. El único que se realiza es la transposición de la válvula pulmonar a la posición aórtica, reemplazando la primera con un homo o heteroinjerto aórtico o, preferiblemente, pulmonar. Esta intervención, descrita hace más de 30 años por Donald Ross, ha ganado considerable popularidad en la última década debido a su contrastada durabilidad y excelente hemodinámica 39,127,331-334,374. Por estas razones, constituye una alternativa muy atractiva para el tratamiento de las lesiones aórticas en enfermos menores de 40 años. No obstante, es una intervención técnicamente compleja que implica un mayor riesgo quirúrgico, por lo que debe ser realizada por equipos experimentados. Aunque permite evitar la anticoagulación durante muchos años, tiene la limitación de la durabilidad de los injertos, sobre todo el pulmonar, a muy largo plazo.
Bioprótesis de pericardio autólogo. Recientemente se ha desarrollado un tipo de bioprótesis que se manufactura en la misma intervención, montando el pericardio del propio paciente sobre un soporte parecido al de los heteroinjertos 375. De esta manera se pretende aumentar la durabilidad de la válvula, aprovechando la ventaja del tejido autólogo, sin que la técnica de implantación sea tan complicada como la de los homoinjertos. Sin embargo, la experiencia con esta prótesis es todavía limitada y los resultados a largo plazo son desconocidos.
Homoinjertos. Son válvulas humanas obtenidas de cadáveres y conservadas frescas en un medio antibiótico o criopreservadas. Aunque la experiencia con las válvulas ventrículo-arteriales, especialmente la aórtica, se remonta a principios de los años sesenta, se utilizan con poca frecuencia. Los homoinjertos aórticos proporcionan una hemodinámica inmejorable, no precisan anticoagulación y tienen una incidencia muy baja de complicaciones 376. Estas características los hacen una alternativa muy atractiva para el paciente joven. Pueden utilizarse de manera aislada o para remplazar la raíz aórtica entera, y resultan especialmente ventajosos en los pacientes con endocarditis infecciosa activa y con importante destrucción tisular en la región valvular aórtica. El principal inconveniente es su menor disponibilidad y el mayor riesgo quirúrgico por la complejidad técnica que entraña su implantación. Para paliar este inconveniente, existen en el mercado homoinjertos criopreservados. También se han utilizado homoinjertos aórticos montados en soportes similares a los de los heteroinjertos, con el fin de facilitar su implantación, e incluso homoinjertos de las válvulas atrioventriculares para la sustitución mitral o tricus-pídea.
Heteroinjertos porcinos. Son las bioprótesis más utilizadas. Se trata de válvulas aórticas porcinas montadas sobre diferentes tipos de soporte que mantienen la configuración espacial de las cúspides aórticas, al tiempo que les confieren cierta elasticidad para disminuir el estrés mecánico. Suelen incorporar un anillo de sutura que permite su implantación, tanto en posición ventrículo-arterial como atrioventricular. En los heteroinjertos de última generación, el tejido valvular es tratado con glutaraldehído a baja o nula presión para esterilizarlo y estabilizar sus componentes, así como con diferentes sustancias antimineralizantes que retardan el proceso de calcificación. El principal inconveniente de los heteroinjertos porcinos es su limitada durabilidad debido a la degeneración tisular, que ocurre sobre todo cuando se colocan en posición mitral a pacientes menores de 60-65 años; a esto hay que añadir las peores características hemodinámicas de las prótesis con tamaño pequeño. En un intento de mejorar la hemodinámica y alargar la duración disminuyendo el estrés mecánico se han introducido a lo largo de la última década los heteroinjertos porcinos sin soporte o stentless. Los datos disponible confirman la ventajosa hemodinámica de estas válvulas en posición aórtica, sin que su duración se vea comprometida 377. Aunque se han propuesto modelos similares para la sustitución de las válvulas atrioventriculares, su anatomía más compleja hace que los resultados sean menos predecibles.
Heteroinjertos de pericardio bovino. Son prótesis construidas a partir de pericardio bovino, recortado de forma que imita la disposición de las cúspides de las válvulas semilunares. Se tratan también con glutaraldehído y se montan sobre un soporte similar al de los heteroinjertos porcinos. Estas prótesis permiten una apertura más amplia de las cúspides que la de los heteroinjertos y garantizan un mejor comportamiento hemodinámico en los tamaños pequeños. Los modelos actuales, como la prótesis de pericardio de Carpentier, han corregido los defectos que se detectaron en diseños anteriores y garantizan una durabilidad comparable a la de los heteroinjertos porcinos.
Complicaciones potenciales de los pacientes con prótesis valvulares
La implantación de una válvula artificial permite mejorar la calidad y esperanza de vida de un número importante de pacientes y se puede considerar un tratamiento de rutina en la cardiopatía valvular avanzada. Sin embargo, los portadores de prótesis se hacen acreedores de una nueva enfermedad, derivada de las potenciales complicaciones protésicas. Las que aparecen en el postoperatorio inmediato se suelen asociar a la técnica quirúrgica, mientras que las que aparecen tardíamente están más en relación con la disfunción protésica, problemas con el tratamiento anticoagulante o infección. Con respecto a la mortalidad hospitalaria, los últimos datos disponibles en nuestro país indican que la sustitución valvular aórtica aislada tiene una tasa del 7%, la mitral un 8% y la doble y triple sustitución, un 10,4 y un 10,5%, respectivamente 1.
Tipos de complicaciones
Disfunción protésica intrínseca. Esta complicación, también conocida como fallo estructural primario de la prótesis, se debe al desgaste y rotura del material en las prótesis mecánicas y a la degeneración y calcificación de los velos en las prótesis biológicas.
En las primeras prótesis mecánicas de jaula y bola, la bola de silicona podía llegar a romperse (al hincharse por la infiltración lipídica) y embolizar sus fragmentos. También se pudo comprobar, en las prótesis de jaula y disco, disfunción por deterioro del disco de plástico. En el momento actual se considera una rareza el fallo estructural primario de una prótesis mecánica, con excepción de la prótesis cóncavo-convexa de Björk-Shiley, que se retiró del mercado en 1986 a causa de los frecuentes casos con fractura del soporte que provocaba la migración embólica del disco y la consiguiente regurgitación masiva.
En las válvulas biológicas, el fallo estructural primario es la causa mas frecuente de disfunción y se debe a cambios degenerativos de los velos. La esclerosis y calcificación progresivas provocan engrosamiento y pérdida de movilidad de las valvas, generando estenosis, mientras que las roturas y desgarros producen insuficiencia. El deterioro estructural está en relación con el tipo de prótesis (los homoinjertos duran más que los heteroinjertos), la edad del receptor (los niños y adolescentes presentan calcificación precoz), la posición de la prótesis (varios estudios, aunque no todos, han demostrado que la mitral dura menos que la aórtica) y circunstancias diversas (insuficiencia renal, embarazo). La degeneración empieza a hacerse significativa a partir de los 5 años y, con el transcurso del tiempo, la tasa de fallos se hace exponencial; a pesar de ello, a los 12 años podemos encontrar más del 50% de las bioprótesis porcinas libres de fallo estructural. Se estima que la reoperación por fallo de la válvula bioprotésica tiene una mortalidad del 25-30%, significativamente más alta que el recambio de una válvula nativa 378,379.
Disfunción protésica extrínseca. Se refiere a la disfunción que ocurre por causas ajenas a la propia válvula. La más común es la fuga perivalvular producida por una separación entre el anillo de la prótesis y el de la válvula sustituida. Se debe a una técnica quirúrgica deficiente o a la mala calidad del anillo receptor. Generalmente aparece en los primeros días o semanas de la operación y constituye una de las causas más frecuentes de reoperación durante el primer año. Puede ser desde ligera hasta severa y ocurre igualmente en prótesis mecánicas que biológicas. Dentro de este grupo, también hay que considerar el atrapamiento por pannus o sutura, la obstrucción extrínseca (por sutura o restos de tejido no escindido), el tamaño inapropiado de la prótesis y la anemia hemolítica clínicamente importante 378,379.
Trombosis de la prótesis. La trombosis es una complicacion poco frecuente (0-1,5% al año en las prótesis mecánicas aórticas y 0,5-4% en las mitrales) pero muy grave ya que, con frecuencia, termina en reoperación o muerte. El mecanismo suele ser la formación de un trombo que interrumpe el movimiento de la bola, del disco único o de uno de los dos discos. La trombosis se puede ver favorecida por la proliferación de tejido anular ( pannus) que, a su vez, coadyuva en el mecanismo obstructivo. El riesgo trombótico aumenta en las prótesis de bola enjaulada, en las colocadas en posición mitral, en los pacientes que llevan dos o más prótesis y en los que siguen un tratamiento anticoagulante inadecuado 378,379.
Endocarditis protésica. Cualquier infección que afecta a una prótesis valvular o a una válvula nativa reconstruida entra dentro de este concepto. La morbilidad asociada con la infección activa, como la trombosis valvular, la embolia o la dehiscencia paravalvular, se incluye en esta categoría 380. Se calcula que alrededor de un 1-4% de las prótesis se infectarán a lo largo de la vida del paciente, y que la endocarditis protésica constituye el 15-20% del total de endocarditis de un hospital terciario 381. La incidencia es del 3% en los 12 primeros meses y del 4-6% a partir de los dos años. En general, se considera que si la presentación tiene lugar en las 8 primeras semanas tras la cirugía, la causa es-tá en relación con un dispositivo contaminado durante la operación o con la infección postoperatoria de la herida, siendo el estafilococo o un germen gramnegativo los agentes responsables más frecuentes. Cuando aparece después de dos meses y, sobre todo, transcurrido el año de la intervención, el germen infectante más frecuente es el estreptococo y la presentación clínica es similar a la de la endocarditis sobre válvula nativa. Los principales factores de riesgo son haber sufrido endocarditis previas y ser portador de varias prótesis; el riesgo, por otra parte, es similar en las prótesis mecánicas y en las biológicas 378,379,381.
Insuficiencia cardíaca con prótesis normofuncionante. Aunque el reflejo clínico, ante un paciente portador de prótesis valvular en insuficiencia cardíaca, deba ser descartar una disfunción protésica, con mucha frecuencia los síntomas están causados por un mecanismo ajeno a la válvula implantada. Entre las numerosas causas que se pueden citar en este apartado, figuran las siguientes: a) progresión de una lesión valvular que, por no ser severa, se dejó sin corregir en su momento y ha evolucionado con el transcurso de los años; algo similar puede decirse del enfermo que en su día fue sometido a sustitución valvular aórtica y comisurotomía mitral y que ahora, al cabo de los años, tiene reestenosis mitral; b) persistencia de hipertensión arterial pulmonar que no ha regresado suficientemente tras la cirugía mitral y que puede ocasionar insuficiencia cardíaca derecha refractaria; este hallazgo no es excepcional pues, aunque siempre se ha considerado que la hipertensión pulmonar que acompaña a las valvulopatías mitrales es reversible, tal vez no sea del todo cierto, especialmente en pacientes añosos con largo tiempo de evolución. En todo caso, la hipertensión arterial pulmonar severa toma su tiempo en bajar y puede provocar un postoperatorio sumamente tórpido, que se alargue incluso durante semanas o meses; c) la disfunción sistólica del ventrículo izquierdo es la causa no protésica más frecuente de insuficiencia cardíaca postoperatoria; como hemos comentado en los apartados correspondientes, la IA y la IM son las valvulopatías que con más frecuencia conducen a la disfunción ventricular irreversible; como factores coadyuvantes se pueden añadir complicaciones surgidas durante la intervención, como infarto perioperatorio, deficiente protección miocárdica, etc.; d) a veces, la indicación de reparar una IT no está clara, prefiriéndose mantener una actitud conservadora en la esperanza de que la reducción del ventrículo derecho y el anillo tricuspídeo alivie la regurgitación. En el curso de los años, la disfunción protésica, la progresión de una lesión nativa, la hipertensión arterial pulmonar residual o la disfuncion ventricular pueden hacer reaparecer los signos de IT. También es relativamente frecuente observar la re-aparición tardía de IT sin ninguno de los factores antes citados; algo así como una IT primaria que, por causas desconocidas (¿disfunción anular progresiva?), reaparece al cabo de unos años de buena evolución clínica, y e) raramente, los síntomas congestivos pueden deberse al desarrollo de una pericarditis constrictiva. Los problemas pericárdicos, especialmente los derrames loculados que comprimen las cavidades derechas, sí son motivo relativamente frecuente de empeoramiento en los primeros días/semanas del postoperatorio.
Tromboembolismo sistémico. Esta categoría incluye cualquier déficit neurológico nuevo, permanente o transitorio, focal o global (excluyendo las hemorragias) o cualquier embolia arterial periférica, a menos que se demuestre que es consecuencia de otra causa, por ejemplo, infecciosa. La incidencia del tromboembolismo protésico puede llegar hasta casi un 6% pacientes-año, siendo el riesgo mayor en los enfermos con prótesis mecánicas que no siguen tratamiento anticoagulante (un 4% pacientes-año) y en los que sólo toman un agente antiplaquetario (2% pacientes-año) que en los que siguen tratamiento dicumarínico regular (1% pacientes-año). El riesgo también aumenta en pacientes mayores de 70 años y cuando hay fibrilación auricular o disfunción ventricular. La probabilidad de tromboembolismo es similar en los pacientes con válvulas mecánicas adecuadamente anticoaguladas y en las bioprótesis 378,379; obviamente, los pacientes portadores de una bioprótesis que están en fibrilación auricular también deben ser anticoagulados.
Accidente hemorrágico. Se define como cualquier episodio de hemorragia interna o externa que produce muerte, ictus, operación u hospitalización, o requiere transfusión, en pacientes que están recibiendo anticoagulantes o fármacos antiplaquetarios. La incidencia de hemorragias en las prótesis mecánicas, mitrales y aórticas oscila entre el 0,5-4% pacientes-año, aunque hay algunos estudios que elevan la tasa al 6-7%. La frecuencia de hemorragia se incrementa cuando se asocia aspirina al tratamiento dicumarínico, sobre todo si la dosis es superior a 75-100 mg 378,379.
Resultados de los principales estudios de prótesis valvulares
Numerosos estudios clínicos han informado sobre la historia natural de los diferentes tipos de prótesis, incluyendo mortalidad inicial y tardía, así como la probabilidad de presentar fallo estructural, fenómenos tromboembólicos, hemorragias y endocarditis. Estos trabajos tienen diversas limitaciones: no son aleatorizados, las poblaciones de estudio son de características distintas, la complicaciones son definidas de forma diferentes, etc. No permiten, por tanto, hacer una comparación real entre las diferentes prótesis. Se han publicado dos estudios que sirven para comparar las prótesis mecánicas con las biológicas: el ensayo de las válvulas cardíacas de Edimburgo 382 y el estudio cooperativo sobre la valvulopatía de la Administración de Veteranos 44. En el estudio escocés se comparó la prótesis de Björk-Shiley con dos porcinas (Hancock y Carpentier Edwards) en un seguimiento de 12 años, encontrándose que las prótesis mecánicas tenían una mejor supervivencia (el 72 frente al 52%), si bien estas diferencias no llegaron a ser significativas y, además, venían empañadas por la mayor tasa de hemorragias en las primeras. La supervivencia sin reoperación fue significativamente mayor en las mecánicas que en las porcinas, tanto en lo referente a la resustitución valvular mitral (el 74 frente al 42%) como la aórtica (el 75 frente al 55%). El estudio de los Veteranos, con un seguimiento de 11 años, puso de manifiesto una tasa de supervivencia similar para la prótesis de Björk-Shiley y los dos modelos de válvula porcina que se estudiaron. Las complicaciones fueron muy distintas en ambos grupos; mientras que en el primero el problema más frecuente fueron las hemorragias ligadas al tratamiento anticoagulante, en el segundo predominaron los fallos estructurales de la válvula, especialmente a partir del quinto año de evolución.
Manejo de los enfermos con prótesis valvulares
Profilaxis de endocarditis infecciosa
Aunque no está del todo claro el beneficio real, se recomienda que todos los pacientes con prótesis valvular hagan prevención de endocarditis infecciosa. En nuestro medio, Bouza et al 202 han sugerido unas pautas y, recientemente, la American Heart Association ha publicado sus guías de prevención 203.
Profilaxis de fiebre reumática
La fiebre reumática se ha convertido en una rareza. A pesar de ello y puesto que la mayoría de estos enfermos tuvieron carditis en su día, se recomienda seguir profilaxis, al menos durante 10 años después del brote inicial o hasta que el paciente cumpla los 40 años 384.
Terapia antitrombótica
Todos los pacientes con prótesis valvular, excepto los portadores de un homoinjerto, precisan de una terapéutica anticoagulante (tabla 43). La duración e intensidad del tratamiento depende fundamentalmente del tipo de prótesis implantada y de la presencia de factores de riesgo tromboembólicos, como fibrilación auricular, embolismo previo, disfunción sistólica del ventículo izquierdo, humo o trombos en la aurícula izquierda. Los dicumarínicos son los fármacos empleados de forma casi universal, aunque en circunstancias especiales (p. ej., durante el primer trimestre de la gestación) también se utiliza la heparina. Los antiagregantes han sido utilizados como coadyuvantes, especialmente la aspirina a bajas dosis y el dipiridamol. El INR debe mantenerse en niveles estables, ya que las oscilaciones en el nivel de anticoagulación pueden ser más trombogénicas que la ausencia de tratamiento 385.
Prótesis mecánicas. Unos valores de INR entre 2 y 3,5 son adecuados para la mayoría de las prótesis modernas. Índices superiores a 3,5 se recomiendan para determinados modelos, dos o más prótesis, o cuando existen factores de riesgo de tromboembolismo asociados. Cuando el INR > 4, los pacientes de edad superior a los 70 años presentan un riesgo hemorrágico elevado. La adición de dosis bajas de aspirina (80-100 mg) disminuye el riesgo tromboembólico, pero aumenta claramente el de hemorragia.
Prótesis biológicas. La anticoagulación durante los primeros tres meses es la norma, ya que en este período la incidencia de tromboembolismo es elevada. Pasado este tiempo, se recomienda seguir sólo con anti-agregantes o sin tratamiento antitrombótico alguno. En las bioprótesis aórticas se ha empleado con buenos resultados la antiagregación aislada con aspirina o ticlopidina. En caso de fibrilación auricular o prótesis mitral con factores de riesgo (aurícula izquierda dilatada, disfunción sistólica severa, embolismo previo) se recomienda la anticoagulación.
Accidentes embólicos durante una terapia antitrombótica adecuada. En este supuesto, se aconsejan las siguientes medidas: a) incrementar la dosis de anticoagulante hasta alcanzar un INR de 2,5-3,5 (si el previo era de 2-3) o de 3,5-4,5 (si el previo era de 2,5-3,5); b) añadir aspirina a dosis de 80-100 mg o incrementar la dosis de aspirina, si es que ya la tomaba el paciente, lo que conlleva un riesgo serio de hemorragia, o añadir ticlopidina al régimen de anticoagulación, y c) si el paciente tomaba solamente aspirina, se aconseja iniciar terapia con el dicumarínico hasta conseguir un INR de 2 a 3.
Terapia antitrombótica en pacientes que precisan un cateterismo cardíaco. Los anticoagulantes orales deben suspenderse 72 h antes, con el fin de que el INR sea < 1,5 cuando se realice el procedimiento. Tras el mismo, se comenzará de nuevo con la medicación, que debe ser acompañada de heparina, en caso de que el paciente presente factores de riesgo, hasta pasados 3-4 días, en que se habrá alcanzado el efecto terapéutico del dicumarínico.
Diagnóstico de las disfunciones protésicas
Obstrucción protésica. La presentación es muy variable, oscilando desde sutiles hallazgos clinicoecocardiográficos hasta un cuadro de edema pulmonar y shock. La presencia de un soplo holosistólico mitral u holodiastólico aórtico sugieren la presencia de disfunción valvular. Cuando se sospecha una trombosis de la válvula, es obligatorio realizar un ecocardiograma, preferentemente transesofágico 386, para evidenciar el movimiento disminuido del disco (la fluoroscopia puede ser incluso más útil), el aumento del gradiente, la regurgitación valvular y el tamaño y localización del material trombótico. En las prótesis biológicas es más común que la obstrucción sea debida a degeneración de los velos; el diagnóstico, en este caso, se realiza por estudios seriados con Doppler, que demuestran un incremento progresivo del gradiente y la disminución paralela del orificio valvular efectivo.
Regurgitación protésica. La presentación clínica puede ser aguda, por desgarro de un velo en una prótesis biológica 387, o por dehiscencia de la sutura; en ambos casos, la infección puede ser el sustrato que origine la regurgitación. Mucho menos frecuente es que la causa sea una trombosis que, como hemos comentado con anterioridad, suele producir obstrucción. Cuando el curso clínico es más crónico, la regurgitación suele ser consecuencia de una fuga perivalvular más pequeña, que aumenta con el tiempo, o de la retracción progresiva de los velos de una bioprótesis. En todos los casos, el estudio con eco-Doppler es definitivo, pues permite objetivar la regurgitación, evaluar el mecanismo y establecer de forma semicuantitativa su severidad 388. En las prótesis mitrales suele ser indispensable la aproximación transesofágica.
Infección protésica. El diagnóstico de endocarditis infecciosa en los portadores de prótesis se basa en los mismos principios que cuando la infección afecta a una válvula nativa. Desde un punto de vista práctico, estamos obligados a descartar la infección valvular siempre que exista fiebre sin una causa definida. La realización de hemocultivos y la práctica de un eco-Doppler son esenciales para confirmar el diagnóstico. En esta afección, la realización del eco transtorácico se debe completar, en la mayoría de los casos, con un eco transesofágico. Esta exploración es mucho más sensible y específica, ya que permite explorar áreas ciegas para el eco convencional, detectar vegetaciones de menor tamaño y objetivar complicaciones, como abscesos y fístulas, con mayor facilidad 389,390. Es importante insistir en que puede ser necesario realizar el estudio ecocardiográfico en más de una ocasión, debido al carácter evolutivo de la endocarditis.
Calendario de visitas periódicas
Primera visita postoperatoria
Se recomienda realizarla entre la cuarta y la sexta semanas de la intervención y debe comprender una revisión clínica completa, incluyendo anamnesis y exploración física dirigidas, ECG, radiografía de tórax y analítica (hemograma, creatinina, electrólitos e INR si fuera necesario). Tras la intervención es imprescindible disponer de un estudio eco-Doppler que permita evaluar el resultado de la cirugía, disponer de los datos basales de la prótesis implantada, evaluar el tamaño y la función del ventrículo izquierdo, objetivar la reducción de la hipertensión pulmonar, si existía previamente, y documentar la ausencia de derrame pericárdico. En muchos centros se realiza el ecocardiograma antes del alta hospitalaria, por lo que no es necesario repetirlo en esta primera visita, salvo que exista disfunción sistólica previa, cuya evolución conviene vigilar de cerca.
Seguimiento en enfermos sin complicaciones
La frecuencia de las revisiones depende de la existencia de lesiones valvulares residuales, el estado de la función ventricular y el grado de hipertensión pulmonar (tabla 44). En la situación óptima de ausencia de lesiones residuales, función ventricular normal y normotensión o ligera hipertensión pulmonar, una evaluación anual parece razonable. En este contexto, no es necesario realizar estudios ecocardiográficos rutinarios a los portadores de prótesis mecánicas, salvo que presenten síntomas o hallazgos exploratorios nuevos en el examen físico. En los pacientes con bioprótesis se recomienda un estudio ecocardiográfico anual, a partir del quinto año en las mitrales y del octavo en las aórticas, aunque no existan síntomas ni signos físicos de disfunción protésica; esta recomendación se debe a que, a partir de las fechas señaladas, se acelera el proceso de degeneración valvular. En caso de apreciarse regurgitación, se debe acortar la cadencia de exploraciones; por ejemplo, cada 3-6 meses, dependiendo de la severidad de la regurgitación.
Seguimiento de enfermos con complicaciones
La persistencia o aparición de síntomas en un paciente intervenido requiere un detallado estudio que permita determinar con exactitud la causa de los mismos. Además de una evaluación clínica completa que incluya un eco-Doppler, puede ser necesario realizar un eco transesofágico para detectar una fuga perivalvular significativa, o una resonancia para apreciar un pericardio engrosado, o incluso un cateterismo para documentar un patrón de constricción pericárdica.
Tratamiento de las complicaciones protésicas
Trombosis protésica
Si el cuadro clínico es poco importante, el tratamiento se inicia con heparina, que suele ser eficaz si el trombo es menor de 5 mm y no produce obstrucción. Cuando la trombosis protésica produce síntomas severos, el paciente debe ser intervenido de urgencia. La trombólisis puede ser una alternativa, pero es ineficaz en el 16-18% de los casos y se acompaña de complicaciones graves, como ictus, embolismo sistémico, sangrado importante y recidiva del cuadro trombótico en un 3-20% de los casos 391. Debería limitarse, por tanto, a los pacientes en los que la cirugía no se puede realizar o es de muy alto riesgo. También puede ser una alternativa cuando los síntomas no sean tan graves ni la situación hemodinámica tan crítica.
Endocarditis infecciosa
El tratamiento exige la identificación del germen causal y una pauta antibiótica adecuada, tanto en dosis como en duración, que no debe ser inferior a 6 semanas. Si el paciente se encuentra estable, se puede demorar la instauración del tratamiento hasta que se identifique el germen responsable 392; por el contrario, si el cuadro es agudo se comienza de inmediato con un régimen que cubra Staphylococcus aureus, generalmente mediante la asociación de vancomicina y un aminoglucósido. En caso de hemocultivo negativo se recurre a añadir rifampicina al régimen anterior. Dado el bajo índice de curación que se obtiene con antibioterapia exclusiva, hay una tendencia creciente a considerar más adecuado un enfoque médico-quirúrgico, con el que se obtienen más curaciones 381. Esta norma terapéutica es especialmente aplicable a los casos con endocarditis temprana. Existe riesgo de recidiva infecciosa tras la operación, que puede llegar hasta el 15% de los casos intervenidos, pero esto no debe ser obs-táculo para una indicación quirúrgica bien fundada (tabla 45). Problema aparte son las infecciones protésicas de los enfermos adictos a drogas parenterales, cuyo riesgo de recidiva es muy elevado.
Recambio protésico
Generalmente se requiere por disfunción valvular, intrínseca o extrínseca, por dehiscencia de sutura o por infección. Pero también puede ser necesario por tromboembolismo recurrente, hemólisis intravascular severa, hemorragias de repetición importantes debidas al tratamiento anticoagulante, trombosis no obstructiva o, simplemente, desproporción entre el tamaño de la prótesis y la superficie corporal del paciente. Si el enfermo se encuentra en situación clínica estable y sin infección protésica, la operación tiene un riesgo similar al de la sustitución primitiva. Si el paciente está grave debido a disfunción protésica hay una clara indicación quirúrgica, aunque a expensas de un riego elevado. Cuando la situación clínica no es tan apremiante, la decisión se debe basar en el conocimiento de la historia natural de las prótesis, además de otros factores como la repercusión sobre la función ventricular, otras lesiones valvulares nativas, hemólisis acompañante, etc.
Criterios para la selección del tipo de prótesis
El sustituto valvular idóneo debería tener un rendimiento hemodinámico óptimo, no ser afectado por daño estructural (como sucede con las prótesis biológicas), no producir tromboembolismo (como sucede con las mecánicas) y, en consecuencia, no necesitar tratamiento anticoagulante, que induce hemorragias y empeora la calidad de vida de los pacientes.
Como se ha indicado previamente, los estudios clínicos no permiten establecer si existe un tipo de prótesis mejor que otro; son, pues, las características del paciente las que nos inclinarán a utilizar el sustituto más adecuado 393. Como recomendación general es siempre mejor la reparación valvular que la implantación de una prótesis 207-209, lo que se va consiguiendo a nivel mitral en un número creciente de enfermos, merced a un mayor adiestramiento de los cirujanos en las técnicas de reparación.
La mayor ventaja de las prótesis mecánicas es su durabilidad, debido a la práctica ausencia de fallo estructural primario; su peor inconveniente es la necesidad de seguir tratamiento anticoagulante de por vida. En consecuencia, siempre que haya circunstancias asociadas que aconsejen el tratamiento dicumarínico (fibrilación auricular crónica, disfunción ventricular severa, válvula mecánica previa), la balanza se inclinará claramente del lado de la prótesis mecánica.
Las bioprótesis estarán indicadas cuando no se pueda o no se quieran tomar anticoagulantes (gestación, deportes de riesgo, actividad física importante), en pacientes muy jóvenes (menores de 20 años) o en los enfermos con escasa esperanza de vida. También, y siempre que no existan factores de riesgo tromboembólico, en pacientes mayores de 65 años que precisen un recambio aórtico, dado que en este grupo de edad la tasa de fallo estructural primario en las bioprótesis porcinas es menor del 10% a los 10 años. Si lo que se va a implantar es una prótesis mitral, el umbral se suele elevar a los 70 años 394. De todas formas, la indicación de bioprótesis porcina en los enfermos mayores es un arma de doble filo, puesto que con frecuencia el paciente sobrevive más tiempo del esperado, introduciéndose en el período del fallo estructural primario; en consecuencia, nos podemos ver abocados a una nueva intervención en un paciente que ahora sí tiene una avanzada edad para la cirugía 163.
En definitiva, para una elección acertada del tipo de prótesis a utilizar deberemos tener en cuenta los siguientes aspectos: a) la edad del paciente y las expectativas de vida relacionadas con potenciales enfermedades concomitantes; b) la presencia de procesos patológicos que, en sí mismos, supongan una indicación para la anticoagulación permanente; c) la presencia de circunstancias que supongan una contraindicación para la anticoagulación o que impidan el cumplimiento adecuado del tratamiento; d) la posibilidad de embarazo en las mujeres en edad fértil; e) la presencia de circunstancias que puedan conducir a un deterioro acelerado de las bioprótesis, como la edad juvenil, la insuficiencia renal o la posición de implantación, y f) la causa que motivó la disfunción tardía de una prótesis implantada previamente (p. ej., trombosis de una prótesis mecánica o degeneración tisular de una bioprótesis).
En todo caso, el paciente debe recibir una información detallada, aplicada a sus circunstancias particulares, sobre las ventajas e inconvenientes de cada uno de los tipos de prótesis; después de esta información aclaratoria deben tenerse en cuenta sus preferencias a la hora de la elección del sustituto valvular. En las tablas 46 y 47 se recogen las recomendaciones recientemente publicadas por el grupo de trabajo para el manejo de los pacientes con valvulopatías del American College of Cardiology y la American Heart Association 3.
Fig. 3. Algoritmo de actuación en la estenosis mitral asintomática, basado en la determinación del área valvular mitral (AVM), la posibilidad de realizar valvuloplastia mitral percutánea con balón (VMPB), la presencia de hipertensión pulmonar significativa y la respuesta hemodinámica al ejercicio. AI: aurícula izquierda; IM: insuficiencia mitral; PAP: presión arterial pulmonar; PCP: presión capilar pulmonar.
Fig. 4. Algoritmo de actuación en la estenosis mitral poco sintomática, basado en criterios similares a los del supuesto anterior. Leyendas como en la figura 3.
Fig. 5. Algoritmo de actuación en la estenosis mitral muy sintomática, basado en criterios similares a los de los supuestos anteriores a los que se añaden el riesgo quirúrgico; si éste es elevado, se debe intentar la valvuloplastia con balón aunque la anatomía valvular no sea del todo favorable. VM: válvula mitral; resto de leyendas como en la figura 3.
Bibliografía
[1]
Cirugía cardiovascular en España en el año 1997. Registro de intervenciones de la Sociedad Española de Cirugía Cardiovascular. Cir Cardiovasc 1999; 6: 103-112.
[2]
Cirugía Cardiovascular en España. El otro registro. Cir Cardiovasc 1999; 6: 133-114.
[3]
ACC/AHA guidelines for the management of patients with valvular heart disease. A report of the American College of Cardiology/American Heart Association task force on practice guidelines (Committee on management of patients with valvular heart disease). J Am Coll Cardiol 1998; 32: 1486-1588.
[4]
La anuloplastia selectiva, regulable y permanente: una técnica original para el tratamiento de la insuficiencia tricúspide. Rev Esp Cardiol 1972; 25: 555-556.
[5]
Aortic stenosis. En: Rahimtoola SH, editor. Valvular Heart Disease and Endocarditis. Atlas of Heart Diseases, Vol XI. St. Louis: Mosby Publishers, 1996.
[6]
New observations on the etiology of aortic valve disease. Hum Pathol 1993; 24: 1330-1342.
[7]
Temporal changes in the causes of aortic stenosis: A surgical pathologic study of 646 cases. Mayo Clin Proc 1987; 62: 119-123.
[8]
Perspective on valvular heart disease: un update. J Am Coll Cardiol 1989; 14: 1-23.
[9]
Inaccuracies of using aortic valve gradients alone to grade severity of aortic stenosis. Br Heart J 1989; 62: 372-378.
[10]
Doppler echocardiography in adults with symptomatic aortic stenosis: diagnostic utility and cost-effectiveness. Arch Intern Med 1988; 148: 2553-2560.
[11]
Resistance to blood flow by stenotic valves: calculation of orifice area. En: Grossman W, editor. Cardiac catheterization and angiography (2.
[12]
Diagnosis and treatment of heart failure based on left ventricular systolic or diastolic dysfunction. JAMA 1994; 271: 1276-1280.
[13]
Hemodynamic determinants of prognosis of aortic valve replacement in critical aortic stenosis and advanced congestive heart failure. Circulation 1980; 62: 42-48.
[14]
Decreased coronary reserve: a mechanism for angina pectoris in patients with aortic stenosis and normal coronary arteries. N Engl J Med 1982; 307: 1362-1366.
[15]
Effects of chronic hypertension and left ventricular hypertrophy on the incidence of sudden cardiac death after coronary artery occlusion in conscious dogs. Circulation 1982; 65: 1192-1197.
[16]
Hypertensive hypertrophic cardiomyopathy of the elderly. N Engl J Med 1985; 312: 277-283.
[17]
Abnormal left ventricular intracavitary flow acceleration in patients undergoing aortic valve replacement for aortic stenosis. A marker for high postoperative morbidity and mortality. Circulation 1992; 86: 926-936.
[18]
Prognostic and management role of cardiovascular ultrasound in surgically treated aortic stenosis. A picture (with pressure) is worth a thousand inotropic agents. Circulation 1992; 86: 1041-1042.
[19]
Abnormal systolic intraventricular flow velocities after valve replacement for aortic stenosis. Mechanisms, predictive factors, and prognostic significance. Circulation 1996; 93: 712-719.
[20]
Patterns of progression of aortic stenosis: a longitudinal hemodynamic study. Circulation 1982; 65: 709-712.
[21]
Spontaneous course of aortic valve disease. Eur Heart J 1987; 8: 471-483.
[22]
Hemodynamic progression of aortic stenosis in adults assessed by Doppler echocardiography. J Am Coll Cardiol 1989; 13: 545-550.
[23]
Prospective study of asymptomatic valvular aortic stenosis: clinical, echocardiographic and exercise predictors of outcome. Circulation 1997; 95: 2262-2270.
[24]
Aortic stenosis. Circulation 1968; 38 (Supl I): 61-67.
[25]
Natural history of valvular aortic stenosis. Br Heart J 1973; 35: 41-44.
[26]
Comparison of outcome of asymptomatic to symptomatic patients older than 20 years of age with valvular aortic stenosis. Am J Cardiol 1988; 61: 123-130.
[27]
The natural history of adults with asymptomatic, hemodinamically significant aortic stenosis. J Am Coll Cardiol 1990; 15: 1012-1017.
[28]
Noninvasive evaluation of global left ventricular function with use of cine nuclear magnetic resonance. J Am Coll Cardiol 1989; 13: 1294-1300.
[29]
Valve area and cardiac output in aortic stenosis: quantification by magnetic resonance velocity mapping. Am Heart J 1993; 126: 1156-1164.
[30]
Exercise testing in patientes with aortic stenosis. Chest 1988; 93: 1083-1087.
[31]
Systemic and left ventricular responses to exercise stress of asymptomatic patients with valvular aortic stenosis. Am J Cardiol 1991; 68: 1469-1476.
[32]
26th Bethesda conference: recommendations for determining eligibility for competition in athlets with cardiovascular abnormalities. Task force 2: acquired valvular heart diseases. J Am Coll Cardiol 1994: 24: 874-880.
[33]
Aortic valve resistance as an adjunt to the Gorlin formula to assessing the severity of aortic stenosis in symptomatic patients. J Am Coll Cardiol 1992; 20: 1517-1523.
[34]
Usefulness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients. Am J Cardiol 1995; 75: 191-194.
[35]
Effects of dobutamine on Doppler echocardiographic indexes of aortic stenosis. J Am Coll Cardiol 1996; 28: 1206-1213.
[36]
The effect of aortic valve replacement on survival. Circulation 1982; 66: 1105-1110.
[37]
Prognosis of congestive heart failure in patients aged > 62 years with unoperated severe valvular aortic stenosis. Am J Cardiol 1993; 72: 846-868.
[38]
Preoperative risk evaluation and stratification on long-term survival after valve replacement for aortic stenosis: reasons for earlier operative intervention. Circulation 1990; 82: 124-139.
[39]
Replacement of the aortic root with a pulmonary autograft in children and young adults with aortic-valve disease. N Engl J Med 1994; 330: 1-6.
[40]
Estenosis aórtica con disfunción sistólica ventricular izquierda: una enfermedad grave pero con buen pronóstico quirúrgico. Rev Esp Cardiol 1989; 42: 631-637.
[41]
Aortic valve replacement for aortic stenosis with severe left ventricular dysfunction: prognostic indicators. Circulation 1997; 95: 2395-2400.
[42]
Prosthetic heart valves. N Engl J Med 1996; 335: 407-416.
[43]
Fourteen-year experience with homovital homografts for aortic valve replacement. J Thorac Cardiovasc Surg 1995; 110: 186-194.
[44]
A comparison of outcomes in men 11 years after heart-valve replacement with a mechanical valve or bioprosthesis: Veterans Affairs Cooperative Study on Valvular Heart Disease. N Engl J Med 1993; 328: 1289-1296.
[45]
«Prophylactic» valve replacement for mild aortic valve disease at time of surgery for other cardiovascular disease? ...No. J Am Coll Cardiol 1999; 33: 2009-2015.
[46]
Clinical and hemodynamic follow-up after percutaneous aortic valvuloplasty in the elderly. Am J Cardiol 1988; 62: 760-763.
[47]
Percutaneous aortic balloon valvuloplasty in octogenarians: morbidity and mortality. Ann Intern Med 1989; 110: 761-766.
[48]
Percutaneous balloon valvuloplasty in patients with severe aortic stenosis and low ejection fraction: immediate results and 1-year follow-up. Circulation 1989; 79: 1189-1196.
[49]
Failure of balloon aortic valvuloplasty to result in sustained clinical improvement in patients with depressed left ventricular function. Am J Cardiol 1990; 65: 72-77.
[50]
Evolución a largo plazo de los pacientes con estenosis aórtica senil sometidos a dilatación valvular percutánea. Rev Esp Cardiol 1992; 45: 162-166.
[51]
Balloon aortic valvuloplasty in adults: failure of procedure to improve long-term survival. J Am Coll Cardiol 1995; 26: 1522-1528.
[52]
Aortic valvuloplasty - a valid alternative ? N Engl J Med 1988; 319: 169-171.
[53]
Catheter balloon valvuloplasty for severe calcific aortic stenosis: a limited role. J Am Coll Cardiol 1994; 23: 1076-1078.
[54]
Risk of patients with severe aortic stenosis undergoing noncardiac surgery. Am J Cardiol 1998; 81: 448-452.
[55]
Demografía del envejecimiento. En: Guillén F, Pérez del Molino J, editores. Síndromes y cuidados en el paciente geriátrico. Barcelona: Masson, 1984; 3-9.
[56]
Cardiac surgery in the octogenarian. J Thorac Cardiovasc Surg 1986; 91: 924-928.
[57]
Surgical management of aortic valve disease in the elderly: a longitudinal analysis. Ann Thorac Surg 1988; 46: 264-269.
[58]
Open-heart surgery in octogenarians. N Engl J Med 1988; 319: 131-136.
[59]
Surgery for aortic stenosis in elderly patients. A study of surgical risk and predictive factors. Circulation 1994; 90: 2891-2898.
[60]
Quality of life in octogenarians after valve replacement due to aortic stenosis. A prospective comparison with younger patients. Eur Heart J 1996; 17: 583-589.
[61]
Valvular heart disease. En: Schlant R, Alexander RW, editores. Hurt's The Heart (9.
[62]
Síndrome de Turner con degeneración mixoide mitroaórtica, QT largo e hipotiroidismo. Rev Esp Cardiol 1988; 41: 501-503.
[63]
Insuficiencia aórtica en niña asintomática: prolapso valvular como único hallazgo. Rev Esp Cardiol 1994; 47: 258-260.
[64]
Insuficiencia aórtica secundaria a aneurisma congénito del seno de Valsalva. Rev Esp Cardiol 1995; 48: 202-204.
[65]
Valvuloplasty in traumatic aortic insufficiency due to subtotal tear of the intima. Ann Thorac Surg 1995; 60: 1098-1100.
[66]
Age dependent dystrophyc calcification of the aortic valve leaflets in normal subjects. J Heart Valve Dis 1994; 3: 37-40.
[67]
Retrograde atrial kick in acute aortic regurgitation. Study of mitral and pulmonary venous flow velocities by trans-thoracic and transesophageal echocardiography. Clin Cardiol 1997; 20: 35-40.
[68]
Transesophageal echocardiography in the diagnosis of traumatic rupture of the aorta. N Engl J Med 1995; 332: 356-362.
[69]
Perivalvular abscesses associated with endocarditis. Clinical features and diagnostic accuracy of two dimensional echocardiography. Chest 1993; 104: 88-93.
[70]
Ecocardiografía en la disección aórtica. Rev Esp Cardiol 1996; 49 (Supl 4): 13-26.
[71]
Diagnostic imaging in the evaluation of suspected aortic disecction: old standards and news directions. N Engl J Med 1993; 328: 35-43.
[72]
Relación funcional entre sobrecarga de volumen y función sistólica ventricular izquierda en la insuficiencia aórtica crónica. Rev Esp Cardiol 1987; 40: 115-21.
[73]
Fisiopatología de las sobrecargas de presión y de volumen del ventrículo izquierdo secundarias a valvulopatía. Rev Esp Cardiol 1989; 42: 603-613.
[74]
Wall stres and paterns of hypertrophy in human left ventricle. J Clin Invest 1975; 56: 56-64.
[75]
Mechanisms of contraction of the normal and failing heart. The ultraestructural basis of the length-tension curve and of the Starling's law of the heart (2.
[76]
Afterload mismatch in aortic and mitral valve disease: implication for surgical therapy. J Am Coll Cardiol 1985; 5: 811-826.
[77]
Coronary flow and resistance reserve in patients with chronic aortic regurgitation, angina pectoris and normal coronary arteries. J Am Coll Cardiol 1988; 11: 478-486.
[78]
Clinical outcome of severe asymptomatic chronic aortic regurgitation: a long-term prospective follow-up study. Am Heart J 1995; 130: 333-339.
[79]
Serial long term assessment of the natural history of asymptomatic patients with chronic aortic regurgitation and normal left ventricular systolic function. Circulation 1991; 84: 1625-1635.
[80]
Mortality and morbidity of aortic regurgitation in clinical practice. A long-term follow-up study. Circulation 1999; 99: 1851-1857.
[81]
Observations on the optimun time for operative intervention for aortic regurgitation. II Serial echocardiographic evaluation of asymptomatic patients. Circulation 1980; 61: 484-492.
[82]
Natural History and left ventricular response in chronic aortic regurgitation. Am J Cardiol 1996; 78: 357-361.
[83]
Right-sided murmurs of aortic insufficiency (diastolic murmurs better heard to the right of the sternum rather than to the left). Am J Med Sci 1963; 61: 533-542.
[84]
The Austin-Flint murmur. Circulation 1972; 45: 558-570.
[85]
Prospective validation of the detection and quantitative assessment of chronic aortic regurgitation by combined echocardiographic and Doppler method. J Am Soc Echocardiograf 1988; 1: 422-429.
[86]
Ecocardiografía Doppler en la insuficiencia valvular aórtica crónica. Rev Esp Cardiol 1986; 39 (Supl 2): 26-31.
[87]
Ecocardiografía bidimensional de contraste en el diagnóstico y cuantificación de las lesiones regurgitantes. Rev Esp Cardiol 1988; 41: 534-539.
[88]
Ecocardiografía-Doppler en la valoración de las regurgitaciones valvulares. Rev Esp Cardiol 1994; 47 (Supl 4): 34-35.
[89]
ACC/AHA guidelines for the clinical aplication of echocardiography. A report of the American College of Cardiology/American Heart Association task force on practice guidelines (Commitee on clinical application of echocardiography, developed in collaboration with the American Society of Echocardiography). Circulation 1997; 95: 1686-1744.
[90]
A simplified method for determining regurgitant fraction by Doppler echocardiogrphy in patients with aortic regurgitation. J Am Coll Cardiol 1994; 24: 1041-1045.
[91]
Non invasive preoperative assessment of chronic valvular heart disease by Doppler ultrasound. Eur Heart J 1988; 9: 874-878.
[92]
Análisis cuantitativo de la insuficiencia valvular izquierda mediante la utilización de técnicas radioisotópicas en equilibrio. Rev Esp Cardiol 1985; 38: 21-25.
[93]
Alteraciones de la perfusión y de la contractilidad segmentarias en la valvulopatía aórtica severa con coronarias normales. Estudio isotópico. Rev Esp Cardiol 1987; 40: 275-279.
[94]
Ventriculografía isotópica con el esfuerzo en la evaluación de la insuficiencia aórtica crónica. Rev Esp Cardiol 1988; 41 (Supl 2): 84-88.
[95]
Exercise induced left ventricular dysfunction in symptomatic and asymptomatic patients with aortic regurgitation: assessment with radionuclide cineangiography. Am J Cardiol 1978; 42: 351-357.
[96]
Left ventricular response to submaximal and maximal exercise in asymptomatic aortic regurgitation. Am J Cardiol 1988; 62: 606-610.
[97]
Left ventricular function in chronic aortic regurgitation. J Am Coll Cardiol 1983; 1: 1374-1380.
[98]
Utilidad de la ventriculografía isotópica en el manejo de pacientes con valvulopatía aórtica. Rev Esp Cardiol 1988; 41 (Supl 2): 77-83.
[99]
Ejection fraction response to supine exercise in asymptomatic aortic regurgitation: relation to simultaneous hemodynamic meassurements. J Am Coll Cardiol 1985; 5: 847-855.
[100]
J Am Coll Cardiol 1996; 28: 1083-1091.
[101]
Nifedipine in asymptomatic patients with severe aortic regurgitation and normal left ventricular function. N Engl J Med 1994; 331: 689-694.
[102]
Longterm nifedipine unloading therapy in asymptomatic patients with chronic severe aortic regurgitation. J Am Coll Cardiol 1990; 16: 424-429.
[103]
Vasodilator therapy in chronic asymptomatic aortic regurgitation: enalapril versus hidralazine therapy. J Am Coll Cardiol 1994; 24: 1046-1053.
[104]
Effects of 12 month quinapril therapy in asymptomatic patients with chronic aortic regurgitation. J Heart Valve Dis 1994; 3: 500-509.
[105]
Tratamiento con isoproterenol de la insuficiencia cardíaca producida por regurgitación aórtica aguda. Presentación de un caso con respuesta terapéutica espectacular. Rev Esp Cardiol 1977; 30: 201-205.
[106]
Doppler echocardiographic assessment of progression of aortic regurgitation. Am J Cardiol 1997; 80: 306-314.
[107]
Interstudy reproducibility of biplane cine-nuclear magnetic resonance measurements of left ventricular function. Am J Cardiol 1991; 67: 1413-1420.
[108]
A new control volume method for calculatory valvular regurgitation. Circulation 1995; 92: 579-586.
[109]
¿Qué pacientes con enfermedad valvular requieren valoración invasiva? Rev Esp Cardiol 1995; 48: 215-222.
[110]
Clinical evolution of a prospective protocol for the timing of surgery in chronic aortic regurgitation. Am Heart J 1990; 120: 649-657.
[111]
Indicación de cirugía en la insuficiencia aórtica crónica. Rev Esp Cardiol 1990; 43: 251-256.
[112]
Aortic regurgitation complicated by extreme left ventricular dilatation. Long-term outcome after surgical correction. J Am Coll Cardiol 1996; 27: 670-677.
[113]
Improved late survival in patients with chronic aortic regurgitation by earlier operation. Circulation 1984; 70 (Supl 1): 147-152.
[114]
Left ventricular performance in patients with coexistent mitral stenosis and aortic insufficiency. J Am Coll Cardiol 1984; 3: 703-711.
[115]
Surgery for aortic regurgitation in women: contrasting indications and outcomes compared with men. Circulation 1996; 94: 2472-2478.
[116]
Asymptomatic aortic regurgitation: indications for operation. J Cardiovasc Surg 1994; 9: 170-173.
[117]
Managing asymptomatic patients with chronic aortic regurgitation. Chest 1997; 111: 1702-1709.
[118]
Ventricular arrhythmias in aortic valve disease. A further marker of impaired left ventricular function. Int J Cardiol 1992; 34: 49-56.
[119]
Heart failure after aortic valve replacement for aortic regurgitation: prospective 20 year study. Am Heart J 1988; 136: 681-687.
[120]
Valve replacement in aortic insufficiency with left ventricular dysfunction. Circulation 1980; 61: 411-421.
[121]
Survival and functional results after valve replacement for aortic regurgitation from 1976 to 1983. Impact of preoperative left ventricular function. Circulation 1985; 72: 1244-1256.
[122]
Valve replacement for regurgitant lesions of the aortic or mitral valve in advanced left ventricular dysfunction. Cardiol Clin 1995; 13: 73-83.
[123]
Sustitución valvular aórtica por homoinjerto pulmonar. Rev Esp Cardiol 1991; 44: 408-410.
[124]
Reconstructive techniques for rheumatic aortic valve disease. J Card Surg 1988; 3: 23-28.
[125]
Long term results of conservative repair of rheumatic aortic valve insufficiency. Eur J Cardiothorac Surg 1988; 2: 217-223.
[126]
Sustitución valvular aórtica con miniesternotomía. Rev Esp Cardiol 1996; 49: 928-930.
[127]
Sustitución valvular aórtica mediante cirugía mínimamente invasiva. Rev Esp Cardiol 1997; 50: 778-781.
[128]
Tratamiento quirúrgico radical de las anulectasias aórticas. Análisis de una serie de 21 pacientes consecutivos. Rev Esp Cardiol 1984; 37: 271-276.
[129]
Tratamiento quirúrgico de los aneurismas de aorta ascendente con insuficiencia aórtica asociada. Reemplazo completo con reimplantación de coronarias. Rev Esp Cardiol 1991; 44: 455-461.
[130]
Replacement of the aortic root in patients with Marfan's syndrome. N Engl J Med 1999; 340: 1307-1313.
[131]
Diagnosis and treatment of diseases of the aorta. En: Schlant R, Alexander RW, editores. Hurt's the Heart (9.
[132]
Aortic disease in Marfan's syndrome [editorial]. N Engl J Med 1999; 340: 1358-1359.
[133]
Progression of aortic dilatation and the benefit of long-term beta-adrenergic blockade in Marfan's syndrome. N Engl J Med 1994; 330: 1335-1341.
[134]
Aortic valve replacement in patients 80 years and older: operative risks and long-term results. Circulation 1993; 88 (Supl 2): 11-16.
[135]
Resultados de la sustitución valvular aórtica en pacientes mayores de 75 años. Rev Clin Esp 1998; 198: 289-293.
[136]
Serial changes in left ventricular function after correction of chronic aortic regurgitation. Dependence on early changes in preload and subsequent regresion of hypertrophy. Am J Cardiol 1983; 51: 476-482.
[137]
Long term serial changes in left ventricular fuction and reverse of ventricular dilatation after valve replacement for chronic aortic regurgitation. Circulation 1988; 78: 1108-1120.
[138]
Serial noninvasive assessment of left ventricular hypertrophy and function after surgical correction of aortic regurgitation. Am J Cardiol 1979; 44: 585-594.
[139]
An atlas of acquired diseases of the heart. Diseases of the valves and pericardium. Filadelfia: WB Saunders Co, 1961; 1: 12-13.
[140]
Valvular heart disease. En: Braunwald E, editor. Heart disease. A textbook of cardiovascular medecine (5.
[141]
La estenosis mitral infantil. Revisión de 25 casos. Rev Esp Cardiol 1971; 24: 231-244.
[142]
Precisión y aplicabilidad de los diversos métodos en técnica Doppler para la cuantificación de la estenosis mitral. Rev Esp Cardiol 1994; 47: 316-326.
[143]
Continuous wave Doppler determination of right ventricular pressure: a simultaneous Doppler catheterization study in 127 patients. J Am Coll Cardiol 1985; 6: 750-759.
[144]
Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome and the mechanism of dilatation. Br Heart J 1988; 60: 299-308.
[145]
ECO transesofágico en la selección de los pacientes para valvuloplastia mitral percutánea. Estudio de 71 pacientes consecutivos. Rev Esp Cardiol 1991; 44: 599-604.
[146]
Papel del Doppler de esfuerzo en la indicación de valvuloplastia percutánea y/o cirugía mitral en pacientes con grado funcional conservado. Rev Esp Cardiol 1993; 46: 160-167.
[147]
Valor del Doppler de esfuerzo para el diagnóstico de la estenosis mitral severa. Rev Esp Cardiol 1997; 50: 98-104.
[148]
Mitral valve disease. Curr Probl Cardiol 1993; 18: 426-447.
[149]
Protocolos de prevención y tratamiento de la enfermedad tromboembólica (III). Prevención del embolismo de origen cardíaco. Rev Esp Cardiol 1993; 46: 780-783.
[150]
Percutaneous balloon valvuloplasty compared with open surgical commissurotomy for mitral stenosis. N Engl J Med 1994; 331: 961-967.
[151]
Valvotomía mitral percutánea. Experiencia del Hospital Universitario San Carlos de Madrid. Rev Esp Cardiol 1993; 46: 352-363.
[152]
Seguimiento actuarial tras valvulopatía mitral percutánea. Incidencia y factores predictores de eventos. Rev Esp Cardiol 1999; 52: 503-511.
[152]
Resultados a largo plazo de la valvuloplastia mitral percutánea. Rev Esp Cardiol 1998; 51: 458-466.
[153]
Indicaciones actuales de la valvuloplastia. En: Sociedad Española de Cardiología, editor. Normas de Actuación Clínica en Cardiología. Madrid: Sociedad Española de Cardiología, 1996; 213-220.
[154]
Balloon valvuloplasty for mitral restenosis after previous surgery: a comparative study. Am Heart J 1990; 120: 568-571.
[155]
Echocardiography can predict wich patients will develope severe mitral regurgitation after percutaneous mitral valvotomy. J Am Coll Cardiol 1996; 27: 1225-1231.
[156]
Predictors, mechanisms and outcome of severe mitral regurgitation complicating percutaneous mitral valvotomy. Am J Cardiol 1992; 70: 1169-1174.
[157]
Evolución de la insuficiencia mitral severa posvalvuloplastia. Rev Esp Cardiol 1998; 52: 21-24.
[158]
Estudio de seguimiento tras valvuloplastia mitral percutánea. Experiencia COR-PAL. Rev Esp Cardiol 1992; 45: 498-505.
[159]
Long-term clinical and echocardiogra-phic follow-up after percutaneous mitral valvuloplasty with the Inoue balloon. Circulation 1999; 99: 1580-1586.
[160]
¿Cuándo operar una valvulopatía mitral? Rev Esp Cardiol 1991; 44: 258-268.
[161]
Indicaciones quirúrgicas de las valvulopatías. En: Sociedad Española de Cardiología, editor. Normas de Actuación Clínica en Cardiología. Madrid: Sociedad Española de Cardiología, 1996; 40-49.
[162]
Valvuloplastia mitral en el anciano. Rev Esp Cardiol 1995; 48 (Supl 3): 30-35.
[163]
Valvulopatías en el anciano. ¿Cuándo operar? Rev Esp Cardiol 1998; 51: 3-9.
[164]
Corazón y gestación. Rev Esp Cardiol 1994; 47 (Supl 3): 76-90.
[165]
Outcome probabilities and life history after surgical commissurotomy: implications for balloon commissurotomy. J Am Coll Cardiol 1991; 17: 29-42.
[166]
Long-term follow-up of patients undergoing closed transventricular mitral commissurotomy: a useful surrogate for percutaneous balloon mitral valvulopasty? J Am Coll Cardiol 1992; 20: 781-786.
[167]
Mitral valve prolapse and the mitral valve prolapse syndrome. Curr Probl Cardiol 1991; 16: 309-375.
[168]
The mitral apparatus: functional anatomy of mitral regurgitation. Circulation 1972; 46: 227-239.
[169]
The mitral valve prolapse syndrome. En: Chizner MA, editor. Classic teachings in clinical cardiology: a tribute to W Proctor Harvey, M.D. Cedar Growe: Laennec Publishing Co, 1996; 1049-1070.
[170]
Inheritance of mitral valve prolapse: effect of age and sex on gene expression. Ann Intern Med 1982; 97: 826-832.
[171]
Hipomastia and mitral-valve propalse: evidence of a linked embryologic and mesenchymal dysplasia. N Engl J Med 1983; 309: 1230-1232.
[172]
Abnormal cardiovascular regulation in the mitral valve prolapse syndrome. Am J Cardiol 1983; 52: 316-320.
[173]
Mitral valve repair for ischemic mitral insufficiency. Ann Thorac Surg 1991; 52: 1246-1251.
[174]
Postinflamatory mitral and aortic valve prolapse: a clinical and pathological study. Circulation 1987; 76: 68-76.
[175]
Mitral valve prolapse in patients with prior rheumatic fever. Circulation 1988; 77: 830-836.
[176]
Significance and prognosis of an isolated late systolic murmur: a 9- to 22-year follow-up. Br Heart J 1974; 36: 525-532.
[177]
Natural history of mitral valve prolapse. Am J Cardiol 1995; 75: 1028-1032.
[178]
Sudden death in mitral valve prolapse with Holter monitoring-documented ventricular fibrillation: evidence of coexisting arrhythmogenic right ventricular cardiomyopathy. Int J Cardiol 1995; 49: 274-278.
[179]
Arrhythmias in mitral valve prolapse: relation to anterior mitral leaflet thickening, clinical variables, and color Doppler echocardiographic parameters. Am Heart J 1994; 128: 919-927.
[180]
Cost-effectiveness of infective endocarditis prophylaxis for mitral valve prolapse with or without a mitral regurgitant murmur. Am J Cardiol 1994; 74: 1024-1029.
[181]
Visual complications of mitral leaflet prolapse. Br Med J 1977; 2: 86-88.
[182]
Further evidence relating mitral-valve prolapse to cerebral ischemic events. N Engl J Med 1980; 302: 139-144.
[183]
The enigma of the risk of stroke in mitral valve prolapse. Stroke 1985; 16: 175-177.
[184]
Diagnóstico clínico en cardiología. Barcelona: JIMS S.L., 1997; II: 44-47.
[185]
Variaciones auscultatorias posturales en el síndrome del prolapso mitral. Presentación de una caso con demostración ecocardiográfica de su mecanismo. Rev Esp Cardiol 1977; 30: 313-316.
[186]
Reassessment of echocardiographic criteria for diagnosis of mitral valve prolapse. Am J Cardiol 1988; 61: 131-135.
[187]
Prolapso valvular mitral: realidad y ficción. Rev Esp Cardiol 1990; 43: 35-48.
[188]
Echocardiographic diagnosis of mitral valve prolapse. J Am Soc Echocardiogr 1994; 7: 286-293.
[189]
Doppler cardíaco. Madrid: Interamericana-Mc Graw Hill, 1988; 48-49.
[190]
Propanolol for patients with mitral valve prolapse. Am Heart J 1977; 93: 422-427.
[191]
Atrial fibrillation and stroke: revisiting the dilemas. Stroke 1994; 25: 1337-1341.
[192]
Natural history of the asymptomatic/minimally symptomatic patient with severe mitral regurgitation secondary to mitral valve prolapse and normal right and left ventricular performance. Am J Cardiol 1994; 74: 374-380.
[193]
Revisión de la insuficiencia mitral. Curr Probl Cardiol 1995; 8: 457-469.
[194]
Valvular heart disease: the influence of changing etiology on nosology. J Heart Valve Dis 1994; 3: 516-526.
[195]
Valvulopatía cardíaca adquirida. Insuficiencia valvular mitral. En: Brandenburg RO, Fuster V, Giuliani ER, McGoon DC, editores. Cardiología. Fundamentos y práctica. Madrid: Ediciones CEA S.A., 1989; 1457-1461.
[196]
Ecocardiografía-Doppler en la valoración de las regurgitaciones valvulares. Rev Esp Cardiol 1994; 47 (Supl 4): 34-45.
[197]
Quantitative Doppler assessment of valvular regurgitation. Circulation 1993; 87: 841-848.
[198]
Descripción de un nuevo método de cuantificación del flujo regurgitante en pacientes con válvula mitral incompetente. Rev Esp Cardiol 1994; 47: 173-180.
[199]
Quantification of mitral regurgitant volume by the color Doppler proximal isovelocity surface area method: a clinical study. J Am Soc Echocardiogr 1995; 8: 48-54.
[200]
The mitral regurgitation index: an echocardiographic guide to severity. J Am Coll Cardiol 1999; 33: 2016-2022.
[201]
Echocardiographic prediction of left ventricular function after correction of mitral regurgitation: results and clinical implications. J Am Coll Cardiol 1994; 24: 1536-1543.
[202]
Profilaxis y manejo del paciente con endocarditis infecciosa. En: Sociedad Española de Cardiología, editor. Normas de Actuación Clínica en Cardiología. Madrid: Sociedad Española de Cardiología, 1996; 89-98.
[203]
Prevention of bacterial endocarditis: recomendations by the American Heart Association. Circulation 1997; 96: 358-366.
[204]
Mitral regurgitation due to ruptured chordae tendineae: early and late results of valve repair. J Thorac Cardiovasc Surg 1985; 89: 491-498.
[205]
Conservative operation for mitral insufficiency: critical analysis supported by postoperative hemodynamic studies of 72 patients. J Thorac Cardiovasc Surg 1989; 79: 326-337.
[206]
Comparative evaluation of mitral valve repair and replacement with Starr, Björk, and porcine valve protheses. Circulation 1984; 70 (Supl I): 187-192.
[207]
Mitral valvuloplasty is superior to valve replacement for preservation of left ventricular function: an intraoperative two-dimensional echocardiographic study. J Am Coll Cardiol 1987; 10: 568-575.
[208]
A comparison of repair and replacement for mitral valve incompetence. J Thorac Cardiovasc Surg 1987; 94: 208-219.
[209]
A comparison of mitral valve reconstruction with mitral valve replacement: intermediate-term results. Ann Thorac Surg 1989; 47: 655-662.
[210]
Mitral regurgitation: a new clinical perspective. Mayo Clin Proc 1997; 72: 1034-1043.
[211]
Valve repair improves the outcome of surgery for mitral regurgitation: a multivariate analysis. Circulation 1995; 91: 1022-1028.
[212]
Impact of preoperative symptoms on survival after surgical correction of organic mitral regurgitation. Rationale for optimizing surgical indications. Circulation 1999; 99: 400-405.
[213]
Ischemic mitral regurgitation. Circulation 1989; 79 (Supl I): 116-121.
[214]
Improving surgical strategies for ischemic mitral regurgitation. J Heart Valve Dis 1993; 2: 533-535.
[215]
Are there indications for reconstructive surgery in severe mitral regurgitation after acute myocardial infarction? Eur J Cardiovasc Thorac Surg 1990; 4: 394-397.
[216]
Outcome of patients sustaining acute ischemic mitral regurgitation during myocardial infarction. Ann Intern Med 1992; 117: 18-24.
[217]
Emergent coronary angioplasty in the treatment of acute ischemic mitral regurgitation: long term results in five cases. J Am Coll Cardiol 1989; 14: 986-991.
[218]
Treatment of severe mitral regurgitation caused by ischemic papillary muscle dysfunction: indications for angioplasty. Am Heart J 1992; 123: 860-865.
[219]
Mitral valve operation in postinfarction rupture of a papillary muscle: inmediate results and long-term follow-up of 22 patients. Mayo Clin Proc 1992; 67: 1023-1030.
[220]
Echocardiography to assist mitral valve repair in patients with coronary artery disease. Cor Art Dis 1966; 7: 211-216.
[221]
The effect of pathophysiology on the surgical treatment of ischemic mitral regurgitation: operative and late risks of repair versus replacement. Eur J Cardiothorac Surg 1995; 9: 568-574.
[222]
Quantifications of mitral annular calcification in octogenarian patients: innocent bystander or marker of pathology. Echocardiography 1991; 8: 329-339.
[223]
Calcificación del anillo valvular mitral en el paciente anciano: significado clínico. Rev Esp Cardiol 1995; 48 (Supl 3): 22-29.
[224]
Superiority of mitral valve repair in surgery for degenerative mitral regurgitation. Eur Heart J 1997; 18: 665-663.
[225]
Is the clinical spectrum and prognosis of native valve infective endocarditis in non-adicts changing? Eur Heart J 1995; 16: 1686-1691.
[226]
Systolic and diastolic properties of the human left ventricle during valve replacement for chronic mitral regurgitation. Am J Cardiol 1981; 47: 40-50.
[227]
Pathology of tricuspid valve stenosis and pure tricuspid regurgitación: part I. Clin Cardiol 1995; 18: 97-102.
[228]
Pathology of tricuspid valve stenosis and pure tricuspid regurgitación: part III. Clin Cardiol 1995; 18: 225-230.
[229]
Etiology of pure tricuspid regurgitation based on annular circumference and leaflet area: analysis of 45 necropsy patients with clinical and morphologic evidence of pure tricuspid regurgitattion. J Am Coll Cardiol 1986; 7: 1063-1074.
[230]
Insuficiencia tricuspídea severa como manifestación principal de un hipertiroidismo. Rev Esp Cardiol 1997; 50: 65-66.
[231]
Afectación valvular tricuspídea y pulmonar en un caso de síndrome carcinoide. Rev Esp Cardiol 1997; 50: 532-534.
[232]
Diagnóstico clínico en cardiología. Barcelona: JIMS S.L., 1997; II: 54-61.
[233]
Systolic propulsion of the eyeballs in tricuspid regurgitation. Lancet 1995; 346: 1706.
[234]
Pulsatile varicose veins associated with tricuspid regurgitation. Br J Surg 1989; 76: 207.
[235]
Color Doppler evaluation of valvular regurgitation in normal subjets. Circulation 1988; 78: 840-847.
[236]
Which physical factors determine tricuspid regurgitation jet area in the clinical setting? Am J Cardiol 1993; 72: 1305-1309.
[237]
Doppler cardíaco. Madrid: Interamericana-McGraw Hill, 1987; 79-84.
[238]
Inmediate and long-term effect of mitral balloon valvotomy on severe pulmonary hypertension in patients with mitral stenosis. Am Heart J 1996; 131: 89-93.
[239]
Efficacy of mitral balloon valvotomy in reducing the severity of associated tricuspid valve regurgitation. Am J Cardiol 1994; 73: 209-211.
[240]
Significant tricuspid regurgitation is a marker for adverse outcome in patients undergoing percutaneous balloon mitral valvuloplasty. J Am Coll Cardiol 1994; 24: 696-702.
[241]
Surgery for tricuspid insufficiency: long-term follow-up after De Vega annuloplasty. Thorac Cardiovasc Surg 1993; 41: 1-8.
[242]
Diagnóstico y tratamiento de las lesiones de la válvula tricúspide: un problema no resuelto. Rev Esp Cardiol 1990: 43: 328-340.
[243]
Adjustable tricuspid valve annuloplasty assisted by intraoperative transesophageal color Doppler echocardiography. Am J Cardiol 1993; 71: 926-931.
[244]
Initial outcome of percutaneous balloon valvuloplasty in rheumatic tricuspid valve stenosis. Am J Cardiol 1993; 71: 252-354.
[245]
Tricuspid valve replacement in rheumatic disease: preoperative predictors of hospital mortality. J Heart Valve Dis 1996; 5: 26-30.
[245]
Tricuspid valve replacement: fifteen years of experience with mechanical protheses and bioprostheses. J Thorac Cardiovasc Surg 1995; 109: 1035-1041.
[246]
Thrombotic obstruction of Björk-Shiley tricuspid valve prosthesis. Report of three cases reoperated with success. Acta Cardiol 1975; 30: 419-426.
[247]
Hydraulic formula for calculation of the area of stenotic mitral valve, other cardiac valves and central circulatory shunts. Am Heart J 1951; 41: 1-29.
[248]
Dependence of Gorlin formula and continuity equation valve areas on transvalvular volumen flow rate in valvular aortic stenosis. Circulation 1994; 89: 827-835.
[249]
Dynamic and isometric exercise during cardiac catheterización. En: Baim DS, Grossman W, editores. Cardiac Catheterization, angiography, and intervention (5.
[250]
Factors influencing accuracy in left ventricular volume determination. Am J Cardiol 1989; 64: 661-664.
[251]
Left ventricular performance in patients with coexistent mitral stenosis and aortic insufficiency. J Am Coll Cardiol 1984; 3: 703-711.
[252]
The natural history of aortic valve disease after mitral valve surgery. J Am Coll Cardiol 1999; 33: 2003-2008.
[253]
Tricuspid valve surgery revisited. J Card Surg 1994; 9: 242-247.
[254]
Valvular heart disease associated with fenfluoramine-phentermine. N Engl J Med 1997; 337: 581-588.
[255]
Further cases of valvular heart disease associated with fenfluoramine-phentermine. N Engl J Med 1997; 337: 635.
[256]
The prevalence of cardiac valvular insufficiency assessed by thransthoracic echocardiogrphy in obese patients treated with appetite suppressant drugs. N Engl J Med 1998; 339: 713-718.
[257]
A population based study of appetite supressant drugs and the risk of cardiac valve regurgitation. N Engl J Med 1998; 339: 719-724.
[258]
An assessment of heart valve abnormalities in obese patients taking dexfenfluoramine, sustained dexfenfluoramine or placebo. N Engl J Med 1998; 339: 725-732.
[259]
Appetite suppressant and valvular heart disease. N Engl J Med 1998; 339: 765-767.
[260]
US Department of Health and Human Services interim public health recommendations. November 1997. MMWR Morb Mortal Wkly Rep 1997; 46: 1061-1066.
[261]
Cardiac valvulopathy associated with exposure to fenfluramine and dexfenfluramine. US Department of Health and Human Services interim public health recommendations. November 1997. JAMA 1997; 278: 1729-1731.
[262]
Carcinoid heart disease clinical and echocardiographic spectrum in 74 patients. Circulation 1993; 87: 1188-1196.
[263]
Echocardiograpahy for carcinoid heart disease. Ann NY Acad Sci 1994; 733: 437-45.
[264]
Metastatic carcinoid tumors and malignant carcinoid syndrome. Ann NY Acad Sci 1994; 753: 464-470.
[265]
Endocardial sclerosis and other heart lesions in the carcinoide disease. Acta Med Scand 1958; 99 (Supl): 99-119.
[266]
Carcinoid heart disease. Correlation of high serotonin levels with valvular abnormalities detected by cardiac catheterization and echocardiography. Circulation 1995; 92: 790-795.
[267]
Carcinoid tumors. Post Grad Med J 1997; 73: 207-214.
[268]
A unique heart disease associated with a unique cancer: carcinoid heart disease. Am J Cardiol 1997; 80: 251-256.
[269]
Carcinoid heart disease: early failure of an allograft valve replacement. Ann Thorac Surg 1994; 58: 1161-1163.
[270]
Ergot alcaloid heart disease. En: Hurst JW, editor. New Types of cardiovascular diseases: topics in clinical cardiology. Nueva York, NY: Igakin-Shorin Medical, 1994; 63-76.
[271]
Mitral, aortic and tricuspid valvular heart disease associated with ergotamine therapy for migraine. Eur Heart J 1997; 18: 701.
[272]
Valve disease associated with ergot alkaloids use: echocardiographic and pathologic correlations. Ann Intern Med 1992; 117: 50-52.
[273]
Radiation induced heart disease: un update. Prog Cardiovas Dis 1984; 27: 173-194.
[274]
Cardiovascular sequelae of therapeutic thoracic radiation. Prog Cardiovasc Dis 1991: 33: 299-311.
[275]
Pathology of radiation-induced heart disease. A surgical and autopsy study of 27 cases. Human Pathol 1996; 27: 766-773.
[276]
Radiation-induced cardiovascular dysfunction. Am J Cardiol 1996; 78: 114-115.
[277]
Two dimensional echocardiographic assessment of radiation induced valvular heart diseases. Amm Heart J 1984; 107: 584-585.
[278]
Post-radiation valvular and coronary artery disease. J Heart Valve Dis 1997; 6: 219-221.
[279]
Radiation associated valvular disease. Chest 1991; 99: 538-545.
[280]
Heart disease following mediastinal irradiation: surgical management. Eur J Cardiothorac Surg 1995; 9: 202-205.
[281]
Enfermedades del tejido conectivo y corazón. Rev Esp Cardiol 1998; 51: 232-242.
[282]
Prevalence, morphologic types, and evolution of cardiac valvular disease in systemic lupus erythematosus. N Engl J Med 1988; 319: 817-823.
[283]
Valvular heart disease in systemic lupus erythematosus. N Engl J Med 1989; 320: 739-741.
[284]
Cardiac disease in systemic lupus erythematosus: prospective study of 70 patients. Ann Rheum Dis 1992; 51: 156-159.
[285]
High prevalence of significant heart valve lesions in patients with the ¿primary' antiphospholipid syndrome. Lupus 1991; 1: 43-47.
[286]
Valvular heart disease in the primary antiphospholipid syndrome. Ann Intern Med 1992; 116: 293-298.
[287]
Ankylosing spondylitis and aortic regurgitation. Circulation 1973; 48: 1014-1027.
[288]
Aortic valve replacement and ascending aorta replacement in ankylosing spondylitis: report of three surgical cases and review of the literature. Thorac Cardiovasc Surg 1982; 30: 310-314.
[289]
Relapsing polychondritis: prospective study of 23 patients and a review of the literature. Medicine (Baltimore) 1976; 55: 193-215.
[290]
Improvement following correction of secondary mitral regurgitation in end-stage cardiomyopathy with mitral annuloplasty. Am J Cardiol 1996; 78: 966-969.
[291]
Different mechanisms of mitral regurgitation in acute and chronic forms of coronary heart disease. Eur Heart J 1983; 4: 557-565.
[292]
Alteraciones hemodinámicas y electrofisiológicas de la miocardiopatía hipertrófica. Rev Esp Cardiol 1996; 49: 56-68.
[293]
Impacto de la estimulación cardíaca eléctrica sobre la función ventricular y la historia natural de los pacientes con miocardiopatía hipertrófica. Rev Esp Cardiol 1996; 49: 596-608.
[294]
The use of pacemakers in the treatment of cardiomyopathies. Curr Probl Cardiol 1996; 21: 385-444.
[295]
La cirugía de resección en la miocardiopatía hipertrófica obstructiva. ¿Recuperación de una herramienta infraestimada? Rev Esp Cardiol 1996; 49: 372-380.
[296]
Pregnancy and cardiovascular disease. En: Braunwald E, editor. Heart Disease. A textbook of Cardiovascular Medicine (5.
[297]
Enhanced thrombin generation in normal and hypertensive pregnancy. Am J Obstet Gynecol 1989; 160: 95-100.
[298]
Murmurs in pregnancy; an audit of echocardiography. Br Med J 1992; 304: 1413-1414.
[299]
The effect of pregnancy on the murmurs of mitral and aortic regurgitation. Circulation 1970; 41: 795-805.
[300]
Physiologic multivalvar regurgitation during pregnancy: A longitudinal Doppler echocardiographic study. Int J Cardiol 1993; 40: 265-272.
[301]
Usefulness of percutaneous balloon commissurotomy for mitral stenosis during pregnancy. Am J Cardiol 1994; 73: 398-400.
[302]
Percutaneous balloon mitral valvotomy in pregnant patients with tight pliable mitral stenosis. Am Heart J 1993; 125: 1106-1109.
[303]
Closed mitral valvotomy during pregnancy: a 20 year experience. Scan J Thorac Cardiovasc Surg 1988; 22: 11-15.
[304]
Balloon valvuloplasty for congenital aortic stenosis in pregnancy. Br J Obstet Gynecol 1993; 100: 1141-1142.
[305]
Role of balloon dilatation of the aortic valve in pregnant patients with severe aortic stenosis. Br Heart J 1993; 70: 544-545.
[306]
Management of the parturient with severe aortic incompetence. J Cardiothorac Vasc Anesth 1995; 9: 575-577.
[307]
A prospective longitudinal evaluation of pregnancy in the Marfan syndrome. Am J Obstet Gynecol 1995; 173: 1599-1606.
[308]
Cardiovascular problemas in pregnant women with the Marfan syndrome. Ann Intern Med 1995; 123: 117-122.
[309]
Umbilical artery flow velocity during maternal cardiopulmonary by-pass. Ann Thorac Surg 1995; 60: 1116-1118.
[310]
Surg Clin North Am 1995; 75: 59-75.
[311]
Pregnancy complicated by aortic dissection. Caesarean delivery during extradural anaesthesia. Br J Anaesth 1995; 75: 358-360.
[312]
Repair of acute type A aortic disection after cesarean section in the thirty-ninth week of pregnancy. J Thoracic Cardiovasc Surg 1994; 107: 314-315.
[313]
Pregnancy and bioprostheses: influence on structural valve deterioration. Am Thorac Surg 1995; 60 (Supl 2): 282-286.
[314]
Outcome of pregnancy in women with valve prostheses. Br Heart J 1994; 71: 196-201.
[315]
Fetal and neonatal outcome of exposure to anticoagulants during pregnancy. Am J Med Genet 1993; 45: 17-21.
[316]
Guide to anticoagulant therapy. Part 2: oral anticoagulants. Circulation 1994; 89: 1469-1480.
[317]
Failure of adjusted doses of subcutaneous haeparin to prevent thromboembolic phenomena in pregnant patients with mechanical cardiac valve prostheses. J Am Coll Cardiol 1996; 27: 1704-1706.
[318]
Anticoagulation in pregnant women with prosthetic heart valves: a double jeopardy. J Am Coll Cardiol 1996; 27: 1704-1706.
[319]
Guidelines for prevention of thromboembolic events in valvular heart disease. Study group of the working group on valvular heart disease of the European Society of Cardiology. Eur Heart J 1995; 16: 1320-1330.
[320]
Comparison of aspirin with placebo in patients treated with warfarin after heart valve replacement. N Engl J Med 1993; 329: 524-529.
[321]
Use of antithrombotic agents during pregnancy. Chest 1995; 108 (Supl): 305-311.
[322]
Second natural history study of congenital heart defects: results of treatment of patients with aortic valvular stenosis. Circulation 1993; 87 (Supl 1): 16-27.
[323]
Valvuloplastia transluminal percutánea con catéter-balón en la estenosis congénita de la válvula aórtica. Rev Esp Cardiol 1985; 38: 396-403.
[324]
Intermediate-term follow-up results of balloon aortic valvuloplasty in infants and children with special reference to causes of restenosis. Am J Cardiol 1989; 64: 1356-1360.
[325]
Balloon aortic valvuloplasty in children. Clin Cardiol 1990; 13: 458-466.
[326]
A intermediate-term effectiveness of balloon valvuloplasty for congenital aortic stenosis. A prospective follow-up study. Circulation 1991; 84: 732-738.
[327]
Balloon aortic valvuloplasty in the young adult with congenital aortic stenosis. Am J Cardiol 1994; 73: 1112-1177.
[328]
Effectiveness of balloon valvuloplasty in the young adult with congenital aortic stenosis. Cathet Cardiovasc Diagn 1995; 36: 122-127.
[329]
Balloon aortic valvuloplasty for aortic stenosis in neonates, children, and young adults. J Interv Cardiol 1995; 8: 477-486.
[330]
Sudden unexpected death from cardiovascular disease in children: a cooperative international study. Am J Cardiol 1974; 34: 89-96.
[331]
Replacement of aortic and mitral valves with a pulmonary autograft. Lancet 1967; 2: 956-958.
[332]
Tratamiento quirúrgico de la estenosis aórtica crítica en el niño mediante la técnica de Ross-Konno. Rev Esp Cardiol 1999; 52: 71-74.
[333]
Reemplazo valvular aórtico con autoinjerto pulmonar (operación de Ross), en pacientes adultos y pediátricos. Estudio preliminar. Rev Esp Cardiol 1999; 52: 113-120.
[334]
Pulmonary autograft procedure for aortic valve disease: long-term results of the pioneer series. Circulation 1997; 96: 2206-2214.
[335]
Severe congenital mitral stenosis in infants. Circulation 1994; 89: 2099-2106.
[336]
Outcome in neonates with Ebstein's anomaly. J Am Coll Cardiol 1992; 19: 1041-1046.
[337]
Ebstein's anomaly: presentation and outcome from fetus to adult. J Am Coll Cardiol 1994; 23: 170-176.
[338]
Congenital pulmonary stenosis resulting from dysplasia of valve. Circulation 1969; 40: 43-53.
[339]
Report from the joint study on the Natural History of Congenital Heart Defects. Circulation 1977; 56 (Supl I): 1-87.
[340]
Long-term follow-up of congenital aortic stenosis, pulmonary stenosis, and ventricular septal defect: report from the Second Joint Study on the Natural History of Congenital Hearts Defects (NHS-2). Circulation 1993; 87 (Supl 1): 1-126.
[341]
Balloon pulmonary valvuloplasty: results of the Valvuloplasty and Angioplasty of Congenital Anomalies Registry. Am J Cardiol 1990; 65: 775-783.
[342]
Percutaneous balloon valvuloplasty for pulmonic stenosis in adolescents and adults. N Engl J Med 1996; 335: 21-25.
[343]
Success determining factors in percutaneous transluminal balloon valvuloplasty of pulmonary valve stenosis. Eur Heart J 1991; 12: 15-23.
[344]
Independent predictors of long-term results after balloon pulmonary valvuloplasty. Valvuloplasty and Angioplasty of Congenital Anomalies (VACA) Registry Investigators. Circulation 1994; 89: 1751-1759.
[345]
Long-term outcome in patients undergoing surgical repair of tetralogy of Fallot. N Engl J Med 1993; 329: 593-599.
[346]
Analysis of probability as an aid in the clinical diagnosis of coronary-artery disease. N Engl J Med 1979; 300: 1350-1358.
[347]
Matching the intensity of risk factor management with the hazard for coronary artery disease events: September 14-15, 1995. J Am Coll Cardiol 1996; 27: 957-1047.
[348]
Indicaciones de coronariografía preoperatoria en pacientes valvulares reumáticos. Estudio prospectivo de 300 casos consecutivos. Rev Esp Cardiol 1980; 333: 235-240.
[349]
Estudio angiográfico prospectivo de la enfermedad coronaria en pacientes con patología valvular crónica severa. Rev Esp Cardiol 1988; 41: 462-466.
[350]
¿Ha variado desde 1980 la indicación de coronariografía preoperatoria en pacientes valvulares? Estudio prospectivo de 300 nuevos casos consecutivos. Rev Esp Cardiol 1988; 41: 586-589.
[351]
Cirugía sin cateterismo en la cardiopatía valvular: antes y después de la técnica Doppler. Rev Esp Cardiol 1990; 43: 97-113.
[352]
Prevalencia de enfermedad coronaria en los pacientes con estenosis aórtica. Rev Esp Cardiol 1992; 45: 427-431.
[353]
Coronariografía preoperatoria en pacientes valvulares. Criterios de indicación en una determinada población. Rev Esp Cardiol 1997; 50: 467-473.
[354]
Coronariografía preoperatoria en pacientes valvulares. Análisis de probabilidad de lesión coronaria. Rev Esp Cardiol 1998; 51: 756-761.
[355]
Angina, coronary risk factors and coronary artery disease in patients with valvular disease: a prospective study. Eur Heart J 1984; 5: 716-726.
[356]
Prevalence of coronary artery disease in patients with valvular heart disease. Acta Med Scand 1985; 218: 365-371.
[357]
Reported frecuency of coronary arterial narrowing by angiogram in patients with valvular aortic stenosis. Am J Cardiol 1992; 70: 539-540.
[358]
Secular trends in coronary atherosclerosis-analysis in patients with valvular regurgitation. N Engl J Med 1996; 335: 316-322.
[359]
Aortic stenosis, angina pectoris, and coronary artery disease. Am Heart J 1977; 93: 382-393.
[360]
Relation of angina pectoris to coronary artery disease in aortic valve stenosis. Am J Cardiol 1985; 55: 1063-1065.
[361]
Coronary sinus blood flow at rest and during isometric exercise in patients with aortic valve disease: mechanism of angina pectoris in presence of normal coronary arteries. Am J Cardiol 1981; 47: 199-205.
[362]
Angina pectoris and coronary artery disease in severe aortic regurgitation. Am J Cardiol 1988; 61: 826-829.
[363]
Frequency of angiographically significant coronary arterial narrowing in mitral stenosis. Am J Cardiol 1986; 57: 802-805.
[364]
Exercise-induced regional wall motion abnormalities on radionuclide angiography: lack of reliability for detection of coronary artery disease in the presence of valvular heart disease. Am J Cardiol 1981; 47: 861-865.
[365]
Mechanisms of regional ischemic changes during dipyridamole echocardiography in patients with severe aortic valve stenosis and normal coronary arteries. Heart 1996; 75: 492-497.
[366]
Early results of aortic valve replacement with or without concomitant coronary artery bypass grafting. Scand J Thorac Cardiov Surg 1991; 25: 29-35.
[367]
Aortic valve replacement in the elderly: effect of gender and coronary artery disease on operative mortality. Circulation 1993; 88 (Supl II): 17-23.
[368]
Long-tern survival following aortic valve replacement. Am Heart J 1976; 91: 311-317
[369]
Aortic valve replacement with coronary bypass grafting: significant determinants of ten-year survival. J Thorac Cardiovasc Surg 1983; 85: 705-711.
[370]
Replacement of aortic valve combined with myocardial revascularization: determinants of early and late risk for 500 patients, 1967-1981. Circulation 1983; 68: 1149-1162.
[371]
Coronary artery disease and its management influence on survival in patients undergoing aortic valve replacement. J Am Coll Cardiol 1987; 10: 66-72.
[372]
The influence of coronary artery disease and bypass grafting on early and late survival after valve replacement for aortic stenosis. J Thorac Cardiovasc Surg 1990; 100: 327-337.
[373]
Thirty-year results of Starr- Edwards prostheses in the aortic and mitral position. Ann Thorac Surg 1997; 63: 613-619.
[374]
Pulmonary autograft aortic valve replacement: long-term results. J Cardiovasc Surg 1991; 6: 529-533.
[375]
The autologous tissue cardiac valve: a new paradigm for heart valve replacement. Ann Thorac Surg 1995; 60 (Supl 2): 189-194.
[376]
Allograft aortic valve replacement: long-term follow-up. Ann Thorac Surg 1995; 60 (Supl 2): 65-70.
[377]
Hemodynamic benefits of the Toronto stenless valve. J Thorac Cardiovasc Surg 1996; 112: 1431-1446.
[378]
Disfunción protésica. Rev Esp Cardiol 1990; 43: 569-580.
[379]
Rendimiento de las prótesis valvulares: seguimiento a largo plazo. Curr Probl Cardiol 1992; 7: 409-425.
[380]
Guidelines for reporting morbidity and mortality after cardiac valve operations. Eur J Cardiothorac Surg 1988; 2: 293-295.
[381]
Endocarditis protésica. Rev Esp Cardiol 1998; 51 (Supl 2): 58-63.
[382]
Biological versus mechanical valves: analysis of 1116 valves inserted in 1012 adult patients with a 4818 patient-year and a 5327 valve-year followup. J Thorac Cardiovasc Surg 1987; 93: 182-198.
[383]
Twelve-year comparison of a Björk-Shiley mechanichal heart valve with porcine bioprostheses. N Engl J Med 1991; 324: 573-579.
[384]
Treatment of acute streptococcal pharyngitis and prevention of rheumatic fever: a statement for health professionals. Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young, the American Heart Association. Pediatrics 1995; 96: 758-764.
[385]
Indicaciones actuales del tratamiento antitrombótico en la enfermedad valvular. Rev Esp Cardiol 1991; 44: 190-202.
[386]
Transesophageal echocardiography for the diagnosis and manegement of nonobstructive thrombosis of mechanichal mitral valve prosthesis. Circulation 1995; 91: 103-110.
[387]
Factores clínicos y ecocardiográficos predictivos de rotura de velos bioprotésicos. Tolerancia clínica a la disfunción protésica. Rev Esp Cardiol 1994; 47: 609-615.
[388]
Valoración del mecanismo de disfunción de las bioprótesis mitrales mediante ecocardiografía transesofágica. Rev Esp Cardiol 1994; 47: 454-460.
[389]
Endocarditis infecciosa activa complicada con absceso paravalvular. Revisión de 40 casos. Rev Esp Cardiol 1991; 44: 306-312.
[390]
Clinical course, microbiologic profile, and diagnosis of periannular complications in prosthetic valve endocarditis. Am J Cardiol 1999; 83: 1075-1079.
[391]
Guidelines for management of left-sided prosthetic valve thrombosis: a role for thrombolytic therapy. J Am Coll Cardiol 1997; 30: 1521-1526.
[392]
Clinical outcome and long-term prognosis of late prosthetic valve endocarditis: a 20-year experience. Clin Infect Dis 1997; 24: 381-386.
[393]
La confrontación prótesis mecánicas versus biológicas en 1991. Rev Esp Cardiol 1991; 44: 330-340.
[394]
Bioprosthetic valve replacement in the elderly. Eur Heart J 1995; 16: 529-533.