Las miocardiopatías constituyen un conjunto extraordinariamente heterogéneo de procesos que sólo tienen en común que afectan el músculo cardíaco y que causan un amplio espectro de formas de disfunción del mismo. El enfoque del manejo y tratamiento de las miocardiopatías es objeto permanente de discusión porque la mayor parte de alternativas en este campo no se han basado en la mejor evidencia científica posible, puesto que con la excepción del tratamiento de la insuficiencia cardíaca en el contexto de la miocardiopatía dilatada, la mayoría de las diferentes opciones no han sido estudiadas mediante amplios (ni reducidos) ensayos clínicos. Pese a ello, este capítulo ha intentado proporcionar al lector las diversas formas de enfocar los problemas clínicos de mayor importancia en la miocardiopatía dilatada, hipertrófica y restrictiva, así como en la miocarditis. Se ha empleado para ello la información más relevante que ha podido localizarse, en consonancia con nuestro propio juicio clínico, aun admitiendo que muchas de las recomendaciones puedan resultar controvertidas.
Palabras clave
Miocardiopatías
Miocarditis
Guías clínicas
INTRODUCCIÓN
Las miocardiopatías se definen como el conjunto de enfermedades del miocardio que causan una mala función del mismo 1. De entre las múltiples clasificaciones que se han realizado de las miocardiopatías, hoy día se acepta comúnmente la de la WHO/ISFC 1. Esta clasificación se realiza según el modelo fisiopatológico o, de ser posible, por los factores etiológicos/patogénicos, dividiéndose en dilatada, hipertrófica, restrictiva, displasia arritmogénica de ventrículo derecho y las denominadas miocardiopatías específicas, incluyendo estas últimas la miocardiopatía isquémica, valvular, hipertensiva y todo un conjunto de formas secundarias a una variedad de agentes y causas, entre las que se encuentra la miocarditis.
Este capítulo se centra en las 3 formas consideradas clásicas, a saber, la miocardiopatía dilatada, hipertrófica y restrictiva, e incluye también la miocarditis, que se considera una miocardiopatía inflamatoria.
Los 4 temas se han centrado en aspectos de manejo y tratamiento, con una introducción previa de aspectos más generales de cada miocardiopatía. En todo momento se ha intentado hacer énfasis en recomendaciones específicas basadas en los niveles de evidencia, aunque en algunos temas, especialmente en los referentes a la miocardiopatía restrictiva y la miocarditis, existe poca información y consenso sobre aspectos concretos.
Miocardiopatía dilatada
La miocardiopatía dilatada (MD) es una causa frecuente de insuficiencia cardíaca 2-5 y es el diagnóstico más frecuente en pacientes sometidos a trasplante cardíaco 6. Desde el punto de vista clínico, la MD se caracteriza por dilatación y disfunción contráctil del ventrículo izquierdo o de ambos ventrículos. La dilatación ventricular es generalmente severa y se acompaña siempre de hipertrofia 1.
La MD puede ser idiopática, genética/familiar, viral y/o inmune, alcohólica/tóxica, o asociada a otras cardiopatías en las cuales el grado de disfunción miocárdica no se explicaría por una determinada sobrecarga hemodinámica o severidad de daño isquémico 1,4. Probablemente, el síndrome clínico de la MD representa un final común al que se llega a través de múltiples mecanismos citotóxicos, metabólicos, inmunológicos, infecciosos y familiares 4. El alcohol, por ejemplo, puede producir disfunción miocárdica severa, con manifestaciones clínicas, hemodinámicas y anatomopatológicas idénticas a las de la MD idiopática 7.
Causas de miocardiopatía dilatada
El síndrome de la MD puede estar causado por una gran diversidad de enfermedades específicas (tabla 1),
aunque la mayoría de los casos son de origen idiopático. En una serie reciente de 673 pacientes con insuficiencia cardíaca estudiados en un centro terciario y evaluados con historia clínica, exploración física, analítica general, coronariografía y biopsia endomiocárdica, el 47% de los casos eran idiopáticos, el 12% miocarditis, el 11% enfermedad coronaria oculta y el 31% restante debidos a causas diversas 8. La diferenciación entre las formas idiopáticas y las secundarias es importante, dado que algunas de estas últimas pueden ser potencialmente reversibles.
Anatomía patológica
Los estudios post mortem demuestran habitualmente dilatación de las cuatro cámaras cardíacas, en especial los ventrículos, que se acompaña a veces de aumento de grosor de la pared. Las válvulas cardíacas son intrínsecamente normales y es frecuente la presencia de trombos intracavitarios 3,5,9. Desde el punto de vista histológico, es típica la presencia de miocitos hipertróficos y muertos, sustituidos por fibrosis con variable afectación del sistema de conducción. Los componentes de la matriz extracelular están aumentados de forma no selectiva 10. Aunque la ausencia de células inflamatorias se utiliza como criterio para diferenciar la MD de la miocarditis, en algunos casos de MD se detectan células T inflamatorias y células endoteliales activadas, sugiriendo la posible contribución de un proceso inflamatorio crónico en la patogenia de esta enfermedad 11.
Etiología y patogenia
La etiología y los mecanismos patogénicos son desconocidos en alrededor de la mitad de los casos de MD 8. Para explicar el daño miocárdico crónico y progresivo se han propuesto tres principales etiopatogenias: a) infección viral crónica del miocardio que produce daño celular; b) alteración de los mecanismos inmunes que conduce probablemente a una enfermedad autoinmune, y c) factores genéticos que serían directa o indirectamente responsables de la enfermedad 5,12-14. La importancia de los factores genéticos ha sido poco valorada durante muchos años. Así, en un estudio retrospectivo realizado en la Clínica Mayo en 1981, sólo un 2% de los casos se identificaron como familiares 4. En los últimos años, sin embargo, diversos estudios prospectivos han demostrado claramente la existencia de transmisión genética de la enfermedad en al menos un 25% de los casos 15-19. No obstante, la verdadera frecuencia de las formas familiares de MD debe estar todavía infraestimada, debido a que, salvo la historia familiar, no existe ninguna característica clínica o histopatológica que permita distinguir las formas familiares de las no familiares. Además, es posible que muchos casos considerados como esporádicos sean realmente formas familiares con mutaciones de novo, penetrancia incompleta o tardía, o evaluación familiar insuficiente 14.
La MD familiar (MDF) es una enfermedad clínica y genéticamente heterogénea 20, como sugieren los diferentes patrones de herencia identificados, entre los que predomina la autosómica dominante, y las diferentes manifestaciones clínicas, pudiendo distinguirse varias formas de la enfermedad 21: a) la MDF pura autosómica dominante, para la que se han identificado 3 locus cromosómicos diferentes, en los cromosomas 9q13-22, 1q32 y 10q21-23, con múltiples genes candidatos identificados en cada locus (recientemente se ha podido comprobar que mutaciones en el gen de la actina cardíaca pueden ser causa de MDF con este tipo de herencia) 22; b) la forma autosómica dominante que se precede de alteraciones de conducción, con tres locus en cromosomas 3p22-25, 1p1-1q1 y 19q13.2-13.3; c) la forma autosómica dominante asociada a miopatía; d) la forma autosómica recesiva; e) la ligada al cromosoma X, por mutaciones en el gen de la distrofina; f) la MD mitocondrial, y g) la miocardiopatía de ventrículo derecho, que puede simular una MD u otras formas de miocardiopatía.
Es posible que exista, además, una predisposición familiar a la MD de origen inmune, aunque hasta ahora no se ha identificado ningún defecto genético en la región del HLA 23.
DIAGNÓSTICO
El estudio del paciente con MD debe enfocarse no sólo al establecimiento del diagnóstico sindrómico, sino hacia la identificación, por los métodos de diagnóstico habituales, de posibles causas tratables o reversibles de la enfermedad 5,24.
La historia clínica debe incluir preguntas relativas al posible consumo de alcohol y cocaína, medicamentos, hábitos nutricionales, estancias en zonas endémicas para infecciones, relación con animales, embarazos recientes, transfusiones sanguíneas, historia familiar de MD, somnolencia diurna y exposición profesional a tóxicos 5. Asimismo, la idea de que la MD idiopática es con frecuencia un problema genético hereditario debe ser tenida en cuenta en la práctica clínica, estudiando sistemáticamente a los familiares de primer grado del paciente 12.
En la mayoría de los pacientes la MD se manifiesta clínicamente entre los 20 y 60 años de edad, aunque la enfermedad puede afectar también a niños y ancianos 5. Los síntomas más frecuentes son los de insuficiencia cardíaca (disnea de esfuerzo progresiva, ortopnea, disnea paroxística nocturna y edemas periféricos). Otras formas de presentación son la detección accidental de cardiomegalia asintomática y los síntomas relacionados con arritmias, alteraciones de conducción, complicaciones tromboembólicas o muerte súbita 5.
La exploración física suele revelar diferentes grados de cardiomegalia y signos de insuficiencia cardíaca. La presencia de un galope presistólico (cuarto ruido) puede preceder a la aparición de insuficiencia cardíaca. El ritmo de galope ventricular (tercer ruido) es la regla en los casos con descompensación de la IC. Es frecuente la presencia de soplos sistólicos de insuficiencia mitral o, menos frecuentemente, tricuspídea 5.
En todo paciente con MD se debe realizar una analítica rutinaria que incluya determinación de hormonas tiroideas y hierro sérico. Dependiendo de las posibilidades diagnósticas derivadas de la historia y exploración física, deberán realizarse otras pruebas de laboratorio más específicas, como las siguientes: anticuerpos antinucleares y otras pruebas serológicas para lupus, determinación de tiamina, carnitina y selenio, anticuerpos antimiosina, evaluación para descartar feocromocitoma, serología viral y pruebas genéticas 5.
En el electrocardiograma, los pacientes con MD presentan frecuentemente bloqueo AV de primer grado, bloqueo completo de rama izquierda, hemibloqueo anterior o alteraciones inespecíficas de conducción intraventricular. Además, un tercio de los pacientes con MD pueden presentar fibrilación auricular. La presencia de taquicardia persistente, como en el caso de fibrilación auricular con rápida respuesta ventricular, puede dar lugar a cierta confusión, dado que la propia arritmia puede ser causa de MD (taquimiocardiopatía) 25.
La radiografía de tórax suele poner de manifiesto cardiomegalia y redistribución venosa por insuficiencia cardíaca 5.
La ecocardiografía bidimensional y Doppler es fundamental para confirmar el diagnóstico, así como muy útil para evaluar el grado de dilatación y disfunción ventricular y para excluir una patología valvular o pericárdica asociada 5. El estudio Doppler permite conocer la severidad de la regurgitación mitral y tricúspide. Además, la presencia de un patrón restrictivo de llenado ventricular parece que identifica un grado más avanzado de enfermedad 26.
La ventriculografía isotópica de primer paso o en equilibrio permite, al igual que la ecocardiografía, estudiar los diámetros y función ventricular, sistólica y diastólica, y la presencia de alteraciones en la motilidad regional, siendo particularmente útil en casos con mala ventana ecocardiográfica 5 y para la valoración de la función ventricular derecha, que tiene importancia pronóstica. Por el contrario, los estudios isotópicos de perfusión con talio 201 y tecnecio 99 no permiten distinguir la MD idiopática de la isquémica 5,27.
La realización de pruebas de estrés físico o farmacológico (en particular la ecocardiografía de ejercicio o tras infusión de dobutamina) es útil para valorar la posible presencia de enfermedad coronaria 28. Por otro lado, las pruebas de esfuerzo cardiopulmonares, con medida del consumo máximo de oxígeno (VO 2 máximo) durante el ejercicio máximo, permiten una valoración objetiva de la capacidad funcional en pacientes con insuficiencia cardíaca 29. Además, la realización de estas pruebas de manera seriada proporciona una información longitudinal muy útil como guía para el tratamiento médico y para alertar al clínico sobre un posible deterioro del estado funcional del paciente 29-31. Un VO 2 máximo inferior a 10-12 ml/kg/min predice una alta mortalidad el primer año (superior al 50%) y se utiliza para la identificación de pacientes que precisan trasplante cardíaco. Otros protocolos de ejercicio pueden ser también utilizados como método alternativo de estimación de la capacidad máxima de ejercicio cuando no es posible obtener el VO 2 máximo 29.
El beneficio de realizar una coronariografía a todos los pacientes con MD no está claro, porque la mayoría o no tienen enfermedad coronaria, o de tenerla, no existe viabilidad para acometer una revascularización. Por consiguiente, la realización sistemática de coronariografía en pacientes con MD constituye una recomendación clase IIb 32. No obstante, debe efectuarse a aquellos pacientes con alta sospecha de enfermedad coronaria y posibilidades de miocardio isquémico-hibernado. Aquí se incluirían pacientes con angina evidente o a quienes una prueba de viabilidad miocárdica ha resultado positiva.
La cateterización de arteria pulmonar puede ser útil como guía para el tratamiento con diuréticos y vasodilatadores parenterales en pacientes con insuficiencia cardíaca severa o en pacientes sometidos a tratamiento convencional que presentan síntomas refractarios 32. El estudio de posibles candidatos a trasplante cardíaco debe incluir cateterismo cardíaco, con determinación de las resistencias pulmonares, fundamental para poder realizar dicho procedimiento 33.
El papel de la biopsia endomiocárdica en la valoración de la etiología de la MD es un tema controvertido. En manos expertas, el riesgo es bajo (menos de un 1% de complicaciones mayores y entre 3 y 4% de complicaciones menores), pero la información clínica que se obtiene de la misma es también baja 34,35. Existe consenso en que la biopsia endomiocárdica no debe emplearse sistemáticamente en la MD (recomendación clase III). Esta recomendación podría cambiar en el caso de que terapias antivirales específicas, como el interferón alfa, demuestren su eficacia en pacientes seleccionados 36. En la actualidad, la biopsia endomiocárdica podría tener sentido en pacientes en los que exista sospecha de alguna enfermedad sistémica que pueda afectar al miocardio, como la hemocromatosis, amiloidosis o sarcoidosis 24, pero en general estas enfermedades suelen poder ser diagnosticadas la mayoría de veces a partir de la afectación de otros órganos (hígado, recto, pulmón).
En pacientes con insuficiencia cardíaca y MD, independientemente de la etiología de ésta, es frecuente la presencia de arritmias supra y ventriculares, que pueden ser causa de síntomas, de morbilidad (como embolia cerebral por fibrilación auricular) y muerte súbita cardíaca. Por ello, la identificación de estas arritmias y de los pacientes con alto riesgo de sufrirlas es un elemento fundamental en el manejo clínico de estos casos 5,37.
La monitorización electrocardiográfica ambulatoria (Holter) es útil para la detección de arritmias asintomáticas (alrededor de la mitad de los pacientes con MD presentan salvas de taquicardia ventricular no sostenida) y para el control de la respuesta al tratamiento en pacientes con arritmias espontáneas frecuentes. No está claro que la presencia de arritmias ventriculares frecuentes y complejas se correlacione con una mayor probabilidad de muerte súbita, aunque sí parece que predice una mayor mortalidad total 37,38.
En el momento actual es controvertido el valor de las pruebas de estimulación eléctrica programada en la identificación de pacientes con MD con riesgo de muerte súbita; la no inducibilidad de arritmias ventriculares no identifica con seguridad a pacientes de menor riesgo y la supresión farmacológica de las arritmias inducibles no predice necesariamente la ausencia de recurrencias. Por tanto, estas pruebas sólo estarían justificadas en estos pacientes en casos con taquiarritmias sintomáticas o que hayan sobrevivido a una fibrilación ventricular 37.
La detección de potenciales tardíos mediante la electrocardiografía con promediado de señales es un predictor independiente de muerte súbita aceptado en pacientes con infarto de miocardio. Aunque esta técnica ha sido aplicada también en pacientes con MD, su eficacia en estos casos es incierta 37,39. La presencia de potenciales tardíos no predice mortalidad en pacientes en espera de trasplante cardíaco.
La dispersión del intervalo QT (> 140 ms) puede ser un predictor de mortalidad en pacientes con MD en espera para trasplante 40.
La escasa variabilidad de la frecuencia cardíaca puede ser predictor de mortalidad en pacientes con insuficiencia cardíaca 41.
Historia natural y predictores de supervivencia
El curso clínico de los pacientes con MD es bastante impredecible en cada caso concreto y depende en parte de la causa de la disfunción ventricular 5. La morbilidad y mortalidad en pacientes con IC son extremadamente altas. En un estudio reciente sobre la influencia del tratamiento inmunosupresor en la miocarditis, por ejemplo, la mortalidad para todo el grupo fue del 20% a un año y del 56% a los 4,3 años 42. Aunque la introducción de nuevas estrategias de tratamiento (en particular los inhibidores de la ECA) ha permitido una mejoría de la supervivencia, diversos estudios longitudinales sugieren que esta mejoría es escasa 43. Una posible explicación a este hecho es que, durante el período en que se realizaron estos estudios, sólo una minoría de pacientes recibían un tratamiento adecuado.
Las dos causas más frecuentes de muerte en pacientes con MD e insuficiencia cardíaca son la muerte súbita y el fallo de bomba progresivo 5. Los datos de la bibliografía indican que entre el 30 y el 50% de los pacientes mueren súbitamente 37. La identificación y tratamiento de los pacientes de alto riesgo es uno de los principales retos que se le plantean al clínico.
Mediante análisis univariados, se han identificado múltiples factores predictores de mortalidad en pacientes con insuficiencia cardíaca (tabla 2).
Muchos de estos factores suponen medidas directas o indirectas de la severidad de la disfunción ventricular. Entre ellos, los más importantes son la clase funcional de la New York Heart Association (NYHA), la fracción de eyección ventricular izquierda y el VO 2 máximo obtenido durante la prueba de esfuerzo cardiopulmonar 5,29,31. Estos determinantes pronósticos asumen que la causa de la disfunción miocárdica no tiene tratamiento específico.
La mayoría de pacientes con MD e insuficiencia cardíaca presentan frecuentemente uno o más de los predictores de mal pronóstico anteriormente mencionados a pesar del tratamiento médico. Aunque con algunas limitaciones, la medida del VO 2 máximo si-gue siendo el mejor predictor objetivo de superviven-cia 29-31. Por tanto, si se dispone de la técnica, se debería realizar una determinación basal del VO 2 máximo en todos los pacientes con MD sintomática. La indicación de un trasplante cardíaco debería ser considerada en candidatos adecuados si, a pesar de un tratamiento correcto, el VO 2 máximo continúa bajando y desciende por debajo de 10-12 ml/kg/min 29-31.
Algunos pacientes con MD muestran disfunción ventricular severa, insuficiencia cardíaca severa y mal pronóstico a pesar de presentar muy poca dilatación ventricular (MD con poca dilatación) 44.
Tratamiento de la miocardiopatía dilatada
(véase la tabla 3 para niveles de recomendación)
Dado que la causa de la MD idiopática es desconocida, hasta ahora no es posible una terapéutica específica de esta enfermedad. Los intentos de tratamiento inmunosupresor, basados en la hipótesis de que la autoinmunidad desempeña un papel etiológico en una alta proporción de pacientes con MD, no han aportado los resultados esperados, por lo que, desde un punto de vista práctico y salvo con fines experimentales concretos, los inmunosupresores no están indicados en el tratamiento de la MD (recomendación clase III) 42. Por otro lado, la posibilidad de que la causa de la disfunción ventricular sea reversible, aplicando medidas terapéuticas específicas debe ser siempre tenida en consideración. Ejemplos frecuentes serían la revascularización coronaria en la MD de origen isquémico cuando existe viabilidad, la supresión de la ingesta etílica en la miocardiopatía alcohólica y la conversión a ritmo sinusal o el control de la respuesta ventricular en casos de fibrilación auricular 5,24,25,45-47.
El tratamiento de los pacientes con MD tiene por objeto: a) controlar los síntomas de insuficiencia cardíaca; b) evitar la progresión de la disfunción ventricular; c) evitar o retrasar la aparición de insuficiencia cardíaca clínica en pacientes con MD asintomática, y d) aumentar la supervivencia. Para ello disponemos en la actualidad de numerosas medidas terapéuticas, tanto farmacológicas como no farmacológicas. Aunque la mayoría de estas medidas son muy eficaces para el control de los síntomas de insuficiencia cardíaca, sólo algunas consiguen un efecto favorable sobre el pronóstico de estos pacientes 5,24,32,48-53.
Algunas medidas generales son recomendables para la mayoría de los pacientes con insuficiencia cardíaca en general. Entre ellas, el abandono del tabaco, la reducción de peso en obesos, el control de la hipertensión, hiperlipemia y diabetes y la reducción de la ingesta alcohólica son beneficiosas para evitar un mayor daño miocárdico. La restricción de la ingesta de sal ayuda a mantener el balance hídrico. La práctica de ejercicio físico moderado, a un nivel adaptado a la situación clínica del paciente, ayuda a mejorar su capacidad de esfuerzo y su situación física general. La aplicación de vacunas antigripal y neumocócica puede disminuir el riesgo de infecciones respiratorias graves y de descompensación cardíaca 48-53.
Diuréticos. Los diuréticos de asa deben ser utilizados en todos los pacientes con síntomas de insuficiencia cardíaca y evidencia de retención hídrica o predisposición a ella (recomendación clase I), ya que son el arma más eficaz para conseguir este objetivo. No obstante, aunque necesarios, los diuréticos no son suficientes, y no deberían ser utilizados como único tratamiento, sino asociados generalmente a inhibidores de la ECA o betabloqueantes 48.
Inhibidores de la enzima convertidora de la angiotensina. Los inhibidores de la enzima de conversión de angiotensina (IECA) han sido ensayados en más de 30 estudios controlados, que incluyeron más de 7.000 pacientes con insuficiencia cardíaca por disfunción sistólica de diversas etiologías y grados de severidad 48,51,53-57. El análisis de esta amplia experiencia indica que los IECA pueden aliviar los síntomas y mejorar el estado clínico de los pacientes con insuficiencia cardíaca crónica 48,57. Asimismo, estos fármacos pueden disminuir el riesgo de muerte, así como el riesgo combinado de muerte u hospitalización 57. El beneficio de los IECA se ha observado en pacientes con síntomas ligeros, moderados y severos y en pacientes con y sin enfermedad coronaria 51,52. Por tanto, todos los pacientes con MD e insuficiencia cardíaca deberían ser tratados con un IECA, salvo que hayan presentado intolerancia o tengan alguna contraindicación para el uso de este tipo de fármacos (recomendación clase I) 48. En pacientes con evidencia o antecedentes de retención hídrica, los IECA se deben asociar a diuréticos. Los IECA se recomiendan también en pacientes con disfunción sistólica sin clínica de insuficiencia cardíaca 48,58. Aunque los estudios clínicos sugieren que todos los IECA podrían tener efectos igualmente favorables, se debería dar preferencia a aquellos fármacos y dosis utilizados en los grandes ensayos clínicos 59.
Bloqueantes betaadrenérgicos. Los betabloqueantes (en particular bisoprolol, metoprolol y carvedilol) han sido hasta la fecha ensayados en alrededor de 10.000 pacientes con insuficiencia cardíaca en más de 20 ensayos clínicos controlados 48,51.60-67. Todos estos estudios incluyeron pacientes con disfunción sistólica que ya tomaban diuréticos y un IECA, con o sin digital. La experiencia con betabloqueantes incluye muy diversos tipos de pacientes, con diferentes causas y severidad de la disfunción ventricular 51. Esta amplia experiencia indica que el tratamiento a largo plazo con betabloqueantes puede disminuir los síntomas y mejorar la situación clínica de los pacientes con insuficiencia cardíaca crónica. Además, al igual que los IECA, los betabloqueantes pueden disminuir el riesgo de muerte y el combinado de muerte y hospitalización. Estos beneficios se han observado en pacientes que ya recibían tratamiento con IECA, lo que sugiere que la inhibición combinada de dos mecanismos neurohormonales puede producir efectos aditivos 48,67.
Por tanto, los pacientes con MD e insuficiencia cardíaca estable en clase funcional II-III de la NYHA deberían ser tratados con un betabloqueante salvo que tengan alguna contraindicación o no toleren el tratamiento (recomendación clase I) 48,51,53; generalmente los betabloqueantes se usan asociados a diuréticos e IECA 48,53. El tratamiento con betabloqueantes debe iniciarse con dosis muy bajas, con incrementos progresivos cada 2-4 semanas si la tolerancia es buena, siendo necesario un estricto control clínico del paciente durante la fase de ajuste de la dosis. Existen pocos datos sobre el efecto de los betabloqueantes en pacientes inestables o que estén o hayan estado recientemente en clase funcional IV, por lo que no se recomienda dicho tratamiento en este tipo de pacientes 48,53.
Se desconoce si existen diferencias en el efecto terapéutico entre diferentes betabloqueantes, aunque los ensayos clínicos han demostrado efectos favorables, tanto con betabloqueantes selectivos como con no selectivos. La posibilidad de que el bloqueo multirreceptor sea superior al bloqueo monorreceptor está siendo actualmente estudiada de manera prospectiva en el estudio COMET (Carvedilol or Metoprolol European Trial) que compara los efectos sobre la supervivencia del carvedilol y metoprolol en más de 3.000 pacientes con insuficiencia cardíaca crónica tratados a lo largo de 4 años 48,51.
Digital. Los resultados de diferentes estudios controlados con placebo en pacientes con miocardiopatía isquémica y no isquémica, de los que sólo uno incluye seguimiento a largo plazo (DIG, Digitalis Investigation Group), indican que el principal beneficio de la digoxina en pacientes con insuficiencia cardíaca es el alivio de los síntomas y la mejoría clínica del paciente, con disminución del riesgo de hospitalización (recomendación clase I). Sin embargo, la digoxina no parece tener un efecto significativo sobre la supervivencia de estos pacientes 48,51,68.
La digoxina, junto con los diuréticos, IECA y betabloqueantes, se recomienda para mejorar la situación clínica de los pacientes con insuficiencia cardíaca por disfunción sistólica. Asimismo, está indicada en pacientes con fibrilación auricular con rápida respuesta ventricular, aunque los betabloqueantes pueden ser más eficaces para controlar la respuesta ventricular durante el ejercicio en estos casos 48,53.
Hidralazina y dinitrato de isosorbide. La combinación de hidralazina y dinitrato de isosorbide no debe utilizarse en pacientes con insuficiencia cardíaca en los que no se hayan probado antes los IECA 48,53,55. No obstante, y aun en ausencia de datos sobre la utilidad de esta combinación en pacientes con intolerancia a los IECA, la utilización de hidralazina y dinitrato de isosorbide debería ser considerada como una alternativa terapéutica en esos pacientes, en particular en los que tienen hipotensión o insuficiencia renal. No existen evidencias que apoyen la utilización de nitratos o hidralazina por separado en pacientes con insuficiencia cardíaca 48.
Antagonistas de receptores de angiotensina II. Hasta la fecha, no existe evidencia clara de que los antagonistas de los receptores de la angiotensina II (ARAII) sean superiores o equivalentes a los IECA en el tratamiento de pacientes con insuficiencia cardíaca por MD 48,69. Por tanto, estos fármacos no deberían ser utilizados en pacientes en los que no se hayan ensayado previamente los IECA. La utilización de ARAII en lugar de IECA es razonable sólo en pacientes que no toleran los IECA debido a angioedema o tos no controlable, dado que los otros efectos secundarios (hipotensión, insuficiencia renal, hipercalemia) pueden aparecer con igual probabilidad que con los IECA 48. Varios estudios multicéntricos están estudiando actualmente los efectos de los ARAII sobre la supervivencia, tanto asociados a IECA como en lugar de éstos.
Calcioantagonistas. Debido a la falta de evidencias que apoyen su eficacia, los antagonistas del calcio no deben ser utilizados para el tratamiento de la insuficiencia cardíaca 48. Los grandes ensayos clínicos (PRAISE, V-HeFT III, MACH-1, DiDi) con nuevos calcioantagonistas no han aportado evidencias de que el tratamiento crónico con estos fármacos pueda mejorar los síntomas de insuficiencia cardíaca o prolongar la vida de los pacientes 48,53,70-72. Debido a las dudas existentes sobre su seguridad, la mayoría de los calcioantagonistas deben ser evitados en pacientes con insuficiencia cardíaca (recomendación clase III). Existe, sin embargo, evidencia suficiente de que el amlodipino no afecta negativamente la supervivencia 70. La posibilidad de que el amlodipino tenga un efecto favorable sobre la supervivencia en pacientes con MD no isquémica requiere todavía confirmación, y está siendo actualmente estudiada (estudio PRAISE II).
Antagonistas de la aldosterona. Sobre la base de los resultados del estudio RALES (Randomized Aldactone Evaluation Study) 73,74, que demuestran una significativa reducción en mortalidad, necesidad de hospitalización por insuficiencia cardíaca y riesgo combinado en pacientes con insuficiencia cardíaca severa tratados con espironolactona (hasta 25 mg/día), el uso de bajas dosis de espironolactona está indicado en pacientes con insuficiencia cardíaca en clase funcional III o IV (recomendación clase I) 48,53. La eficacia y seguridad de los antagonistas de la aldosterona en pacientes con IC leve o moderada siguen siendo desconocidas 48.
Inotrópicos. La administración oral de diversos agentes inotrópicos positivos, entre los que se incluyen los inhibidores de la fosfodiesterasa (milrinona), agonistas betaadrenérgicos (xamoterol), vesnarinona y agentes dopaminérgicos (como la ibopamina) se ha asociado con una mayor mortalidad, por lo que se desaconseja su uso en pacientes con MD e insuficiencia cardíaca (recomendación clase III) 48,53. Sin embargo, la administración intravenosa intermitente de alguno de estos fármacos (dobutamina, milrinona) puede producir un beneficio sintomático en algunos pacientes con insuficiencia cardíaca refractaria 75. En algunos casos este beneficio puede durar algunas semanas 76. No obstante, su uso a largo plazo puede aumentar la mortalidad 77. Por tanto, la ausencia de datos sobre su eficacia y sus posibles riesgos hacen que no se pueda recomendar el uso de infusiones intermitentes de estos fármacos para el tratamiento de la insuficiencia cardíaca, incluso en estadios avanzados 48,53.
Antiarrítmicos. Dado que los pacientes con disfunción ventricular e insuficiencia cardíaca tienen alta incidencia de arritmias ventriculares frecuentes y complejas y un alto riesgo de muerte súbita, ha existido un gran interés en el tratamiento antiarrítmico de estos pacientes 37,78. Aunque todos los fármacos antiarrítmicos pueden ser capaces de suprimir la actividad ectópica ventricular, este efecto no se acompaña de una reducción en el riesgo de muerte súbita en ensayos clínicos controlados 79. Por el contrario, la mayoría de los fármacos antiarrítmicos tienen efecto inotrópico negativo y pueden aumentar el riesgo de arritmias graves, en especial en pacientes con disfunción sistólica severa 80,81. Por tanto, no se recomienda de forma general el tratamiento antiarrítmico de los pacientes con arritmias ventriculares asintomáticas o no sostenidas. La utilización de fármacos o dispositivos antiarrítmicos debería reservarse para pacientes con a) taquicardia ventricular sostenida o sintomática, fibrilación ventricular o historia de muerte súbita resucitada, o b) arritmias auriculares recurrentes o sostenidas. En estos pacientes, el tratamiento debe ser individualizado y supervisado por un electrofisiólogo en caso necesario 37,48.
Los agentes antiarrítmicos de clase I no deben ser utilizados en pacientes con disfunción ventricular, excepto para el tratamiento inmediato de arritmias ventriculares graves refractarias a otros tratamientos 48. Algunos antiarrítmicos de clase III, como la amiodarona, no parecen aumentar el riesgo de muerte en pacientes con insuficiencia cardíaca 82,83, por lo que son los preferibles para el tratamiento de las arritmias auricu-lares en estos pacientes. No obstante, debido a su toxicidad y a las equívocas evidencias en cuanto a su eficacia 82,83, no se recomienda el uso general de la amiodarona para prevenir la muerte súbita en pacientes ya tratados con fármacos que reducen la mortalidad, como los IECA y betabloqueantes 48,51.
Anticoagulantes. En ausencia de ensayos clínicos definitivos, no está aclarado qué pacientes con MD e insuficiencia cardíaca deben recibir tratamiento anticoagulante (recomendación clase IIb). La utilización de anticoagulantes orales estaría justificada en aquellos pacientes con insuficiencia cardíaca descompensada, antecedentes de episodios embólicos o que estén en fibrilación auricular (recomendación clase I) 32,48,84.
Otros fármacos. Diversos fármacos, como los antagonistas de los receptores de endotelina 85, están siendo ensayados a nivel experimental. La administración de flosequinan se ha asociado con una mayor mortalidad 86. Asimismo, la administración de prostaciclina en infusión continua no mejora la situación clínica de los pacientes y aumenta la mortalidad 87. Por tanto, por una u otra razón, ninguno de estos fármacos son recomendables actualmente para el tratamiento de pacientes con MD e insuficiencia cardíaca (recomendación clase III).
No existen grandes estudios prospectivos a largo plazo que analicen el efecto del tratamiento farmacológico en pacientes asintomáticos con MD. No obstante, la extrapolación de los favorables resultados obtenidos en algunos ensayos con IECA que incluían pacientes de estas características (como el SOLVD y el Munich Mild Heart Failure Trial) 58,88 justifican el uso de este tipo de fármacos en estos pacientes (recomendación clase I).
En los grandes ensayos clínicos de tratamiento de la insuficiencia cardíaca, la inclusión de los pacientes se basa habitualmente en características demográficas y de severidad de la disfunción ventricular, sin tener en cuenta la etiología de ésta. Sin embargo, algunos estudios recientes sugieren que la causa de la disfunción ventricular (en particular si es isquémica o no isquémica) puede influir en su pronóstico a largo plazo y en la respuesta a ciertas intervenciones terapéuticas 51. Algunos estudios, aunque no todos, sugieren que el pronóstico puede ser mejor en la disfunción ventricular no isquémica que en la isquémica 51. Los resultados contradictorios sobre los beneficios de los IECA en pacientes isquémicos y no isquémicos hacen imposible establecer recomendaciones firmes sobre el uso de estos agentes en relación con la etiología de la disfunción ventricular 55,57. El carvedilol 64-66 y, recientemente, el bisoprolol 62 han demostrado una reducción de la mortalidad, tanto en pacientes isquémicos como no isquémicos. Asimismo, la digoxina, el amlodipino y la amiodarona han demostrado mejores resultados en pacientes no isquémicos 68,70,83. No existe actualmente una explicación clara para estas diferencias. La realización de futuros estudios para aclarar los efectos de la etiología de la disfunción ventricular sobre la respuesta al tratamiento es de particular importancia para prevenir la progresión de la enfermedad hacia estadios más avanzados. Una estrategia terapéutica individualizada, basada en la etiología de la enfermedad y en posibles factores patogénicos, puede suponer un gran avance en el tratamiento de estos pacientes 51.
Estimulación eléctrica. La estimulación DDD no es aplicable a la gran mayoría de pacientes con MD y su uso inapropiado puede ser causa de deterioro hemodinámico 89. Sin embargo, en una pequeña proporción de pacientes seleccionados (identificables por criterios electro y ecocardiográficos) la estimulación DDD podría tener efectos beneficiosos 90. El efecto de la estimulación eléctrica biventricular está siendo actualmente objeto de investigación.
Ablación con radiofrecuencia. La ablación con radiofrecuencia de las taquicardias ventriculares tiene hoy día un papel muy limitado en pacientes con MD, debido probablemente a lo difuso de la afectación miocárdica, con presencia de múltiples circuitos de reentrada difíciles de mapear 37.
Dispositivos antiarrítmicos. La utilización de desfibriladores implantables (DAI) ha dado buenos resultados en pacientes de alto riesgo postinfarto y en los que han sobrevivido a una muerte súbita. Sin embargo, no existe actualmente evidencia suficiente de que el implante de un DAI pueda prevenir la muerte súbita o prolongar la vida en pacientes con insuficiencia cardíaca y arritmias ventriculares asintomáticas 37. No existen estudios controlados sobre el efecto del DAI en pacientes con MD y taquicardia o fibrilación ventricular. No obstante, la baja incidencia de recurrencias de parada cardíaca observada con estos dispositivos en comparación con las descritas antes de su utilización, hace que deba considerarse el implante de un DAI en pacientes con MD y taquiarritmias malignas que se consideren candidatos adecuados 37. En la actualidad, tampoco existen datos comparativos entre el tratamiento con fármacos antiarrítmicos y el DAI en pacientes con MD y taquicardia o fibrilación ventricular documentadas, aunque es posible que el DAI pueda ser superior en estos casos 37.
Tratamiento quirúrgico. El trasplante cardíaco es el tratamiento final de elección en pacientes con MD e insuficiencia cardíaca intratable o muy baja probabilidad de supervivencia a corto plazo, pero siempre y cuando sean considerados candidatos adecuados por el equipo médico responsable (recomendación clase I) 33. No obstante, debido a la obligada limitación en el número de donantes, la posibilidad de otras estrategias de tratamiento alternativas debe ser cuidadosamente examinada 31,53.
La MD de origen isquémico es probablemente la principal fuente de trasplante cardíaco. Las experiencias más recientes con la cirugía de revascularización en pacientes con angina y mala función ventricular han dado resultados comparables a los del trasplante cardíaco. Asimismo, la revascularización puede mejorar el estado funcional en pacientes sin angina pero con miocardio viable. Por tanto, en estos pacientes, antes de su inclusión en la lista de trasplante se deberían considerar las posibilidades de revascularización miocárdica 31.
Los resultados preliminares obtenidos con la ventriculotomía izquierda parcial (operación de Batista), en pacientes con MD no isquémica, demuestran que esta técnica puede conseguir los objetivos de reducción del volumen ventricular, mejorando la fracción de eyección y reduciendo las presiones de llenado 91. No obstante, la mortalidad con esta técnica sigue siendo alta y su efecto sobre la supervivencia es desconocido. Por tanto, esta operación debería ser utilizada sólo en pacientes seleccionados en instituciones especializadas 91.
En pacientes seleccionados, la cardiomioplastia dinámica puede mejorar la función sistólica y la capacidad funcional, pero su papel en el tratamiento de la MD no está todavía establecido 31.
La utilización de dispositivos de asistencia ventricular izquierda puede permitir la estabilización de pacientes en espera para trasplante que de otra manera no hubieran sobrevivido 92.
MIOCARDIOPATÍA HIPERTRÓFICA
La miocardiopatía hipertrófica (MH) es una enfermedad con una importante heterogeneidad en cuanto a su base genética, manifestaciones clínicas y pronóstico 93-96. Se caracteriza, fundamentalmente, por la presencia de una hipertrofia ventricular de causa desconocida (generalmente de predominio septal) y por una excelente función sistólica 93-96. Los gradientes intraventriculares dinámicos constituyen un rasgo primordial de esta entidad, pero sabemos que sólo se detectan en una parte de los pacientes y buena parte de las manifestaciones son consecuencia de las alteraciones diastólicas. En la última década se han producido importantes avances en el conocimiento de las bases genéticas y moleculares de la enfermedad, sus mecanismos fisiopatológicos y se han generado expectativas ante la posibilidad de implementar nuevas alternativas terapéuticas al tratamiento clásico (tabla 4 y fig. 1).
Por ello, es nuestro propósito intentar resumir la información que actualmente existe sobre el manejo de los pacientes con MH, tanto desde el punto de vista diagnóstico como terapéutico. Dividiremos las recomendaciones en aquellas encaminadas a mejorar los síntomas de la enfermedad y en las que deben realizarse para identificar a los pacientes con riesgo de muerte súbita y para su prevención.
Bases diagnósticas generales
El diagnóstico clínico de los pacientes con MH sigue basándose en la demostración de una hipertrofia ventricular en ausencia de factores cardíacos o sistémicos que la justifiquen 93-96. Los síntomas más frecuentes -disnea, angina, palpitaciones-, se manifiestan en más de la mitad de los pacientes, pero son comunes en otras patologías cardiovasculares. Sin embargo, algunos datos clínicos como, por ejemplo, disnea en presencia de una buena función sistólica o angina con coronarias angiográficamente normales pueden orientar hacia el diagnóstico. Mucho más específica, sin embargo, sería la aparición de síncope o presíncope en individuos jóvenes previamente asintomáticos. Un episodio de muerte súbita recuperada en un niño, joven, o adulto, sin duda obliga a descartar esta patología 93-96. Tras la anamnesis, la exploración física dirigida puede ser diagnóstica cuando se detecta una semiología característica de gradiente intraventricular dinámico, pero en caso contrario, es poco reveladora.
Con frecuencia, un electrocardiograma manifiestamente patológico (ondas Q, hipertrofia ventricular, patrones de preexcitación o severas alteraciones de la repolarización), muchas veces en un individuo asintomático, es la primera clave diagnóstica 93-96. Actualmente se sabe que en muchos niños con enfermedad genéticamente demostrada, y también en algunos adultos, pueden observarse electrocardiogramas anormales (en general alteraciones más sutiles que las previas) en ausencia de hipertrofia ventricular macroscópica 97,98. De hecho, se ha sugerido que en ciertas circunstancias un simple electrocardiograma podría ser más sensible para el diagnóstico de la enfermedad que las modernas técnicas de imagen 97-98.
El ecocardiograma Doppler es la herramienta clínica que mejor permite reconocer las a veces complejas alteraciones estructurales y funcionales características de estos pacientes 93-96. Generalmente se acepta que para confirmar el diagnóstico de MH se requiere una hipertrofia 15 mm en algún segmento ventricular. No obstante, en algunos casos es importante corregir en función de la superficie corporal y considerar anormal grosores > 2 desviaciones estándar de la media 96-99. En los casos en que el Doppler demuestra un gradiente intraventricular significativo (> 30 mmHg) suele visualizarse un movimiento anterior sistólico de la válvula mitral que alcanza el septo interventricular 93-96. Esta técnica también es útil para estudiar las anomalías secundarias a los problemas de distensibilidad y relajación ventricular típicos de estos pacientes. Se debe señalar aquí que la historia natural de la MH se caracteriza, en muchos casos, por cambios en el grado de hipertrofia y/o función ventricular. En este sentido, está bien establecido que en el screening de niños con familiares afectados es preciso realizar estudios ecocardiográficos seriados para descartar la aparición de hipertrofia ventricular con el desarrollo corporal 97. Por otra parte, también se conoce bastante bien la evolución de la hipertrofia con el paso del tiempo y existe información consistente que sugiere un adelgazamiento progresivo de las paredes ventriculares con la edad 9396.99. Finalmente, aunque mucho más raro, también se sabe que en algunos pacientes este fenómeno se asocia a dilatación ventricular y deterioro progresivo de la función sistólica incluso evolucionando hacia una fase congestiva. Todo lo expuesto explica que el ecocardiograma deba considerarse como la técnica de elección (recomendación clase I) tanto para el diagnóstico de la enfermedad como para su seguimiento. Aunque otras nuevas técnicas de imagen (fundamentalmente la resonancia magnética nuclear) se están empleando cada vez más en situaciones especiales (mala ventana ultrasónica, MH apical), todavía existe poca información sobre la utilidad de su empleo más rutinario (tabla 5).
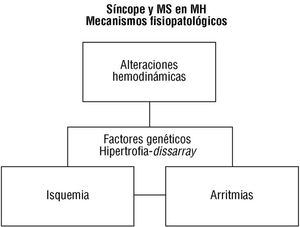
Como ya se ha mencionado, los avances en el campo de la genética han cuestionado paradigmas diagnósticos que parecían bien asentados (tabla 4). Así, la demostración de que la enfermedad puede estar presente en pacientes sin hipertrofia ventricular ha supuesto un hallazgo revolucionario 98. No deja de ser inquietante aceptar las limitaciones de las técnicas diagnósticas habituales en una enfermedad cuya primera manifestación puede ser la muerte súbita 98. El cardiólogo clínico interesado en la MH siempre ha intentado buscar signos patognomónicos para alcanzar un diagnóstico de certeza. Sin embargo, esto le ha obligado a realizar una auténtica peregrinación intelectual y conceptual, concentrando su interés en diferentes aspectos de la enfermedad, que ha constituido una diana en constante movimiento (tabla 4). Se debe aceptar que la hipertrofia ventricular probablemente no sea el único factor diagnóstico/pronóstico primordial en esta enfermedad del sarcómero, de base genética identificable y cuyos mecanismos patofisiológicos (fig. 1)
Fig. 1. Mecanismos fundamentales implicados en el síncope y la muerte súbita (MS) en pacientes con miocardiopatía hipertrófica (MH).
tienen, en realidad, un trasfondo molecular y no están necesariamente limitados a la víscera cardíaca 99-102. En la tabla 6 se presentan los nuevos criterios diagnósticos sugeridos para los familiares de primer grado de pacientes con enfermedad probada 103. Es trascendental (recomendación clase I) realizar una evaluación clínica completa (con ECG y ecocardiograma) en todos los familiares de primer grado de un caso índice, ya que tienen una probabilidad del 50% de tener la enfermedad.
Hasta el momento se conocen 8 genes (con una o varias mutaciones en cada gen) que pueden causar la enfermedad 100-103. Se sabe que la heterogeneidad genética tiene importantes implicaciones clínicas y pronósticas. Así, algunas mutaciones tienen peor pronóstico, otras se asocian a una sintomatología más severa y otras predicen una aparición más tardía de la enfermedad (unión proteína C a miosina cardíaca) 100-102. Además, mientras que en algunas mutaciones parece existir una cierta relación entre la severidad de las alteraciones morfológicas/funcionales y el pronóstico (cadena pesada beta miosina cardíaca), otras se caracterizan por una evolución desfavorable a pesar de una expresión clínica aparentemente «benigna» (troponina T cardíaca) 100-102. Por último, la misma mutación puede producir manifestaciones fenotípicas variadas, mientras que mutaciones diferentes pueden ser clínicamente indistinguibles. La caracterización genética de la MH puede efectuarse perfectamente estudiando linfocitos de sangre periférica. Sin embargo, desde el punto de vista práctico, la tecnología todavía es relativamente sofisticada y, en el momento de realizar estas recomendaciones, únicamente se está empleando con fines de investigación. Por ello, y aunque es seguro que muy pronto serán necesarias pautas sobre cuándo y cómo emplear los tests de diagnóstico genético (tanto con fines diagnósticos como pronósticos), todavía no tenemos información al respecto, ni posibilidad de su uso sistemático en la práctica clínica (tabla 5).
Enfoque del paciente asintomático
En el paciente asintomático, una vez realizado el diagnóstico, el planteamiento inicial debe centrarse en prevenir la aparición de complicaciones y estratificar el pronóstico, fundamentalmente estudiando el riesgo de muerte súbita. Como medidas preventivas generales hay que recomendar la supresión del ejercicio físico a nivel de competición (recomendación clase I) debido a que, en más de la mitad de los casos, la muerte súbita se presenta en pacientes jóvenes y asintomáticos durante o inmediatamente después de realizar un ejercicio físico de cierta intensidad 104-108. Recientemente, también se ha llegado a un cierto grado de consenso con respecto al subgrupo de pacientes en quienes debe desaconsejarse cualquier actividad deportiva (gradientes o hipertrofia severa, síntomas). En cualquier caso, aunque parecería prudente aconsejar la supresión de todo tipo de ejercicio físico, hay que tener en cuenta las implicaciones psicológicas de estas medidas en los jóvenes. Además, recientemente se han descrito series de pacientes con MH que han practicado ejercicio intenso de forma regular, sin que esto conllevara implicaciones clínicas o pronósticas desfavorables 109. El otro aspecto a recordar es la profilaxis de endocarditis infecciosa 93,94 en pacientes con gradientes intraventriculares o insuficiencia mitral significativa (recomendación clase I) 110.
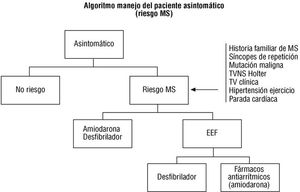
Sin embargo, no existe evidencia (recomendación clase III) de que ninguna medida terapéutica (farmacológica, dispositivo o cirugía) mejore la historia natural de la enfermedad (excepto en subgrupos de riesgo que posteriormente se definirán) por lo que su uso no está justificado en pacientes asintomáticos (tabla 5 y fig. 2). Finalmente, tampoco está establecido el tipo de seguimiento más aconsejable para los pacientes asintomáticos, una vez estudiados, pero parece razonable recomendar revisiones clínicas con repetición de las exploraciones diagnósticas básicas cada 1-2 años.
Valoración del riesgo de muerte súbita
La muerte súbita, al representar cerca de la mitad de la mortalidad de esta patología y presentarse frecuentemente en individuos jóvenes y asintomáticos, sigue siendo un aspecto preocupante tras establecer el diagnóstico de la enfermedad 104-108 (figs. 1 y 2; tabla 7). Aunque desde centros de referencia clásicamente se mencionaba una incidencia anual del 2-3% en adultos, y del doble en niños y jóvenes, datos más recientes de series de pacientes no seleccionados y menos sintomáticos sugieren, uniformemente, un pronóstico mucho más benigno 111. Esto es importante al condicionar los algoritmos de decisión, ya que los esfuerzos terapéuticos deben ser dirigidos y sólo pueden ser exhaustivos cuando sean capaces de identificar marcadores de riesgo con un alto valor predictivo. En caso contrario, se están aconsejando medidas, no exentas de complicaciones o de efectos secundarios a largo plazo, a muchos pacientes que en realidad no están en riesgo. La etiopatogenia de la muerte súbita en la MH todavía no es del todo conocida y parece ser multifactorial, aunque las arritmias ventriculares son el mecanismo patogenético más frecuentemente invocado (tabla 7)
104-108. Sin embargo, es importante recordar qué subgrupos de pacientes tienen un mayor riesgo (fig. 2 y tabla 7)
Fig. 2. Manejo del paciente asintomático con o sin factores de riesgo de muerte súbita (MS). EEF: estudio electrofisiológico; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida.
y cuál es la mejor forma de estratificar su pronóstico (fig. 3).
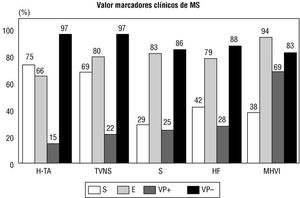
Fig. 3. Sensibilidad (S), especificidad (E), valor predictivo positivo (VP+) y valor predictivo negativo (VP-) de los diferentes marcadores clínicos de riesgo de muerte súbita (MS) en la miocardiopatía hipertrófica (MH). H-TA: respuesta tensional anormal (pacientes menores de 40 años); TVNS: taquicardia ventricular no sostenida; S: síncope; HF: historia familiar de muerte súbita. MHVI: máxima hipertrofia ventricular ( 20 o 25 mm en dos segmentos ventriculares.
Además, sigue siendo válido, como principio general, insistir en que la correlación entre el estado sintomático, la severidad de la hipertrofia ventricular, el grado de obstrucción o la importancia del compromiso diastólico con el riesgo de muerte súbita es pobre 93,94,104-108. Recientemente, sin embargo, se ha sugerido 112 que los pacientes con mayor grado de hipertrofia y aquellos con gradientes más importantes tendrían peor pronóstico.
Se sabe que la muerte súbita es más frecuente en niños y jóvenes, y que en ellos los antecedentes familiares de muerte súbita y los episodios sincopales son claros marcadores de riesgo. En jóvenes con estos antecedentes es importante depurar la importancia relativa de los mecanismos potencialmente implicados (predisponentes o desencadenantes). En estos pacientes, debe realizarse una evaluación hemodinámica completa (obstrucción-diástole), estudiar si existe isquemia, valorar los reflejos neurovasculares y, sobre todo, conocer el sustrato arritmogénico 113-117. En niños y adultos jóvenes se ha sugerido que la isquemia podría desempeñar un papel desencadenante especialmente relevante. En este sentido, la realización de pruebas incruentas para documentar isquemia parece indicada en los supuestos mencionados 114. Recientemente se ha señalado que la detección de milking en la coronariografía sería un importante marcador de riesgo en niños 118. Sin embargo, debido a que esta exploración es cruen-ta no parece adecuado recomendar su empleo sistemático 118,119, excepto en situaciones muy especiales como, por ejemplo, en pacientes con otros factores de riesgo para muerte súbita y ante la presencia de angina o documentación objetiva de isquemia severa. Sin embargo, sí existe más consenso en la necesidad de descartar anomalías en las respuestas vasculares y en los reflejos neurovegetativos 115-117. Así, existe bastante evidencia de que la aparición de una respuesta hipotensiva al ejercicio implicaría un pronóstico desfavorable y que este dato sería especialmente importante en los pacientes jóvenes (fig. 2 y tabla 7). En ellos, el valor predictivo negativo de este signo sería del 97% 115-116 (una respuesta tensional normal implica buen pronóstico). A su vez, el test de la mesa basculante parece útil para diferenciar los mecanismos neurovegetativos de los síncopes producidos por arritmias malignas, aunque el valor pronóstico de esta exploración es más controvertido 117.
En adultos, la taquicardia ventricular no sostenida (para su detección idealmente debería practicarse Holter de 48 h) sigue siendo uno de los mejores marcadores clínicos actualmente disponibles para identificar a los pacientes con riesgo de muerte súbita (figs 2 y 3; tabla 7) 93,94,120. Se detecta en el 25% de los pacientes adultos con la enfermedad. Así, aunque el valor predictivo positivo de este dato es pobre, la ausencia de esta arritmia (que generalmente cursa de forma sintomática) tiene un alto valor predictivo negativo (97%) 93,95,120. La prevalencia de taquicardia ventricular no sostenida parece ser mucho menor en niños 113, aunque en ellos también parece tener un mal significado pronóstico 121. Recientemente, sin embargo, se ha sugerido que su significado pronóstico sería peor en los pacientes sintomáticos con otras manifestaciones clínicas de la enfermedad, mientras que su pronóstico sería más benigno si se detecta en pacientes completamente asintomáticos 122. También se ha sugerido que los episodios muy aislados de taquicardia no sostenida serían de mejor pronóstico que los episodios repetitivos, complejos o aquellos más prolongados 123. Finalmente, otra forma de establecer el riesgo de muerte súbita sería «agrupando» los factores de riesgo clásicos (antecedentes familiares de muerte súbita, síncope de re-petición, taquicardia ventricular en el Holter e hipotensión de ejercicio) de cada paciente. Así, la presencia de 2 o más de estos factores implicaría medidas terapéuticas específicas (amiodarona frente a desfibrilador), mientras que la presencia de un solo factor requeriría únicamente un estudio profundo y una estrecha vigilancia clínica 124.
El valor de los estudios electrofisiológicos en el subgrupo de pacientes con arritmias ventriculares detectadas por Holter es controvertido 93,95,125. Sin embargo, estos estudios están indicados en pacientes cuyas arritmias tienen repercusiones clínicas, como los resucitados de una parada cardíaca, aquellos con arritmias ventriculares sostenidas y aquellos con síncopes de repetición. En algunos casos en que la indicación de implantación de desfibrilador puede sentarse clínicamente, los estudios electrofisiológicos pueden limitarse a comprobar el correcto funcionamiento del dispositivo.
Finalmente, ya se ha mencionado las implicaciones pronósticas de la mutación específica causante de la enfermedad 100-102 y en este sentido puede ser importante el consejo genético.
Independientemente de posibles consideraciones terapéuticas, parece aconsejable (recomendación clase I) realizar un Holter en la evaluación pronóstica de los pacientes con MH. De la misma forma, parece recomendable (recomendación clase IIa) realizar un test de esfuerzo en estos pacientes, fundamentalmente en los jóvenes con otros factores de riesgo, para valorar los reflejos neurovasculares. Por último, los estudios electrofisiológicos están indicados en pacientes resucitados de una parada cardíaca previa, aquellos con documentación de arritmias ventriculares sostenidas (recomendación clase IIa) y probablemente también en aquellos que presentan síncopes de repetición. La utilidad de estos estudios en todos los pacientes con historia familiar de MS, ante un único episodio sincopal o por arritmias no sostenidas en el Holter, es más dudosa (recomendación clase IIb) (fig. 2; tablas 5 y 7).
Enfoque del paciente con manifestaciones/síntomas específicos
En estos pacientes es importante conocer si la alteración fisiopatológica responsable fundamental es diastólica o bien es la «obstrucción» sistólica. Generalmente, la disnea se correlaciona con la elevación de la presión capilar pulmonar secundaria a las alteraciones diastólicas 93-96. En este caso, tras estudiar la existencia de isquemia asociada, se puede iniciar un tratamiento con antagonistas del calcio. Los betabloqueantes estarían recomendados en casos con mala respuesta al verapamilo y son de primera elección en los pacientes con gradientes intraventriculares significativos. En presencia de datos clínicos de insuficiencia cardíaca franca se debe ser cauto con la medicación y con el aumento de las dosis. Los diuréticos pueden emplearse con precaución.
Se deben emplear las mismas consideraciones terapéuticas que para la disnea. Es importante documentar la isquemia de forma objetiva. Las alteraciones electrocardiográficas basales de estos pacientes restan valor diagnóstico al test de esfuerzo. Si se documenta isquemia, debe realizarse una coronariografía para descartar la presencia de lesiones en los vasos epicárdicos y estudiar fenómenos dinámicos ( milking, compresión de septales) 93-96,118,119. En pacientes con lesiones coronarias fijas habrá que valorar las posibilidades de revascularización (angioplastia frente a cirugía) con las que se han descrito buenos resultados. En las recomendaciones sobre coronariografía recientemente publicadas por el ACC/AHA 126 se ha considerado recomendación clase I realizar una coronariografía a los pacientes con MH y angina cuando se considera que el conocimiento de la anatomía coronaria puede afectar al tratamiento. De igual modo, se ha considerado una recomendación clase I realizar una coronariografía a los pacientes con MH y angina cuando se planea una intervención quirúgica 126.
Aunque su relación con las arritmias supra o ventriculares no es buena, es preciso descartar estas arritmias (estudio Holter). Como más adelante se refleja, la amiodarona es útil para la supresión de ambos tipos de arritmias. En los pacientes con extrasístoles ventriculares frecuentes, los betabloqueantes son especialmente efectivos desde el punto de vista sintomático 93,96. La aparición de fibrilación auricular puede ocasionar un deterioro hemodinámico grave por la pérdida de la contribución auricular a un llenado ventricular que ya está comprometido 127. Siempre debe intentarse la cardioversión (farmacológica o eléctrica si existe compromiso hemodinámico) 94,127. La taquicardia ventricular sostenida clínica es rara en estos pacientes y obliga a descartar alteraciones estructurales asociadas (aneurismas apicales, etc) 128. Cuando se documenta esta arritmia, su manejo terapéutico (farmacológico o desfibrilador) debe ser guiado por un estudio electrofisio-lógico 125,128.
Los pacientes con síncope requieren una evaluación completa del riesgo de muerte súbita. El riesgo es mayor en pacientes jóvenes, fundamentalmente si existe historia familiar de muerte súbita 93-96. El riesgo también es mayor si existen síncopes de repetición. En ambas situaciones debe realizarse un estudio hemodinámico completo que incluya valoración de la respuesta vascular periférica y también un estudio electrofisiológico 114-116,125. En el síncope relacionado con el ejercicio puede estar implicado el gradiente intraventricular. En adultos es importante descartar síncope vasovagal e hipersensibilidad del seno carotídeo.
En todos los pacientes recuperados de una parada cardíaca debe realizarse un estudio exhaustivo de los factores predisponentes/desencadenantes, ya detallado en el apartado de muerte súbita. Es trascendental recabar toda la información posible del episodio (especialmente electrocardiográfica). En estos pacientes debe considerarse la colocación de un desfibrilador implantable con o sin un estudio electrofisiológico previo 125,129,130. En cualquier caso, existe información, tanto de estudios clásicos 107 como de datos más recientes con implantación de desfibriladores, que sugieren que el pronóstico de los pacientes con MH recuperados de una parada cardíaca podría ser algo más benigno del encontrado en pacientes con cardiopatía isquémica e infarto de miocardio subyacente 129. Actualmente, si logra identificarse una taquiarritmia ventricular sostenida como causa de la parada cardíaca, tiende a favorecerse el implante de un desfibrilador sobre otras alternativas 130.
Tratamiento médico
El tratamiento farmacológico de los pacientes con MH es difícil de estandarizar. Esto se debe, en primer lugar, a que las diversas manifestaciones fisiopatológicas de la enfermedad condicionan aproximaciones terapéuticas diferentes. En segundo lugar, faltan estudios controlados que hayan contrastado de forma sistematizada diferentes alternativas de tratamiento médico en subgrupos homogéneos de pacientes. Además, la respuesta de cada paciente a un determinado tratamiento es variable y las dosis óptimas deben elegirse también de forma individualizada 93-96,99,106. Todo ello hace que las principales escuelas que se han dedicado a estudiar de forma específica esta patología puedan optar por tratamientos diferentes, incluso ante enfermos con características fisiopatológicas similares. Por último, hay que recordar que los pacientes sintomáticos precisan un seguimiento clínico estrecho, fundamentalmente tras modificaciones en el tratamiento farmacológico.
En la tabla 8 se resumen las recomendaciones terapéuticas en la MH.
Desde la década de los 60, los betabloqueantes se han convertido en la piedra angular del tratamiento de los pacientes sintomáticos con MH, tanto en su forma obstructiva y también, aunque probablemente de forma menos consistente, en la no obstructiva 93-96,99,106. Estos fármacos mejoran todos los síntomas fundamentales de esta patología incluyendo la disnea, la angina y el síncope (recomendación clase I). La mayor experiencia se ha centrado en el propranolol a dosis de 160-320 mg/día, aunque algunos autores aconsejan aumentar significativamente las dosis en pacientes refractarios o ante la recurrencia de la sintomatología. También se ha sugerido que el sotalol (un betabloqueante con acciones tipo III) podría ser especialmente útil en los pacientes con MH y arritmias ventriculares. Sin embargo, la experiencia clínica con este fármaco todavía es limitada. Los betabloqueantes inhiben la estimulación simpática y reducen los requerimientos de oxígeno (reduciendo la frecuencia cardíaca, la contractilidad miocárdica y el estrés sistólico parietal). Por virtud de su inotropismo negativo, tienden a normalizar la función sistólica hiperdinámica y a disminuir el gradiente intraventricular. Su eficacia es moderada en los gradientes intraventriculares fijos, pero son muy efectivos en la prevención del aumento de los gradientes dinámicos tras maniobras de provocación 93-96,106,131. Sus posibles efectos beneficiosos sobre las alteraciones diastólicas o sobre las arritmias ventriculares de la MH son controvertidos.
Desde la década de los 70, el uso de estos fármacos (fundamentalmente el verapamilo) se ha ido consolidando en el tratamiento de los pacientes sintomáticos con MH 93-97,98,106. Disminuyen el consumo de oxígeno miocárdico al reducir la frecuencia cardíaca, disminuir la presión arterial, tener un efecto inotrópico negativo y reducir el gradiente intraventricular. Además, la mejoría clínica también se debe a la mejoría del llenado y relajación ventriculares. Por ello, parecen especialmente indicados (recomendación clase I) en pacientes que no mejoran con los betabloqueantes y en los pacientes sin gradientes intraventriculares, fundamentalmente cuando existe un compromiso significativo de la función diastólica. Se ha sugerido que más de la mitad de los pacientes refractarios a betabloqueantes obtienen mejoría clínica mantenida con el verapamilo. El empleo de estos fármacos en pacientes inestables o cuando se requieren dosis importantes debe realizarse de forma controlada en un ambiente hospitalario, para evitar la aparición de efectos adversos. Así, ocasionalmente pueden precipitar alteraciones de la conducción, empeorar los gradientes por vasodilatación periférica y más raramente, en especial en pacientes muy sintomáticos y con datos de congestión venosa pulmonar, pueden agravar la insuficiencia cardíaca.
El importante efecto inotrópico negativo (por bloqueo de los canales del calcio) de este fármaco antiarrítmico (Clase IA), unido a su capacidad de aumentar las resistencias periféricas, lo han hecho especialmente atractivo para el tratamiento de esta enfermedad. De hecho, se ha demostrado muy útil para abolir el gradiente intraventricular, tanto en estudios invasivos agudos como durante el seguimiento, lo que se ha asociado con la mejoría clínica obtenida 93-97,99,106. En un estudio aleatorizado y doble ciego, la disopiramida (600 mg/día) era más eficaz que el propranolol (160 mg/día) para disminuir el gradiente intraventricular y mejorar el tiempo de ejercicio 132,133. No obstante, no existe suficiente evidencia del efecto beneficioso de este fármaco a largo plazo y, además, no infrecuentemente los pacientes deben suspender esta medicación debido a los efectos secundarios derivados de sus propiedades parasimpaticolíticas (retención urinaria, estreñimiento, etc.), lo que también limita su aplicación clínica. La cibenzolina se ha apuntado como una alternativa interesante al tener menos efectos secundarios. La actitud sería, probablemente, una recomendación clase IIa para el uso de disopiramida en pacientes con gradientes y síntomas refractarios a betabloqueantes y verapamilo.
La amiodarona, inicialmente utilizada como fármaco antianginoso por sus efectos vasodilatadores, es un antiarrítmico de la clase III y en menor medida tiene efectos antiadrenérgicos (clase II) y es bloqueante de los canales del calcio (clase IV). Aunque se ha sugerido que la amiodarona podría mejorar los síntomas de algunos pacientes refractarios al tratamiento convencional (bradicardia, mejoría diastólica, efecto inotrópico negativo), la evidencia en este sentido es circunstancial y no aceptada por muchos autores 93-96.
Sin embargo, y al contrario que los antiarrítmicos clase I, la amiodarona es un fármaco de extrema utilidad en el tratamiento de las arritmias, tanto supraventriculares como ventriculares de la MH 93-96. Aunque actualmente existe una gran sensibilidad para no interpretar la mera supresión de una arritmia ventricular como un efecto clínico beneficioso, algunos estudios han sugerido que la amiodarona no sólo es útil para suprimir la taquicardia ventricular en el Holter, sino que también parece ser eficaz en la prevención de la muerte súbita. En un estudio ya clásico, un grupo londinense 134 demostró la utilidad de la amiodarona (dosis media de 300 mg/día) en la prevención de la muerte súbita en pacientes con taquicardia ventricular no sostenida al compararlos con una serie de controles históricos con la misma arritmia. Tras 5 años de seguimiento no se detectaron episodios de muerte súbita en los pacientes que recibieron amiodarona. Estos datos, sin embargo, han sido cuestionados: en primer lugar, al no tratarse de un estudio aleatorizado, las diferencias entre ambas series podrían deberse no ya a un efecto beneficioso de la amiodarona, sino a los posibles efectos arritmogénicos de los fármacos utilizados en el grupo control. En segundo lugar, otros grupos, si bien utilizando probablemente dosis demasiado altas de amiodarona, han encontrado efectos adversos con el tratamiento y episodios de muerte súbita 135. En tercer lugar, como ya hemos dicho, el pronóstico de pacientes asintomáticos con taquicardia ventricular no sostenida parece ser bastante bueno 122 y en ellos no parece justificado un tratamiento crónico con amiodarona por sus bien conocidos efectos secundarios. Afortunadamente, existen datos que sugieren que los efectos beneficiosos en la MH se obtienen con valores plasmáticos < 1,5 mg/ml con los que los efectos secundarios importantes son más raros. Por último, la amiodarona también se ha demostrado extremadamente efectiva para el control de las arritmias supraventriculares de los pacientes con MH, fundamentalmente para controlar las crisis agudas y prevenir la recurrencia de la fibrilación auricular 127.
Por ello, en pacientes sintomáticos con MH parece razonable emplear la amiodarona a dosis bajas y con monitorización periódica de valores plasmáticos, tanto en pacientes con taquicardia ventricular no sostenida detectada en Holter como para el tratamiento y prevención de recurrencias de arritmias supraventriculares (ambas recomendación clase IIa) 122,123,127,134. Sin embargo, hoy día parece poco justificable el empleo «indiscriminado y sistemático» de este fármaco en pacientes completamente asintomáticos en los que se ha detectado un único episodio de taquicardia ventricular no sostenida, o en todos los pacientes jóvenes con historia de algún episodio sincopal o con historia familiar de muerte súbita (recomendación clase IIb). Sin embargo, algunos expertos sugieren la posibilidad de utilizar la amiodarona (o el desfibrilador) en pacientes con > 2 de los factores de riesgo clásicos 124.
La digoxina, por su efecto inotrópico positivo, se ha considerado clásicamente contraindicada en esta enfermedad, en especial en los pacientes con gradientes intraventriculares (recomendación clase III) 93-96. No obstante, el uso cuidadoso de la digoxina es útil para controlar la respuesta ventricular en los pacientes con fibrilación auricular y este fármaco también puede emplearse en los raros casos que terminan evolucionando a una fase dilatada de la enfermedad. Los diuréticos también deben de utilizarse con gran precaución porque pequeñas reducciones de la precarga pueden comprometer el llenado ventricular 93-96. Sin embargo, el uso prudente de diuréticos parece eficaz para controlar episodios de insuficiencia cardíaca cuando se asocian a betabloqueantes o verapamilo.
Otro problema importante es la prevención de fenómenos embólicos. Las embolias sistémicas son relativamente frecuentes en pacientes con MH y arritmias supraventriculares, mayormente en presencia de fibrilación auricular 93-96,127. Por este motivo se aconseja la anticoagulación de los pacientes con fibrilación auricular crónica o con episodios paroxísticos frecuentes (recomendación clase I) 93-96,99,106,136. Por último, también está bien descrito en la bibliografía el riesgo de endocarditis infecciosa, fundamentalmente en pacientes con gradientes intraventriculares o insuficiencia mitral importante y dilatación de la aurícula izquierda 93-96,99,110. Por ello, en estos pacientes debe emplearse profilaxis antibiótica (recomendación clase I) según la pauta convencional.
Medidas no farmacológicas
La implantación de marcapasos secuenciales constituye una interesante alternativa terapéutica en pa-cientes sintomáticos refractarios al tratamiento mé-dico 137,143. Existe suficiente evidencia de que en pacientes seleccionados con gradientes intraventriculares importantes, los marcapasos son efectivos, mejorando los gradientes (en un 50%) y los síntomas en la mayoría de los casos. Los resultados más optimistas han sido publicados por el grupo de Bethesda 138, demostrando un beneficio clínico marcado y mantenido en una serie relativamente amplia de pacientes 137.139. Otros investigadores han apoyado estas observaciones, aunque con resultados menos espectaculares. La electroestimulación, al preexcitar el ápex del ventrículo derecho, produce un movimiento paradójico del septo interventricular, que condiciona una contracción ventricular menos uniforme y efectiva. Se reduce así el gradiente intraventricular, el movimiento anterior de la válvula mitral y el grado de insuficiencia mitral. A veces esto se asocia a una reducción de la presión telediastólica del ventrículo izquierdo. Aunque también se han sugerido otros posibles efectos beneficiosos (mejoría diastólica, remodelado ventricular incluso con reducción del grado de hipertrofia) no existen datos concluyentes 137-139. Al programar el marcapasos es preciso seleccionar el intervalo AV más largo que permita una captura ventricular completa. En caso contrario, se comprometería el llenado ventricular disminuyendo el gasto cardíaco y empeorando los síntomas a pesar de disminuir el gradiente intraventricular. También se ha sugerido el valor de la electroestimulación en los pacientes con MH y gradientes provocables, aunque la evaluación es más compleja y su utilidad más controvertida. Aunque la experiencia con marcapasos es mayoritariamente favorable, algunos estudios hemodinámicos agudos (con una metodología rigurosa y optimización cuidadosa del intervalo AV), han alertado sobre un posible efecto perjudicial en algunos pacientes 141. Más preocupante es que tres estudios aleatorizados clínicos recientemente finalizados, tanto en Europa (estudio PIC) 139,140 como en América (Clínica Mayo y M-Pathy 142,143) obtienen resultados menos alentadores. Insisten en que no todos los pacientes obtienen mejoría (algunos empeoran) y que a veces una mejoría subjetiva no parece correlacionarse con cambios hemodinámicos objetivos, sugiriendo que también existe un efecto placebo importante 139-143.
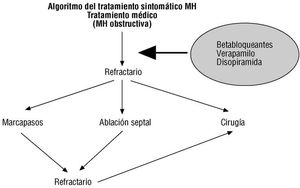
Se puede concluir, por tanto, que en pacientes con gradientes intraventriculares que tienen una sintomatología refractaria al tratamiento médico (aquellos en los que de otra manera se contemplaría la cirugía) existe evidencia de que la electroestimulación secuencial puede mejorar la situación clínica de algunos de los pacientes. Sin embargo, el grado de evidencia existente sobre su efectividad real, a la luz de los mencionados estudios, es débil (recomendación clase IIb) y, de hecho, así ha sido considerado por el comité de marcapasos americano 144. Además, estos pacientes dependen críticamente de una programación óptima del marcapasos (que podría cambiar en diferentes situaciones) y precisan de un estrecho seguimiento clínico) (fig. 4 y tabla 8).
Fig. 4. Diagrama que resume las posibilidades terapéuticas en pacientes sintomáticos con miocardiopatía hipertrófica (MH) obstructiva.
Esta revolucionaria técnica consiste en crear un «infarto septal controlado» que podríamos comparar a una «miectomía química percutánea» 145,147. Inyectando alcohol en una rama septal (por medio de la luz de un catéter-balón de angioplastia inflado) se consigue una necrosis localizada en el territorio irrigado por dicha septal. Antes de inyectar el alcohol puede ser útil inyectar contraste ecocardiográfico para «mapear» el territorio de distribución vascular de la rama seleccionada y confirmar que se actúa sobre la zona donde se produce el gradiente 148. Con este procedimiento se induce un infarto (con curva enzimática típica) con la consiguiente acinesia septal y disminución del gradiente intraventricular. La reducción del gradiente intraventricular parece ser más efectiva que la inducida con marcapasos y de magnitud similar a la obtenida con la miotomía-miectomía. Los estudios hasta ahora publicados también confirman una clara mejoría clínica, aunque el intervalo de seguimiento es todavía modesto 145-147. Con ecocardiografía y resonancia magnética se logra identificar la zona de la ablación como un adelgazamiento localizado «imagen en sacabocados» del septo anterior proximal. Además, durante el seguimiento se puede apreciar un remodelado septal, pero no parecen existir datos sugerentes de disfunción sistólica o dilatación ventricular. Es importante insistir, no obstante, que ésta es una técnica relativamente nueva y con un tiempo de seguimiento necesariamente corto. Además, no está exenta de posibles complicaciones (extravasación del alcohol, arritmias ventriculares, etc.), y con frecuencia se asocia a alteraciones de la conducción ventricular, que pueden ser permanentes, requiriendo la implantación de un marcapasos. Finalmente, la posibilidad de que la cicatriz septal pudiera ser arritmogénica en el futuro no puede ser descartada.
Debido a que sólo disponemos de estudios observacionales, en pacientes seleccionados y con un tiempo de seguimiento corto, su utilidad queda confinada a pacientes refractarios al tratamiento convencional en centros con experiencia, y debe confirmarse en posteriores estudios con mayor número de pacientes y un seguimiento prolongado (actualmente no se pueden establecer niveles de recomendación).
A raíz de los estudios en pacientes con cardiopatía isquémica, el uso de desfibriladores implantables como alternativa al tratamiento antiarrítmico convencional está aumentando de forma exponencial. Lo mismo sucede en pacientes con MH, en los que esta opción se prefiere al tratamiento con amiodarona en muchos subgrupos de pacientes 148,149. Así, los pacientes con riesgo de muerte súbita en los que se logre identificar un mecanismo arritmogénico son claros candidatos a este dispositivo 127. En concreto, actualmente el desfibrilador parece claramente indicado (recomendación clase I) en pacientes resucitados de una parada cardíaca, en los cuales se logran documentar arritmias ventriculares sostenidas, bien durante el episodio clínico 130, bien durante el estudio electrofisiológico (generalmente taquicardia ventricular polimórfica) 125,129. La recomendación sería similar (recomendación clase I) en pacientes con documentación de arritmias ventriculares sostenidas clínicas si la misma arritmia puede ser inducida mediante estimulación programada (tabla 8). Sin embargo, la inducción de fibrilación ventricular o taquicardia ventricular polimorfa (clásicamente consideradas como arritmias no específicas en pacientes con cardiopatía isquémica) en otros subgrupos de pacientes con MH (síncope previo, historia familiar de muerte súbita o arritmias no sostenidas en el Holter) probablemente no deba considerarse como una indicación suficiente (recomendación clase IIb) para implantar un desfibrilador. No obstante, y aunque falta evidencia que lo justifique, la gran aceptación de este dispositivo para prevenir el riesgo de muerte súbita hace que muchos investigadores estén incrementando su uso incluyendo incluso pacientes con dos o más factores de riesgo de muerte súbita 124 o a aquellos en los que se identifica «cualquier» marcador de riesgo (aunque esto no parece recomendable).
En cualquier caso, el número de estudios que demuestran la efectividad a largo plazo de estos dis-positivos en pacientes con MH todavía es escaso 129,130,148,149. Por otra parte, incluso en pacientes seleccionados, el número de descargas del dispositivo parece ser menor que la encontrada en pacientes con cardiopatía isquémica 129, lo que ha sido interpretado como otro dato a favor del mecanismo etiopatogénico multifactorial propio de la MH (fig. 2).
La cirugía constituye una alternativa eficaz y consolidada por el tiempo en pacientes con MH refractarios (clases III y IV de la NYHA) al tratamiento médico (recomendación clase I) 150,151 (fig. 4). Estos casos probablemente representen < 5% de los pacientes con MH. La miotomía-miectomía (técnica de Morrow) es la técnica más utilizada y permite reducir o abolir los gradientes intraventriculares y disminuir el grado de insuficiencia mitral. Se ha demostrado que estos efectos se mantienen a largo plazo y que los pacientes obtienen una mejoría clínica mantenida. En pacientes con poca hipertrofia septal, anomalías estructurales del aparato valvular mitral y, ocasionalmente, en algunos pacientes con insuficiencia mitral severa puede estar más indicado el reemplazo valvular (técnica de Cooley), también con buenos resultados. La miectomía convencional no parece ser efectiva en pacientes que presentan una inserción anómala del músculo papilar directamente en la valva mitral 151. Hoy día, la mortalidad hospitalaria se ha reducido a un 1-4%, pero los resultados siguen dependiendo de la experiencia del grupo quirúrgico en esta patología. El riesgo quirúrgico aumenta en los pacientes ancianos y en los que requieren revascularización coronaria asociada. Por otro lado, la efectividad de la cirugía para prevenir la muerte súbita no ha sido establecida. De igual modo, no existe suficiente evidencia que justifique el desbridamiento quirúrgico (o la implantación de stents) en los pacientes con puentes intramiocárdicos en la descendente anterior 118,119, aunque esta posibilidad pueda contemplarse en pacientes muy seleccionados con angina refractaria e isquemia importante objetivable. Finalmente, en los raros casos en los que la enfermedad evoluciona hacia una fase dilatada con insuficiencia cardíaca debe considerarse la posibilidad del trasplante cardíaco 152.
MIOCARDIOPATÍA RESTRICTIVA
Introducción
La miocardiopatía restrictiva (MR) se define como una enfermedad del miocardio/endocardio que produce disfunción diastólica secundaria a aumento de la rigidez ventricular, con volúmenes diastólicos normales o disminuidos en uno o ambos ventrículos. La función sistólica suele estar preservada, y el espesor de la pared conservado o incrementado dependiendo de la etiología. Esta pérdida de la distensibilidad es secundaria a infiltración o fibrosis.
Como consecuencia de estas alteraciones hemodinámicas, se producen síntomas y signos de fracaso ventricular derecho y/o izquierdo según las cavidades afectadas. A menudo predomina la afectación derecha con aumento de la presión venosa, ascitis y edemas. Si por el contrario predomina la afectación izquierda, se manifiesta por signos de insuficiencia cardíaca izquierda.
De los tres tipos fisiopatológicos de miocardiopatía, la MR es la menos común en nuestro medio, < 5% de todas las miocardiopatías, pudiendo tener un origen idiopático o asociado a otras enfermedades. En el mundo occidental la amiloidosis es la más frecuente y mejor estudiada. En ciertas zonas de África, Asia, América central y del sur la fibrosis endomiocárdica es endémica 153.
En general, se trata de un tipo de miocardiopatía cuya terapéutica es con frecuencia decepcionante. Uno de los puntos cruciales de su manejo es diferenciarla cuidadosamente de la pericarditis constrictiva (PC), puesto que ésta tiene una terapia quirúrgica 154.
Diagnóstico sindrómico
El diagnóstico de MR puede sospecharse cuando concurran al menos dos de los tres criterios siguientes: a) insuficiencia cardíaca sin causa aparente; b) ecocardiograma sugestivo (véase apartado de exploraciones complementarias) pero que en esencia sería un registro con cavidades ventriculares poco dilatadas, con función sistólica preservada (o sólo ligeramente disminuida) y con signos de disfunción diastólica, y c) manifestaciones sistémicas que puedan sugerir cualquiera de las entidades capaces de dar lugar a MR (veánse formas específicas).
Manifestaciones clínicas
La mayoría de los pacientes se diagnostican cuando la enfermedad está muy avanzada y existen claros síntomas de fracaso ventricular. Los síntomas incluyen disnea, disnea paroxística nocturna, ortopnea, edemas, ascitis, cansancio y fatiga.
La angina es excepcional, excepto en la amiloidosis. Un tercio de los pacientes que cursan con MR idiopática pueden presentar complicaciones tromboembólicas. Los trastornos de conducción son comunes en la amiloidosis y sarcoidosis. Asimismo, las arritmias auriculares son frecuentes en la idiopática y en la amiloidosis. No se debe olvidar que en muchas ocasiones la afectación miocárdica es secundaria a una enfermedad sistémica, pudiendo tener el paciente cualquier otra sintomatología asociada.
Exploración física
En el examen físico los pacientes presentan las consecuencias de la elevación de las presiones de llenado. Las del lado derecho, valoradas por la presión venosa que está llamativamente elevada, con los colapsos x e y pronunciados. Ascitis y edemas están presentes en casos avanzados y en ocasiones con manifiesta hepatomegalia dolorosa y pulsátil. A la auscultación pueden existir soplos de regurgitaciones auriculoventriculares y tercer ruido 155.
Pruebas complementarias
El ECG casi siempre es anormal, pero muy inespecífico, describiéndose anormalidades de la repolarización, bloqueos de rama de predominio izquierdo, bloqueos AV, arritmias auriculares y bajo voltaje.
La radiografía de tórax en la MR no se caracteriza, a diferencia de la MD, por un gran crecimiento del tamaño de la silueta cardíaca.
El ecocardiograma-Doppler es el elemento diagnóstico incruento fundamental y suele proporcionar información muy útil desde el punto de vista anatómico y hemodinámico 156,157. La realización del mismo ante la sospecha de MR constituye una recomendación clase I. Estructuralmente se observan cavidades ventriculares no dilatadas y con función sistólica normal o sólo ligeramente disminuida, con espesores normales en los casos idiopáticos y aumentados en los casos infiltrativos. Generalmente las aurículas están dilatadas y este agrandamiento es superior al observado en la PC. El pericardio suele ser normal, aunque pueden detectarse pequeños derrames, bien como manifestaciones de la congestión sistémica o en casos de etiología infiltrativa. El estudio funcional con técnica Doppler permite valorar los flujos a nivel valvular auriculoventricular y en las venas hepáticas y pulmonares 158. A nivel mitral el flujo restrictivo se caracteriza por la presencia de onda E aumentada (> 1 m/s), disminución de la onda A(< 0,5 m/s) y el consiguiente incremento de la ratio E/A (> 2), disminución del tiempo de desaceleración mitral (< 150 ms) y un tiempo de relajación isovolumétrico disminuido (< 70 ms). En las venas pulmonares y hepáticas, la onda sistólica está muy disminuida, con un incremento importante de la onda diastólica y una onda auricular más ancha y profunda. A la inspiración, el flujo pulmonar no se modifica; no así el flujo hepático, que se caracteriza por la presencia de un flujo retrógrado antes de la contracción auricular.
El cateterismo cardíaco en la MR aporta información de gran valor para documentar el diagnóstico, valorar la severidad, distinguirla si es posible de la PC y, en casos seleccionados, establecer la etiología mediante biopsia endomiocárdica 159. No obstante, no es una exploración absolutamente imprescindible y su realización constituye una recomendación clase IIa. Las anomalías de aurícula derecha se caracterizan por aumento de la presión venosa (15-20 mmHg), con morfología de seno y profundo que se intensifica y se hace abrupto con la inspiración, mientras que las otras ondas no se modifican. En el ventrículo derecho se obtiene una presión diastólica elevada, con una presión sistólica alrededor de 40-45 mmHg. A este nivel se aprecia la morfología típica descrita como dip plateau, caracterizada por una declinación rápida, temprana y profunda protodiastólica, seguida de una meseta durante la cual no tiene aumento la presión ventricular. Estos datos son idénticos a los que se obtienen en la PC. A nivel pulmonar existe una hipertensión moderada y una presión capilar elevada. La presión de llenado ventricular izquierda presenta la misma morfología que la de ventrículo derecho, con igualación de presiones entre ambas cámaras. Por otra parte, una presión de llenado ventricular izquierda basal o con el esfuerzo > 5 mmHg orienta más hacia una MR que la PC. La ventriculografía izquierda suele ser normal. La biopsia endomiocárdica es una parte integral del diagnóstico en algunos pacientes con MR. En casos en los que la distinción con la PC es difícil, la biopsia puede ser diagnóstica.
Diagnóstico diferencial con la pericarditis constrictiva
Una historia de pericarditis antigua o de tuberculosis, cirugía cardíaca previa, traumatismo o tratamiento radioterápico torácico previos nos orientará hacia PC. Inversamente, el diagnóstico previo de amiloidosis, hemocromatosis o sarcoidosis orienta hacia MR.
Numerosas técnicas se han utilizado en el diagnóstico diferencial: la ecocardiografía-Doppler 160, el cateterismo cardíaco 161, la biopsia endomiocárdica 162, la tomografía computarizada y la resonancia magnética 163.
En la tabla 9 se recogen las diferencias más notables entre ambas entidades. Ninguna técnica es totalmente segura y en algunos pacientes puede ser necesario (aunque muy raramente) llegar a realizar una toracotomía diagnóstica.
Formas específicas (tabla 10)
164
Se detallan los aspectos diagnósticos y de manejo únicamente de las formas más comunes.
Existen casos de base genética, puesto que se han descrito afectaciones familiares, a veces asociados con miopatía esquelética, con herencia autosómica dominante y desarrollo en la tercera o cuarta década de la vida, con bloqueo AV y debilidad muscular. La escasa experiencia acumulada en la infancia sugiere su mayor presencia en niñas y peor pronóstico que en el adulto.
El curso clínico suele ser tórpido, con cardiomegalia ligera a moderada, predominio de agrandamiento biauricular y trombos en los apéndices auriculares. La fibrosis intersticial es variable en extensión, desde inexistente a severa, con tendencia a distribución parcelar, pudiendo involucrar a los nódulos sinoatrial y atrioventricular.
La afectación cardíaca es más común en la forma primaria, ocasionada por la producción de inmunoglobulinas de cadena ligera por las células plasmáticas y en probable relación con mieloma múltiple. La forma secundaria lo es por depósito de transtiretina, una proteína no inmunoglobulina, bien sea familiar, senil o secundaria a proceso inflamatorio crónico (por ejemplo, tuberculosis o artritis reumatoide). La familiar se hereda con carácter autosómico dominante. El 95% de los octogenarios tienen depósito cardíaco de amiloide, aunque no tengan manifestaciones clínicas 165.
La amiloidosis, una enfermedad que raramente se considera en el diagnóstico diferencial de la insuficiencia cardíaca con función sistólica normal, puede causar trastornos de la conducción, arritmias supra o ventriculares, insuficiencia cardíaca o una combinación de ambas. La forma familiar es autosómica dominante heterozigota, con un riesgo de transmisión al hijo del afectado del 50%, de comienzo tardío y posible presentación sin manifestaciones sistémicas.
La amiloidosis debe sospecharse en cardiopatía con disfunción diastólica ventricular y evidencia asociada de neuropatía periférica (síndrome del túnel carpiano), neuropatía autonómica (diarrea o impotencia) y nefropatía. Las manifestaciones cardiovasculares se expresan de cuatro formas 164: a) MR con predominio de fallo cardíaco; b) miocardiopatía con disfunción sistólica, lo que ocurre cuando hay infiltración amiloide severa con reemplazamiento miocárdico y angina de pecho por depósito de amiloide en las coronarias epicárdicas; c) hipotensión ortostática, que sucede en el 10% por depósito de amiloide en el sistema nervioso autónomo, vasos o sistema adrenal, y d) arritmias y alteraciones de la conducción cardíaca, con muerte súbita relativamente común.
En la exploración física es poco corriente, a pesar de la restricción al llenado, la presencia de cuarto ruido, en relación con la infiltración amiloide de las aurículas. El ECG pone de manifiesto con frecuencia (mitad de los pacientes) bajo voltaje, imagen de necrosis inferior o ausencia de r inicial en precordiales derechas y arritmias, siendo la fibrilación auricular la más común y las ventriculares complejas no infrecuentes. Los trastornos de la conducción cardíaca son peculiares de la forma familiar polineuropática. El moteado característico de las paredes en el ecocardiograma está rara vez presente, de modo que no debiera nunca olvidarse la posible combinación (de hecho, más común) de cavidades ventriculares pequeñas, dilatación biauricular, engrosamiento (asimétrico a veces) de las paredes ventriculares y del septo interauricular, velos AV engrosados con regurgitación mitral o tricúspide y patrón restrictivo en el Doppler.
En la práctica, un ECG con bajo voltaje, eco con paredes ventriculares engrosadas y función sistólica global conservada en paciente con insuficiencia cardíaca, peculiar combinación voltaje/masa, lo hace distinguirse de la pericarditis constrictiva o de una hipertrofia definida de ventrículo izquierdo de cualquier otro origen. La sospecha debe confirmarse en la forma primaria con la búsqueda de inmunoglobulina monoclonal en suero u orina. La biopsia es pieza fundamental, buscando amiloide en grasa peritoneal, o a nivel gingival, rectal, médula ósea, renal o endomiocárdico. En la forma familiar se ha descrito la mutación genética. La gammagrafía con tecnecio, galio o antimiosina demuestra incremento difuso de la captación miocárdica.
Se ha dado valor pronóstico ominoso al patrón restrictivo del flujo Doppler transmitral resultante de la combinación de tiempo de deceleración de la onda E corta y relación E/A incrementada 166.
En la terapia farmacológica destaca la contraindicación relativa de la digoxina y de los antagonistas del calcio, por su ligazón a las fibrillas de amiloide. Se recomienda el uso prudente de dosis bajas de diuréticos y vasodilatadores, por el riesgo potencial de hipotensión.
Enfermedad infiltrativa granulomatosa con afectación multisistémica, de pulmones, sistema reticuloendotelial y piel, preferentemente. La casi constante infiltración pulmonar conduce a fibrosis, hipertensión pulmonar e insuficiencia cardíaca derecha (cor pulmonale). La sarcoidosis cardíaca per se se presenta en menos de un 5% de los casos 164.
Afecta típicamente a jóvenes o adultos, de ambos sexos, de mediana edad. La granulomatosis miocárdica puede expresarse como bloqueo cardíaco, insuficiencia cardíaca congestiva, arritmias ventriculares, síncope y muerte súbita. La insuficiencia cardíaca puede ser manifestación de disfunción diastólica o, más frecuentemente, de disfunción sistólica con dilatación ventricular homogénea o con aneurismas e insuficiencia mitral secundaria. Los granulomas presentan cierto tropismo por las porciones basales y la infiltración del nodo AV y del His es relativamente común.
El diagnóstico debe sospecharse en pacientes relativamente jóvenes con alguna de las manifestaciones clínicas antedichas y adenopatías hiliares bilaterales en la radiología de tórax. El ecocardiograma con hipocinesia difusa, así como anomalías segmentarias del movimiento del septo basal, con ápex ventricular indemne, sería también sugestivo. El talio 201 podría demostrar defectos segmentarios de la perfusión. Se ha sugerido que una captación anormal de galio 67 podría predecir una respuesta favorable a esteroides 167.
Los corticoides se propugnan para intentar detener la progresión de la granulomatosis y la infiltración consiguiente del sistema de conducción. En algunos casos es necesaria la implantación de marcapasos definitivo o incluso de un desfibrilador automático en pacientes con arritmias malignas.
Se caracteriza por depósito excesivo de Fe en diversos parénquimas (hígado, corazón, gónadas y páncreas) en relación con: a) afectación familiar o idiopática; b) defecto de síntesis de hemoglobina; c) enfermedad hepática crónica, y d) por toma excesiva de Fe oral durante años.
El depósito férrico cardíaco no tiene por qué correr paralelo al de otros órganos, aunque el daño miocárdico sí tiene correlación con la cuantía de aquél y puede manifestarse como miocardiopatía dilatada o restrictiva, con disfunción sistólica o diastólica, respectivamente
Las manifestaciones clínicas son de un amplio abanico, desde aquellos asintomáticos, a pesar de evidencia ecocardiográfica, a otros con clínica de insuficiencia cardíaca. Son raros los trastornos de conducción y las arritmias ventriculares. El diagnóstico se basa en el hallazgo de Fe sérico elevado (> 180 pg/dl), saturación elevada de transferrina (> 80%), incremento de la ferritina sérica (> 900 ng/dl) y ascenso del Fe urinario (> 9 mg/24h). Cuando se sospeche carga familiar hereditaria se puede indagar el gen HH de la hemocromatosis.
El tratamiento específico, sistémico, incluye las flebotomías reiteradas 168 o el empleo del agente quelante desferroxiamina.
Se han descrito dos formas o variantes de esta singular MR; la más frecuente ocurre, preferente o exclusivamente, en países tropicales, denominada fibrosis endomiocárdica, y la propia de climas templados, denominada endocarditis fibroplástica parietal de Löffler. Ha sido postulado que ambas son fases diferentes de una afección progresiva resultante del efecto tóxico de los eosinófilos sobre el propio corazón 164.
Fibrosis endomiocárdica. Ocurre con preferencia en el África tropical, aunque también se han descrito casos en India, Brasil, Colombia y Sri-Lanka. Afecta a ambos sexos, más común en niños, adultos jóvenes, especialmente individuos de raza negra. Un 50% presentan insuficiencia cardíaca biventricular, un 40% izquierda pura y 10% derecha pura. Cuando afecta al ventrículo derecho se produce una fibrosis gruesa y densa del tracto de entrada y del ápex, con afectación de cuerdas tendíneas y músculos papilares, con posible trombosis y fibrosis obliterativa del ápex que distorsiona la válvula tricúspide. Cuando afecta al ventrículo izquierdo, la similitud es pareja, respetando únicamente el velo anterior mitral y el tracto de salida. Los depósitos cálcicos endocárdicos no son infrecuentes.
El curso clínico es irregular, asistiéndose a fases de recaída aguda o subaguda, a pesar de un comienzo insidioso, y otras de estabilización espontánea aparente, con supervivencias de hasta 12 años. El peor pronóstico ocurre en aquellos pacientes en que se inicia con insuficiencia cardíaca derecha avanzada.
La forma con insuficiencia cardíaca derecha se acompaña de insuficiencia tricúspide severa con agrandamiento de aurícula derecha, hígado pulsátil, ascitis, edemas periféricos, voltaje del qRs disminuido, alteraciones inespecíficas de la repolarización, crecimiento de aurícula derecha con patrón qR en V1, fibrilación auricular, calcificación del ápex ventricular en la radiología de tórax y engrosamiento de la pared posteroinferior del ventrículo derecho, obliteración del ápex, insuficiencia tricúspide y dilatación ventricular con morfología restrictiva del llenado ventricular en eco-Doppler.
La calcificación de la pared ventricular se presta a diagnóstico diferencial con otras entidades: la pericarditis constrictiva localizada, el seudoxantoma elástico 169 y la secundaria a hipoparatiroidismo asociado a insuficiencia renal crónica 170.
La forma con sintomatología de insuficiencia cardíaca izquierda y soplo de insuficiencia mitral se acompaña de signos electrocardiográficos en forma de alteraciones inespecíficas de la repolarización, crecimiento de aurícula izquierda o fibrilación auricular, así como de datos ecocardiográficos del tipo de engrosamiento y movilidad reducida de la pared posterobasal del ventrículo izquierdo y del velo posterior mitral, con regurgitación mitral, agrandamiento de la aurícula izquierda y obliteración apical. El ventriculograma puede demostrar trombos intracavitarios ocasionales.
La práctica de biopsia endomiocárdica rara vez estaría indicada por el peligro potencial de movilizar un trombo mural, con la consiguiente embolización pulmonar o sistémica.
En aquellos casos en fase avanzada el pronóstico es sombrío, con una mortalidad estimada del 35-50% a los 2 años. La terapia farmacológica es puramente «paliativa», con la digital para controlar la fibrilación auricular como indicación prácticamente única, y los diuréticos poco eficaces, incluso con ascitis. La escisión quirúrgica del endocardio fibrótico y el remplazamiento de las válvulas mitral o tricúspide conducen a alivio sintomático manifiesto, siempre que se asuma el alto riesgo de una compleja intervención, que implica mortalidades operatorias del 15 al 25% 171.
Endocarditis de Löffler (síndrome hipereosinofílico). La hipereosinofilia de cualquier origen puede ir asociada a enfermedad endomiocárdica. Su patogenia radica en que una eosinofilia severa mayor de 1.500 eosinófilos/ ml durante 6 o más meses, de origen alérgico, autoinmune (por ejemplo, síndrome de Churg-Strauss), parasitario, idiopático o por enfermedad maligna (por ejemplo, leucosis), causaría daño tisular atribuible a proteínas citotóxicas. Estas proteínas podrían depositarse en el miocardio por un período prolongado de tiempo con daño tisular continuado (fase necrótica) que puede afectar a pericardio, miocardio y endocardio; se continuaría con otra fase trombótica caracterizada por formación de trombos murales y finalmente sobrevendría la fase fibrótica, bien localizada o difusa.
El paciente típico sería un varón en la tercera o cuarta década de la vida, con síndrome hipereosinofílico, que vive en un país templado y en el que la afectación cardíaca acaecería en las 3/4 partes de los casos. Las manifestaciones clínicas incluirían pérdida de peso, fiebre, tos, exantema cutáneo e insuficiencia cardíaca congestiva en fases avanzadas (en más de la mitad), tanto derecha como izquierda. La presencia de cardiomegalia, soplo sistólico de insuficiencia mitral y embolismo sistémico son comunes. El ECG puede demostrar anomalías inespecíficas de la repolarización, arritmias como fibrilación auricular y alteraciones de la conducción como bloqueo de rama derecha. En el ecocardiograma aparece engrosamiento de la pared posterobasal, a veces con movimiento reducido del velo posterior mitral e insuficiencia mitral secundaria en el Doppler, agrandamiento de aurículas en relación con regurgitación AV y obliteración del ápex de ambos ventrículos, a consecuencia del engrosamiento fibroso endomiocárdico y del posible depósito de trombos murales apicales.
Los corticoides pueden tener un efecto beneficioso en la fase de miocarditis aguda, junto a fármacos citotóxicos como la hidroxiurea, lo que podría prolongar la supervivencia 164. La cirugía de resección endomiocárdica parece ofrecer al menos alivio paliativo 164.
Resumen del manejo
La MR es la entidad en que el manejo está menos establecido. El diagnóstico tiene 3 fases, por las que es inexcusable pasar: el sindrómico, el etiológico y el diferencial. En cuanto al sindrómico, debe sospecharse MR cuando un paciente presente insuficiencia cardíaca de causa no aclarada en presencia de un ecocardiograma sugestivo (ventrículos poco dilatados con contractilidad prácticamente conservada, miocardio de grosor normal o aumentado, aurículas grandes y -lo más importante- signos de disfunción diastólica). En cuanto al diagnóstico etiológico, debe insistirse en que las etiologías específicas son poco frecuentes, aunque es de importancia capital diagnosticarlas por su trascendencia terapéuticas y que los hallazgos sugestivos de cada etiología concreta (amiloidosis, hemocromatosis, sarcoidosis, etc.) no hay que buscarlos en el corazón, sino en el resto de órganos y sistemas. Con respecto al diagnóstico diferencial con la pericarditis constrictiva, hoy día éste es posible efectuarlo con certeza en más del 90% de casos según los datos obtenidos de la historia clínica, la exploración física y las técnicas de imagen, pero vuelve a ser de importancia máxima no dejar de efectuarlo por su trascendencia terapéutica.
Finalmente, el tratamiento de la insuficiencia cardíaca y las arritmias, así como la prevención de tromboembolias, podría considerase el estándar con escasos matices, mientras que el específico será el tratamiento médico de cada entidad específica, existiendo la posibilidad de cirugía en el caso de la fibrosis endomiocárdica y culminando todo ello en el trasplante cardíaco, fundamentalmente en casos de insuficiencia cardíaca refractaria, siempre que no exista enfermedad sistémica extracardíaca que comprometa el resultado.
MIOCARDITIS
Introducción
En un contexto de presentación aguda, la miocardiopatía dilatada idiopática se ha asociado a un proceso de inflamación miocárdica, la miocarditis. Las presentaciones clínicas de una miocardiopatía dilatada y una miocarditis pueden ser muy variables y en ocasiones no se distinguen con facilidad una de otra 3,172-174. Como sea que ninguno de los dos términos se pueden intercambiar ni utilizar con precisión, es preferible emplear el término de enfermedad miocárdica idiopática para aquellas enfermedades del miocardio que no se puedan clasificar correctamente 175. El término se utilizará en este capítulo por pura conveniencia, y no con la pretensión de introducir una terminología nueva.
Diagnóstico
Se cree que una parte importante de las miocarditis son virales. Virus cardiotropos producen una lesión del miocardio que expone nuevos antígenos al sistema inmunitario, generando con ello una respuesta inmunológica secundaria. Se cree que la miocarditis se presenta a menudo en forma de manifestaciones sistémicas, cambios electrocardiográficos o ecocardiográficos sugestivos de miopericarditis y con una función ventricular normal. Estos pacientes se curan en general sin lesión residual. Otro subgrupo de pacientes con lesión miocárdica cursan con disfunción ventricular y se curan con secuelas (disfunción, dilatación). Este grupo de enfermos puede permanecer estable durante años o su curso ser progresivo hacia una dilatación y disfunción ventricular graves que condicionan un fallo cardíaco. Finalmente, hay pacientes que tienen un curso clínico fulminante y fallecen a las pocas horas de las primeras manifestaciones clínicas 174. La patología viral puede abarcar todo el espectro clínico descrito. El aislamiento de genoma viral, habitualmente enterovirus, se ha llevado a cabo por varios grupos 176,177. Es posible que la presencia de virus dañe el miocardio 178 y sean los responsables del mal pronóstico que tienen los pacientes portadores de virus en el miocardio con respecto a los enfermos en los cuales no se detecta genoma de enterovirus 179.
Parecería lógico considerar que si la miocarditis es la precursora de una miocardiopatía, un porcentaje importante de pacientes con miocardiopatía presentarían miocarditis en evolución. Sin embargo, en las grandes series necrópsicas de pacientes con miocardiopatía dilatada la miocarditis es de muy baja prevalencia. En las formas agudas de la enfermedad la incidencia es más alta.
La biopsia endomiocárdica, el único instrumento disponible para detectar miocarditis, es de una sensibilidad muy baja, alrededor del 20% en estudios efectuados in vivo y ex vivo. De hecho, la biopsia como patrón oro se ha cuestionado en diversos estudios en los cuales se ha comparado los resultados obtenidos por biopsia en pacientes con miocardiopatía dilatada o miocarditis que han fallecido o se han trasplantado con el análisis minucioso de todo el corazón explantado. En estas condiciones, la sensibilidad de la biopsia, teniendo en cuenta que se pueden recoger diversas muestras, oscila entre el 0 y el 50%. En un análisis, Hauck estudió 38 corazones provenientes de una autopsia de pacientes en los cuales la miocarditis había sido fundamental en el desenlace clínico fatal; obtuvo ex vivo 10 muestras mediante un biotomo de las partes septal y apical del ventrículo derecho. Los resultados pusieron de manifiesto que sólo un 17% de las 380 biopsias fueron indicativas de miocarditis, y utilizando 5 fragmentos la sensibilidad fue inferior al 50% 180. En otro estudio post mortem de pacientes fallecidos de miocarditis, Chow et al concluyeron que se requerían más de 17 fragmentos de biopsia de ventrículo derecho para alcanzar una sensibilidad diagnóstica del 80% 181. Obrador publicó el rendimiento de la biopsia en una serie de corazones de pacientes con miocardiopatía dilatada explantados durante una operación de trasplante, y a los cuales se había practicado una biopsia preoperatoria. Se detectó un patrón histológico de miocarditis en sólo un 17% de las biopsias que se practicaron a pacientes que en la pieza de cardiectomía mostraron miocarditis 175. Por tanto, el rendimiento diagnóstico de la biopsia en la detección de miocarditis es bajo 181.
El tratamiento inmunosupresor
La descripción original de Mason del tratamiento con éxito, mediante inmunosupresores, de la miocarditis diagnosticada por biopsia 182 originó un estado de opinión en el cual se creía que dicho tratamiento podría curar la enfermedad o retrasar la evolución de la misma. Sin embargo, las observaciones clínicas desde entonces no han corroborado estas impresiones iniciales: algunos pacientes tratados no mejoran, otros no tratados mejoran y otros sometidos a tratamiento inmunosupresor intenso fallecen. El mismo Mason fue el promotor de un importante ensayo clínico destinado a estudiar la respuesta de la enfermedad miocárdica de presentación aguda en relación al tratamiento inmunosupresor. Los resultados demostraron que, aplicando los criterios diagnósticos de miocarditis de Dallas (tabla 11)
183, el hallazgo de miocarditis en un contexto de enfermedad miocárdica idiopática aguda fue del 9,6%. Además, la respuesta de los pacientes tratados con inmunosupresores, en términos de aumento de la fracción de eyección, fue similar a la obtenida en el grupo control 42, lo cual puso en evidencia lo que algunos grupos de investigadores hace años sospechaban: que el componente inflamatorio que se detecta adyacente a las fibras miocárdicas lesionadas identificadas por microscopia óptica (habitualmente linfocitos) puede ser consecuencia y no causa de la lesión miocárdica. En este contexto de incertidumbre diagnóstica y patogénica, un porcentaje importante de pacientes con enfermedad miocárdica idiopática quedan sin ser catalogados de forma precisa y sin una orientación terapéutica.
Búsqueda de una alternativa diagnóstica
Este problema clínico ha conducido a la búsqueda de alternativas diagnósticas a la biopsia endomiocárdica. Sin embargo, como sea que los criterios diagnósticos de miocarditis son esencialmente histológicos (lesión e infiltrado), el diagnóstico de miocarditis siempre requerirá la constatación de un patólogo. Una forma de sortear este problema es a través del uso de métodos diagnósticos que se demuestran eficaces en la detección por separado de cada uno de los componentes de la miocarditis: los infiltrados linfocitarios o la lesión celular. De esta forma se han empleado dos métodos isotópicos: la captación miocárdica de galio 67 y la de anticuerpos monoclonales antimiosina cardíaca.
El galio 67 se fija a los lisosomas de los linfocitos activados, y ello fue la base de su empleo en la detección de inflamación miocárdica. En un estudio de 68 pacientes con miocardiopatía dilatada se detectó una captación de galio 67 en sólo el 7%. La probabilidad de miocarditis se quintuplicaba si la imagen demostraba una positividad. Un estudio prospectivo en 91 pacientes puso de manifiesto una falta de sensibilidad y especificidad en la detección de miocarditis 184,185. Sin embargo, queda la duda de la falta de idoneidad de la biopsia endomiocárdica como patrón oro para detectar miocarditis.
Los anticuerpos monoclonales antimiosina marcados con 111In han aportado recientemente un instrumento valioso para la detección de lesión miocárdica, el otro componente de la miocarditis. Estos anticuerpos se unen a la miosina confinada en el interior de la célula miocárdica únicamente en caso de pérdida de integridad de la membrana celular, lo cual ocurre en la necrosis miocárdica 186-190.
Estudios clínicos con anticuerpos monoclonales antimiosina en patología miocárdica aguda
Son diversos los estudios publicados en las diferentes presentaciones clínicas del espectro de patología miocárdica 191-194: enfermedad aguda o subaguda, crónica estable o crónica inestable. Dec et al han publicado que la miocarditis en la miocardiopatía dilatada es más frecuente si la biopsia endomiocárdica se lleva a cabo durante las primeras 4 semanas de presentación de la enfermedad 193. Las probabilidades de detección decrecen con el paso del tiempo. Dos estudios del mismo centro publicaron 28 y 74 pacientes con miocardiopatía dilatada, una gran parte de los cuales eran de presentación aguda. La prevalencia de miocarditis detectada por biopsia fue del 15%. Los dos estudios revelaron que todos los pacientes con biopsia positiva tenían un estudio isotópico positivo, indicando con ello la alta sensibilidad del método. Todos los enfermos con un estudio isotópico negativo tenían una biopsia negativa, lo cual hacía de esta técnica una de gran utilidad para descartar miocarditis sin necesidad de emplear la biopsia endomiocárdica. Sin embargo, al menos la mitad de los pacientes con captación positiva de anticuerpos no tenían una evidencia por biopsia de miocarditis.
Conceptualmente, esta aparente falta de especificidad puede tener una doble interpretación: o se trata de falsos positivos de los anticuerpos antimiosina o bien, debido al error de muestreo que comporta la biopsia, un falso negativo de la misma. En un trabajo reciente recogimos 21 pacientes (16 varones, 5 mujeres de 26 ± 9 años de edad) remitidos a la sala de urgencias por la sospecha de miocarditis 195. Tenían una enfermedad viral precedente (52%), dolor torácico (57%), trastornos electrocardiográficos inespecíficos (100%), taqui o bradiarritmias (14%) y una elevación de las CPK (90%). En 6 la función ventricular fue normal (62 ± 12%) y en los 15 restantes se detectó una disfunción ventricular (FE: 35 ± 14%) y 10 de los 15 se presentaron con fallo cardíaco. Todos los pacientes tenían una antimiosina positiva. A 13 de estos 15 se les pudo practicar una biopsia endomiocárdica y en sólo 1 caso se detectó miocarditis. Por tanto, esta pequeña serie ilustra lo anteriormente descrito de la falta de sensibilidad de la biopsia, a la vez que aporta una sensibilidad de los anticuerpos monoclonales antimiosina del 100% en la detección positiva, no de presunción, de inflamación miocárdica aguda. Esto está de acuerdo con los datos de Narula et al, quienes utilizan de forma fiable la captación de anticuerpos para el diagnóstico diferencial, en ocasiones de gran dificultad especialmente en personas jóvenes, entre una miocarditis y un infarto agudo de miocardio: la evidencia de enfermedad difusa favorece la miocarditis, mientras la enfermedad localizada haría más probable el infarto agudo de miocardio, aun cuando hay miocarditis que son predominantemente focales 195.
Lesión miocárdica en la miocardiopatía dilatada crónica
En el contexto de la miocardiopatía dilatada crónica, la prevalencia de miocarditis en las grandes series necrópsicas es baja. Curiosamente, cuando apareció la posibilidad de trasplantar y se hicieron biopsias repetidas a estos pacientes con la intención de buscar y tratar una miocarditis, se observó que los resultados eran dispares, entre el 0% a más del 50% según diversos grupos 174. La aparición de un consenso de criterios diagnósticos 183 no ha solucionado esta variedad de prevalencia, aunque en el mencionado estudio de Mason la prevalencia en situaciones de fallo cardíaco reciente de origen desconocido fue < 10% 42.
En pacientes con miocardiopatía dilatada crónica estable varios estudios han publicado una alta prevalencia, cerca de un 70%, de lesión miocárdica 196. La identificación de esta lesión en pacientes estables aporta conceptualmente dos elementos de importancia clínica: la miocardiopatía dilatada no es una entidad inerte, inactiva, sino que hay una actividad inflamatoria de base subyacente; en segundo lugar, como sea que conceptualmente un estudio antimiosina positivo implica que hay una pérdida de células miocárdicas en el momento del estudio, el hallazgo de una positividad en un paciente crónico estable comportaría que hay una pérdida constante de masa miocárdica que podría explicar la evolutividad de esta enfermedad, que había quedado hasta entonces inexplicada.
La pregunta que sigue a estas observaciones es obvia: ¿es esta captación de anticuerpos antimiosina debida a la presencia de una miocarditis subyacente? En un estudio se compararon los estudios antimiosina pretrasplante con el resultado histológico de toda la pieza de cardiectomía, revelando que en una gran mayoría de casos la lesión no se asocia a inflamación (miocarditis) 197.
Lesión sin inflamación: ¿apoptosis?
El concepto de «lesión sin inflamación» cobró todo su sentido cuando Narula observó que la apoptosis de la célula miocárdica se observaba con frecuencia en pacientes con miocardiopatía dilatada 195. La apoptosis es una forma de muerte celular (muerte celular programada) que es patogénica y morfológicamente distinta de la necrosis. La necrosis cursa con una explosión celular, inflamación y cambios morfológicos característicos, mientras que la apoptosis es un proceso genéticamente determinado, requiere energía, cursa con una involución morfológica de la célula y no se acompaña de cambios inflamatorios. La apoptosis no se detecta histológicamente si no se llevan a cabo tinciones especiales. Es posible que la apoptosis pueda explicar la captación de anticuerpos antimiosina por la célula miocárdica apoptótica, aunque este fenómeno aún no se ha demostrado.
Cambios evolutivos de la lesión miocárdica en la miocardiopatía dilatada
Sea cual fuere la explicación de la lesión identificable por anticuerpos antimiosina, lo cierto es que se producen modificaciones en la intensidad de la misma en diversas situaciones clínicas: en condiciones de estabilidad clínica y hemodinámica, por ejemplo enfermos de dispensario, a largo plazo no se observan cambios en la prevalencia ni intensidad de captación, lo cual implica una estabilidad de la lesión. En cambio, en situaciones en las cuales la miocardiopatía dilatada es de aparición aguda o subaguda la lesión sufre modificaciones sustanciales: es habitualmente muy prevalente e importante en la fase de presentación de la enfermedad y hay una reducción o desaparición de la lesión durante el seguimiento. En estas últimas circunstancias se produce un aumento significativo de la fracción de eyección que no ocurre en situaciones de estabilidad 199. Por tanto, se detecta una correlación entre la reducción del grado de lesión con un aumento de la fracción de eyección en la miocardiopatía dilatada. Esto explica el mejor pronóstico de la enfermedad miocárdica de aparición aguda que la crónica.
Patrones evolutivos de captación tras la enfermedad miocárdica de aparición aguda
Sin embargo, lo que es estadísticamente cierto en relación con la reducción de la lesión después de la presentación aguda de una miocardiopatía dilatada, es matizable desde el punto de vista individual. En efecto, la posibilidad de estudiar la evolutividad a largo plazo de la lesión miocárdica después de la presentación de la enfermedad se hacía muy difícil, y su in-terpretación incierta, mediante el uso de la biopsia endomiocárdica que, por otra parte, era de difícil justificación en un paciente con un curso clínico estable. En un seguimiento de hasta 10 años, estudios antimiosina sistemáticos permitieron observar tres patrones evolutivos de lesión miocárdica tras la presentación aguda: la desaparición de la misma, su persistencia a largo plazo o la recurrencia asintomática de la lesión después de su desaparición. Estos tres patrones son de significado pronóstico incierto, a pesar de que la normalización de la lesión se asoció a una mejor fracción de eyección al final del seguimiento. La persistencia de la lesión podría explicar la evolución silente de enfermos que se presentan con una patología aguda a una cronicidad y eventualmente a un fallo cardíaco. Las implicaciones clínicas de estos patrones evolutivos están por establecer. Parecería razonable que estudios antimiosina repetidamente negativos impliquen una curación de la actividad lesional de la enfermedad. Quedaría por ver si el paciente ha curado con o sin secuelas, principalmente en relación a la reducción de la fracción de eyección. Por otro lado, parecería a priori justificado limitar la actividad física competitiva a pacientes tras haber sufrido un proceso miocárdico inflamatorio y que queden con una función ventricular normal pero con una persistencia de la lesión, aunque esto requiere confirmación.
Sea como fuere, la descripción de la lesión miocárdica en las diversas situaciones clínicas asociadas a una enfermedad miocárdica idiopática plantea más problemas conceptuales que resuelve problemas prácticos. La primera consideración es entender que aún no sabemos cuál es el mecanismo de lesión miocárdica persistente: en algunos pacientes puede ser una miocarditis histológica clásica, con elementos de lesión e inflamación, mientras que en otros puede ser una apoptosis. Se requerirán más estudios para dilucidar la naturaleza de la lesión en los diversos contextos clínicos. En segundo lugar, la presencia de la lesión y sus implicaciones en relación a la pérdida de masa miocárdica crónica plantean la necesidad de interrupción de la misma. Tampoco en este sentido hay en la actualidad perspectivas terapéuticas, aunque en observaciones muy aisladas se ha podido constatar que pacientes estables con captaciones altas de antimiosina sometidos a tratamiento con bolos de corticoides han visto desaparecer de forma inmediata la lesión (observaciones no publicadas). La posible aparición de agentes antivirales y su impacto en la reducción/desaparición de la lesión miocárdica de pacientes en los que se detecta genoma viral podría conformar un posible futuro contexto clínico.
Implicaciones pronósticas de la captación de anticuerpos antimiosina
En la población infantil, una captación elevada de antimiosina detectada poco después de la presentación de la enfermedad tiene un significado pronóstico. Cuanto más alta, mayores las probabilidades de complicaciones graves. En adultos, la captación de anticuerpos no tiene relación con el pronóstico. En cambio, la intensidad de la captación parece tenerla, a pesar de que por sí misma no tiene un valor pronóstico independiente. Su empleo conjunto con otras variables clínicas y ecocardiográficas es útil en la estratificación del riesgo de la miocardiopatía dilatada (muerte o necesidad de trasplante) 198,199. Esto puede ser útil en la valoración del momento adecuado para indicar un posible trasplante cardíaco, tanto en la indicación de intervención en un subgrupo de pacientes asintomáticos de alto riesgo, como en la exclusión momentánea de pacientes que tienen una baja probabilidad de sufrir acontecimientos clínicos graves.
Manejo diagnóstico-terapéutico: recomendaciones
La única forma de diagnosticar miocarditis es mediante el empleo de la anatomía patológica: la biopsia endomiocárdica, el estudio necrópsico o la cardiectomía postrasplante. La baja sensibilidad de la detección de miocarditis por biopsia, las dudas sobre la relevancia patogenética de la inflamación miocárdica (primaria frente a secundaria a la lesión) y el hallazgo de una alta prevalencia de lesión sin inflamación en la enfermedad miocárdica idiopática replantea el papel de la biopsia endomiocárdica, tanto en el diagnóstico como en el manejo del paciente con enfermedad miocárdica idiopática.
Tanto desde el punto de vista clínico como en el de futuras investigaciones parecería oportuno profundizar en el estudio de la etiología, patogenia y posible tratamiento de las causas que conducen a la lesión celular miocárdica, acompañada o no de miocarditis. En este sentido, las técnicas capaces de detectar daño miocárdico aportan la posibilidad de diagnosticar positivamente un proceso de lesión celular subyacente, seguir su curso y la posible evolución frente a futuras opciones terapéuticas (tabla 12).
En relación al empleo de los inmunosupresores (azatioprina, ciclosporina, corticoides) los datos actuales no apoyan su uso sistemático en el tratamiento de la enfermedad miocárdica aguda o crónica, a pesar de que se recogen casos aislados de efectos espectaculares tras su administración; por ello, en un contexto de paciente grave se justifica su empleo (recomendación clase IIb). Parecería pertinente que los esfuerzos terapéuticos estuviesen basados cada vez más en el conocimiento de la etiología y/o patogenia de la enfermedad: en este sentido se está llevando a cabo el European Study of Epidemiology and Treatment of Cardiac Inflammatory Disease (ESETCID) 200 en el cual la terapéutica empleada se lleva a cabo en función del tipo de afectación miocárdica inflamatoria: pacientes con una miocarditis por citomegalovirus son aleatorizados a grupos de tratamiento placebo frente a hiperinmunoglobulina; aquellos pacientes en los cuales se detecta genoma de enterovirus en el miocardio se aleatorizan a un tratamiento de interferón-alfa frente a placebo, y en los que no se detecta anomalía alguna se aleatorizan a un tratamiento inmunosupresor frente a placebo. Es de esperar que los resultados de este estudio permitan racionalizar la aproximación diagnóstica y terapéutica a este grupo de enfermedades del miocardio.
Las miocardiopatías se definen como el conjunto de enfermedades del miocardio que causan una mala función del mismo 1. De entre las múltiples clasificaciones que se han realizado de las miocardiopatías, hoy día se acepta comúnmente la de la WHO/ISFC 1. Esta clasificación se realiza según el modelo fisiopatológico o, de ser posible, por los factores etiológicos/patogénicos, dividiéndose en dilatada, hipertrófica, restrictiva, displasia arritmogénica de ventrículo derecho y las denominadas miocardiopatías específicas, incluyendo estas últimas la miocardiopatía isquémica, valvular, hipertensiva y todo un conjunto de formas secundarias a una variedad de agentes y causas, entre las que se encuentra la miocarditis.
Este capítulo se centra en las 3 formas consideradas clásicas, a saber, la miocardiopatía dilatada, hipertrófica y restrictiva, e incluye también la miocarditis, que se considera una miocardiopatía inflamatoria.
Los 4 temas se han centrado en aspectos de manejo y tratamiento, con una introducción previa de aspectos más generales de cada miocardiopatía. En todo momento se ha intentado hacer énfasis en recomendaciones específicas basadas en los niveles de evidencia, aunque en algunos temas, especialmente en los referentes a la miocardiopatía restrictiva y la miocarditis, existe poca información y consenso sobre aspectos concretos.
Miocardiopatía dilatada
La miocardiopatía dilatada (MD) es una causa frecuente de insuficiencia cardíaca 2-5 y es el diagnóstico más frecuente en pacientes sometidos a trasplante cardíaco 6. Desde el punto de vista clínico, la MD se caracteriza por dilatación y disfunción contráctil del ventrículo izquierdo o de ambos ventrículos. La dilatación ventricular es generalmente severa y se acompaña siempre de hipertrofia 1.
La MD puede ser idiopática, genética/familiar, viral y/o inmune, alcohólica/tóxica, o asociada a otras cardiopatías en las cuales el grado de disfunción miocárdica no se explicaría por una determinada sobrecarga hemodinámica o severidad de daño isquémico 1,4. Probablemente, el síndrome clínico de la MD representa un final común al que se llega a través de múltiples mecanismos citotóxicos, metabólicos, inmunológicos, infecciosos y familiares 4. El alcohol, por ejemplo, puede producir disfunción miocárdica severa, con manifestaciones clínicas, hemodinámicas y anatomopatológicas idénticas a las de la MD idiopática 7.
Causas de miocardiopatía dilatada
El síndrome de la MD puede estar causado por una gran diversidad de enfermedades específicas (tabla 1),
aunque la mayoría de los casos son de origen idiopático. En una serie reciente de 673 pacientes con insuficiencia cardíaca estudiados en un centro terciario y evaluados con historia clínica, exploración física, analítica general, coronariografía y biopsia endomiocárdica, el 47% de los casos eran idiopáticos, el 12% miocarditis, el 11% enfermedad coronaria oculta y el 31% restante debidos a causas diversas 8. La diferenciación entre las formas idiopáticas y las secundarias es importante, dado que algunas de estas últimas pueden ser potencialmente reversibles.
Anatomía patológica
Los estudios post mortem demuestran habitualmente dilatación de las cuatro cámaras cardíacas, en especial los ventrículos, que se acompaña a veces de aumento de grosor de la pared. Las válvulas cardíacas son intrínsecamente normales y es frecuente la presencia de trombos intracavitarios 3,5,9. Desde el punto de vista histológico, es típica la presencia de miocitos hipertróficos y muertos, sustituidos por fibrosis con variable afectación del sistema de conducción. Los componentes de la matriz extracelular están aumentados de forma no selectiva 10. Aunque la ausencia de células inflamatorias se utiliza como criterio para diferenciar la MD de la miocarditis, en algunos casos de MD se detectan células T inflamatorias y células endoteliales activadas, sugiriendo la posible contribución de un proceso inflamatorio crónico en la patogenia de esta enfermedad 11.
Etiología y patogenia
La etiología y los mecanismos patogénicos son desconocidos en alrededor de la mitad de los casos de MD 8. Para explicar el daño miocárdico crónico y progresivo se han propuesto tres principales etiopatogenias: a) infección viral crónica del miocardio que produce daño celular; b) alteración de los mecanismos inmunes que conduce probablemente a una enfermedad autoinmune, y c) factores genéticos que serían directa o indirectamente responsables de la enfermedad 5,12-14. La importancia de los factores genéticos ha sido poco valorada durante muchos años. Así, en un estudio retrospectivo realizado en la Clínica Mayo en 1981, sólo un 2% de los casos se identificaron como familiares 4. En los últimos años, sin embargo, diversos estudios prospectivos han demostrado claramente la existencia de transmisión genética de la enfermedad en al menos un 25% de los casos 15-19. No obstante, la verdadera frecuencia de las formas familiares de MD debe estar todavía infraestimada, debido a que, salvo la historia familiar, no existe ninguna característica clínica o histopatológica que permita distinguir las formas familiares de las no familiares. Además, es posible que muchos casos considerados como esporádicos sean realmente formas familiares con mutaciones de novo, penetrancia incompleta o tardía, o evaluación familiar insuficiente 14.
La MD familiar (MDF) es una enfermedad clínica y genéticamente heterogénea 20, como sugieren los diferentes patrones de herencia identificados, entre los que predomina la autosómica dominante, y las diferentes manifestaciones clínicas, pudiendo distinguirse varias formas de la enfermedad 21: a) la MDF pura autosómica dominante, para la que se han identificado 3 locus cromosómicos diferentes, en los cromosomas 9q13-22, 1q32 y 10q21-23, con múltiples genes candidatos identificados en cada locus (recientemente se ha podido comprobar que mutaciones en el gen de la actina cardíaca pueden ser causa de MDF con este tipo de herencia) 22; b) la forma autosómica dominante que se precede de alteraciones de conducción, con tres locus en cromosomas 3p22-25, 1p1-1q1 y 19q13.2-13.3; c) la forma autosómica dominante asociada a miopatía; d) la forma autosómica recesiva; e) la ligada al cromosoma X, por mutaciones en el gen de la distrofina; f) la MD mitocondrial, y g) la miocardiopatía de ventrículo derecho, que puede simular una MD u otras formas de miocardiopatía.
Es posible que exista, además, una predisposición familiar a la MD de origen inmune, aunque hasta ahora no se ha identificado ningún defecto genético en la región del HLA 23.
DIAGNÓSTICO
El estudio del paciente con MD debe enfocarse no sólo al establecimiento del diagnóstico sindrómico, sino hacia la identificación, por los métodos de diagnóstico habituales, de posibles causas tratables o reversibles de la enfermedad 5,24.
La historia clínica debe incluir preguntas relativas al posible consumo de alcohol y cocaína, medicamentos, hábitos nutricionales, estancias en zonas endémicas para infecciones, relación con animales, embarazos recientes, transfusiones sanguíneas, historia familiar de MD, somnolencia diurna y exposición profesional a tóxicos 5. Asimismo, la idea de que la MD idiopática es con frecuencia un problema genético hereditario debe ser tenida en cuenta en la práctica clínica, estudiando sistemáticamente a los familiares de primer grado del paciente 12.
En la mayoría de los pacientes la MD se manifiesta clínicamente entre los 20 y 60 años de edad, aunque la enfermedad puede afectar también a niños y ancianos 5. Los síntomas más frecuentes son los de insuficiencia cardíaca (disnea de esfuerzo progresiva, ortopnea, disnea paroxística nocturna y edemas periféricos). Otras formas de presentación son la detección accidental de cardiomegalia asintomática y los síntomas relacionados con arritmias, alteraciones de conducción, complicaciones tromboembólicas o muerte súbita 5.
La exploración física suele revelar diferentes grados de cardiomegalia y signos de insuficiencia cardíaca. La presencia de un galope presistólico (cuarto ruido) puede preceder a la aparición de insuficiencia cardíaca. El ritmo de galope ventricular (tercer ruido) es la regla en los casos con descompensación de la IC. Es frecuente la presencia de soplos sistólicos de insuficiencia mitral o, menos frecuentemente, tricuspídea 5.
En todo paciente con MD se debe realizar una analítica rutinaria que incluya determinación de hormonas tiroideas y hierro sérico. Dependiendo de las posibilidades diagnósticas derivadas de la historia y exploración física, deberán realizarse otras pruebas de laboratorio más específicas, como las siguientes: anticuerpos antinucleares y otras pruebas serológicas para lupus, determinación de tiamina, carnitina y selenio, anticuerpos antimiosina, evaluación para descartar feocromocitoma, serología viral y pruebas genéticas 5.
En el electrocardiograma, los pacientes con MD presentan frecuentemente bloqueo AV de primer grado, bloqueo completo de rama izquierda, hemibloqueo anterior o alteraciones inespecíficas de conducción intraventricular. Además, un tercio de los pacientes con MD pueden presentar fibrilación auricular. La presencia de taquicardia persistente, como en el caso de fibrilación auricular con rápida respuesta ventricular, puede dar lugar a cierta confusión, dado que la propia arritmia puede ser causa de MD (taquimiocardiopatía) 25.
La radiografía de tórax suele poner de manifiesto cardiomegalia y redistribución venosa por insuficiencia cardíaca 5.
La ecocardiografía bidimensional y Doppler es fundamental para confirmar el diagnóstico, así como muy útil para evaluar el grado de dilatación y disfunción ventricular y para excluir una patología valvular o pericárdica asociada 5. El estudio Doppler permite conocer la severidad de la regurgitación mitral y tricúspide. Además, la presencia de un patrón restrictivo de llenado ventricular parece que identifica un grado más avanzado de enfermedad 26.
La ventriculografía isotópica de primer paso o en equilibrio permite, al igual que la ecocardiografía, estudiar los diámetros y función ventricular, sistólica y diastólica, y la presencia de alteraciones en la motilidad regional, siendo particularmente útil en casos con mala ventana ecocardiográfica 5 y para la valoración de la función ventricular derecha, que tiene importancia pronóstica. Por el contrario, los estudios isotópicos de perfusión con talio 201 y tecnecio 99 no permiten distinguir la MD idiopática de la isquémica 5,27.
La realización de pruebas de estrés físico o farmacológico (en particular la ecocardiografía de ejercicio o tras infusión de dobutamina) es útil para valorar la posible presencia de enfermedad coronaria 28. Por otro lado, las pruebas de esfuerzo cardiopulmonares, con medida del consumo máximo de oxígeno (VO 2 máximo) durante el ejercicio máximo, permiten una valoración objetiva de la capacidad funcional en pacientes con insuficiencia cardíaca 29. Además, la realización de estas pruebas de manera seriada proporciona una información longitudinal muy útil como guía para el tratamiento médico y para alertar al clínico sobre un posible deterioro del estado funcional del paciente 29-31. Un VO 2 máximo inferior a 10-12 ml/kg/min predice una alta mortalidad el primer año (superior al 50%) y se utiliza para la identificación de pacientes que precisan trasplante cardíaco. Otros protocolos de ejercicio pueden ser también utilizados como método alternativo de estimación de la capacidad máxima de ejercicio cuando no es posible obtener el VO 2 máximo 29.
El beneficio de realizar una coronariografía a todos los pacientes con MD no está claro, porque la mayoría o no tienen enfermedad coronaria, o de tenerla, no existe viabilidad para acometer una revascularización. Por consiguiente, la realización sistemática de coronariografía en pacientes con MD constituye una recomendación clase IIb 32. No obstante, debe efectuarse a aquellos pacientes con alta sospecha de enfermedad coronaria y posibilidades de miocardio isquémico-hibernado. Aquí se incluirían pacientes con angina evidente o a quienes una prueba de viabilidad miocárdica ha resultado positiva.
La cateterización de arteria pulmonar puede ser útil como guía para el tratamiento con diuréticos y vasodilatadores parenterales en pacientes con insuficiencia cardíaca severa o en pacientes sometidos a tratamiento convencional que presentan síntomas refractarios 32. El estudio de posibles candidatos a trasplante cardíaco debe incluir cateterismo cardíaco, con determinación de las resistencias pulmonares, fundamental para poder realizar dicho procedimiento 33.
El papel de la biopsia endomiocárdica en la valoración de la etiología de la MD es un tema controvertido. En manos expertas, el riesgo es bajo (menos de un 1% de complicaciones mayores y entre 3 y 4% de complicaciones menores), pero la información clínica que se obtiene de la misma es también baja 34,35. Existe consenso en que la biopsia endomiocárdica no debe emplearse sistemáticamente en la MD (recomendación clase III). Esta recomendación podría cambiar en el caso de que terapias antivirales específicas, como el interferón alfa, demuestren su eficacia en pacientes seleccionados 36. En la actualidad, la biopsia endomiocárdica podría tener sentido en pacientes en los que exista sospecha de alguna enfermedad sistémica que pueda afectar al miocardio, como la hemocromatosis, amiloidosis o sarcoidosis 24, pero en general estas enfermedades suelen poder ser diagnosticadas la mayoría de veces a partir de la afectación de otros órganos (hígado, recto, pulmón).
En pacientes con insuficiencia cardíaca y MD, independientemente de la etiología de ésta, es frecuente la presencia de arritmias supra y ventriculares, que pueden ser causa de síntomas, de morbilidad (como embolia cerebral por fibrilación auricular) y muerte súbita cardíaca. Por ello, la identificación de estas arritmias y de los pacientes con alto riesgo de sufrirlas es un elemento fundamental en el manejo clínico de estos casos 5,37.
La monitorización electrocardiográfica ambulatoria (Holter) es útil para la detección de arritmias asintomáticas (alrededor de la mitad de los pacientes con MD presentan salvas de taquicardia ventricular no sostenida) y para el control de la respuesta al tratamiento en pacientes con arritmias espontáneas frecuentes. No está claro que la presencia de arritmias ventriculares frecuentes y complejas se correlacione con una mayor probabilidad de muerte súbita, aunque sí parece que predice una mayor mortalidad total 37,38.
En el momento actual es controvertido el valor de las pruebas de estimulación eléctrica programada en la identificación de pacientes con MD con riesgo de muerte súbita; la no inducibilidad de arritmias ventriculares no identifica con seguridad a pacientes de menor riesgo y la supresión farmacológica de las arritmias inducibles no predice necesariamente la ausencia de recurrencias. Por tanto, estas pruebas sólo estarían justificadas en estos pacientes en casos con taquiarritmias sintomáticas o que hayan sobrevivido a una fibrilación ventricular 37.
La detección de potenciales tardíos mediante la electrocardiografía con promediado de señales es un predictor independiente de muerte súbita aceptado en pacientes con infarto de miocardio. Aunque esta técnica ha sido aplicada también en pacientes con MD, su eficacia en estos casos es incierta 37,39. La presencia de potenciales tardíos no predice mortalidad en pacientes en espera de trasplante cardíaco.
La dispersión del intervalo QT (> 140 ms) puede ser un predictor de mortalidad en pacientes con MD en espera para trasplante 40.
La escasa variabilidad de la frecuencia cardíaca puede ser predictor de mortalidad en pacientes con insuficiencia cardíaca 41.
Historia natural y predictores de supervivencia
El curso clínico de los pacientes con MD es bastante impredecible en cada caso concreto y depende en parte de la causa de la disfunción ventricular 5. La morbilidad y mortalidad en pacientes con IC son extremadamente altas. En un estudio reciente sobre la influencia del tratamiento inmunosupresor en la miocarditis, por ejemplo, la mortalidad para todo el grupo fue del 20% a un año y del 56% a los 4,3 años 42. Aunque la introducción de nuevas estrategias de tratamiento (en particular los inhibidores de la ECA) ha permitido una mejoría de la supervivencia, diversos estudios longitudinales sugieren que esta mejoría es escasa 43. Una posible explicación a este hecho es que, durante el período en que se realizaron estos estudios, sólo una minoría de pacientes recibían un tratamiento adecuado.
Las dos causas más frecuentes de muerte en pacientes con MD e insuficiencia cardíaca son la muerte súbita y el fallo de bomba progresivo 5. Los datos de la bibliografía indican que entre el 30 y el 50% de los pacientes mueren súbitamente 37. La identificación y tratamiento de los pacientes de alto riesgo es uno de los principales retos que se le plantean al clínico.
Mediante análisis univariados, se han identificado múltiples factores predictores de mortalidad en pacientes con insuficiencia cardíaca (tabla 2).
Muchos de estos factores suponen medidas directas o indirectas de la severidad de la disfunción ventricular. Entre ellos, los más importantes son la clase funcional de la New York Heart Association (NYHA), la fracción de eyección ventricular izquierda y el VO 2 máximo obtenido durante la prueba de esfuerzo cardiopulmonar 5,29,31. Estos determinantes pronósticos asumen que la causa de la disfunción miocárdica no tiene tratamiento específico.
La mayoría de pacientes con MD e insuficiencia cardíaca presentan frecuentemente uno o más de los predictores de mal pronóstico anteriormente mencionados a pesar del tratamiento médico. Aunque con algunas limitaciones, la medida del VO 2 máximo si-gue siendo el mejor predictor objetivo de superviven-cia 29-31. Por tanto, si se dispone de la técnica, se debería realizar una determinación basal del VO 2 máximo en todos los pacientes con MD sintomática. La indicación de un trasplante cardíaco debería ser considerada en candidatos adecuados si, a pesar de un tratamiento correcto, el VO 2 máximo continúa bajando y desciende por debajo de 10-12 ml/kg/min 29-31.
Algunos pacientes con MD muestran disfunción ventricular severa, insuficiencia cardíaca severa y mal pronóstico a pesar de presentar muy poca dilatación ventricular (MD con poca dilatación) 44.
Tratamiento de la miocardiopatía dilatada
(véase la tabla 3 para niveles de recomendación)
Dado que la causa de la MD idiopática es desconocida, hasta ahora no es posible una terapéutica específica de esta enfermedad. Los intentos de tratamiento inmunosupresor, basados en la hipótesis de que la autoinmunidad desempeña un papel etiológico en una alta proporción de pacientes con MD, no han aportado los resultados esperados, por lo que, desde un punto de vista práctico y salvo con fines experimentales concretos, los inmunosupresores no están indicados en el tratamiento de la MD (recomendación clase III) 42. Por otro lado, la posibilidad de que la causa de la disfunción ventricular sea reversible, aplicando medidas terapéuticas específicas debe ser siempre tenida en consideración. Ejemplos frecuentes serían la revascularización coronaria en la MD de origen isquémico cuando existe viabilidad, la supresión de la ingesta etílica en la miocardiopatía alcohólica y la conversión a ritmo sinusal o el control de la respuesta ventricular en casos de fibrilación auricular 5,24,25,45-47.
El tratamiento de los pacientes con MD tiene por objeto: a) controlar los síntomas de insuficiencia cardíaca; b) evitar la progresión de la disfunción ventricular; c) evitar o retrasar la aparición de insuficiencia cardíaca clínica en pacientes con MD asintomática, y d) aumentar la supervivencia. Para ello disponemos en la actualidad de numerosas medidas terapéuticas, tanto farmacológicas como no farmacológicas. Aunque la mayoría de estas medidas son muy eficaces para el control de los síntomas de insuficiencia cardíaca, sólo algunas consiguen un efecto favorable sobre el pronóstico de estos pacientes 5,24,32,48-53.
Algunas medidas generales son recomendables para la mayoría de los pacientes con insuficiencia cardíaca en general. Entre ellas, el abandono del tabaco, la reducción de peso en obesos, el control de la hipertensión, hiperlipemia y diabetes y la reducción de la ingesta alcohólica son beneficiosas para evitar un mayor daño miocárdico. La restricción de la ingesta de sal ayuda a mantener el balance hídrico. La práctica de ejercicio físico moderado, a un nivel adaptado a la situación clínica del paciente, ayuda a mejorar su capacidad de esfuerzo y su situación física general. La aplicación de vacunas antigripal y neumocócica puede disminuir el riesgo de infecciones respiratorias graves y de descompensación cardíaca 48-53.
Diuréticos. Los diuréticos de asa deben ser utilizados en todos los pacientes con síntomas de insuficiencia cardíaca y evidencia de retención hídrica o predisposición a ella (recomendación clase I), ya que son el arma más eficaz para conseguir este objetivo. No obstante, aunque necesarios, los diuréticos no son suficientes, y no deberían ser utilizados como único tratamiento, sino asociados generalmente a inhibidores de la ECA o betabloqueantes 48.
Inhibidores de la enzima convertidora de la angiotensina. Los inhibidores de la enzima de conversión de angiotensina (IECA) han sido ensayados en más de 30 estudios controlados, que incluyeron más de 7.000 pacientes con insuficiencia cardíaca por disfunción sistólica de diversas etiologías y grados de severidad 48,51,53-57. El análisis de esta amplia experiencia indica que los IECA pueden aliviar los síntomas y mejorar el estado clínico de los pacientes con insuficiencia cardíaca crónica 48,57. Asimismo, estos fármacos pueden disminuir el riesgo de muerte, así como el riesgo combinado de muerte u hospitalización 57. El beneficio de los IECA se ha observado en pacientes con síntomas ligeros, moderados y severos y en pacientes con y sin enfermedad coronaria 51,52. Por tanto, todos los pacientes con MD e insuficiencia cardíaca deberían ser tratados con un IECA, salvo que hayan presentado intolerancia o tengan alguna contraindicación para el uso de este tipo de fármacos (recomendación clase I) 48. En pacientes con evidencia o antecedentes de retención hídrica, los IECA se deben asociar a diuréticos. Los IECA se recomiendan también en pacientes con disfunción sistólica sin clínica de insuficiencia cardíaca 48,58. Aunque los estudios clínicos sugieren que todos los IECA podrían tener efectos igualmente favorables, se debería dar preferencia a aquellos fármacos y dosis utilizados en los grandes ensayos clínicos 59.
Bloqueantes betaadrenérgicos. Los betabloqueantes (en particular bisoprolol, metoprolol y carvedilol) han sido hasta la fecha ensayados en alrededor de 10.000 pacientes con insuficiencia cardíaca en más de 20 ensayos clínicos controlados 48,51.60-67. Todos estos estudios incluyeron pacientes con disfunción sistólica que ya tomaban diuréticos y un IECA, con o sin digital. La experiencia con betabloqueantes incluye muy diversos tipos de pacientes, con diferentes causas y severidad de la disfunción ventricular 51. Esta amplia experiencia indica que el tratamiento a largo plazo con betabloqueantes puede disminuir los síntomas y mejorar la situación clínica de los pacientes con insuficiencia cardíaca crónica. Además, al igual que los IECA, los betabloqueantes pueden disminuir el riesgo de muerte y el combinado de muerte y hospitalización. Estos beneficios se han observado en pacientes que ya recibían tratamiento con IECA, lo que sugiere que la inhibición combinada de dos mecanismos neurohormonales puede producir efectos aditivos 48,67.
Por tanto, los pacientes con MD e insuficiencia cardíaca estable en clase funcional II-III de la NYHA deberían ser tratados con un betabloqueante salvo que tengan alguna contraindicación o no toleren el tratamiento (recomendación clase I) 48,51,53; generalmente los betabloqueantes se usan asociados a diuréticos e IECA 48,53. El tratamiento con betabloqueantes debe iniciarse con dosis muy bajas, con incrementos progresivos cada 2-4 semanas si la tolerancia es buena, siendo necesario un estricto control clínico del paciente durante la fase de ajuste de la dosis. Existen pocos datos sobre el efecto de los betabloqueantes en pacientes inestables o que estén o hayan estado recientemente en clase funcional IV, por lo que no se recomienda dicho tratamiento en este tipo de pacientes 48,53.
Se desconoce si existen diferencias en el efecto terapéutico entre diferentes betabloqueantes, aunque los ensayos clínicos han demostrado efectos favorables, tanto con betabloqueantes selectivos como con no selectivos. La posibilidad de que el bloqueo multirreceptor sea superior al bloqueo monorreceptor está siendo actualmente estudiada de manera prospectiva en el estudio COMET (Carvedilol or Metoprolol European Trial) que compara los efectos sobre la supervivencia del carvedilol y metoprolol en más de 3.000 pacientes con insuficiencia cardíaca crónica tratados a lo largo de 4 años 48,51.
Digital. Los resultados de diferentes estudios controlados con placebo en pacientes con miocardiopatía isquémica y no isquémica, de los que sólo uno incluye seguimiento a largo plazo (DIG, Digitalis Investigation Group), indican que el principal beneficio de la digoxina en pacientes con insuficiencia cardíaca es el alivio de los síntomas y la mejoría clínica del paciente, con disminución del riesgo de hospitalización (recomendación clase I). Sin embargo, la digoxina no parece tener un efecto significativo sobre la supervivencia de estos pacientes 48,51,68.
La digoxina, junto con los diuréticos, IECA y betabloqueantes, se recomienda para mejorar la situación clínica de los pacientes con insuficiencia cardíaca por disfunción sistólica. Asimismo, está indicada en pacientes con fibrilación auricular con rápida respuesta ventricular, aunque los betabloqueantes pueden ser más eficaces para controlar la respuesta ventricular durante el ejercicio en estos casos 48,53.
Hidralazina y dinitrato de isosorbide. La combinación de hidralazina y dinitrato de isosorbide no debe utilizarse en pacientes con insuficiencia cardíaca en los que no se hayan probado antes los IECA 48,53,55. No obstante, y aun en ausencia de datos sobre la utilidad de esta combinación en pacientes con intolerancia a los IECA, la utilización de hidralazina y dinitrato de isosorbide debería ser considerada como una alternativa terapéutica en esos pacientes, en particular en los que tienen hipotensión o insuficiencia renal. No existen evidencias que apoyen la utilización de nitratos o hidralazina por separado en pacientes con insuficiencia cardíaca 48.
Antagonistas de receptores de angiotensina II. Hasta la fecha, no existe evidencia clara de que los antagonistas de los receptores de la angiotensina II (ARAII) sean superiores o equivalentes a los IECA en el tratamiento de pacientes con insuficiencia cardíaca por MD 48,69. Por tanto, estos fármacos no deberían ser utilizados en pacientes en los que no se hayan ensayado previamente los IECA. La utilización de ARAII en lugar de IECA es razonable sólo en pacientes que no toleran los IECA debido a angioedema o tos no controlable, dado que los otros efectos secundarios (hipotensión, insuficiencia renal, hipercalemia) pueden aparecer con igual probabilidad que con los IECA 48. Varios estudios multicéntricos están estudiando actualmente los efectos de los ARAII sobre la supervivencia, tanto asociados a IECA como en lugar de éstos.
Calcioantagonistas. Debido a la falta de evidencias que apoyen su eficacia, los antagonistas del calcio no deben ser utilizados para el tratamiento de la insuficiencia cardíaca 48. Los grandes ensayos clínicos (PRAISE, V-HeFT III, MACH-1, DiDi) con nuevos calcioantagonistas no han aportado evidencias de que el tratamiento crónico con estos fármacos pueda mejorar los síntomas de insuficiencia cardíaca o prolongar la vida de los pacientes 48,53,70-72. Debido a las dudas existentes sobre su seguridad, la mayoría de los calcioantagonistas deben ser evitados en pacientes con insuficiencia cardíaca (recomendación clase III). Existe, sin embargo, evidencia suficiente de que el amlodipino no afecta negativamente la supervivencia 70. La posibilidad de que el amlodipino tenga un efecto favorable sobre la supervivencia en pacientes con MD no isquémica requiere todavía confirmación, y está siendo actualmente estudiada (estudio PRAISE II).
Antagonistas de la aldosterona. Sobre la base de los resultados del estudio RALES (Randomized Aldactone Evaluation Study) 73,74, que demuestran una significativa reducción en mortalidad, necesidad de hospitalización por insuficiencia cardíaca y riesgo combinado en pacientes con insuficiencia cardíaca severa tratados con espironolactona (hasta 25 mg/día), el uso de bajas dosis de espironolactona está indicado en pacientes con insuficiencia cardíaca en clase funcional III o IV (recomendación clase I) 48,53. La eficacia y seguridad de los antagonistas de la aldosterona en pacientes con IC leve o moderada siguen siendo desconocidas 48.
Inotrópicos. La administración oral de diversos agentes inotrópicos positivos, entre los que se incluyen los inhibidores de la fosfodiesterasa (milrinona), agonistas betaadrenérgicos (xamoterol), vesnarinona y agentes dopaminérgicos (como la ibopamina) se ha asociado con una mayor mortalidad, por lo que se desaconseja su uso en pacientes con MD e insuficiencia cardíaca (recomendación clase III) 48,53. Sin embargo, la administración intravenosa intermitente de alguno de estos fármacos (dobutamina, milrinona) puede producir un beneficio sintomático en algunos pacientes con insuficiencia cardíaca refractaria 75. En algunos casos este beneficio puede durar algunas semanas 76. No obstante, su uso a largo plazo puede aumentar la mortalidad 77. Por tanto, la ausencia de datos sobre su eficacia y sus posibles riesgos hacen que no se pueda recomendar el uso de infusiones intermitentes de estos fármacos para el tratamiento de la insuficiencia cardíaca, incluso en estadios avanzados 48,53.
Antiarrítmicos. Dado que los pacientes con disfunción ventricular e insuficiencia cardíaca tienen alta incidencia de arritmias ventriculares frecuentes y complejas y un alto riesgo de muerte súbita, ha existido un gran interés en el tratamiento antiarrítmico de estos pacientes 37,78. Aunque todos los fármacos antiarrítmicos pueden ser capaces de suprimir la actividad ectópica ventricular, este efecto no se acompaña de una reducción en el riesgo de muerte súbita en ensayos clínicos controlados 79. Por el contrario, la mayoría de los fármacos antiarrítmicos tienen efecto inotrópico negativo y pueden aumentar el riesgo de arritmias graves, en especial en pacientes con disfunción sistólica severa 80,81. Por tanto, no se recomienda de forma general el tratamiento antiarrítmico de los pacientes con arritmias ventriculares asintomáticas o no sostenidas. La utilización de fármacos o dispositivos antiarrítmicos debería reservarse para pacientes con a) taquicardia ventricular sostenida o sintomática, fibrilación ventricular o historia de muerte súbita resucitada, o b) arritmias auriculares recurrentes o sostenidas. En estos pacientes, el tratamiento debe ser individualizado y supervisado por un electrofisiólogo en caso necesario 37,48.
Los agentes antiarrítmicos de clase I no deben ser utilizados en pacientes con disfunción ventricular, excepto para el tratamiento inmediato de arritmias ventriculares graves refractarias a otros tratamientos 48. Algunos antiarrítmicos de clase III, como la amiodarona, no parecen aumentar el riesgo de muerte en pacientes con insuficiencia cardíaca 82,83, por lo que son los preferibles para el tratamiento de las arritmias auricu-lares en estos pacientes. No obstante, debido a su toxicidad y a las equívocas evidencias en cuanto a su eficacia 82,83, no se recomienda el uso general de la amiodarona para prevenir la muerte súbita en pacientes ya tratados con fármacos que reducen la mortalidad, como los IECA y betabloqueantes 48,51.
Anticoagulantes. En ausencia de ensayos clínicos definitivos, no está aclarado qué pacientes con MD e insuficiencia cardíaca deben recibir tratamiento anticoagulante (recomendación clase IIb). La utilización de anticoagulantes orales estaría justificada en aquellos pacientes con insuficiencia cardíaca descompensada, antecedentes de episodios embólicos o que estén en fibrilación auricular (recomendación clase I) 32,48,84.
Otros fármacos. Diversos fármacos, como los antagonistas de los receptores de endotelina 85, están siendo ensayados a nivel experimental. La administración de flosequinan se ha asociado con una mayor mortalidad 86. Asimismo, la administración de prostaciclina en infusión continua no mejora la situación clínica de los pacientes y aumenta la mortalidad 87. Por tanto, por una u otra razón, ninguno de estos fármacos son recomendables actualmente para el tratamiento de pacientes con MD e insuficiencia cardíaca (recomendación clase III).
No existen grandes estudios prospectivos a largo plazo que analicen el efecto del tratamiento farmacológico en pacientes asintomáticos con MD. No obstante, la extrapolación de los favorables resultados obtenidos en algunos ensayos con IECA que incluían pacientes de estas características (como el SOLVD y el Munich Mild Heart Failure Trial) 58,88 justifican el uso de este tipo de fármacos en estos pacientes (recomendación clase I).
En los grandes ensayos clínicos de tratamiento de la insuficiencia cardíaca, la inclusión de los pacientes se basa habitualmente en características demográficas y de severidad de la disfunción ventricular, sin tener en cuenta la etiología de ésta. Sin embargo, algunos estudios recientes sugieren que la causa de la disfunción ventricular (en particular si es isquémica o no isquémica) puede influir en su pronóstico a largo plazo y en la respuesta a ciertas intervenciones terapéuticas 51. Algunos estudios, aunque no todos, sugieren que el pronóstico puede ser mejor en la disfunción ventricular no isquémica que en la isquémica 51. Los resultados contradictorios sobre los beneficios de los IECA en pacientes isquémicos y no isquémicos hacen imposible establecer recomendaciones firmes sobre el uso de estos agentes en relación con la etiología de la disfunción ventricular 55,57. El carvedilol 64-66 y, recientemente, el bisoprolol 62 han demostrado una reducción de la mortalidad, tanto en pacientes isquémicos como no isquémicos. Asimismo, la digoxina, el amlodipino y la amiodarona han demostrado mejores resultados en pacientes no isquémicos 68,70,83. No existe actualmente una explicación clara para estas diferencias. La realización de futuros estudios para aclarar los efectos de la etiología de la disfunción ventricular sobre la respuesta al tratamiento es de particular importancia para prevenir la progresión de la enfermedad hacia estadios más avanzados. Una estrategia terapéutica individualizada, basada en la etiología de la enfermedad y en posibles factores patogénicos, puede suponer un gran avance en el tratamiento de estos pacientes 51.
Estimulación eléctrica. La estimulación DDD no es aplicable a la gran mayoría de pacientes con MD y su uso inapropiado puede ser causa de deterioro hemodinámico 89. Sin embargo, en una pequeña proporción de pacientes seleccionados (identificables por criterios electro y ecocardiográficos) la estimulación DDD podría tener efectos beneficiosos 90. El efecto de la estimulación eléctrica biventricular está siendo actualmente objeto de investigación.
Ablación con radiofrecuencia. La ablación con radiofrecuencia de las taquicardias ventriculares tiene hoy día un papel muy limitado en pacientes con MD, debido probablemente a lo difuso de la afectación miocárdica, con presencia de múltiples circuitos de reentrada difíciles de mapear 37.
Dispositivos antiarrítmicos. La utilización de desfibriladores implantables (DAI) ha dado buenos resultados en pacientes de alto riesgo postinfarto y en los que han sobrevivido a una muerte súbita. Sin embargo, no existe actualmente evidencia suficiente de que el implante de un DAI pueda prevenir la muerte súbita o prolongar la vida en pacientes con insuficiencia cardíaca y arritmias ventriculares asintomáticas 37. No existen estudios controlados sobre el efecto del DAI en pacientes con MD y taquicardia o fibrilación ventricular. No obstante, la baja incidencia de recurrencias de parada cardíaca observada con estos dispositivos en comparación con las descritas antes de su utilización, hace que deba considerarse el implante de un DAI en pacientes con MD y taquiarritmias malignas que se consideren candidatos adecuados 37. En la actualidad, tampoco existen datos comparativos entre el tratamiento con fármacos antiarrítmicos y el DAI en pacientes con MD y taquicardia o fibrilación ventricular documentadas, aunque es posible que el DAI pueda ser superior en estos casos 37.
Tratamiento quirúrgico. El trasplante cardíaco es el tratamiento final de elección en pacientes con MD e insuficiencia cardíaca intratable o muy baja probabilidad de supervivencia a corto plazo, pero siempre y cuando sean considerados candidatos adecuados por el equipo médico responsable (recomendación clase I) 33. No obstante, debido a la obligada limitación en el número de donantes, la posibilidad de otras estrategias de tratamiento alternativas debe ser cuidadosamente examinada 31,53.
La MD de origen isquémico es probablemente la principal fuente de trasplante cardíaco. Las experiencias más recientes con la cirugía de revascularización en pacientes con angina y mala función ventricular han dado resultados comparables a los del trasplante cardíaco. Asimismo, la revascularización puede mejorar el estado funcional en pacientes sin angina pero con miocardio viable. Por tanto, en estos pacientes, antes de su inclusión en la lista de trasplante se deberían considerar las posibilidades de revascularización miocárdica 31.
Los resultados preliminares obtenidos con la ventriculotomía izquierda parcial (operación de Batista), en pacientes con MD no isquémica, demuestran que esta técnica puede conseguir los objetivos de reducción del volumen ventricular, mejorando la fracción de eyección y reduciendo las presiones de llenado 91. No obstante, la mortalidad con esta técnica sigue siendo alta y su efecto sobre la supervivencia es desconocido. Por tanto, esta operación debería ser utilizada sólo en pacientes seleccionados en instituciones especializadas 91.
En pacientes seleccionados, la cardiomioplastia dinámica puede mejorar la función sistólica y la capacidad funcional, pero su papel en el tratamiento de la MD no está todavía establecido 31.
La utilización de dispositivos de asistencia ventricular izquierda puede permitir la estabilización de pacientes en espera para trasplante que de otra manera no hubieran sobrevivido 92.
MIOCARDIOPATÍA HIPERTRÓFICA
La miocardiopatía hipertrófica (MH) es una enfermedad con una importante heterogeneidad en cuanto a su base genética, manifestaciones clínicas y pronóstico 93-96. Se caracteriza, fundamentalmente, por la presencia de una hipertrofia ventricular de causa desconocida (generalmente de predominio septal) y por una excelente función sistólica 93-96. Los gradientes intraventriculares dinámicos constituyen un rasgo primordial de esta entidad, pero sabemos que sólo se detectan en una parte de los pacientes y buena parte de las manifestaciones son consecuencia de las alteraciones diastólicas. En la última década se han producido importantes avances en el conocimiento de las bases genéticas y moleculares de la enfermedad, sus mecanismos fisiopatológicos y se han generado expectativas ante la posibilidad de implementar nuevas alternativas terapéuticas al tratamiento clásico (tabla 4 y fig. 1).
Por ello, es nuestro propósito intentar resumir la información que actualmente existe sobre el manejo de los pacientes con MH, tanto desde el punto de vista diagnóstico como terapéutico. Dividiremos las recomendaciones en aquellas encaminadas a mejorar los síntomas de la enfermedad y en las que deben realizarse para identificar a los pacientes con riesgo de muerte súbita y para su prevención.
Bases diagnósticas generales
El diagnóstico clínico de los pacientes con MH sigue basándose en la demostración de una hipertrofia ventricular en ausencia de factores cardíacos o sistémicos que la justifiquen 93-96. Los síntomas más frecuentes -disnea, angina, palpitaciones-, se manifiestan en más de la mitad de los pacientes, pero son comunes en otras patologías cardiovasculares. Sin embargo, algunos datos clínicos como, por ejemplo, disnea en presencia de una buena función sistólica o angina con coronarias angiográficamente normales pueden orientar hacia el diagnóstico. Mucho más específica, sin embargo, sería la aparición de síncope o presíncope en individuos jóvenes previamente asintomáticos. Un episodio de muerte súbita recuperada en un niño, joven, o adulto, sin duda obliga a descartar esta patología 93-96. Tras la anamnesis, la exploración física dirigida puede ser diagnóstica cuando se detecta una semiología característica de gradiente intraventricular dinámico, pero en caso contrario, es poco reveladora.
Con frecuencia, un electrocardiograma manifiestamente patológico (ondas Q, hipertrofia ventricular, patrones de preexcitación o severas alteraciones de la repolarización), muchas veces en un individuo asintomático, es la primera clave diagnóstica 93-96. Actualmente se sabe que en muchos niños con enfermedad genéticamente demostrada, y también en algunos adultos, pueden observarse electrocardiogramas anormales (en general alteraciones más sutiles que las previas) en ausencia de hipertrofia ventricular macroscópica 97,98. De hecho, se ha sugerido que en ciertas circunstancias un simple electrocardiograma podría ser más sensible para el diagnóstico de la enfermedad que las modernas técnicas de imagen 97-98.
El ecocardiograma Doppler es la herramienta clínica que mejor permite reconocer las a veces complejas alteraciones estructurales y funcionales características de estos pacientes 93-96. Generalmente se acepta que para confirmar el diagnóstico de MH se requiere una hipertrofia 15 mm en algún segmento ventricular. No obstante, en algunos casos es importante corregir en función de la superficie corporal y considerar anormal grosores > 2 desviaciones estándar de la media 96-99. En los casos en que el Doppler demuestra un gradiente intraventricular significativo (> 30 mmHg) suele visualizarse un movimiento anterior sistólico de la válvula mitral que alcanza el septo interventricular 93-96. Esta técnica también es útil para estudiar las anomalías secundarias a los problemas de distensibilidad y relajación ventricular típicos de estos pacientes. Se debe señalar aquí que la historia natural de la MH se caracteriza, en muchos casos, por cambios en el grado de hipertrofia y/o función ventricular. En este sentido, está bien establecido que en el screening de niños con familiares afectados es preciso realizar estudios ecocardiográficos seriados para descartar la aparición de hipertrofia ventricular con el desarrollo corporal 97. Por otra parte, también se conoce bastante bien la evolución de la hipertrofia con el paso del tiempo y existe información consistente que sugiere un adelgazamiento progresivo de las paredes ventriculares con la edad 9396.99. Finalmente, aunque mucho más raro, también se sabe que en algunos pacientes este fenómeno se asocia a dilatación ventricular y deterioro progresivo de la función sistólica incluso evolucionando hacia una fase congestiva. Todo lo expuesto explica que el ecocardiograma deba considerarse como la técnica de elección (recomendación clase I) tanto para el diagnóstico de la enfermedad como para su seguimiento. Aunque otras nuevas técnicas de imagen (fundamentalmente la resonancia magnética nuclear) se están empleando cada vez más en situaciones especiales (mala ventana ultrasónica, MH apical), todavía existe poca información sobre la utilidad de su empleo más rutinario (tabla 5).
Como ya se ha mencionado, los avances en el campo de la genética han cuestionado paradigmas diagnósticos que parecían bien asentados (tabla 4). Así, la demostración de que la enfermedad puede estar presente en pacientes sin hipertrofia ventricular ha supuesto un hallazgo revolucionario 98. No deja de ser inquietante aceptar las limitaciones de las técnicas diagnósticas habituales en una enfermedad cuya primera manifestación puede ser la muerte súbita 98. El cardiólogo clínico interesado en la MH siempre ha intentado buscar signos patognomónicos para alcanzar un diagnóstico de certeza. Sin embargo, esto le ha obligado a realizar una auténtica peregrinación intelectual y conceptual, concentrando su interés en diferentes aspectos de la enfermedad, que ha constituido una diana en constante movimiento (tabla 4). Se debe aceptar que la hipertrofia ventricular probablemente no sea el único factor diagnóstico/pronóstico primordial en esta enfermedad del sarcómero, de base genética identificable y cuyos mecanismos patofisiológicos (fig. 1)
Fig. 1. Mecanismos fundamentales implicados en el síncope y la muerte súbita (MS) en pacientes con miocardiopatía hipertrófica (MH).
tienen, en realidad, un trasfondo molecular y no están necesariamente limitados a la víscera cardíaca 99-102. En la tabla 6 se presentan los nuevos criterios diagnósticos sugeridos para los familiares de primer grado de pacientes con enfermedad probada 103. Es trascendental (recomendación clase I) realizar una evaluación clínica completa (con ECG y ecocardiograma) en todos los familiares de primer grado de un caso índice, ya que tienen una probabilidad del 50% de tener la enfermedad.
Hasta el momento se conocen 8 genes (con una o varias mutaciones en cada gen) que pueden causar la enfermedad 100-103. Se sabe que la heterogeneidad genética tiene importantes implicaciones clínicas y pronósticas. Así, algunas mutaciones tienen peor pronóstico, otras se asocian a una sintomatología más severa y otras predicen una aparición más tardía de la enfermedad (unión proteína C a miosina cardíaca) 100-102. Además, mientras que en algunas mutaciones parece existir una cierta relación entre la severidad de las alteraciones morfológicas/funcionales y el pronóstico (cadena pesada beta miosina cardíaca), otras se caracterizan por una evolución desfavorable a pesar de una expresión clínica aparentemente «benigna» (troponina T cardíaca) 100-102. Por último, la misma mutación puede producir manifestaciones fenotípicas variadas, mientras que mutaciones diferentes pueden ser clínicamente indistinguibles. La caracterización genética de la MH puede efectuarse perfectamente estudiando linfocitos de sangre periférica. Sin embargo, desde el punto de vista práctico, la tecnología todavía es relativamente sofisticada y, en el momento de realizar estas recomendaciones, únicamente se está empleando con fines de investigación. Por ello, y aunque es seguro que muy pronto serán necesarias pautas sobre cuándo y cómo emplear los tests de diagnóstico genético (tanto con fines diagnósticos como pronósticos), todavía no tenemos información al respecto, ni posibilidad de su uso sistemático en la práctica clínica (tabla 5).
Enfoque del paciente asintomático
En el paciente asintomático, una vez realizado el diagnóstico, el planteamiento inicial debe centrarse en prevenir la aparición de complicaciones y estratificar el pronóstico, fundamentalmente estudiando el riesgo de muerte súbita. Como medidas preventivas generales hay que recomendar la supresión del ejercicio físico a nivel de competición (recomendación clase I) debido a que, en más de la mitad de los casos, la muerte súbita se presenta en pacientes jóvenes y asintomáticos durante o inmediatamente después de realizar un ejercicio físico de cierta intensidad 104-108. Recientemente, también se ha llegado a un cierto grado de consenso con respecto al subgrupo de pacientes en quienes debe desaconsejarse cualquier actividad deportiva (gradientes o hipertrofia severa, síntomas). En cualquier caso, aunque parecería prudente aconsejar la supresión de todo tipo de ejercicio físico, hay que tener en cuenta las implicaciones psicológicas de estas medidas en los jóvenes. Además, recientemente se han descrito series de pacientes con MH que han practicado ejercicio intenso de forma regular, sin que esto conllevara implicaciones clínicas o pronósticas desfavorables 109. El otro aspecto a recordar es la profilaxis de endocarditis infecciosa 93,94 en pacientes con gradientes intraventriculares o insuficiencia mitral significativa (recomendación clase I) 110.
Sin embargo, no existe evidencia (recomendación clase III) de que ninguna medida terapéutica (farmacológica, dispositivo o cirugía) mejore la historia natural de la enfermedad (excepto en subgrupos de riesgo que posteriormente se definirán) por lo que su uso no está justificado en pacientes asintomáticos (tabla 5 y fig. 2). Finalmente, tampoco está establecido el tipo de seguimiento más aconsejable para los pacientes asintomáticos, una vez estudiados, pero parece razonable recomendar revisiones clínicas con repetición de las exploraciones diagnósticas básicas cada 1-2 años.
Valoración del riesgo de muerte súbita
La muerte súbita, al representar cerca de la mitad de la mortalidad de esta patología y presentarse frecuentemente en individuos jóvenes y asintomáticos, sigue siendo un aspecto preocupante tras establecer el diagnóstico de la enfermedad 104-108 (figs. 1 y 2; tabla 7). Aunque desde centros de referencia clásicamente se mencionaba una incidencia anual del 2-3% en adultos, y del doble en niños y jóvenes, datos más recientes de series de pacientes no seleccionados y menos sintomáticos sugieren, uniformemente, un pronóstico mucho más benigno 111. Esto es importante al condicionar los algoritmos de decisión, ya que los esfuerzos terapéuticos deben ser dirigidos y sólo pueden ser exhaustivos cuando sean capaces de identificar marcadores de riesgo con un alto valor predictivo. En caso contrario, se están aconsejando medidas, no exentas de complicaciones o de efectos secundarios a largo plazo, a muchos pacientes que en realidad no están en riesgo. La etiopatogenia de la muerte súbita en la MH todavía no es del todo conocida y parece ser multifactorial, aunque las arritmias ventriculares son el mecanismo patogenético más frecuentemente invocado (tabla 7)
104-108. Sin embargo, es importante recordar qué subgrupos de pacientes tienen un mayor riesgo (fig. 2 y tabla 7)
Fig. 2. Manejo del paciente asintomático con o sin factores de riesgo de muerte súbita (MS). EEF: estudio electrofisiológico; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida.
y cuál es la mejor forma de estratificar su pronóstico (fig. 3).
Fig. 3. Sensibilidad (S), especificidad (E), valor predictivo positivo (VP+) y valor predictivo negativo (VP-) de los diferentes marcadores clínicos de riesgo de muerte súbita (MS) en la miocardiopatía hipertrófica (MH). H-TA: respuesta tensional anormal (pacientes menores de 40 años); TVNS: taquicardia ventricular no sostenida; S: síncope; HF: historia familiar de muerte súbita. MHVI: máxima hipertrofia ventricular ( 20 o 25 mm en dos segmentos ventriculares.
Además, sigue siendo válido, como principio general, insistir en que la correlación entre el estado sintomático, la severidad de la hipertrofia ventricular, el grado de obstrucción o la importancia del compromiso diastólico con el riesgo de muerte súbita es pobre 93,94,104-108. Recientemente, sin embargo, se ha sugerido 112 que los pacientes con mayor grado de hipertrofia y aquellos con gradientes más importantes tendrían peor pronóstico.
Se sabe que la muerte súbita es más frecuente en niños y jóvenes, y que en ellos los antecedentes familiares de muerte súbita y los episodios sincopales son claros marcadores de riesgo. En jóvenes con estos antecedentes es importante depurar la importancia relativa de los mecanismos potencialmente implicados (predisponentes o desencadenantes). En estos pacientes, debe realizarse una evaluación hemodinámica completa (obstrucción-diástole), estudiar si existe isquemia, valorar los reflejos neurovasculares y, sobre todo, conocer el sustrato arritmogénico 113-117. En niños y adultos jóvenes se ha sugerido que la isquemia podría desempeñar un papel desencadenante especialmente relevante. En este sentido, la realización de pruebas incruentas para documentar isquemia parece indicada en los supuestos mencionados 114. Recientemente se ha señalado que la detección de milking en la coronariografía sería un importante marcador de riesgo en niños 118. Sin embargo, debido a que esta exploración es cruen-ta no parece adecuado recomendar su empleo sistemático 118,119, excepto en situaciones muy especiales como, por ejemplo, en pacientes con otros factores de riesgo para muerte súbita y ante la presencia de angina o documentación objetiva de isquemia severa. Sin embargo, sí existe más consenso en la necesidad de descartar anomalías en las respuestas vasculares y en los reflejos neurovegetativos 115-117. Así, existe bastante evidencia de que la aparición de una respuesta hipotensiva al ejercicio implicaría un pronóstico desfavorable y que este dato sería especialmente importante en los pacientes jóvenes (fig. 2 y tabla 7). En ellos, el valor predictivo negativo de este signo sería del 97% 115-116 (una respuesta tensional normal implica buen pronóstico). A su vez, el test de la mesa basculante parece útil para diferenciar los mecanismos neurovegetativos de los síncopes producidos por arritmias malignas, aunque el valor pronóstico de esta exploración es más controvertido 117.
En adultos, la taquicardia ventricular no sostenida (para su detección idealmente debería practicarse Holter de 48 h) sigue siendo uno de los mejores marcadores clínicos actualmente disponibles para identificar a los pacientes con riesgo de muerte súbita (figs 2 y 3; tabla 7) 93,94,120. Se detecta en el 25% de los pacientes adultos con la enfermedad. Así, aunque el valor predictivo positivo de este dato es pobre, la ausencia de esta arritmia (que generalmente cursa de forma sintomática) tiene un alto valor predictivo negativo (97%) 93,95,120. La prevalencia de taquicardia ventricular no sostenida parece ser mucho menor en niños 113, aunque en ellos también parece tener un mal significado pronóstico 121. Recientemente, sin embargo, se ha sugerido que su significado pronóstico sería peor en los pacientes sintomáticos con otras manifestaciones clínicas de la enfermedad, mientras que su pronóstico sería más benigno si se detecta en pacientes completamente asintomáticos 122. También se ha sugerido que los episodios muy aislados de taquicardia no sostenida serían de mejor pronóstico que los episodios repetitivos, complejos o aquellos más prolongados 123. Finalmente, otra forma de establecer el riesgo de muerte súbita sería «agrupando» los factores de riesgo clásicos (antecedentes familiares de muerte súbita, síncope de re-petición, taquicardia ventricular en el Holter e hipotensión de ejercicio) de cada paciente. Así, la presencia de 2 o más de estos factores implicaría medidas terapéuticas específicas (amiodarona frente a desfibrilador), mientras que la presencia de un solo factor requeriría únicamente un estudio profundo y una estrecha vigilancia clínica 124.
El valor de los estudios electrofisiológicos en el subgrupo de pacientes con arritmias ventriculares detectadas por Holter es controvertido 93,95,125. Sin embargo, estos estudios están indicados en pacientes cuyas arritmias tienen repercusiones clínicas, como los resucitados de una parada cardíaca, aquellos con arritmias ventriculares sostenidas y aquellos con síncopes de repetición. En algunos casos en que la indicación de implantación de desfibrilador puede sentarse clínicamente, los estudios electrofisiológicos pueden limitarse a comprobar el correcto funcionamiento del dispositivo.
Finalmente, ya se ha mencionado las implicaciones pronósticas de la mutación específica causante de la enfermedad 100-102 y en este sentido puede ser importante el consejo genético.
Independientemente de posibles consideraciones terapéuticas, parece aconsejable (recomendación clase I) realizar un Holter en la evaluación pronóstica de los pacientes con MH. De la misma forma, parece recomendable (recomendación clase IIa) realizar un test de esfuerzo en estos pacientes, fundamentalmente en los jóvenes con otros factores de riesgo, para valorar los reflejos neurovasculares. Por último, los estudios electrofisiológicos están indicados en pacientes resucitados de una parada cardíaca previa, aquellos con documentación de arritmias ventriculares sostenidas (recomendación clase IIa) y probablemente también en aquellos que presentan síncopes de repetición. La utilidad de estos estudios en todos los pacientes con historia familiar de MS, ante un único episodio sincopal o por arritmias no sostenidas en el Holter, es más dudosa (recomendación clase IIb) (fig. 2; tablas 5 y 7).
Enfoque del paciente con manifestaciones/síntomas específicos
En estos pacientes es importante conocer si la alteración fisiopatológica responsable fundamental es diastólica o bien es la «obstrucción» sistólica. Generalmente, la disnea se correlaciona con la elevación de la presión capilar pulmonar secundaria a las alteraciones diastólicas 93-96. En este caso, tras estudiar la existencia de isquemia asociada, se puede iniciar un tratamiento con antagonistas del calcio. Los betabloqueantes estarían recomendados en casos con mala respuesta al verapamilo y son de primera elección en los pacientes con gradientes intraventriculares significativos. En presencia de datos clínicos de insuficiencia cardíaca franca se debe ser cauto con la medicación y con el aumento de las dosis. Los diuréticos pueden emplearse con precaución.
Se deben emplear las mismas consideraciones terapéuticas que para la disnea. Es importante documentar la isquemia de forma objetiva. Las alteraciones electrocardiográficas basales de estos pacientes restan valor diagnóstico al test de esfuerzo. Si se documenta isquemia, debe realizarse una coronariografía para descartar la presencia de lesiones en los vasos epicárdicos y estudiar fenómenos dinámicos ( milking, compresión de septales) 93-96,118,119. En pacientes con lesiones coronarias fijas habrá que valorar las posibilidades de revascularización (angioplastia frente a cirugía) con las que se han descrito buenos resultados. En las recomendaciones sobre coronariografía recientemente publicadas por el ACC/AHA 126 se ha considerado recomendación clase I realizar una coronariografía a los pacientes con MH y angina cuando se considera que el conocimiento de la anatomía coronaria puede afectar al tratamiento. De igual modo, se ha considerado una recomendación clase I realizar una coronariografía a los pacientes con MH y angina cuando se planea una intervención quirúgica 126.
Aunque su relación con las arritmias supra o ventriculares no es buena, es preciso descartar estas arritmias (estudio Holter). Como más adelante se refleja, la amiodarona es útil para la supresión de ambos tipos de arritmias. En los pacientes con extrasístoles ventriculares frecuentes, los betabloqueantes son especialmente efectivos desde el punto de vista sintomático 93,96. La aparición de fibrilación auricular puede ocasionar un deterioro hemodinámico grave por la pérdida de la contribución auricular a un llenado ventricular que ya está comprometido 127. Siempre debe intentarse la cardioversión (farmacológica o eléctrica si existe compromiso hemodinámico) 94,127. La taquicardia ventricular sostenida clínica es rara en estos pacientes y obliga a descartar alteraciones estructurales asociadas (aneurismas apicales, etc) 128. Cuando se documenta esta arritmia, su manejo terapéutico (farmacológico o desfibrilador) debe ser guiado por un estudio electrofisio-lógico 125,128.
Los pacientes con síncope requieren una evaluación completa del riesgo de muerte súbita. El riesgo es mayor en pacientes jóvenes, fundamentalmente si existe historia familiar de muerte súbita 93-96. El riesgo también es mayor si existen síncopes de repetición. En ambas situaciones debe realizarse un estudio hemodinámico completo que incluya valoración de la respuesta vascular periférica y también un estudio electrofisiológico 114-116,125. En el síncope relacionado con el ejercicio puede estar implicado el gradiente intraventricular. En adultos es importante descartar síncope vasovagal e hipersensibilidad del seno carotídeo.
En todos los pacientes recuperados de una parada cardíaca debe realizarse un estudio exhaustivo de los factores predisponentes/desencadenantes, ya detallado en el apartado de muerte súbita. Es trascendental recabar toda la información posible del episodio (especialmente electrocardiográfica). En estos pacientes debe considerarse la colocación de un desfibrilador implantable con o sin un estudio electrofisiológico previo 125,129,130. En cualquier caso, existe información, tanto de estudios clásicos 107 como de datos más recientes con implantación de desfibriladores, que sugieren que el pronóstico de los pacientes con MH recuperados de una parada cardíaca podría ser algo más benigno del encontrado en pacientes con cardiopatía isquémica e infarto de miocardio subyacente 129. Actualmente, si logra identificarse una taquiarritmia ventricular sostenida como causa de la parada cardíaca, tiende a favorecerse el implante de un desfibrilador sobre otras alternativas 130.
Tratamiento médico
El tratamiento farmacológico de los pacientes con MH es difícil de estandarizar. Esto se debe, en primer lugar, a que las diversas manifestaciones fisiopatológicas de la enfermedad condicionan aproximaciones terapéuticas diferentes. En segundo lugar, faltan estudios controlados que hayan contrastado de forma sistematizada diferentes alternativas de tratamiento médico en subgrupos homogéneos de pacientes. Además, la respuesta de cada paciente a un determinado tratamiento es variable y las dosis óptimas deben elegirse también de forma individualizada 93-96,99,106. Todo ello hace que las principales escuelas que se han dedicado a estudiar de forma específica esta patología puedan optar por tratamientos diferentes, incluso ante enfermos con características fisiopatológicas similares. Por último, hay que recordar que los pacientes sintomáticos precisan un seguimiento clínico estrecho, fundamentalmente tras modificaciones en el tratamiento farmacológico.
En la tabla 8 se resumen las recomendaciones terapéuticas en la MH.
Desde la década de los 60, los betabloqueantes se han convertido en la piedra angular del tratamiento de los pacientes sintomáticos con MH, tanto en su forma obstructiva y también, aunque probablemente de forma menos consistente, en la no obstructiva 93-96,99,106. Estos fármacos mejoran todos los síntomas fundamentales de esta patología incluyendo la disnea, la angina y el síncope (recomendación clase I). La mayor experiencia se ha centrado en el propranolol a dosis de 160-320 mg/día, aunque algunos autores aconsejan aumentar significativamente las dosis en pacientes refractarios o ante la recurrencia de la sintomatología. También se ha sugerido que el sotalol (un betabloqueante con acciones tipo III) podría ser especialmente útil en los pacientes con MH y arritmias ventriculares. Sin embargo, la experiencia clínica con este fármaco todavía es limitada. Los betabloqueantes inhiben la estimulación simpática y reducen los requerimientos de oxígeno (reduciendo la frecuencia cardíaca, la contractilidad miocárdica y el estrés sistólico parietal). Por virtud de su inotropismo negativo, tienden a normalizar la función sistólica hiperdinámica y a disminuir el gradiente intraventricular. Su eficacia es moderada en los gradientes intraventriculares fijos, pero son muy efectivos en la prevención del aumento de los gradientes dinámicos tras maniobras de provocación 93-96,106,131. Sus posibles efectos beneficiosos sobre las alteraciones diastólicas o sobre las arritmias ventriculares de la MH son controvertidos.
Desde la década de los 70, el uso de estos fármacos (fundamentalmente el verapamilo) se ha ido consolidando en el tratamiento de los pacientes sintomáticos con MH 93-97,98,106. Disminuyen el consumo de oxígeno miocárdico al reducir la frecuencia cardíaca, disminuir la presión arterial, tener un efecto inotrópico negativo y reducir el gradiente intraventricular. Además, la mejoría clínica también se debe a la mejoría del llenado y relajación ventriculares. Por ello, parecen especialmente indicados (recomendación clase I) en pacientes que no mejoran con los betabloqueantes y en los pacientes sin gradientes intraventriculares, fundamentalmente cuando existe un compromiso significativo de la función diastólica. Se ha sugerido que más de la mitad de los pacientes refractarios a betabloqueantes obtienen mejoría clínica mantenida con el verapamilo. El empleo de estos fármacos en pacientes inestables o cuando se requieren dosis importantes debe realizarse de forma controlada en un ambiente hospitalario, para evitar la aparición de efectos adversos. Así, ocasionalmente pueden precipitar alteraciones de la conducción, empeorar los gradientes por vasodilatación periférica y más raramente, en especial en pacientes muy sintomáticos y con datos de congestión venosa pulmonar, pueden agravar la insuficiencia cardíaca.
El importante efecto inotrópico negativo (por bloqueo de los canales del calcio) de este fármaco antiarrítmico (Clase IA), unido a su capacidad de aumentar las resistencias periféricas, lo han hecho especialmente atractivo para el tratamiento de esta enfermedad. De hecho, se ha demostrado muy útil para abolir el gradiente intraventricular, tanto en estudios invasivos agudos como durante el seguimiento, lo que se ha asociado con la mejoría clínica obtenida 93-97,99,106. En un estudio aleatorizado y doble ciego, la disopiramida (600 mg/día) era más eficaz que el propranolol (160 mg/día) para disminuir el gradiente intraventricular y mejorar el tiempo de ejercicio 132,133. No obstante, no existe suficiente evidencia del efecto beneficioso de este fármaco a largo plazo y, además, no infrecuentemente los pacientes deben suspender esta medicación debido a los efectos secundarios derivados de sus propiedades parasimpaticolíticas (retención urinaria, estreñimiento, etc.), lo que también limita su aplicación clínica. La cibenzolina se ha apuntado como una alternativa interesante al tener menos efectos secundarios. La actitud sería, probablemente, una recomendación clase IIa para el uso de disopiramida en pacientes con gradientes y síntomas refractarios a betabloqueantes y verapamilo.
La amiodarona, inicialmente utilizada como fármaco antianginoso por sus efectos vasodilatadores, es un antiarrítmico de la clase III y en menor medida tiene efectos antiadrenérgicos (clase II) y es bloqueante de los canales del calcio (clase IV). Aunque se ha sugerido que la amiodarona podría mejorar los síntomas de algunos pacientes refractarios al tratamiento convencional (bradicardia, mejoría diastólica, efecto inotrópico negativo), la evidencia en este sentido es circunstancial y no aceptada por muchos autores 93-96.
Sin embargo, y al contrario que los antiarrítmicos clase I, la amiodarona es un fármaco de extrema utilidad en el tratamiento de las arritmias, tanto supraventriculares como ventriculares de la MH 93-96. Aunque actualmente existe una gran sensibilidad para no interpretar la mera supresión de una arritmia ventricular como un efecto clínico beneficioso, algunos estudios han sugerido que la amiodarona no sólo es útil para suprimir la taquicardia ventricular en el Holter, sino que también parece ser eficaz en la prevención de la muerte súbita. En un estudio ya clásico, un grupo londinense 134 demostró la utilidad de la amiodarona (dosis media de 300 mg/día) en la prevención de la muerte súbita en pacientes con taquicardia ventricular no sostenida al compararlos con una serie de controles históricos con la misma arritmia. Tras 5 años de seguimiento no se detectaron episodios de muerte súbita en los pacientes que recibieron amiodarona. Estos datos, sin embargo, han sido cuestionados: en primer lugar, al no tratarse de un estudio aleatorizado, las diferencias entre ambas series podrían deberse no ya a un efecto beneficioso de la amiodarona, sino a los posibles efectos arritmogénicos de los fármacos utilizados en el grupo control. En segundo lugar, otros grupos, si bien utilizando probablemente dosis demasiado altas de amiodarona, han encontrado efectos adversos con el tratamiento y episodios de muerte súbita 135. En tercer lugar, como ya hemos dicho, el pronóstico de pacientes asintomáticos con taquicardia ventricular no sostenida parece ser bastante bueno 122 y en ellos no parece justificado un tratamiento crónico con amiodarona por sus bien conocidos efectos secundarios. Afortunadamente, existen datos que sugieren que los efectos beneficiosos en la MH se obtienen con valores plasmáticos < 1,5 mg/ml con los que los efectos secundarios importantes son más raros. Por último, la amiodarona también se ha demostrado extremadamente efectiva para el control de las arritmias supraventriculares de los pacientes con MH, fundamentalmente para controlar las crisis agudas y prevenir la recurrencia de la fibrilación auricular 127.
Por ello, en pacientes sintomáticos con MH parece razonable emplear la amiodarona a dosis bajas y con monitorización periódica de valores plasmáticos, tanto en pacientes con taquicardia ventricular no sostenida detectada en Holter como para el tratamiento y prevención de recurrencias de arritmias supraventriculares (ambas recomendación clase IIa) 122,123,127,134. Sin embargo, hoy día parece poco justificable el empleo «indiscriminado y sistemático» de este fármaco en pacientes completamente asintomáticos en los que se ha detectado un único episodio de taquicardia ventricular no sostenida, o en todos los pacientes jóvenes con historia de algún episodio sincopal o con historia familiar de muerte súbita (recomendación clase IIb). Sin embargo, algunos expertos sugieren la posibilidad de utilizar la amiodarona (o el desfibrilador) en pacientes con > 2 de los factores de riesgo clásicos 124.
La digoxina, por su efecto inotrópico positivo, se ha considerado clásicamente contraindicada en esta enfermedad, en especial en los pacientes con gradientes intraventriculares (recomendación clase III) 93-96. No obstante, el uso cuidadoso de la digoxina es útil para controlar la respuesta ventricular en los pacientes con fibrilación auricular y este fármaco también puede emplearse en los raros casos que terminan evolucionando a una fase dilatada de la enfermedad. Los diuréticos también deben de utilizarse con gran precaución porque pequeñas reducciones de la precarga pueden comprometer el llenado ventricular 93-96. Sin embargo, el uso prudente de diuréticos parece eficaz para controlar episodios de insuficiencia cardíaca cuando se asocian a betabloqueantes o verapamilo.
Otro problema importante es la prevención de fenómenos embólicos. Las embolias sistémicas son relativamente frecuentes en pacientes con MH y arritmias supraventriculares, mayormente en presencia de fibrilación auricular 93-96,127. Por este motivo se aconseja la anticoagulación de los pacientes con fibrilación auricular crónica o con episodios paroxísticos frecuentes (recomendación clase I) 93-96,99,106,136. Por último, también está bien descrito en la bibliografía el riesgo de endocarditis infecciosa, fundamentalmente en pacientes con gradientes intraventriculares o insuficiencia mitral importante y dilatación de la aurícula izquierda 93-96,99,110. Por ello, en estos pacientes debe emplearse profilaxis antibiótica (recomendación clase I) según la pauta convencional.
Medidas no farmacológicas
La implantación de marcapasos secuenciales constituye una interesante alternativa terapéutica en pa-cientes sintomáticos refractarios al tratamiento mé-dico 137,143. Existe suficiente evidencia de que en pacientes seleccionados con gradientes intraventriculares importantes, los marcapasos son efectivos, mejorando los gradientes (en un 50%) y los síntomas en la mayoría de los casos. Los resultados más optimistas han sido publicados por el grupo de Bethesda 138, demostrando un beneficio clínico marcado y mantenido en una serie relativamente amplia de pacientes 137.139. Otros investigadores han apoyado estas observaciones, aunque con resultados menos espectaculares. La electroestimulación, al preexcitar el ápex del ventrículo derecho, produce un movimiento paradójico del septo interventricular, que condiciona una contracción ventricular menos uniforme y efectiva. Se reduce así el gradiente intraventricular, el movimiento anterior de la válvula mitral y el grado de insuficiencia mitral. A veces esto se asocia a una reducción de la presión telediastólica del ventrículo izquierdo. Aunque también se han sugerido otros posibles efectos beneficiosos (mejoría diastólica, remodelado ventricular incluso con reducción del grado de hipertrofia) no existen datos concluyentes 137-139. Al programar el marcapasos es preciso seleccionar el intervalo AV más largo que permita una captura ventricular completa. En caso contrario, se comprometería el llenado ventricular disminuyendo el gasto cardíaco y empeorando los síntomas a pesar de disminuir el gradiente intraventricular. También se ha sugerido el valor de la electroestimulación en los pacientes con MH y gradientes provocables, aunque la evaluación es más compleja y su utilidad más controvertida. Aunque la experiencia con marcapasos es mayoritariamente favorable, algunos estudios hemodinámicos agudos (con una metodología rigurosa y optimización cuidadosa del intervalo AV), han alertado sobre un posible efecto perjudicial en algunos pacientes 141. Más preocupante es que tres estudios aleatorizados clínicos recientemente finalizados, tanto en Europa (estudio PIC) 139,140 como en América (Clínica Mayo y M-Pathy 142,143) obtienen resultados menos alentadores. Insisten en que no todos los pacientes obtienen mejoría (algunos empeoran) y que a veces una mejoría subjetiva no parece correlacionarse con cambios hemodinámicos objetivos, sugiriendo que también existe un efecto placebo importante 139-143.
Se puede concluir, por tanto, que en pacientes con gradientes intraventriculares que tienen una sintomatología refractaria al tratamiento médico (aquellos en los que de otra manera se contemplaría la cirugía) existe evidencia de que la electroestimulación secuencial puede mejorar la situación clínica de algunos de los pacientes. Sin embargo, el grado de evidencia existente sobre su efectividad real, a la luz de los mencionados estudios, es débil (recomendación clase IIb) y, de hecho, así ha sido considerado por el comité de marcapasos americano 144. Además, estos pacientes dependen críticamente de una programación óptima del marcapasos (que podría cambiar en diferentes situaciones) y precisan de un estrecho seguimiento clínico) (fig. 4 y tabla 8).
Fig. 4. Diagrama que resume las posibilidades terapéuticas en pacientes sintomáticos con miocardiopatía hipertrófica (MH) obstructiva.
Esta revolucionaria técnica consiste en crear un «infarto septal controlado» que podríamos comparar a una «miectomía química percutánea» 145,147. Inyectando alcohol en una rama septal (por medio de la luz de un catéter-balón de angioplastia inflado) se consigue una necrosis localizada en el territorio irrigado por dicha septal. Antes de inyectar el alcohol puede ser útil inyectar contraste ecocardiográfico para «mapear» el territorio de distribución vascular de la rama seleccionada y confirmar que se actúa sobre la zona donde se produce el gradiente 148. Con este procedimiento se induce un infarto (con curva enzimática típica) con la consiguiente acinesia septal y disminución del gradiente intraventricular. La reducción del gradiente intraventricular parece ser más efectiva que la inducida con marcapasos y de magnitud similar a la obtenida con la miotomía-miectomía. Los estudios hasta ahora publicados también confirman una clara mejoría clínica, aunque el intervalo de seguimiento es todavía modesto 145-147. Con ecocardiografía y resonancia magnética se logra identificar la zona de la ablación como un adelgazamiento localizado «imagen en sacabocados» del septo anterior proximal. Además, durante el seguimiento se puede apreciar un remodelado septal, pero no parecen existir datos sugerentes de disfunción sistólica o dilatación ventricular. Es importante insistir, no obstante, que ésta es una técnica relativamente nueva y con un tiempo de seguimiento necesariamente corto. Además, no está exenta de posibles complicaciones (extravasación del alcohol, arritmias ventriculares, etc.), y con frecuencia se asocia a alteraciones de la conducción ventricular, que pueden ser permanentes, requiriendo la implantación de un marcapasos. Finalmente, la posibilidad de que la cicatriz septal pudiera ser arritmogénica en el futuro no puede ser descartada.
Debido a que sólo disponemos de estudios observacionales, en pacientes seleccionados y con un tiempo de seguimiento corto, su utilidad queda confinada a pacientes refractarios al tratamiento convencional en centros con experiencia, y debe confirmarse en posteriores estudios con mayor número de pacientes y un seguimiento prolongado (actualmente no se pueden establecer niveles de recomendación).
A raíz de los estudios en pacientes con cardiopatía isquémica, el uso de desfibriladores implantables como alternativa al tratamiento antiarrítmico convencional está aumentando de forma exponencial. Lo mismo sucede en pacientes con MH, en los que esta opción se prefiere al tratamiento con amiodarona en muchos subgrupos de pacientes 148,149. Así, los pacientes con riesgo de muerte súbita en los que se logre identificar un mecanismo arritmogénico son claros candidatos a este dispositivo 127. En concreto, actualmente el desfibrilador parece claramente indicado (recomendación clase I) en pacientes resucitados de una parada cardíaca, en los cuales se logran documentar arritmias ventriculares sostenidas, bien durante el episodio clínico 130, bien durante el estudio electrofisiológico (generalmente taquicardia ventricular polimórfica) 125,129. La recomendación sería similar (recomendación clase I) en pacientes con documentación de arritmias ventriculares sostenidas clínicas si la misma arritmia puede ser inducida mediante estimulación programada (tabla 8). Sin embargo, la inducción de fibrilación ventricular o taquicardia ventricular polimorfa (clásicamente consideradas como arritmias no específicas en pacientes con cardiopatía isquémica) en otros subgrupos de pacientes con MH (síncope previo, historia familiar de muerte súbita o arritmias no sostenidas en el Holter) probablemente no deba considerarse como una indicación suficiente (recomendación clase IIb) para implantar un desfibrilador. No obstante, y aunque falta evidencia que lo justifique, la gran aceptación de este dispositivo para prevenir el riesgo de muerte súbita hace que muchos investigadores estén incrementando su uso incluyendo incluso pacientes con dos o más factores de riesgo de muerte súbita 124 o a aquellos en los que se identifica «cualquier» marcador de riesgo (aunque esto no parece recomendable).
En cualquier caso, el número de estudios que demuestran la efectividad a largo plazo de estos dis-positivos en pacientes con MH todavía es escaso 129,130,148,149. Por otra parte, incluso en pacientes seleccionados, el número de descargas del dispositivo parece ser menor que la encontrada en pacientes con cardiopatía isquémica 129, lo que ha sido interpretado como otro dato a favor del mecanismo etiopatogénico multifactorial propio de la MH (fig. 2).
La cirugía constituye una alternativa eficaz y consolidada por el tiempo en pacientes con MH refractarios (clases III y IV de la NYHA) al tratamiento médico (recomendación clase I) 150,151 (fig. 4). Estos casos probablemente representen < 5% de los pacientes con MH. La miotomía-miectomía (técnica de Morrow) es la técnica más utilizada y permite reducir o abolir los gradientes intraventriculares y disminuir el grado de insuficiencia mitral. Se ha demostrado que estos efectos se mantienen a largo plazo y que los pacientes obtienen una mejoría clínica mantenida. En pacientes con poca hipertrofia septal, anomalías estructurales del aparato valvular mitral y, ocasionalmente, en algunos pacientes con insuficiencia mitral severa puede estar más indicado el reemplazo valvular (técnica de Cooley), también con buenos resultados. La miectomía convencional no parece ser efectiva en pacientes que presentan una inserción anómala del músculo papilar directamente en la valva mitral 151. Hoy día, la mortalidad hospitalaria se ha reducido a un 1-4%, pero los resultados siguen dependiendo de la experiencia del grupo quirúrgico en esta patología. El riesgo quirúrgico aumenta en los pacientes ancianos y en los que requieren revascularización coronaria asociada. Por otro lado, la efectividad de la cirugía para prevenir la muerte súbita no ha sido establecida. De igual modo, no existe suficiente evidencia que justifique el desbridamiento quirúrgico (o la implantación de stents) en los pacientes con puentes intramiocárdicos en la descendente anterior 118,119, aunque esta posibilidad pueda contemplarse en pacientes muy seleccionados con angina refractaria e isquemia importante objetivable. Finalmente, en los raros casos en los que la enfermedad evoluciona hacia una fase dilatada con insuficiencia cardíaca debe considerarse la posibilidad del trasplante cardíaco 152.
MIOCARDIOPATÍA RESTRICTIVA
Introducción
La miocardiopatía restrictiva (MR) se define como una enfermedad del miocardio/endocardio que produce disfunción diastólica secundaria a aumento de la rigidez ventricular, con volúmenes diastólicos normales o disminuidos en uno o ambos ventrículos. La función sistólica suele estar preservada, y el espesor de la pared conservado o incrementado dependiendo de la etiología. Esta pérdida de la distensibilidad es secundaria a infiltración o fibrosis.
Como consecuencia de estas alteraciones hemodinámicas, se producen síntomas y signos de fracaso ventricular derecho y/o izquierdo según las cavidades afectadas. A menudo predomina la afectación derecha con aumento de la presión venosa, ascitis y edemas. Si por el contrario predomina la afectación izquierda, se manifiesta por signos de insuficiencia cardíaca izquierda.
De los tres tipos fisiopatológicos de miocardiopatía, la MR es la menos común en nuestro medio, < 5% de todas las miocardiopatías, pudiendo tener un origen idiopático o asociado a otras enfermedades. En el mundo occidental la amiloidosis es la más frecuente y mejor estudiada. En ciertas zonas de África, Asia, América central y del sur la fibrosis endomiocárdica es endémica 153.
En general, se trata de un tipo de miocardiopatía cuya terapéutica es con frecuencia decepcionante. Uno de los puntos cruciales de su manejo es diferenciarla cuidadosamente de la pericarditis constrictiva (PC), puesto que ésta tiene una terapia quirúrgica 154.
Diagnóstico sindrómico
El diagnóstico de MR puede sospecharse cuando concurran al menos dos de los tres criterios siguientes: a) insuficiencia cardíaca sin causa aparente; b) ecocardiograma sugestivo (véase apartado de exploraciones complementarias) pero que en esencia sería un registro con cavidades ventriculares poco dilatadas, con función sistólica preservada (o sólo ligeramente disminuida) y con signos de disfunción diastólica, y c) manifestaciones sistémicas que puedan sugerir cualquiera de las entidades capaces de dar lugar a MR (veánse formas específicas).
Manifestaciones clínicas
La mayoría de los pacientes se diagnostican cuando la enfermedad está muy avanzada y existen claros síntomas de fracaso ventricular. Los síntomas incluyen disnea, disnea paroxística nocturna, ortopnea, edemas, ascitis, cansancio y fatiga.
La angina es excepcional, excepto en la amiloidosis. Un tercio de los pacientes que cursan con MR idiopática pueden presentar complicaciones tromboembólicas. Los trastornos de conducción son comunes en la amiloidosis y sarcoidosis. Asimismo, las arritmias auriculares son frecuentes en la idiopática y en la amiloidosis. No se debe olvidar que en muchas ocasiones la afectación miocárdica es secundaria a una enfermedad sistémica, pudiendo tener el paciente cualquier otra sintomatología asociada.
Exploración física
En el examen físico los pacientes presentan las consecuencias de la elevación de las presiones de llenado. Las del lado derecho, valoradas por la presión venosa que está llamativamente elevada, con los colapsos x e y pronunciados. Ascitis y edemas están presentes en casos avanzados y en ocasiones con manifiesta hepatomegalia dolorosa y pulsátil. A la auscultación pueden existir soplos de regurgitaciones auriculoventriculares y tercer ruido 155.
Pruebas complementarias
El ECG casi siempre es anormal, pero muy inespecífico, describiéndose anormalidades de la repolarización, bloqueos de rama de predominio izquierdo, bloqueos AV, arritmias auriculares y bajo voltaje.
La radiografía de tórax en la MR no se caracteriza, a diferencia de la MD, por un gran crecimiento del tamaño de la silueta cardíaca.
El ecocardiograma-Doppler es el elemento diagnóstico incruento fundamental y suele proporcionar información muy útil desde el punto de vista anatómico y hemodinámico 156,157. La realización del mismo ante la sospecha de MR constituye una recomendación clase I. Estructuralmente se observan cavidades ventriculares no dilatadas y con función sistólica normal o sólo ligeramente disminuida, con espesores normales en los casos idiopáticos y aumentados en los casos infiltrativos. Generalmente las aurículas están dilatadas y este agrandamiento es superior al observado en la PC. El pericardio suele ser normal, aunque pueden detectarse pequeños derrames, bien como manifestaciones de la congestión sistémica o en casos de etiología infiltrativa. El estudio funcional con técnica Doppler permite valorar los flujos a nivel valvular auriculoventricular y en las venas hepáticas y pulmonares 158. A nivel mitral el flujo restrictivo se caracteriza por la presencia de onda E aumentada (> 1 m/s), disminución de la onda A(< 0,5 m/s) y el consiguiente incremento de la ratio E/A (> 2), disminución del tiempo de desaceleración mitral (< 150 ms) y un tiempo de relajación isovolumétrico disminuido (< 70 ms). En las venas pulmonares y hepáticas, la onda sistólica está muy disminuida, con un incremento importante de la onda diastólica y una onda auricular más ancha y profunda. A la inspiración, el flujo pulmonar no se modifica; no así el flujo hepático, que se caracteriza por la presencia de un flujo retrógrado antes de la contracción auricular.
El cateterismo cardíaco en la MR aporta información de gran valor para documentar el diagnóstico, valorar la severidad, distinguirla si es posible de la PC y, en casos seleccionados, establecer la etiología mediante biopsia endomiocárdica 159. No obstante, no es una exploración absolutamente imprescindible y su realización constituye una recomendación clase IIa. Las anomalías de aurícula derecha se caracterizan por aumento de la presión venosa (15-20 mmHg), con morfología de seno y profundo que se intensifica y se hace abrupto con la inspiración, mientras que las otras ondas no se modifican. En el ventrículo derecho se obtiene una presión diastólica elevada, con una presión sistólica alrededor de 40-45 mmHg. A este nivel se aprecia la morfología típica descrita como dip plateau, caracterizada por una declinación rápida, temprana y profunda protodiastólica, seguida de una meseta durante la cual no tiene aumento la presión ventricular. Estos datos son idénticos a los que se obtienen en la PC. A nivel pulmonar existe una hipertensión moderada y una presión capilar elevada. La presión de llenado ventricular izquierda presenta la misma morfología que la de ventrículo derecho, con igualación de presiones entre ambas cámaras. Por otra parte, una presión de llenado ventricular izquierda basal o con el esfuerzo > 5 mmHg orienta más hacia una MR que la PC. La ventriculografía izquierda suele ser normal. La biopsia endomiocárdica es una parte integral del diagnóstico en algunos pacientes con MR. En casos en los que la distinción con la PC es difícil, la biopsia puede ser diagnóstica.
Diagnóstico diferencial con la pericarditis constrictiva
Una historia de pericarditis antigua o de tuberculosis, cirugía cardíaca previa, traumatismo o tratamiento radioterápico torácico previos nos orientará hacia PC. Inversamente, el diagnóstico previo de amiloidosis, hemocromatosis o sarcoidosis orienta hacia MR.
Numerosas técnicas se han utilizado en el diagnóstico diferencial: la ecocardiografía-Doppler 160, el cateterismo cardíaco 161, la biopsia endomiocárdica 162, la tomografía computarizada y la resonancia magnética 163.
En la tabla 9 se recogen las diferencias más notables entre ambas entidades. Ninguna técnica es totalmente segura y en algunos pacientes puede ser necesario (aunque muy raramente) llegar a realizar una toracotomía diagnóstica.
Formas específicas (tabla 10)
164
Se detallan los aspectos diagnósticos y de manejo únicamente de las formas más comunes.
Existen casos de base genética, puesto que se han descrito afectaciones familiares, a veces asociados con miopatía esquelética, con herencia autosómica dominante y desarrollo en la tercera o cuarta década de la vida, con bloqueo AV y debilidad muscular. La escasa experiencia acumulada en la infancia sugiere su mayor presencia en niñas y peor pronóstico que en el adulto.
El curso clínico suele ser tórpido, con cardiomegalia ligera a moderada, predominio de agrandamiento biauricular y trombos en los apéndices auriculares. La fibrosis intersticial es variable en extensión, desde inexistente a severa, con tendencia a distribución parcelar, pudiendo involucrar a los nódulos sinoatrial y atrioventricular.
La afectación cardíaca es más común en la forma primaria, ocasionada por la producción de inmunoglobulinas de cadena ligera por las células plasmáticas y en probable relación con mieloma múltiple. La forma secundaria lo es por depósito de transtiretina, una proteína no inmunoglobulina, bien sea familiar, senil o secundaria a proceso inflamatorio crónico (por ejemplo, tuberculosis o artritis reumatoide). La familiar se hereda con carácter autosómico dominante. El 95% de los octogenarios tienen depósito cardíaco de amiloide, aunque no tengan manifestaciones clínicas 165.
La amiloidosis, una enfermedad que raramente se considera en el diagnóstico diferencial de la insuficiencia cardíaca con función sistólica normal, puede causar trastornos de la conducción, arritmias supra o ventriculares, insuficiencia cardíaca o una combinación de ambas. La forma familiar es autosómica dominante heterozigota, con un riesgo de transmisión al hijo del afectado del 50%, de comienzo tardío y posible presentación sin manifestaciones sistémicas.
La amiloidosis debe sospecharse en cardiopatía con disfunción diastólica ventricular y evidencia asociada de neuropatía periférica (síndrome del túnel carpiano), neuropatía autonómica (diarrea o impotencia) y nefropatía. Las manifestaciones cardiovasculares se expresan de cuatro formas 164: a) MR con predominio de fallo cardíaco; b) miocardiopatía con disfunción sistólica, lo que ocurre cuando hay infiltración amiloide severa con reemplazamiento miocárdico y angina de pecho por depósito de amiloide en las coronarias epicárdicas; c) hipotensión ortostática, que sucede en el 10% por depósito de amiloide en el sistema nervioso autónomo, vasos o sistema adrenal, y d) arritmias y alteraciones de la conducción cardíaca, con muerte súbita relativamente común.
En la exploración física es poco corriente, a pesar de la restricción al llenado, la presencia de cuarto ruido, en relación con la infiltración amiloide de las aurículas. El ECG pone de manifiesto con frecuencia (mitad de los pacientes) bajo voltaje, imagen de necrosis inferior o ausencia de r inicial en precordiales derechas y arritmias, siendo la fibrilación auricular la más común y las ventriculares complejas no infrecuentes. Los trastornos de la conducción cardíaca son peculiares de la forma familiar polineuropática. El moteado característico de las paredes en el ecocardiograma está rara vez presente, de modo que no debiera nunca olvidarse la posible combinación (de hecho, más común) de cavidades ventriculares pequeñas, dilatación biauricular, engrosamiento (asimétrico a veces) de las paredes ventriculares y del septo interauricular, velos AV engrosados con regurgitación mitral o tricúspide y patrón restrictivo en el Doppler.
En la práctica, un ECG con bajo voltaje, eco con paredes ventriculares engrosadas y función sistólica global conservada en paciente con insuficiencia cardíaca, peculiar combinación voltaje/masa, lo hace distinguirse de la pericarditis constrictiva o de una hipertrofia definida de ventrículo izquierdo de cualquier otro origen. La sospecha debe confirmarse en la forma primaria con la búsqueda de inmunoglobulina monoclonal en suero u orina. La biopsia es pieza fundamental, buscando amiloide en grasa peritoneal, o a nivel gingival, rectal, médula ósea, renal o endomiocárdico. En la forma familiar se ha descrito la mutación genética. La gammagrafía con tecnecio, galio o antimiosina demuestra incremento difuso de la captación miocárdica.
Se ha dado valor pronóstico ominoso al patrón restrictivo del flujo Doppler transmitral resultante de la combinación de tiempo de deceleración de la onda E corta y relación E/A incrementada 166.
En la terapia farmacológica destaca la contraindicación relativa de la digoxina y de los antagonistas del calcio, por su ligazón a las fibrillas de amiloide. Se recomienda el uso prudente de dosis bajas de diuréticos y vasodilatadores, por el riesgo potencial de hipotensión.
Enfermedad infiltrativa granulomatosa con afectación multisistémica, de pulmones, sistema reticuloendotelial y piel, preferentemente. La casi constante infiltración pulmonar conduce a fibrosis, hipertensión pulmonar e insuficiencia cardíaca derecha (cor pulmonale). La sarcoidosis cardíaca per se se presenta en menos de un 5% de los casos 164.
Afecta típicamente a jóvenes o adultos, de ambos sexos, de mediana edad. La granulomatosis miocárdica puede expresarse como bloqueo cardíaco, insuficiencia cardíaca congestiva, arritmias ventriculares, síncope y muerte súbita. La insuficiencia cardíaca puede ser manifestación de disfunción diastólica o, más frecuentemente, de disfunción sistólica con dilatación ventricular homogénea o con aneurismas e insuficiencia mitral secundaria. Los granulomas presentan cierto tropismo por las porciones basales y la infiltración del nodo AV y del His es relativamente común.
El diagnóstico debe sospecharse en pacientes relativamente jóvenes con alguna de las manifestaciones clínicas antedichas y adenopatías hiliares bilaterales en la radiología de tórax. El ecocardiograma con hipocinesia difusa, así como anomalías segmentarias del movimiento del septo basal, con ápex ventricular indemne, sería también sugestivo. El talio 201 podría demostrar defectos segmentarios de la perfusión. Se ha sugerido que una captación anormal de galio 67 podría predecir una respuesta favorable a esteroides 167.
Los corticoides se propugnan para intentar detener la progresión de la granulomatosis y la infiltración consiguiente del sistema de conducción. En algunos casos es necesaria la implantación de marcapasos definitivo o incluso de un desfibrilador automático en pacientes con arritmias malignas.
Se caracteriza por depósito excesivo de Fe en diversos parénquimas (hígado, corazón, gónadas y páncreas) en relación con: a) afectación familiar o idiopática; b) defecto de síntesis de hemoglobina; c) enfermedad hepática crónica, y d) por toma excesiva de Fe oral durante años.
El depósito férrico cardíaco no tiene por qué correr paralelo al de otros órganos, aunque el daño miocárdico sí tiene correlación con la cuantía de aquél y puede manifestarse como miocardiopatía dilatada o restrictiva, con disfunción sistólica o diastólica, respectivamente
Las manifestaciones clínicas son de un amplio abanico, desde aquellos asintomáticos, a pesar de evidencia ecocardiográfica, a otros con clínica de insuficiencia cardíaca. Son raros los trastornos de conducción y las arritmias ventriculares. El diagnóstico se basa en el hallazgo de Fe sérico elevado (> 180 pg/dl), saturación elevada de transferrina (> 80%), incremento de la ferritina sérica (> 900 ng/dl) y ascenso del Fe urinario (> 9 mg/24h). Cuando se sospeche carga familiar hereditaria se puede indagar el gen HH de la hemocromatosis.
El tratamiento específico, sistémico, incluye las flebotomías reiteradas 168 o el empleo del agente quelante desferroxiamina.
Se han descrito dos formas o variantes de esta singular MR; la más frecuente ocurre, preferente o exclusivamente, en países tropicales, denominada fibrosis endomiocárdica, y la propia de climas templados, denominada endocarditis fibroplástica parietal de Löffler. Ha sido postulado que ambas son fases diferentes de una afección progresiva resultante del efecto tóxico de los eosinófilos sobre el propio corazón 164.
Fibrosis endomiocárdica. Ocurre con preferencia en el África tropical, aunque también se han descrito casos en India, Brasil, Colombia y Sri-Lanka. Afecta a ambos sexos, más común en niños, adultos jóvenes, especialmente individuos de raza negra. Un 50% presentan insuficiencia cardíaca biventricular, un 40% izquierda pura y 10% derecha pura. Cuando afecta al ventrículo derecho se produce una fibrosis gruesa y densa del tracto de entrada y del ápex, con afectación de cuerdas tendíneas y músculos papilares, con posible trombosis y fibrosis obliterativa del ápex que distorsiona la válvula tricúspide. Cuando afecta al ventrículo izquierdo, la similitud es pareja, respetando únicamente el velo anterior mitral y el tracto de salida. Los depósitos cálcicos endocárdicos no son infrecuentes.
El curso clínico es irregular, asistiéndose a fases de recaída aguda o subaguda, a pesar de un comienzo insidioso, y otras de estabilización espontánea aparente, con supervivencias de hasta 12 años. El peor pronóstico ocurre en aquellos pacientes en que se inicia con insuficiencia cardíaca derecha avanzada.
La forma con insuficiencia cardíaca derecha se acompaña de insuficiencia tricúspide severa con agrandamiento de aurícula derecha, hígado pulsátil, ascitis, edemas periféricos, voltaje del qRs disminuido, alteraciones inespecíficas de la repolarización, crecimiento de aurícula derecha con patrón qR en V1, fibrilación auricular, calcificación del ápex ventricular en la radiología de tórax y engrosamiento de la pared posteroinferior del ventrículo derecho, obliteración del ápex, insuficiencia tricúspide y dilatación ventricular con morfología restrictiva del llenado ventricular en eco-Doppler.
La calcificación de la pared ventricular se presta a diagnóstico diferencial con otras entidades: la pericarditis constrictiva localizada, el seudoxantoma elástico 169 y la secundaria a hipoparatiroidismo asociado a insuficiencia renal crónica 170.
La forma con sintomatología de insuficiencia cardíaca izquierda y soplo de insuficiencia mitral se acompaña de signos electrocardiográficos en forma de alteraciones inespecíficas de la repolarización, crecimiento de aurícula izquierda o fibrilación auricular, así como de datos ecocardiográficos del tipo de engrosamiento y movilidad reducida de la pared posterobasal del ventrículo izquierdo y del velo posterior mitral, con regurgitación mitral, agrandamiento de la aurícula izquierda y obliteración apical. El ventriculograma puede demostrar trombos intracavitarios ocasionales.
La práctica de biopsia endomiocárdica rara vez estaría indicada por el peligro potencial de movilizar un trombo mural, con la consiguiente embolización pulmonar o sistémica.
En aquellos casos en fase avanzada el pronóstico es sombrío, con una mortalidad estimada del 35-50% a los 2 años. La terapia farmacológica es puramente «paliativa», con la digital para controlar la fibrilación auricular como indicación prácticamente única, y los diuréticos poco eficaces, incluso con ascitis. La escisión quirúrgica del endocardio fibrótico y el remplazamiento de las válvulas mitral o tricúspide conducen a alivio sintomático manifiesto, siempre que se asuma el alto riesgo de una compleja intervención, que implica mortalidades operatorias del 15 al 25% 171.
Endocarditis de Löffler (síndrome hipereosinofílico). La hipereosinofilia de cualquier origen puede ir asociada a enfermedad endomiocárdica. Su patogenia radica en que una eosinofilia severa mayor de 1.500 eosinófilos/ ml durante 6 o más meses, de origen alérgico, autoinmune (por ejemplo, síndrome de Churg-Strauss), parasitario, idiopático o por enfermedad maligna (por ejemplo, leucosis), causaría daño tisular atribuible a proteínas citotóxicas. Estas proteínas podrían depositarse en el miocardio por un período prolongado de tiempo con daño tisular continuado (fase necrótica) que puede afectar a pericardio, miocardio y endocardio; se continuaría con otra fase trombótica caracterizada por formación de trombos murales y finalmente sobrevendría la fase fibrótica, bien localizada o difusa.
El paciente típico sería un varón en la tercera o cuarta década de la vida, con síndrome hipereosinofílico, que vive en un país templado y en el que la afectación cardíaca acaecería en las 3/4 partes de los casos. Las manifestaciones clínicas incluirían pérdida de peso, fiebre, tos, exantema cutáneo e insuficiencia cardíaca congestiva en fases avanzadas (en más de la mitad), tanto derecha como izquierda. La presencia de cardiomegalia, soplo sistólico de insuficiencia mitral y embolismo sistémico son comunes. El ECG puede demostrar anomalías inespecíficas de la repolarización, arritmias como fibrilación auricular y alteraciones de la conducción como bloqueo de rama derecha. En el ecocardiograma aparece engrosamiento de la pared posterobasal, a veces con movimiento reducido del velo posterior mitral e insuficiencia mitral secundaria en el Doppler, agrandamiento de aurículas en relación con regurgitación AV y obliteración del ápex de ambos ventrículos, a consecuencia del engrosamiento fibroso endomiocárdico y del posible depósito de trombos murales apicales.
Los corticoides pueden tener un efecto beneficioso en la fase de miocarditis aguda, junto a fármacos citotóxicos como la hidroxiurea, lo que podría prolongar la supervivencia 164. La cirugía de resección endomiocárdica parece ofrecer al menos alivio paliativo 164.
Resumen del manejo
La MR es la entidad en que el manejo está menos establecido. El diagnóstico tiene 3 fases, por las que es inexcusable pasar: el sindrómico, el etiológico y el diferencial. En cuanto al sindrómico, debe sospecharse MR cuando un paciente presente insuficiencia cardíaca de causa no aclarada en presencia de un ecocardiograma sugestivo (ventrículos poco dilatados con contractilidad prácticamente conservada, miocardio de grosor normal o aumentado, aurículas grandes y -lo más importante- signos de disfunción diastólica). En cuanto al diagnóstico etiológico, debe insistirse en que las etiologías específicas son poco frecuentes, aunque es de importancia capital diagnosticarlas por su trascendencia terapéuticas y que los hallazgos sugestivos de cada etiología concreta (amiloidosis, hemocromatosis, sarcoidosis, etc.) no hay que buscarlos en el corazón, sino en el resto de órganos y sistemas. Con respecto al diagnóstico diferencial con la pericarditis constrictiva, hoy día éste es posible efectuarlo con certeza en más del 90% de casos según los datos obtenidos de la historia clínica, la exploración física y las técnicas de imagen, pero vuelve a ser de importancia máxima no dejar de efectuarlo por su trascendencia terapéutica.
Finalmente, el tratamiento de la insuficiencia cardíaca y las arritmias, así como la prevención de tromboembolias, podría considerase el estándar con escasos matices, mientras que el específico será el tratamiento médico de cada entidad específica, existiendo la posibilidad de cirugía en el caso de la fibrosis endomiocárdica y culminando todo ello en el trasplante cardíaco, fundamentalmente en casos de insuficiencia cardíaca refractaria, siempre que no exista enfermedad sistémica extracardíaca que comprometa el resultado.
MIOCARDITIS
Introducción
En un contexto de presentación aguda, la miocardiopatía dilatada idiopática se ha asociado a un proceso de inflamación miocárdica, la miocarditis. Las presentaciones clínicas de una miocardiopatía dilatada y una miocarditis pueden ser muy variables y en ocasiones no se distinguen con facilidad una de otra 3,172-174. Como sea que ninguno de los dos términos se pueden intercambiar ni utilizar con precisión, es preferible emplear el término de enfermedad miocárdica idiopática para aquellas enfermedades del miocardio que no se puedan clasificar correctamente 175. El término se utilizará en este capítulo por pura conveniencia, y no con la pretensión de introducir una terminología nueva.
Diagnóstico
Se cree que una parte importante de las miocarditis son virales. Virus cardiotropos producen una lesión del miocardio que expone nuevos antígenos al sistema inmunitario, generando con ello una respuesta inmunológica secundaria. Se cree que la miocarditis se presenta a menudo en forma de manifestaciones sistémicas, cambios electrocardiográficos o ecocardiográficos sugestivos de miopericarditis y con una función ventricular normal. Estos pacientes se curan en general sin lesión residual. Otro subgrupo de pacientes con lesión miocárdica cursan con disfunción ventricular y se curan con secuelas (disfunción, dilatación). Este grupo de enfermos puede permanecer estable durante años o su curso ser progresivo hacia una dilatación y disfunción ventricular graves que condicionan un fallo cardíaco. Finalmente, hay pacientes que tienen un curso clínico fulminante y fallecen a las pocas horas de las primeras manifestaciones clínicas 174. La patología viral puede abarcar todo el espectro clínico descrito. El aislamiento de genoma viral, habitualmente enterovirus, se ha llevado a cabo por varios grupos 176,177. Es posible que la presencia de virus dañe el miocardio 178 y sean los responsables del mal pronóstico que tienen los pacientes portadores de virus en el miocardio con respecto a los enfermos en los cuales no se detecta genoma de enterovirus 179.
Parecería lógico considerar que si la miocarditis es la precursora de una miocardiopatía, un porcentaje importante de pacientes con miocardiopatía presentarían miocarditis en evolución. Sin embargo, en las grandes series necrópsicas de pacientes con miocardiopatía dilatada la miocarditis es de muy baja prevalencia. En las formas agudas de la enfermedad la incidencia es más alta.
La biopsia endomiocárdica, el único instrumento disponible para detectar miocarditis, es de una sensibilidad muy baja, alrededor del 20% en estudios efectuados in vivo y ex vivo. De hecho, la biopsia como patrón oro se ha cuestionado en diversos estudios en los cuales se ha comparado los resultados obtenidos por biopsia en pacientes con miocardiopatía dilatada o miocarditis que han fallecido o se han trasplantado con el análisis minucioso de todo el corazón explantado. En estas condiciones, la sensibilidad de la biopsia, teniendo en cuenta que se pueden recoger diversas muestras, oscila entre el 0 y el 50%. En un análisis, Hauck estudió 38 corazones provenientes de una autopsia de pacientes en los cuales la miocarditis había sido fundamental en el desenlace clínico fatal; obtuvo ex vivo 10 muestras mediante un biotomo de las partes septal y apical del ventrículo derecho. Los resultados pusieron de manifiesto que sólo un 17% de las 380 biopsias fueron indicativas de miocarditis, y utilizando 5 fragmentos la sensibilidad fue inferior al 50% 180. En otro estudio post mortem de pacientes fallecidos de miocarditis, Chow et al concluyeron que se requerían más de 17 fragmentos de biopsia de ventrículo derecho para alcanzar una sensibilidad diagnóstica del 80% 181. Obrador publicó el rendimiento de la biopsia en una serie de corazones de pacientes con miocardiopatía dilatada explantados durante una operación de trasplante, y a los cuales se había practicado una biopsia preoperatoria. Se detectó un patrón histológico de miocarditis en sólo un 17% de las biopsias que se practicaron a pacientes que en la pieza de cardiectomía mostraron miocarditis 175. Por tanto, el rendimiento diagnóstico de la biopsia en la detección de miocarditis es bajo 181.
El tratamiento inmunosupresor
La descripción original de Mason del tratamiento con éxito, mediante inmunosupresores, de la miocarditis diagnosticada por biopsia 182 originó un estado de opinión en el cual se creía que dicho tratamiento podría curar la enfermedad o retrasar la evolución de la misma. Sin embargo, las observaciones clínicas desde entonces no han corroborado estas impresiones iniciales: algunos pacientes tratados no mejoran, otros no tratados mejoran y otros sometidos a tratamiento inmunosupresor intenso fallecen. El mismo Mason fue el promotor de un importante ensayo clínico destinado a estudiar la respuesta de la enfermedad miocárdica de presentación aguda en relación al tratamiento inmunosupresor. Los resultados demostraron que, aplicando los criterios diagnósticos de miocarditis de Dallas (tabla 11)
183, el hallazgo de miocarditis en un contexto de enfermedad miocárdica idiopática aguda fue del 9,6%. Además, la respuesta de los pacientes tratados con inmunosupresores, en términos de aumento de la fracción de eyección, fue similar a la obtenida en el grupo control 42, lo cual puso en evidencia lo que algunos grupos de investigadores hace años sospechaban: que el componente inflamatorio que se detecta adyacente a las fibras miocárdicas lesionadas identificadas por microscopia óptica (habitualmente linfocitos) puede ser consecuencia y no causa de la lesión miocárdica. En este contexto de incertidumbre diagnóstica y patogénica, un porcentaje importante de pacientes con enfermedad miocárdica idiopática quedan sin ser catalogados de forma precisa y sin una orientación terapéutica.
Búsqueda de una alternativa diagnóstica
Este problema clínico ha conducido a la búsqueda de alternativas diagnósticas a la biopsia endomiocárdica. Sin embargo, como sea que los criterios diagnósticos de miocarditis son esencialmente histológicos (lesión e infiltrado), el diagnóstico de miocarditis siempre requerirá la constatación de un patólogo. Una forma de sortear este problema es a través del uso de métodos diagnósticos que se demuestran eficaces en la detección por separado de cada uno de los componentes de la miocarditis: los infiltrados linfocitarios o la lesión celular. De esta forma se han empleado dos métodos isotópicos: la captación miocárdica de galio 67 y la de anticuerpos monoclonales antimiosina cardíaca.
El galio 67 se fija a los lisosomas de los linfocitos activados, y ello fue la base de su empleo en la detección de inflamación miocárdica. En un estudio de 68 pacientes con miocardiopatía dilatada se detectó una captación de galio 67 en sólo el 7%. La probabilidad de miocarditis se quintuplicaba si la imagen demostraba una positividad. Un estudio prospectivo en 91 pacientes puso de manifiesto una falta de sensibilidad y especificidad en la detección de miocarditis 184,185. Sin embargo, queda la duda de la falta de idoneidad de la biopsia endomiocárdica como patrón oro para detectar miocarditis.
Los anticuerpos monoclonales antimiosina marcados con 111In han aportado recientemente un instrumento valioso para la detección de lesión miocárdica, el otro componente de la miocarditis. Estos anticuerpos se unen a la miosina confinada en el interior de la célula miocárdica únicamente en caso de pérdida de integridad de la membrana celular, lo cual ocurre en la necrosis miocárdica 186-190.
Estudios clínicos con anticuerpos monoclonales antimiosina en patología miocárdica aguda
Son diversos los estudios publicados en las diferentes presentaciones clínicas del espectro de patología miocárdica 191-194: enfermedad aguda o subaguda, crónica estable o crónica inestable. Dec et al han publicado que la miocarditis en la miocardiopatía dilatada es más frecuente si la biopsia endomiocárdica se lleva a cabo durante las primeras 4 semanas de presentación de la enfermedad 193. Las probabilidades de detección decrecen con el paso del tiempo. Dos estudios del mismo centro publicaron 28 y 74 pacientes con miocardiopatía dilatada, una gran parte de los cuales eran de presentación aguda. La prevalencia de miocarditis detectada por biopsia fue del 15%. Los dos estudios revelaron que todos los pacientes con biopsia positiva tenían un estudio isotópico positivo, indicando con ello la alta sensibilidad del método. Todos los enfermos con un estudio isotópico negativo tenían una biopsia negativa, lo cual hacía de esta técnica una de gran utilidad para descartar miocarditis sin necesidad de emplear la biopsia endomiocárdica. Sin embargo, al menos la mitad de los pacientes con captación positiva de anticuerpos no tenían una evidencia por biopsia de miocarditis.
Conceptualmente, esta aparente falta de especificidad puede tener una doble interpretación: o se trata de falsos positivos de los anticuerpos antimiosina o bien, debido al error de muestreo que comporta la biopsia, un falso negativo de la misma. En un trabajo reciente recogimos 21 pacientes (16 varones, 5 mujeres de 26 ± 9 años de edad) remitidos a la sala de urgencias por la sospecha de miocarditis 195. Tenían una enfermedad viral precedente (52%), dolor torácico (57%), trastornos electrocardiográficos inespecíficos (100%), taqui o bradiarritmias (14%) y una elevación de las CPK (90%). En 6 la función ventricular fue normal (62 ± 12%) y en los 15 restantes se detectó una disfunción ventricular (FE: 35 ± 14%) y 10 de los 15 se presentaron con fallo cardíaco. Todos los pacientes tenían una antimiosina positiva. A 13 de estos 15 se les pudo practicar una biopsia endomiocárdica y en sólo 1 caso se detectó miocarditis. Por tanto, esta pequeña serie ilustra lo anteriormente descrito de la falta de sensibilidad de la biopsia, a la vez que aporta una sensibilidad de los anticuerpos monoclonales antimiosina del 100% en la detección positiva, no de presunción, de inflamación miocárdica aguda. Esto está de acuerdo con los datos de Narula et al, quienes utilizan de forma fiable la captación de anticuerpos para el diagnóstico diferencial, en ocasiones de gran dificultad especialmente en personas jóvenes, entre una miocarditis y un infarto agudo de miocardio: la evidencia de enfermedad difusa favorece la miocarditis, mientras la enfermedad localizada haría más probable el infarto agudo de miocardio, aun cuando hay miocarditis que son predominantemente focales 195.
Lesión miocárdica en la miocardiopatía dilatada crónica
En el contexto de la miocardiopatía dilatada crónica, la prevalencia de miocarditis en las grandes series necrópsicas es baja. Curiosamente, cuando apareció la posibilidad de trasplantar y se hicieron biopsias repetidas a estos pacientes con la intención de buscar y tratar una miocarditis, se observó que los resultados eran dispares, entre el 0% a más del 50% según diversos grupos 174. La aparición de un consenso de criterios diagnósticos 183 no ha solucionado esta variedad de prevalencia, aunque en el mencionado estudio de Mason la prevalencia en situaciones de fallo cardíaco reciente de origen desconocido fue < 10% 42.
En pacientes con miocardiopatía dilatada crónica estable varios estudios han publicado una alta prevalencia, cerca de un 70%, de lesión miocárdica 196. La identificación de esta lesión en pacientes estables aporta conceptualmente dos elementos de importancia clínica: la miocardiopatía dilatada no es una entidad inerte, inactiva, sino que hay una actividad inflamatoria de base subyacente; en segundo lugar, como sea que conceptualmente un estudio antimiosina positivo implica que hay una pérdida de células miocárdicas en el momento del estudio, el hallazgo de una positividad en un paciente crónico estable comportaría que hay una pérdida constante de masa miocárdica que podría explicar la evolutividad de esta enfermedad, que había quedado hasta entonces inexplicada.
La pregunta que sigue a estas observaciones es obvia: ¿es esta captación de anticuerpos antimiosina debida a la presencia de una miocarditis subyacente? En un estudio se compararon los estudios antimiosina pretrasplante con el resultado histológico de toda la pieza de cardiectomía, revelando que en una gran mayoría de casos la lesión no se asocia a inflamación (miocarditis) 197.
Lesión sin inflamación: ¿apoptosis?
El concepto de «lesión sin inflamación» cobró todo su sentido cuando Narula observó que la apoptosis de la célula miocárdica se observaba con frecuencia en pacientes con miocardiopatía dilatada 195. La apoptosis es una forma de muerte celular (muerte celular programada) que es patogénica y morfológicamente distinta de la necrosis. La necrosis cursa con una explosión celular, inflamación y cambios morfológicos característicos, mientras que la apoptosis es un proceso genéticamente determinado, requiere energía, cursa con una involución morfológica de la célula y no se acompaña de cambios inflamatorios. La apoptosis no se detecta histológicamente si no se llevan a cabo tinciones especiales. Es posible que la apoptosis pueda explicar la captación de anticuerpos antimiosina por la célula miocárdica apoptótica, aunque este fenómeno aún no se ha demostrado.
Cambios evolutivos de la lesión miocárdica en la miocardiopatía dilatada
Sea cual fuere la explicación de la lesión identificable por anticuerpos antimiosina, lo cierto es que se producen modificaciones en la intensidad de la misma en diversas situaciones clínicas: en condiciones de estabilidad clínica y hemodinámica, por ejemplo enfermos de dispensario, a largo plazo no se observan cambios en la prevalencia ni intensidad de captación, lo cual implica una estabilidad de la lesión. En cambio, en situaciones en las cuales la miocardiopatía dilatada es de aparición aguda o subaguda la lesión sufre modificaciones sustanciales: es habitualmente muy prevalente e importante en la fase de presentación de la enfermedad y hay una reducción o desaparición de la lesión durante el seguimiento. En estas últimas circunstancias se produce un aumento significativo de la fracción de eyección que no ocurre en situaciones de estabilidad 199. Por tanto, se detecta una correlación entre la reducción del grado de lesión con un aumento de la fracción de eyección en la miocardiopatía dilatada. Esto explica el mejor pronóstico de la enfermedad miocárdica de aparición aguda que la crónica.
Patrones evolutivos de captación tras la enfermedad miocárdica de aparición aguda
Sin embargo, lo que es estadísticamente cierto en relación con la reducción de la lesión después de la presentación aguda de una miocardiopatía dilatada, es matizable desde el punto de vista individual. En efecto, la posibilidad de estudiar la evolutividad a largo plazo de la lesión miocárdica después de la presentación de la enfermedad se hacía muy difícil, y su in-terpretación incierta, mediante el uso de la biopsia endomiocárdica que, por otra parte, era de difícil justificación en un paciente con un curso clínico estable. En un seguimiento de hasta 10 años, estudios antimiosina sistemáticos permitieron observar tres patrones evolutivos de lesión miocárdica tras la presentación aguda: la desaparición de la misma, su persistencia a largo plazo o la recurrencia asintomática de la lesión después de su desaparición. Estos tres patrones son de significado pronóstico incierto, a pesar de que la normalización de la lesión se asoció a una mejor fracción de eyección al final del seguimiento. La persistencia de la lesión podría explicar la evolución silente de enfermos que se presentan con una patología aguda a una cronicidad y eventualmente a un fallo cardíaco. Las implicaciones clínicas de estos patrones evolutivos están por establecer. Parecería razonable que estudios antimiosina repetidamente negativos impliquen una curación de la actividad lesional de la enfermedad. Quedaría por ver si el paciente ha curado con o sin secuelas, principalmente en relación a la reducción de la fracción de eyección. Por otro lado, parecería a priori justificado limitar la actividad física competitiva a pacientes tras haber sufrido un proceso miocárdico inflamatorio y que queden con una función ventricular normal pero con una persistencia de la lesión, aunque esto requiere confirmación.
Sea como fuere, la descripción de la lesión miocárdica en las diversas situaciones clínicas asociadas a una enfermedad miocárdica idiopática plantea más problemas conceptuales que resuelve problemas prácticos. La primera consideración es entender que aún no sabemos cuál es el mecanismo de lesión miocárdica persistente: en algunos pacientes puede ser una miocarditis histológica clásica, con elementos de lesión e inflamación, mientras que en otros puede ser una apoptosis. Se requerirán más estudios para dilucidar la naturaleza de la lesión en los diversos contextos clínicos. En segundo lugar, la presencia de la lesión y sus implicaciones en relación a la pérdida de masa miocárdica crónica plantean la necesidad de interrupción de la misma. Tampoco en este sentido hay en la actualidad perspectivas terapéuticas, aunque en observaciones muy aisladas se ha podido constatar que pacientes estables con captaciones altas de antimiosina sometidos a tratamiento con bolos de corticoides han visto desaparecer de forma inmediata la lesión (observaciones no publicadas). La posible aparición de agentes antivirales y su impacto en la reducción/desaparición de la lesión miocárdica de pacientes en los que se detecta genoma viral podría conformar un posible futuro contexto clínico.
Implicaciones pronósticas de la captación de anticuerpos antimiosina
En la población infantil, una captación elevada de antimiosina detectada poco después de la presentación de la enfermedad tiene un significado pronóstico. Cuanto más alta, mayores las probabilidades de complicaciones graves. En adultos, la captación de anticuerpos no tiene relación con el pronóstico. En cambio, la intensidad de la captación parece tenerla, a pesar de que por sí misma no tiene un valor pronóstico independiente. Su empleo conjunto con otras variables clínicas y ecocardiográficas es útil en la estratificación del riesgo de la miocardiopatía dilatada (muerte o necesidad de trasplante) 198,199. Esto puede ser útil en la valoración del momento adecuado para indicar un posible trasplante cardíaco, tanto en la indicación de intervención en un subgrupo de pacientes asintomáticos de alto riesgo, como en la exclusión momentánea de pacientes que tienen una baja probabilidad de sufrir acontecimientos clínicos graves.
Manejo diagnóstico-terapéutico: recomendaciones
La única forma de diagnosticar miocarditis es mediante el empleo de la anatomía patológica: la biopsia endomiocárdica, el estudio necrópsico o la cardiectomía postrasplante. La baja sensibilidad de la detección de miocarditis por biopsia, las dudas sobre la relevancia patogenética de la inflamación miocárdica (primaria frente a secundaria a la lesión) y el hallazgo de una alta prevalencia de lesión sin inflamación en la enfermedad miocárdica idiopática replantea el papel de la biopsia endomiocárdica, tanto en el diagnóstico como en el manejo del paciente con enfermedad miocárdica idiopática.
Tanto desde el punto de vista clínico como en el de futuras investigaciones parecería oportuno profundizar en el estudio de la etiología, patogenia y posible tratamiento de las causas que conducen a la lesión celular miocárdica, acompañada o no de miocarditis. En este sentido, las técnicas capaces de detectar daño miocárdico aportan la posibilidad de diagnosticar positivamente un proceso de lesión celular subyacente, seguir su curso y la posible evolución frente a futuras opciones terapéuticas (tabla 12).
En relación al empleo de los inmunosupresores (azatioprina, ciclosporina, corticoides) los datos actuales no apoyan su uso sistemático en el tratamiento de la enfermedad miocárdica aguda o crónica, a pesar de que se recogen casos aislados de efectos espectaculares tras su administración; por ello, en un contexto de paciente grave se justifica su empleo (recomendación clase IIb). Parecería pertinente que los esfuerzos terapéuticos estuviesen basados cada vez más en el conocimiento de la etiología y/o patogenia de la enfermedad: en este sentido se está llevando a cabo el European Study of Epidemiology and Treatment of Cardiac Inflammatory Disease (ESETCID) 200 en el cual la terapéutica empleada se lleva a cabo en función del tipo de afectación miocárdica inflamatoria: pacientes con una miocarditis por citomegalovirus son aleatorizados a grupos de tratamiento placebo frente a hiperinmunoglobulina; aquellos pacientes en los cuales se detecta genoma de enterovirus en el miocardio se aleatorizan a un tratamiento de interferón-alfa frente a placebo, y en los que no se detecta anomalía alguna se aleatorizan a un tratamiento inmunosupresor frente a placebo. Es de esperar que los resultados de este estudio permitan racionalizar la aproximación diagnóstica y terapéutica a este grupo de enfermedades del miocardio.
Bibliografía
[1]
Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of the Cardiomyopathies. Circulation 1996; 93: 841-842.
[2]
Classification and natural history of primary myocardial disease. Prog Cardiovasc Dis 1984; 27: 73-94.
[3]
The challenge of cardiomyopathy. J Am Coll Cardiol 1989; 13: 1219-1239.
[4]
The natural history of idiopathic dilated cardiomyopathy. Am J Cardiol 1981; 47: 525-531.
[5]
Idiopathic dilated cardiomyopathy. N Engl J Med 1994; 331: 1564-1575.
[6]
Prevalence and etiology of idiopathic dilated cardiomyopathy (summary of a National Heart, Lung and Blood Institute Workshop). Am J Cardiol 1992; 69: 1458-1466.
[7]
The effects of alcoholism on skeletal and cardiac muscle. N Engl J Med 1989; 320: 409-415.
[8]
The causes of dilated cardiomyopathy: a clinicopathologic review of 673 patients. J Am Coll Cardiol 1994; 23: 586-590.
[9]
Pathologic anatomy of the dilated cardiomyopathies. Am J Cardiol 1989; 64: 9C-11C.
[10]
Extracellular matrix components in dilated cardiomyopathy. Immunohistochemical study of endomyocardial biopsy specimens. Jpn Heart J 1996; 37: 483-494.
[11]
Immunohistological evidence for chronic intramyocardial inflamatory process in dilated cardiomyopathy. Heart 1996; 75: 295-300.
[12]
Familial dilated cardiomyopathy: Heart Muscle Disease Study Group. J Am Coll Cardiol 1999; 34: 181-190.
[13]
Autoimmunity in idiopathic dilated cardiomyopathy. Mayo Clin Proc 1994; 69: 193-195.
[14]
Familial dilated cardiomyopathy. Br Heart J 1994; 72 (Supl): 35-41.
[15]
Familial aggregation of idiopathic dilated cardiomyopathy. Am J Cardiol 1985; 55: 1232-1233.
[16]
Clinical and pathologic study of familial dilated cardiomyopathy. Am J Cardiol 1990; 65: 1449-1453.
[17]
The frequency of familial dilated cardiomyopathy in a series of patients with idiopathic dilated cardiomyopathy. N Engl J Med 1992; 326: 77-82.
[18]
Familial dilated cardiomyopathy in the United Kingdom. Br Heart J 1995; 73: 417-421.
[19]
Familial dilated cardiomyopahy: cardiac abnormalities are common in asymptomatic relatives and may represent early disease. J Am Coll Cardiol 1998; 31: 195-201.
[20]
Frequency and phenotypes of familial dilated cardiomyopathy. J Am Coll Cardiol 1998; 31: 186-194.
[21]
Guidelines for the study of familial dilated cardiomyopathies. Eur Heart J 1999; 20: 93-102.
[22]
Actin mutations in dilated cardiomyopahy, a heritable form of heart failure. Science 1998; 280: 750-752.
[23]
Exclusion of a primary gene defect at the HLA locus in familial dilated cardiomyopathy. J Med Genet 1995; 32: 876-880.
[24]
Marcadores de la actuación clínica en pacientes con miocardiopatía dilatada. Rev Esp Cardiol 1996; 49: 682-692.
[25]
Reversibility of tachycardia-induced cardiomyopathy after cure of incessant supraventricular tachycardia. J Am Coll Cardiol 1990; 16: 739-744.
[26]
Restrictive left ventricular filling pattern in dilated cardiomyopathy assessed by Doppler echocardiography: clinical, echocardiographic and hemodynamic correlations and prognostic implications. Heart Muscle Disease Study Group. J Am Coll Cardiol 1993; 22: 808-815.
[27]
Utility of various radionuclide techniques for distinguishing ischemic from non-ischemic dilated cardiomyopathy. Arch Intern Med 1992; 152: 769-772.
[28]
Dobutamine stress echocardiography: Detection of coronary artery disease in patients with dilated cardiomyopathy. J Am Coll Cardiol 1994; 24: 934-939.
[29]
Valoración funcional del paciente en insuficiencia cardíaca. Indicadores pronósticos. Monocardio 1995; 39: 65-75.
[30]
Value of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation 1991; 83: 778-786.
[31]
End-stage heart failure and timing of heart transplantation. En: Camerini F, Gavazzi A, De María, editores. Advances in cardiomyopathies. Milan: Spinger-Verlag Italia, 1998; 280-293.
[32]
Guidelines for the Evaluation and Management of Heart Failure. J Am Coll Cardiol 1995; 26: 1376-1398.
[33]
Selection and management of patients for cardiac transplantation. Curr Opin Cardiol 1994; 9: 315-325.
[34]
Morbidity of endomyocardal biopsy in cardiomyopathy. Am J Cardiol 1991; 68: 133-136.
[35]
Endomyocardial biopsy and the causes of dilated cardiomyopathy. J Am Coll Cardiol 1994; 23: 591-592.
[36]
Myocardial enterovirus infection with left ventricular dysfunction: a benign disease compared with idiopathic dilated cardiomyopathy. J Am Coll Cardiol 1995; 25: 1170-1175.
[37]
Prevention of sudden death in patients with dilated cardiomyopathy. En: Camerini F, Gavazzi A, De María, editores. Advances in cardiomyopathies. Milan: Spinger-Verlag Italia, 1998; 220-228.
[38]
Ventricular arrhythmias in dilated cardiomyopathy as an independent prognostic hallmark. Italian Multicenter Cardiomyopathy Study (SPIC) Group. Am J Cardiol 1992; 69: 1451-1457.
[39]
Prognostic value of an abnormal signal-averaged electrocardiogram in patients with non-ischemic congestive cardiomyopathy. Circulation 1993; 87: 1083-1092.
[40]
QT dispersion as a marker of risk in patients awaiting heart transplantation. J Am Coll Cardiol 1997; 29: 1576-1584.
[41]
Depressed heart rate variability as an independent predictor of death in chronic congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol 1997; 79: 1645-1650.
[42]
A clinical trial of immunosupresive therapy for myocarditis. N Engl J Med 1995; 333: 269-275.
[43]
Survival after the onset of congestive heart failure in Framingham Heart Study subjects. Circulation 1993; 88: 107-115.
[44]
Mildly dilated congestive cardiomyopathy. Use of prospective diagnostic criteria and description of the clinical course without heart trasplantation. Circulation 1990; 81: 506-517.
[45]
Clinical determinants of mortality in patients with angiographically disgnosed ischemic or nonischemic cardiomyopathy. J Am Coll Cardiol 1997; 30: 1002-1008.
[46]
Diagnostic considerations in the adult patient with cardiomyopathy or congestive heart failure. Cardiovasc Clin 1988; 19: 35-56.
[47]
Cocaína y corazón. Rev Esp Cardiol 1998; 51: 396-401.
[48]
Consensus Recommendations for the Management of Chronic Heart Failure. Am J Cardiol 1999; 83: 2A-38A.
[49]
Diagnosis and managemente of heart failure. Br Med J 1994; 308: 321-328.
[50]
Drug therapy: the management of chronic heart failure. N Engl J Med 1996; 335: 490-498.
[51]
Etiology and response to drug treatment in heart failure. J Am Coll Cardiol 1998; 32: 1167-1172.
[52]
Medical treatment of heart failure: Problems in dilated cardiomyopathy. En: Camerini F, Gavazzi A, De María, editores. Advances in cardiomyopathies. Milan: Spinger-Verlag Italia, 1998; 229-235.
[53]
Guías del diagnóstico, clasificación y tratamiento de la insuficiencia cardíaca y del shock cardiogénico. Grupo de Trabajo de Insuficiencia Cardíaca de la Sociedad Española de Cardiología. Rev Esp Cardiol 1999; 52 (Supl 2): 1-54.
[54]
Effects of enalapril on mortality in severe congestive heart failure: results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987; 316: 1429-1435.
[55]
A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive heart failure. N Engl J Med 1991; 325: 303-310.
[56]
Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991; 325: 293-302.
[57]
Overview of randomized trialsof angiotensin-converting enzyme inhibitors on mortality and morbidity in patients with heart failure. JAMA 1995; 273: 1450-1456.
[58]
Effect of enalapril on mortality and the development of heart failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327: 685-691.
[59]
Do angiotensin-converting enzyme inhibitors prolong life in patients with heart failure treated in clinical practice? J Am Coll Cardiol 1996; 28: 1323-1327.
[60]
Beneficial effects of metoprolol in idiopathic dilated cardiomyopathy. Lancet 1993; 342: 1441-1446.
[61]
Effects of metoprolol-CR in patients with ischaemic and dilated cardiomyopathy: the RESOLVD Pilot Study (phase II) [resumen]. Eur Heart J 1998; 19 (Supl): 308.
[62]
The Cardiac Insufficiency Bisoprolol Study (CIBIS-II): a randomised trial. Lancet 1999; 353: 9-13.
[63]
Rationale, design, and organization of the Metoprolol CR/XL Randomized Intervention Trial in Heart Failure (MERIT-HF). Am J Cardiol 1997; 80 (Supl 9B): 54J-58J.
[64]
The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996; 334: 1349-1355.
[65]
Double-blind, placebo-controlled study of the effects of carvedilol in patients with moderate to severe heart failure. Circulation 1996; 94: 2793-2799.
[66]
Carvedilol produces dose-related improvements in left ventricular function anf survival in subjects with chronic heart failure. Circulation 1996; 94: 2807-2816.
[67]
Clinical effects of beta-adrenergic blockade in chronic heart failure. A meta-analysis of double-blind, placebo-controlled, randomized trials. Circulation 1998; 98: 1184-1191.
[68]
The effect of digoxin on mortality and morbidity in patients with heart failure. N Engl J Med 1997; 336: 525-533.
[69]
Randomised Trial of losartan versus captopril in patients over 65 with heart failure (Evaluation of Losartan in the Elderly Study, ELITE). Lancet 1997; 349: 747-752.
[70]
Effect of amlodipine in morbidity and mortality in severe chronic heart failure. N Engl J Med 1996; 335: 1107-1114.
[71]
Effect of the calcium antagonist felodipine as suplementary vasodilator therapy in patients with chronic heart failure treated with enalapril: V-HeFT III. Circulation 1997; 96; 856-863.
[72]
Diltiazem improves cardiac function and exercise capacity in patients with idiopathic dilated cardiomyopathy. Circulation 1996; 94: 346-352.
[73]
Effectiveness of spironolactone added to an angiotensin-converting enzyme inhibitor and a loop diuretic for severe chronic congestive heart failure. Am J Cardiol 1996; 78: 902-907.
[74]
Presentación de resultados del Estudio RALES. American Heart Association Scientific Sessions. Dallas, Texas, noviembre de 1998.
[75]
Long-term benefit of dobutamine in patients with congestive cardiomyopathy. Am Heart J 1980; 100: 622-630.
[76]
Sustained improvement of cardiac function in patients with congestive heart failure after short-term infusion of dobutamine. Circulation 1984; 69: 113-119.
[77]
Intermittent, ambulatory dobutamine infusions in patients with severe congestive heart failure. Am Heart J 1986; 112: 787-791.
[78]
Sudden unexpected death in patients with congestive heart failure: a second frontier. Circulation 1985; 72: 681-685.
[79]
Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med 1989; 321: 406-412.
[80]
Hemodynamic consequences of antiarrhythmic drug therapy in patients with chronic heart failure. J Cardiovasc Electrophysiol 1991; 2 (Supl): S240-S247.
[81]
The inverse relationship between baseline left vebtricular ejection fraction and outcome of antiarrhythmic therapy: a dangerous imbalance in the risk-benefit ratio. Am Heart J 1989; 118: 433-440.
[82]
Randomised trial of low-dose amiodarone in severe heart failure. Lancet 1994; 344: 493-498.
[83]
Effects of amiodarone on clinical status and left ventricular function in patients with congestive heart failure. Circulation 1996; 93: 2128-2134.
[84]
Antithrombotic therapy in atrial fibrillation: a review of randomized trials with special reference to the Stroke Prevention in Atrial Fibrillation II (SPAF II) trial. Progr Cardiovasc Dis 1996; 38: 337-342.
[85]
Role of endogenous endothelin in chronic heart failure. Effect of long-term treatment with an endothelin antagonist on survival, hemodynamics and cardiac remodeling. Circulation 1997; 96: 1976-1982.
[86]
Can further benefit be achieved by added flosequinan in patients with congestive heart failure who remain symptomatic on diuretic, digoxin, and an angiotensin converting enzyme inhibitor? Results of the Flosequinan-ACE Inhibitor Trial (FACET). Circulation 1993; 88: 492-501.
[87]
A randomized controlled trial of epoprostenol trerapy for severe congestive heart failure: The Folan International Randomized Survival Trial (FIRST). Am Heart J 1997; 134: 44-54.
[88]
Impact of converting enzyme inhibition on progression of chronic heart failure: results of the Munich Mild Heart Failure trial. Br Heart J 1992; 67: 289-296.
[89]
Dual chamber pacing with a short atrioventricular delay in congestive heart failure: a randomized study. J Am Coll Cardiol 1995; 26: 967-973.
[90]
Impacto de la estimulación cardíaca eléctrica sobre la función ventricular y la historia natural de los pacientes con miocardiopatía. Rev Esp Cardiol 1996; 49: 598-608.
[91]
The current role of left ventricular reduction for treatment of heart failure. J Am Coll Cardiol 1998; 32: 1809-1810.
[92]
Left ventricular assist device as bridge to transplantation. En: Camerini F, Gavazzi A, De María, editores. Advances in cardiomyopathies. Milan: Spinger-Verlag Italia, 1998; 303-312.
[93]
The management of hypertrophic cardiomyopathy. N Engl J Med 1997; 336: 775-785.
[94]
Hypertrophic cardiomyopathy. Interrelations of cinical manifestations, pathophysiology and therapy. N Engl J Med 1987; 316: 844-852.
[95]
Arrhythmias in the cardiomyopathies and mitral valve prolapse. Progress in Cardiology 1/2. En: Zipes DP, Rowlands DJ, editores. Filadelfia: Lea Febiger, 1988; 59-75.
[96]
Hypertrophic cardiomyopathy. The importance of the site and the extent of hypertrophy. A review. Prog Cardiovasc Dis 1985; 28: 1-83.
[97]
Development and progression of left ventricular hypertrophy in children with hypertrophic cardiomyopathy. N Engl J Med 1986; 315: 610-614.
[98]
Hypertrophic cardiomyopathy without hypertrophy: two families with myocardial disarray in the absence of increased myocardial mass. Br Heart J 1990; 63: 287-290.
[99]
Hypertrophic cardiomyopathy. JAMA 1999; 282-2302-2302.
[100]
Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1. N Engl J Med 1989; 321: 1372-1378.
[101]
Characteristics and prognostic implications of myosin missense mutations in familial hypertrophic cardiomyopathy. N Engl J Med 1992; 326: 1108-1111.
[102]
Human cardiac myosin binding protein C mutations cause late-onset familial hypertrophic cardiomyopathy. N Engl J Med 1998; 338: 1248-1257.
[103]
Experience from clinical genetics in hypertrophic cardiomyopathy: proposal for new diagnostic criteria in adult members of affected families. Heart 1997; 77: 130-132.
[104]
Sudden death in hypertro phic cardiomyopathy: a profile of 78 patients. Circulation 1982; 65: 1388-1394.
[105]
Sudden Death in Hypertrophic cardiomyopathy. Assessment of patients at high risk. Circulation 1989; 80: 1489-1492.
[106]
Perspectives on the role of new treatment strategies in hypertrophic obstructive cardiomyopathy. J Am Coll Cardiol 1999; 33: 1071-1075.
[107]
Long-term outcome of patients with hypertrophic cardiomyopath successfully resucitated after cardiac arrest. J Am Coll Cardiol 1989; 13: 2183-2187.
[108]
Muerte súbita en la miocardiopatía hipertrófica. Rev Esp Cardiol 1996; 49: 288-304.
[109]
Surviving competitive athletics with hypertrophic cardiomyopathy. Am J Cardiol 1994; 73: 1098-1104.
[110]
Infective endocarditis in hypertrophic cardiomyopathy. Prevalence, incidence, and indications for antibiotic profilaxis. Circulation 1999; 99: 2132-2137.
[111]
Clinical course and prognosis of hypertrophic cardiomyopathy in an outpatient population. N Engl J Med 1989; 320: 794-798.
[112]
Clinical course of hypertrophic cardiomyopathy in a regional United States cohort. JAMA 1999; 281: 650-655.
[113]
Arrythmias and prognosis in infants, children and adolescents with hypertrophic cardiomyopathy. J Am Coll Cardiol 1988; 11: 147-151.
[114]
Myocardial ischemia detected by thallium scintigraphy is frequently related to cardiac arrest and syncope in young patientes with hypertrophic cardiomyopathy. J Am Coll Cardiol 1993; 22: 796-804.
[115]
Prospective prognostic assessment of blood pressure response during exercise in patients with hypertrophic cardiomyopathy. Circulation 1997; 96: 2987-2991.
[116]
Reduced cardiopulmonary baroreflex sensitivity in patientes with hypertrophic cardiomyopathy. J Am Coll Cardiol 1998; 31: 1377-1382.
[117]
Assessment of the diagnostic value of head-up tilt testing in the evaluation of syncope in hypertrophic cardiomyopathy. Am J Cardiol 1994; 73: 601-604.
[118]
Myocardial bridging with coronary compression in children with hypertrophic cardiomyopathy: a risk factor for sudden death. N Engl J Med 1998; 339: 1201-1209.
[119]
Milking in hypertrophic cardiomyopathy [carta]. J Am Coll Cardiol 1999; 34: 949-950.
[120]
Prognostic significance of 24 hour ambulatory electrocardiographic monitoring in patientes with hypertrophic cardiomyopathy: a prospective study. Am J Cardiol 1981; 48: 252-257.
[121]
Non-sustained ventricular tachycardia and sudden death in hypertrophic cardiomyopathy. J Am Coll Cardiol 1998; 31: Supl 26A.
[122]
Prognosis of asymptomatic patientes with hypertrophic cardiomyopathy and nonsustained ventricular tachycardia Circulation 1994; 90: 2743-2747.
[123]
Prognostic value of nonsustained ventricular tachycardia and the potential role of amiodarone treatment in hypertrophic cardiomyopathy: assessment in an unselected non-referral based patient population. Heart 1998; 79: 331-336.
[124]
Amiodarone and sudden death in patients with hypertrophic cardiomyopathy. Heart 1998; 79: 3.
[125]
Inducible polymorphic ventricular tachycardia and ventricular fibrillation in a subgroup of patients with hypertrophic cardiomyopathy and high risk for sudden death. J Am Coll Cardiol 1987; 10: 761-769.
[126]
ACC/AHA Guidelines for coronary angiography. J Am Coll Cardiol 1999; 33: 1756-1824.
[127]
Atrial fibrillation in hypertrophic cardiomyopathy. J Am Coll Cardiol 1990; 15: 1279-1285.
[128]
Clinical sustained uniform ventricular tachycardia in hypertrophic cardiomyopathy: association with left ventricular apical aneurysm. Br Heart J 1989; 61: 178-182.
[129]
Hypertrophic cardiomyopathy: role of implantable cardioverter-defibrillator. J Am Coll Cardiol 1998; 31: 1081-1085.
[130]
Survival after cardiac arrest or sustained ventricular tachycardia in patientes with hypertrophic cardiomyopathy. J Am Coll Cardiol 1999; 33: 1596-1601.
[131]
Long-term propranolol therapy in muscular subaortic stenosis. Br Heart J 1970; 32: 804-811.
[132]
Muscular subaortic stenosis: hemodynamic and clinical improvement after disopyramide. N Eng J Med 1982; 307: 997.
[133]
Disopyramide in hypertrophic cardiomyopathy II. Non-invasive assessment after oral administration. Am J Cardiol 1988; 62: 1252-1255.
[134]
Improved survival with amiodarone in patients with hypertrophic cardiomyopathy and ventricular tachycardia. Br Heart J 1985; 53: 412-417.
[135]
Sudden death during empiric amiodarone therapy in symptomatic hypertrophic cardiomyopathy. Am J Cardiol 1991; 67: 169-174.
[136]
Cerebrovascular complications associated with idiopathic hyepertrophic subaortic stenosis. Stroke 1984; 15: 282-287.
[137]
Effects of dual chamber pacing in hypertrophic obstructive cardiomyopathy. Lancet 1992; 339: 1318-1323.
[138]
Impact of dual-chamber permanent pacing in patients with obstructive hypertrophic cardiomyopathy with symptoms refractory to verapamil and beta-adrenergic blocker therapy. Circulation 1992; 85: 2149-2161.
[139]
Pacing in hypertrophic obstructive cardiomyopathy. Eur Heart J 1997; 18: 1249-1256.
[140]
Placebo effect of pacemaker implantation in obstructive hypertrophic cardiomyopathy. Am J Cardiol 1999; 83: 903-907.
[141]
Effect of dual chamber pacing on systolic and diastolic function in patients with hypertrophic cardiomyopathy. Acute Doppler echocardiographic and cardiac catheterization hemodynamic study. J Am Coll Cardiol 1996; 27: 421-430.
[142]
Dual-chamber pacing for hypertrophic cardiomyoapthy: a randomized, double blind, cross-over trial. J Am Coll Cardiol 1997; 29: 435-441.
[143]
Assessment of permanent dual-chamber pacing as a treatment for drug refractory symptomatic patients with obstructive hypertrophic cardiomyopathy. A randomized, double blind crossover study (M-Pathy). Circulation 1999; 99: 2927-2933.
[144]
ACC/AHA guidelines for implantation of cardiac pacemaker and antiarrythmia devices: A report of the Ameriacn College of Cardiology/Ameriacn Aeart Association Task Force on practice guidelines (A Committee on pacemaker implantation). J Am Coll Cardiol 1998; 31: 1175-1206.
[145]
Non-surgical myocardial reduction for hypertrophic obstructive cardiomyopathy. Lancet 1995; 346: 211-214.
[146]
Induction of subaortic septal ischemia to reduce obstruction in hypertrophic cardiomyopathy. Studies to develop a new catheter-based concept of treatment. Eur Heart J 1997; 18: 846-851.
[147]
Percutaneous transluminal septal myocardial ablation in hypertrophic cardiomyopathy. Results with respect to intraprocedural myocardial contrast echocardiography. Circulation 1998; 98: 2415-2421.
[148]
The role of ICD in patients with dilated and hypertrophic cardiomyopathy. PACE 1992; 15: 616-626.
[149]
The value of electrophysiology study and prophilactic implantation of cardioverter defibrillator in patients with hypertrophic cardiomyopathy. Pacing Clin Electrophysiol 1998; 21: 299-302.
[150]
Current operative treatment of obstructive hypertrophic cardiomyopathy. Circulation 1988; 78: 487-495.
[151]
Pitfalls in clinical recognition and a novel operative approach for hypertrophic cardiomyopathy with severe outflow obstruction due to anomalous papillary muscle. Circulation 1998; 98: 2505-2508.
[152]
Clinicopathologic features of hypertrophic cardiomyopathy managed by cardiac transplantation. Am J Cardiol 1993; 72: 434-440.
[153]
Cardiomyopathies and specific heart muscle diseases: definitions, terminology, classifications and new and old approaches. Postgrad Med J 1992;68 (Suppl 1): S3-S6.
[154]
Surgical management of pericardial diseases. Cardiol Clin 1990; 8: 683-696.
[155]
Miocardiopatía restrictiva: concepto, clasificación y actitud clínica. Rev Esp Cardiol 1996; 49: 523-531.
[156]
Echocardiographic observations in patients with systemic infiltrative disease involving the heart. Am J Cardiol 1997; 39: 184-188.
[157]
Demonstration of restrictive ventricular physiology by Doppler echocardiography. J Am Coll Cardiol 1988; 11: 757-768.
[158]
Miocardiopatía restrictiva. En: García Fernández MA. Principios y práctica del Doppler cardíaco. Madrid: McGraw-Hill Interamericana, 1995; 317-326.
[159]
Restrictive cardiomyopathy. En: Schlant RC, Alexander RW, editores. Hurst's. The Heart: Arteries and Veins. (8ª ed.). Nueva York: McGraw-Hill, 1994; 1639-1641.
[160]
Differentiation of constrictive pericarditis and restrictive cardiomyopathy by Doppler echocardiography. Circulation 1989; 79: 357-370.
[161]
Left ventricular filling in differentiating restrictive amyloid cardiomyopathy and constrictive pericarditis. Am J Cardiol 1981; 47: 791-796.
[162]
Clinical merit of endomyocardial biopsy. Circulation 1989; 79: 971-979.
[163]
Constrictive pericarditis and restrictive myocardiopathy: evaluation with MR imaging. Radiology 1992; 182: 369-373.
[164]
Restrictive and infiltrative cardiomyopathies. En: Braunwald E, editor. Heart Disease. Boston: WB Saunders Co, 1997; 1426-1434.
[165]
Aging amyloid and cardiomyopathy. N Engl J Med 1997; 336: 502-504.
[166]
Prognostic significace of Doppler measures of diastolic function in cardiac amyloidosis: a Doppler echocardiograhic study. Circulation 1991; 83: 808-816.
[167]
Diagnostic and prognostic value of myocardial scintigraphy with thallium-201 and gallium-67 in cardiac sarcoidosis. Chest 1995; 107: 330-334.
[168]
Myocardial involvement in idiopathic hemochromatosis, morphological and clinical improvement following venesection. Am J Med 1981; 70: 1200-1275.
[169]
Restrictive cardiomyopathy in pseudoxanthoma elasticum. Chest 1980; 78: 113-115.
[170]
Restricción miocárdica severa secundaria a calcificación masiva de ventrículo izquierdo. Imágenes en cardiología. Rev Esp Cardiol 1999; 52: 53.
[171]
Long-term follow-up of patients with endomyocardial fibrosis: effects of surgery. Heart 1998; 79: 362-367.
[172]
Myocarditis. I. N Engl J Med 1966; 275: 832-834.
[173]
Myocarditis. II. N Engl J Med 1966; 275: 944-945.
[174]
Active myocarditis in the spectrum of acute dilated cardiomyopathies _clinical features, histologic correlates, and clinical outcome. N Engl J Med 1985; 312: 885-890.
[175]
La miocardiopatía dilatada y el problema del diagnóstico de miocarditis. Una propuesta para la superación de la polémica. En: Marín E, García Dorado D, Iñiguez Romo, Alonso Martín, Fernández Avilés, editores. Puesta al día. Insuficiencia cardíaca. Sociedad Española de Cardiología, 1993.
[176]
End-stage dilated cardiomyopathy: persistence of enterovitrus RNA in myocardium at heart transplantation and lack of immune response. Circulation 1989; 80: 1128-1136.
[177]
Molecular probes for detection of persisting enterovirus infection of human heart and their prognostic value. Eur Heart J 1991; 12 (Supl D): 56-59.
[178]
Enterovirus persistence and myocardial damage detected by 111In-monoclonal antimyosin antibodies in patients with dilated cardiomyopathy. Eur J Cardiol 1996; 17: 454-459.
[179]
Clinical and prognostic significance of detection of enteroviral RNA in the myocardium of patients with myocarditis or dilated cardiomyopathy. Circulation 1994; 89: 2582-2589.
[180]
Evaluation of postmortem endomyocardial biopsy specimens from 38 patients with lymphocytic myocarditis: implications for the role of sampling error. Mayo Clin Proc 1989; 64: 1235-1245.
[181]
Chronic non-ischemic heart disease and endomyocardial biopsies. Worth the extra? Eur Heart J 1991; 12: 218-223.
[182]
Treatment of acute inflammatory myocarditis assisted by endomyocardial biopsy. Am J Cardiol 1980; 45: 1037-1044.
[183]
Myocarditis. A histopathologic definition and classification. Am J Cardiov Pathol 1987; 1: 3-14.
[184]
Gallium-67 citrate snanning for noninvasive detection of inflammation in pericardial diseases. Am J Cardiol 1980; 46: 879-884.
[185]
Gallium-67 imaging in patients with dilated cardiomyopathy and biopsy-proven myocarditis. Circulation 1984; 70: 58-62.
[186]
Early imaging of experimental myocardial infarction by intracoronary administration of 131I-labeled anticardiac myosin (Fab')2 fragments. Circulation 1978; 58: 1137-1142.
[187]
Specificity of localization of myosin-specific antibody fragments in experimental myocardial infarction: histologic, histochemical, autoradiographic and scintigraphic studies. Circulation 1979; 60: 1527-1531.
[188]
Myocardial injury: quantitation by cell sorting initiated with antimyosin fluorescent spheres. Science 1982; 217: 1050-1053.
[189]
Monoclonal antibody to cardiac myosin: imaging of experimental myocardial infarction. Hybridoma 1984; 3: 11-23.
[190]
Scintigraphic quantification of myocardial necrosis in patients after intravenous injection of myosin-specific antibody. Circulation 1986; 74: 501-508.
[191]
Indium 111-monoclonal antimyosin antibody imaging in the diagnosis of acute myocarditis. Circulation 1987; 76: 306-311.
[192]
Indium-111 antimyosin scintigraphy to assess miocardial damage in patients with suspected myocarditis and cardiac rejection. J Nucl Med 1988; 29: 1893-1900.
[193]
Antimyosin antibody cardiac imaging: its role in the diagnosis of myocarditis. J Am Coll Cardiol 1990; 16: 97-104.
[194]
Recognition of acute myocarditis masquerading as acute myocardial infarction. N Engl J Med 1992; 328: 100-104.
[195]
Apoptosis in end-stage heart failure. N Engl J Med 1996; 335: 1182-1189.
[196]
High prevalence of ongoing myocyte damage in patients with chronic dilated cardiomyopathy. J Am Coll Cardiol 1989; 13: 1289-1293.
[197]
Active myocardial damage without attending inflammatory response in idiopathic dilated cardiomyopathy. J Am Coll Cardiol 1993; 21: 1667-1671.
[198]
Presence, evolving changes, and prognostic implications of myocardial damage detected in idiopathic and alcoholic dilated cardiomyopathy by 111-In monoclonal antimyosin antibodies. Circulation 1994; 89: 2054-2061.
[199]
The role of 111-In-Monoclonal antimyosin antibodies in risk stratification of patients with dilated cardiomyopathy referred for heart transplantation. Transpl Proceedings 1997; 29: 589-591.
[200]
The European Study of Epidemiology and Treatment of Cardiac Inflammatory Disease (ESETCID). Eur Heart J 1995; 16: 173-175.