Como es bien conocido, la función cardiovascular se caracteriza, entre otros factores, por diversos índices y parámetros biomecánicos, y a su vez depende de los fenómenos que éstos describen. El artículo de Bia et al1 publicado en este número de Revista Española de Cardiología estudia estos parámetros mediante técnicas in vitro, y establece conclusiones que pueden servir para la caracterización precoz de la enfermedad arterial degenerativa. Existen numerosos trabajos que estudian la influencia cardiovascular de parámetros mecánicos en distintos niveles2-7. Asimismo, en algunos trabajos clínicos se evidencia la necesidad de nuevos índices hemodinámicos que pueden surgir de una interpretación correcta de la biomecánica8.
En este breve comentario se pretende precisar la definición y la utilidad de algunos de estos parámetros, así como establecer sus limitaciones desde una perspectiva general de la aplicación clínica y de la investigación básica. Es necesario advertir que el objetivo de una caracterización precisa de estos términos biomecánicos no es el empleo de fórmulas complejas o modelos matemáticos gratuitos, sino caracterizar de la manera más simple y realista posible la respuesta real de las arterias.
Los factores mecánicos pueden establecerse a distintos niveles:
- Niveles sistémico global y regional, estudiando, por ejemplo, el efecto Windkessel de mayor distensibilidad elástica de la aorta proximal, la resistencia global al flujo de la vasculatura periférica y la propagación global de las ondas de pulso.
- Nivel local integrado, mediante modelos unidimensionales que integran la sección arterial, por los cuales se explica la velocidad de las ondas de pulso (ecuación de Moens-Korteweg) y se definen parámetros elásticos como los módulos presión-deformación (Ep) o presión-diámetro (Epd) empleados en el artículo1 publicado en este número, o viscoelásticos como Vpd igualmente citado en dicho artículo.
- Nivel local puntual, a través de modelos tridimensionales que estudian punto a punto tanto el movimiento del fluido sanguíneo como la respuesta del tejido de la pared arterial. En éste se formulan las relaciones básicas entre las fuerzas aplicadas sobre el tejido (tensiones) y sus elongaciones unitarias (deformaciones), descritas por la mecánica de medios continuos, mediante modelos como la elasticidad lineal (módulos de Young E o de Poisson v) o la elasticidad no lineal.
- Nivel micromecánico, estudiando fenómenos como la microestructura de la pared arterial constituida por células musculares lisas y matriz conectiva extracelular de elastina y colágeno, la mecánica celular (p. ej., para las células del endotelio) o incluso la mecánica molecular de las cadenas de proteínas que forman la microestructura del tejido conectivo.
En todos los niveles citados existen modelos y pueden medirse parámetros mecánicos, así como correlacionarse con la función cardiovascular2,3, la existencia de afecciones o el riesgo de éstas4.
A pesar de que en ocasiones el estudio matemático detallado de la biomecánica y la hemodinámica pudiera parecer novedoso o reciente, debe advertirse en primer lugar que todos los fenómenos básicos aquí citados están perfectamente descritos no sólo en los textos clásicos de biomecánica de Fung9-11, sino también en los textos de hemodinámica12. Por otra parte, muchos de los fenómenos han sido estudiados y caracterizados hace decenas o centenares de años, incluso en algún caso en el siglo xviii: el efecto Windkessel fue descrito por Hales en 173313, y caracterizado con precisión por O. Frank en 189914; la velocidad de ondas del pulso sanguíneo fue caracterizada por Young en 180815 y popularizada algo más tarde por Moens16 y Korteweg17. A Young se debe asimismo el módulo elástico de igual nombre (E); por último, los modelos viscoelásticos lineales como el de Kelvin-Voigt fueron formulados por Boltzmann en 187618 y aplicados a las arterias por Hardung19. También es de destacar que la mayoría de estos trabajos fueron desarrollados en el ámbito de la medicina, al que pertenecen muchos de los anteriores autores, y no en ámbitos más abstractos o técnicos como la matemática o la ingeniería.
A pesar de lo anterior, todavía necesitamos realizar más investigación básica para conocer mejor las propiedades del flujo sanguíneo, así como la respuesta del tejido arterial, en los diversos niveles citados anteriormente. Esta investigación se basa en nuevas técnicas experimentales, nuevos modelos matemáticos y de simulación por ordenador20,21, o bien en nuevas técnicas de obtención o tratamiento de imagen22,23. Asimismo, el conocimiento más profundo puede y debe repercutir en aplicaciones clínicas en el estudio, el tratamiento y la prevención de enfermedades.
El artículo de Bia et al1 publicado en este número de la Revista describe una investigación interesante por la cual se caracterizan propiedades mecánicas locales a nivel integrado en la sección para diversas regiones arteriales. Para ello se efectúan mediciones in vitro en ovejas con un procedimiento riguroso, y en condiciones de flujo pulsátil similares a las fisiológicas. La caracterización del módulo elástico arterial y del amortiguamiento de la pared, realizada con tono muscular, permite corroborar fenómenos conocidos de la circulación sistémica, como la mayor flexibilidad de la aorta proximal respecto de las arterias periféricas (efecto Windkessel). Además se determinan otros resultados interesantes como la constancia de la constante de tiempo viscoelástica (τ = FAP). Estos estudios aportan datos que pudieran ser de utilidad para la caracterización de desviaciones o anomalías patológicas o factores que impliquen riesgo cardiovascular.
RESUMEN DE CONCEPTOS Y NOMENCLATURA
En el artículo de Bia1, y más en general en la biomecánica, se emplean diversos conceptos técnicos que pueden no ser de uso común en la práctica médica. Por ello, puede resultar conveniente recordar su significado preciso o incluso la nomenclatura correcta en español (a menudo se producen traducciones ad hoc incorrectas de términos en inglés, con la consiguiente confusión). Con objeto de ofrecer una terminología consistente, se ofrece a continuación --sin pretensión de originalidad-- un resumen que puede ser de utilidad para el estudio de índices biomecánicos en la hemodinámica. Puede encontrarse una descripción más detallada en artículos específicos9,10,12.
Tensiones, deformaciones y módulos elásticos
Las acciones mecánicas sobre el tejido se caracterizan mediante el concepto de tensión (fuerza por unidad de superficie), que produce deformaciones de éste en distintas direcciones. Básicamente, tensiones y deformaciones están relacionadas por los módulos elásticos (fig. 1).
Fig. 1. Tensiones, deformaciones y módulos elásticos.
Parámetros de la sección arterial
Los conceptos anteriores sirven para determinar la respuesta de la sección arterial mediante modelos sencillos integrados en esta sección (fig. 2).
Fig. 2. Modelos de sección arterial.
Modelos que definen el comportamiento de la pared arterial: elasticidad lineal/no lineal
Se compara a continuación la respuesta mecánica que tendría una arteria frente a variaciones de presión sanguínea, en la hipótesis ideal de un tejido elástico lineal, frente a la respuesta real que no es lineal ni es perfectamente elástica (fig. 3).
Fig. 3. Modelos de elasticidad.
Un tejido perfectamente elástico y lineal (fig. 3A) se caracteriza, en todo su rango de deformación, por un único módulo de elasticidad (pendiente de la recta de respuesta), con una sola rama para carga y descarga. Sin embargo, los tejidos blandos del cuerpo humano son altamente no lineales, y su respuesta tampoco es perfectamente elástica. Por tanto, no cabe establecer un módulo de elasticidad único, sino que éste debe evaluarse en cada punto de manera incremental, mediante la tangente (para perturbaciones pequeñas de presión) o mediante una secante a la curva de respuesta del material (p. ej., entre la presión diastólica y sistólica). En la figura 3B se muestra el resultado de un ensayo in vitro de una carótida humana sana (realizado en el Departamento de Ciencia de Materiales, Universidad Politécnica de Madrid, por G. Guinea et al [comunicación personal]). En este ensayo se evidencia una primera fase para presiones bajas en que la arteria es más flexible, y la respuesta mecánica se debe principalmente a la elastina. Cuando se aumenta la presión, se produce una fuerte elevación de rigidez debido a que las fibras de colágeno entran en tensión. Este mecanismo natural de rigidización, común a la mayoría de los tejidos blandos, le dota de estabilidad y previene de daño, evitando deformaciones excesivas que pudieran romper el tejido. Por otra parte, aunque el ensayo fue realizado a velocidad lenta, se observa una clara diferencia entre las ramas de carga y descarga, por lo que el tejido no responde exactamente a un modelo elástico. Se ha encajado un modelo analítico elástico no lineal (en verde) que permite una simulación por ordenador mediante elementos finitos del tejido20. Los autores del trabajo publicado en este número de la Revista1 caracterizan los distintos módulos elásticos que emplean de forma secante o tangente, según los casos.
Viscoelasticidad
Por último, se resume a continuación brevemente el modelo viscoelástico más elemental, denominado de Kelvin-Voigt, también empleado por los autores en el artículo al que hace referencia este editorial1. La viscoelasticidad proporciona una respuesta retardada en el tiempo frente a la respuesta elástica que sería teóricamente instantánea. El modelo de Kelvin-Voigt tiene diversas limitaciones, como que predice una histéresis dependiente de la frecuencia12. Sin embargo, para una caracterización bajo una frecuencia única como el utilizado por Bia et al1 puede ser adecuado (fig. 4).
Fig. 4. Modelo viscoelástico.
POTENCIALES LINEAS ADICIONALES DE INVESTIGACION BASICA
Como se dijo antes, existen aún numerosas limitaciones a nuestro conocimiento de la biomecánica cardiovascular y de la hemodinámica. En relación con los tejidos, debe considerarse que exhiben características complejas que son necesarias tener en cuenta para interpretaciones realistas, tales como la elasticidad no lineal, su anisotropía, la necesidad de obtención de propiedades mediante experimentos realistas in vitro comprobados con medidas in vivo, la viscoelasticidad o poroelasticidad. Asimismo, son necesarias determinaciones a otras escalas, como puede ser la mecánica celular del endotelio. No resulta viable un único modelo matemático o de simulación que incorpore todos los fenómenos anteriores, por lo que es necesario decidir en función de la aplicación concreta.
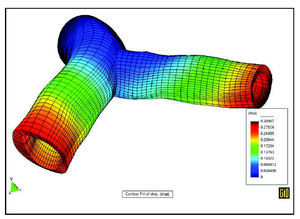
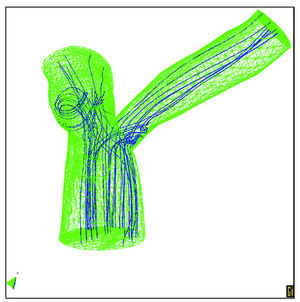
Por otra parte, conviene sacar partido de los avances tecnológicos y científicos en equipamiento experimental, técnicas de imagen, modelos matemáticos y numéricos y su aplicación en simulación por ordenador. En este sentido, cabe citar las técnicas de dinámica de fluidos que permiten determinaciones precisas de efectos hemodinámicos locales tridimensionales. Igualmente, los métodos de elementos finitos pueden ofrecer información precisa del estado y la evolución mecanobiológica del tejido arterial. Como ejemplo de este tipo de modelos se ofrece el resultado de la figura siguiente, obtenida mediante una simulación acoplada del flujo sanguíneo y la deformación de la pared arterial en la coronaria izquierda24, cuya geometría se ha reconstruido a partir de modernas técnicas de imagen cardiovascular in vivo y geometría computacional (figs. 5 y 6).
Fig. 5. Simulación conjunta de flujo y deformación de la pared arterial.
Fig. 6. TModelo tridimensional con predicción de la trayectoria de las partículas.
CONCLUSION
Como Bia et al1 nos recuerdan, las alteraciones mecánicas son una de las manifestaciones más precoces de la enfermedad arterial degenerativa. La adecuada comprensión de estos fenómenos y su estudio detallado permitirán la detección, el tratamiento y la vigilancia de sus efectos en el sistema cardiovascular con los beneficios sanitarios consiguientes.
Véase artículo en págs. 167-74
Correspondencia: Dr. J.M. Goicolea Ruigómez.
Grupo de Mecánica Computacional. Universidad Politécnica de Madrid.
Prof. Aranguren, s/n. Ciudad Universitaria. 28040 Madrid. España.
Correo electrónico: goico@mecanica.upm.es