El desarrollo de las técnicas de intervencionismo coronario percutáneo se puede resumir en cuatro oleadas o revoluciones: la propia aparición de la técnica de angioplastia coronaria con balón, el desarrollo de las endoprótesis coronarias (stents) para solucionar las limitaciones de la angioplastia con balón, la adición de fármacos antiproliferativos en los stents farmacoactivos para evitar la reestenosis y, finalmente, la aparición de las endoprótesis vasculares bioabsorbibles. Este artículo comienza con una breve descripción de los dispositivos utilizados en el intervencionismo a lo largo de tres décadas que han conducido a la aparición final de las endoprótesis bioabsorbibles. Posteriormente, se revisan las principales características y dificultades en el desarrollo de estas endoprótesis. El núcleo de este artículo es una descripción de los productos en desarrollo y de los resultados preclínicos y clínicos disponibles actualmente. La conclusión refleja una visión del prometedor futuro del intervencionismo y las endoprótesis bioabsorbibles.
Palabras clave
El anuncio de la disponibilidad de sistemas de endoprótesis bioabsorbibles (BVS) para tratamiento de la enfermedad coronaria ha despertado gran interés entre la comunidad científica involucrada en el intervencionismo coronario percutáneo (ICP)1. El desarrollo y la popularidad del ICP se pueden distribuir en cuatro periodos, comenzando con la primera descripción de la angioplastia coronaria con balón en 1977 por Andreas Gruentzig2. Este avance supuso una importante alternativa mínimamente invasiva a la cirugía coronaria tanto para los pacientes como para los cardiólogos. Los dispositivos que marcaron la aparición de la segunda y la tercera época del ICP fueron los stents metálicos convencionales (SMC), después seguidos de los stents farmacoactivos (SFA). Algunos autores defienden la existencia de un «santo grial» del ICP, los BVS, que identifican como la solución óptima para la reparación vascular total tras tres décadas de búsqueda, al menor coste posible para el sistema sanitario. La próxima época de BVS se ha definido como la «cuarta revolución», y se ha acuñado un nuevo término para describir los prometedores resultados clínicos: la terapia de reparación vascular (TRV)3,4.
Historia del ICP: Las Cuatro RevolucionesEl impacto clínico y social del desarrollo de la angioplastia con balón descrito por Gruentzig se considera una revolución mayor en el terreno de la cardiología. En la mayoría de los casos, este procedimiento permite recuperar el flujo sanguíneo de una zona del corazón, con lo que se reduce drásticamente la estancia hospitalaria y se acelera la recuperación del paciente en comparación con la cirugía de revascularización coronaria. Sin embargo, en un número significativo de casos, la angioplastia coronaria se asocia con sus propias complicaciones5–7, como la disección de la arteria y el riesgo o la aparición de oclusiones agudas, que podrían necesitar una solución quirúrgica. Además, entre un 30 y un 60% de los pacientes tratados con angioplastia con balón presentan reestenosis en el primer año y requieren nueva revascularización.
Estos problemas motivaron la aparición de la segunda ola de dispositivos en la década de los noventa, los SMC8. Los robustos SMC colocados en el interior de la arteria enferma tras la realización de la angioplastia con balón resolvían el problema de la oclusión aguda sellando las disecciones y evitando el fenómeno del retroceso elástico del vaso, así como el remodelado negativo constrictivo tardío. El uso de estos dispositivos conlleva una reducción en la tasa de reestenosis9, con cifras de necesidad de nueva revascularización entre el 15 y el 30%. Una buena parte de las reestenosis en el stent se derivan de una causa específica: la hiperplasia neointimal10. La excesiva proliferación de tejido dentro del stent es el principal pero no el único problema asociado con el empleo de estos dispositivos. La presencia de un implante metálico rígido y permanente restringe la motilidad vascular y podría causar tardíamente una mala aposición tardía del stent11,12. La presencia de estas estructuras metálicas endovasculares también puede condicionar negativamente la realización de futuras técnicas de revascularización y la obtención de imagen no invasiva mediante resonancia magnética (RM) o tomografía computarizada (TC)13. Otra de las limitaciones de estos dispositivos aparece cuando los stents se colocan sobre una bifurcación y afectan al acceso y el flujo a las ramas laterales por la propia estructura metálica («ramas enjauladas»)14,15.
Para resolver el problema de la reestenosis en el stent (un 15–30% de tasa de nuevas revascularizaciones), se emplearon distintos métodos de braquiterapia, con resultados no completamente satisfactorios16. La solución a este problema, que representa la tercera ola de dispositivos, apareció en los primeros años del siglo xxi con el desarrollo de los SFA17–22. La tercera revolución está marcada por la adopción universal de este dispositivo, que ha reducido la necesidad de nueva revascularización por reestenosis en el stent siempre por debajo del 10%. El mecanismo para reducir la hiperplasia neointimal que emplean estos dispositivos es la liberación de fármacos antiproliferativos y/o antiinflamatorios (sirolimus, everolimus, paclitaxel) desde un sustrato polimérico que recubre la superficie del stent. Los resultados clínicos iniciales de los SMC fueron tan prometedores que la siguiente revolución, las endoprótesis vasculares bioabsorbibles, permaneció latente por bastante tiempo. El primer estudio clínico con una endoprótesis totalmente bioabsorbible, la endoprótesis de Igaki-Tamai23,24, se desarrolló en agosto de 2000. Los importantes retos técnicos en el desarrollo de este dispositivo y los resultados positivos demostrados por los SFA marcaron la pauta de mercado que restó prioridad al desarrollo de nuevos dispositivos de esta clase.
Tras los primeros y espectaculares resultados de los SFA de primera generación, los siguientes resultados clínicos a largo plazo descubrieron problemas no previstos inicialmente. Muchos de los fármacos antiproliferativos empleados en los SFA no solo limitan el crecimiento de la hiperplasia no deseada dentro de los stents, sino que también empeoran la cobertura endotelial representativa del proceso normal de reparación vascular.
A largo plazo, se observaron fenómenos persistentes de retraso en la reparación vascular, que paradójicamente puede causar reestenosis tardía o la rara pero muy temida aparición de una complicación de alta letalidad: la trombosis tardía del stent25–39. Además del retraso en la reparación vascular, la trombosis se ha atribuido a reacciones inflamatorias crónicas al material polimérico empleado en los SFA y/o a la plataforma metálica permanente y fenómenos de mala aposición tardía40.
Para prevenir la aparición de la trombosis tardía, se prolongó el periodo en que los pacientes tratados con SFA debían permanecer con doble tratamiento antiplaquetario, como reflejan las guías de actuación del American College of Cardiology/American Heart Association (ACC/AHA)41. Además, los SFA metálicos comparten algunas de las desventajas de los SMC, relacionadas con la presencia de implantes metálicos permanentes: restricción de la vasorreactividad3,42, limitación de eventuales técnicas de nueva revascularización e imagen no invasiva y empeoramiento del acceso y el flujo a las ramas laterales enjauladas. Estos fenómenos marcan que hay margen para una nueva revolución en los dispositivos de ICP, los BVS.
La TRV con BVS pretende solucionar todas las limitaciones de las generaciones previas de dispositivos para el ICP. Estas endoprótesis se comportan mecánicamente como un stent metálico en los primeros meses tras el implante para evitar la oclusión aguda y el remodelado negativo de las arterias. Por otra parte, también pueden liberar fármacos antiproliferativos y/o antiinflamatorios para suprimir el fenómeno de reestenosis del stent y pueden sufrir modificaciones que ayuden en una reendotelización adecuada. Las ventajas sobre los SMC aparecen con el tiempo al reabsorberse la endoprótesis43: no hay obstáculos permanentes en las bifurcaciones ni en territorios que requieran nuevo tratamiento revascularizador ni para las técnicas de imagen no invasivas. La tabla 1 resume los aspectos fundamentales en las cuatro fases de la evolución del ICP.
Historia del intervencionismo coronario percutáneo y perspectivas futuras.
| Beneficios para la salud/solución de problemas | Nuevos problemas | |
| Años ochenta: primera revolución, balones de angioplastia | • Restaura el flujo coronario sin necesidad de cirugía | • Oclusiones agudas secundarias a disecciones que en muchas ocasiones requieren cirugía |
| • Si es exitosa: significativa reducción en costes sanitarios y aumento del bienestar del paciente en comparación con la cirugía | • Reestenosis 30-60% que requiere nueva revascularización | |
| Años noventa: segunda revolución, SMC | • Para los casos de tratamiento accesible, esencialmente elimina la aparición de oclusiones agudas y la necesidad de cirugía | • Reestenosis en el stent debida a hiperplasia neointimal |
| • Reduce la tasa de reestenosis a un 15-30%, con la consecuente reducción en necesidad de nueva revascularización | • La presencia permanente de implantes rígidos afecta a la reparación vascular (respuesta vasomotora anormal, imposibilidad de remodelado adaptativo posterior) y posibles tratamientos revascularizadores futuros, así como obtención de imágenes no invasivas y posible alteración del flujo y el acceso a ramas laterales | |
| • Mecanismo de funcionamiento: sellado de disecciones, prevención de oclusión aguda del vaso, prevención del retroceso elástico agudo y crónico (desde horas a semanas tras el tratamiento) y elimina el remodelado constrictivo tardío (pérdida general de calibre del vaso, que causa reestenosis) | ||
| Primera década del s. xxi: tercera revolución, SFA | • Reducción de la reestenosis en el stent a < 10%, con la consecuente reducción aún mayor de nuevas revascularizaciones | • El efecto farmacológico afecta a la proliferación de células endoteliales necesarias para la recuperación funcional |
| • Mecanismo: liberación prolongada de fármacos antiproliferativos y/o antiinflamatorios, reducen la hiperplasia neointimal | • Inflamación persistente, reestenosis tardía y mayor posibilidad de trombosis tardía del stent | |
| • Requiere tratamiento antiplaquetario doble prolongado | ||
| • Comparte los problemas de los SMC como implante rígido permanente | ||
| Segunda década: cuarta revolución, BVS | • Mantiene los beneficios del SMC sin la permanencia de prótesis metálica | Obstáculos y retos para su empleo universal: |
| • Proporciona los beneficios de los SFA metálicos sin la permanencia de prótesis, lo que elimina la posibilidad de trombosis tardía del stent | • Facilidad de uso al menos similar a la de los SMC | |
| • Permite cicatrización vascular completa, elimina el remodelado expansivo y restaura la respuesta vasomotora | • Selección de materiales y diseño con el adecuado balance funcional, especialmente en cuanto a fuerza radial, retroceso, perfil de degradación y biocompatibilidad | |
| • Facilita la posibilidad de reintervención quirúrgica o percutánea | • Selección del fármaco y el recubrimiento necesarios para obtener el suficiente crecimiento neointimal | |
| • Permite la obtención de imágenes no invasivas (RM, TC) sin artefactos | • Definir los objetivos preclínicos y clínicos y las estrategias necesarias de tratamiento para demostrar una clara ventaja sobre los SFA metálicos | |
| • Conserva el acceso libre a las ramas laterales | ||
| • Disminuye la necesidad de doble tratamiento antiplaquetario prolongado |
BVS: sistemas de endoprótesis bioabsorbibles farmacoactivas; RM: resonancia magnética; SFA: stents farmacoactivos; SMC: stents metálicos convencionales; TC: tomografía computarizada.
El desarrollo y la optimización de estos dispositivos deben demostrar su eficacia y su seguridad en ensayos clínicos adecuadamente diseñados para poder producirlos y comercializarlos en todo el mundo. Sin embargo, este proceso presenta sus propios retos para convertir estos dispositivos en protagonistas de la cuarta revolución en una realidad global.
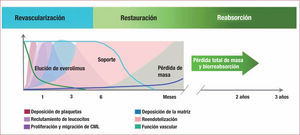
Endoprótesis Vasculares Bioabsorbibles: PerspectivaFases de funcionamiento del dispositivo en relación con las necesidades clínicasLas dificultades en la selección del material y de diseño de la endoprótesis pueden reflejarse en un modelo de tres fases de función del dispositivo en relación con el proceso de reparación vascular44. Como se observa en la figura, la primera fase del proceso es la revascularización: la apertura de una arteria bloqueada y el mantenimiento de su permeabilidad hasta que esta se autoperpetúe. La segunda fase es la restauración: la reducción coordinada en la integridad de la endoprótesis junto con la recuperación progresiva de la arteria hasta alcanzar la vasorreactividad normal, lo que recupera la salud arterial. La tercera fase es la reabsorción: la degradación completa y absorción de la endoprótesis por el cuerpo.
Revascularización, restauración y reabsorción: un modelo para comprender las tres fases de la cicatrización arterial tras el implante de endoprótesis vasculares bioabsorbibles (ABSORB Extend) (tabla 4). CML: células de músculo liso vascular.
La primera fase para obtener una reparación completa de la arteria tratada abarca desde el implante de la endoprótesis hasta el tercer mes45,46. El primer reto para obtener una revascularización arterial adecuada es el transporte del BVS a través de los vasos coronarios hasta la lesión objetivo. Una vez alcanzado el segmento arterial pretendido, la endoprótesis debe proporcionar el soporte mecánico suficiente para evitar el retroceso agudo, las oclusiones por disección y el remodelado arterial negativo. Conseguir la fuerza radial apropiada y evitar un retroceso significativo son uno de los retos técnicos más complejos en los BVS poliméricos. El vaso necesita este soporte mecánico durante aproximadamente 3 meses para mantener la luz arterial adecuada45,47. La fuerza radial necesaria en estos dispositivos se obtiene gracias a un diseño adecuado y la optimización del proceso de elaboración del polímero. Además, el sistema de la endoprótesis dotado de un recubrimiento farmacológico debe liberar este agente terapéutico con la cinética adecuada para inhibir la hiperplasia neointimal y, al mismo tiempo, promover la endotelización fisiológica del segmento tratado. Como se detalla más adelante, la gama de materiales y diseños de las endoprótesis que se han utilizado para obtener los objetivos descritos es muy amplia.
Segunda fase: restauraciónLa segunda fase de la funcionalidad del dispositivo tiene una duración variable, muy dependiente del diseño de la endoprótesis. El BVS, que mantiene la fuerza radial similar a los SMC durante al menos los primeros 3 meses, debe mostrar una degradación gradual hacia material inerte con pérdida de esta fuerza radial. La degradación progresiva y benigna de partes de la endoprótesis resulta en elementos desconectados, que permiten la recuperación progresiva de la respuesta vasomotora normal. Durante esta fase es esencial que la endoprótesis mantenga una cobertura endotelial adecuada y no induzca inflamación, que podría originar reestenosis. El equilibrio entre estos fenómenos, habitualmente contrapuestos, a lo largo del tiempo ha requerido de una importante experiencia y de grandes avances en el terreno de los materiales bioabsorbibles48,49.
Tercera fase: reabsorciónLa tercera fase de la función de estos dispositivos tiene como meta la desaparición completa de la endoprótesis que deje como resultado un vaso absolutamente recuperado con permeabilidad persistente. La ausencia de material protésico permanente conlleva ausencia de inflamación, reestenosis o trombosis tardía, así como de las ya descritas limitaciones mecánicas de las prótesis permanentes. Esta es la situación óptima a largo plazo para la salud vascular. El aspecto más importante de esta fase es la gradualidad en la reabsorción para mantener la biocompatibilidad. Este proceso incluye la infiltración por tejido conjuntivo que reemplaza en el espacio a la estructura de la endoprótesis (puntos de reabsorción), con maduración progresiva del tejido conjuntivo hasta conseguir finalmente una estructura totalmente amalgamada con la pared arterial.
Diseño, desarrollo y fabricaciónLa labor de ingeniería necesaria para el diseño de los BVS y su sistema de liberación ha sido muy importante, tanto para cubrir las necesidades clínicas como los requisitos de las agencias reguladoras con vistas a su aprobación para la comercialización mundial. El producto final engloba el sistema de liberación basado en un catéter balón, la propia endoprótesis bioabsorbible con su recubrimiento independiente absorbible diseñado para la liberación de fármacos o agentes activos y, finalmente, un embalaje adecuado para mantener la barrera estéril. El agente activo, habitualmente farmacológico, puede formar parte del BVS, aunque hay diseños que no incluyen agentes antiproliferativos. A modo de resumen, el proceso de fabricación de estos sistemas comienza con la manufactura del balón catéter, la fabricación del propio BVS, el recubrimiento de la citada endoprótesis con el agente activo/fármaco (cuando se usa), el montaje de la endoprótesis al sistema liberador, el empaquetado en barrera estéril sellada del dispositivo y, finalmente, la esterilización del producto final. Los atributos deseables y las características clave de este tipo de productos y procesos se describen a continuación:
- 1.
Navegabilidad. Una lección aprendida en la experiencia comercial de las primeras tres generaciones de dispositivos para el ICP es la importancia de conducir intactos los sistemas (balones, SMC o SFA) hasta alcanzar la zona a tratar. Si el operador no puede conducir fácilmente el dispositivo hasta alcanzar la lesión objetivo en la coronaria, el producto se rechaza. Los perfiles de cruce de catéteres, balones y stents y su dirigibilidad y flexibilidad son puntos esenciales en la navegabilidad a través de anatomías complejas. Está más allá de los objetivos de este artículo tratar este tema, pero es un punto muy importante para el diseño exitoso de una endoprótesis bioabsorbible.
- 2.
Diseño y materiales de la endoprótesis. Se debe tener en cuenta distintos aspectos:
- •
¿Qué material bioabsorbible se debe utilizar? Algunos de los materiales previamente empleados pueden desencadenar inflamación vascular persistente50.
- •
¿Cuál es el mejor diseño geométrico de la endoprótesis?
- •
¿Cómo se debe procesar los biomateriales, la mayoría de ellos polímeros, para crear una estructura con propiedades semejantes al metal en los primeros 3 meses que luego pierda progresivamente la fuerza mecánica hasta permitir la restauración vascular mediante la reabsorción completa y benigna?
- •
- 3.
Recubrimiento de la endoprótesis. La liberación de fármacos antiproliferativos o antiinflamatorios se lleva a cabo mediante distintos diseños, bien a través de una fina capa de polímero bioabsorbible que recubre la endoprótesis, bien embebiendo el fármaco en la propia endoprótesis bioabsorbible. El perfil de liberación del fármaco sigue las reglas observadas en los SFA metálicos. De este modo se emulan o adaptan los perfiles de liberación del fármaco de los SFA que han demostrado mayor eficacia y seguridad tanto en las pruebas in vitro como en los ensayos preclínicos y clínicos. El uso de recubrimientos bioabsorbibles sobre SMC podría considerarse como la «revolución 3.5». Su comportamiento a corto plazo es similar al de los SFA metálicos. A medio-largo plazo, solo persiste la estructura metálica similar a un SMC, y se postula un perfil de seguridad a largo plazo análogo al de este. Sin embargo, comparte las mencionadas limitaciones a largo plazo de las prótesis metálicas permanentes.
- 4.
Adaptación de la endoprótesis al sistema de liberación. Otra lección aprendida de las generaciones previas de dispositivos es la importancia de una fijación eficaz de la endoprótesis al sistema de liberación. Este reto es común a todos los tipos de endoprótesis utilizadas en el ICP. La pérdida de un stent o una endoprótesis en el trayecto hasta la lesión es una complicación grave, y recuperarla muchas veces requiere tratamientos complejos, incluso cirugía urgente. En el caso de los BVS, la adaptación exitosa al sistema de liberación para conseguir un perfil de cruce adecuado sin dañar el recubrimiento o la propia endoprótesis es verdaderamente compleja. En el diseño de cualquiera de estas endoprótesis, esta operación continuará siendo fundamental.
- 5.
Empaquetado y esterilización. El empaquetado en barrera estéril de los dispositivos debe ser diseñado y validado51 para:
- •
Permitir la adecuada identificación del producto con un etiquetado claro.
- •
Proteger el producto de posibles daños mecánicos durante el envío y el almacenamiento.
- •
Mantener un entorno inerte en el interior del paquete es importante para que durante la esterilización por irradiación no se pierda fármaco o se deteriore la endoprótesis.
- •
Permitir la entrada y salida de gases de esterilización, como el óxido de etileno, y mantener los niveles de humedad.
- •
Mantener la esterilidad del producto durante toda la vida útil del dispositivo.
- •
El proceso final de esterilización debe diseñarse y validarse52 para:
- •
Reducir la contaminación microbiana inicial (< 10–100 unidades formadores de colonias) para alcanzar una contaminación ideal de solo 1/106 unidades producidas.
- •
Conseguir esa esterilización sin comprometer las delicadas propiedades de la endoprótesis bioabsorbible, el sistema de liberación y el recubrimiento farmacológico o de agente activo.
Esta combinación de factores supone un reto desde el punto de vista de compatibilidad de materiales. Los avances en este terreno se encaminan a procedimientos de esterilización efectivos pero sostenibles y a otro tipo de soluciones creativas que deben ser aplicables a estos dispositivos combinados53–56.
Evaluación preclínicaAunque la metodología de evaluación sistemática de la seguridad preclínica de los BVS se basa en la utilizada previamente por los SMC y los SFA, el carácter único de estos dispositivos en su comportamiento funcional de revascularización, restauración y reabsorción exige modificaciones. La selección del modelo (arterias coronarias porcinas y arterias iliacas de conejo), los objetivos del estudio (seguridad, farmacocinética), el diseño de los estudios y los objetivos finales son similares a los descritos para los stents permanentes. De hecho, deben reproducir los mismos objetivos clínicos finales y aplicaciones que los stents permanentes57–60. Los siguientes aspectos son únicos en el estudio de los BVS y constituyen la base de cualquier programa preclínico que se plantee:
- 1.
Objetivos del estudio. La seguridad y la farmacocinética son objetivos comunes a los estudios de los SMC y los BVS. En los segundos, además, es obligatorio realizar estudios de degradación para caracterizar su velocidad y establecer correlaciones con su funcionamiento y su seguridad. Los estudios de degradación deben sincronizarse con los estudios de seguridad para establecer puntos temporales críticos dentro de la vida útil del implante; por ejemplo, la biocompatibilidad durante la fase de más rápida degradación y tras ella. Se debe valorar requisitos adicionales y más rigurosos en el terreno farmacológico y de biocompatibilidad respecto a los contaminantes o productos de degradación (lixiviados) y los metabolitos resultantes de la degradación final. Se debe prestar especial atención a los productos de degradación que el cuerpo debe excretar (p. ej., polianhídridos), radicalmente opuestos a los que se asimilan o se metabolizan (p. ej., ácido poliláctico, ácido poliglicólico).
- 2.
Diseño del estudio y dispositivos control. El diseño de los estudios preclínicos de seguridad de cualquier prótesis farmacoactiva debe incorporar el análisis de dispositivos control en comparación con los analizados, lo que permite una evaluación adecuada de la biocompatibilidad y los objetivos de seguridad de cada uno de los componentes de la endoprótesis, tanto individual como colectivamente. Idealmente, el análisis de los BVS con liberación farmacológica debe incluir la endoprótesis con y sin fármaco. Dependiendo de los objetivos finales del estudio, se puede utilizar como controles tanto SMC como SFA. Se debe tener en consideración que tanto el funcionamiento de la endoprótesis como los objetivos seleccionados en este caso no son totalmente equivalentes a los observados con SMC, como se comenta en 4.
- 3.
Duración del estudio. Los estudios preclínicos deben evaluar el funcionamiento del sistema en puntos temporales críticos e incluir una duración que cubra toda la vida útil de la endoprótesis. Estos intervalos incluyen fases agudas (< 7 días), subagudas (28–90 días) y crónicas (≥ 180 días). La evaluación de la fase crónica depende de la farmacocinética prevista y el perfil de degradación en intervalos de tiempo definidos (al menos tres intervalos) y de la vida útil estimada, definida como el tiempo que la pared arterial o el cuerpo entero están expuestos a los productos de degradación.
- 4.
Objetivos de seguridad. Como el modelo anatómico y la función de revascularización son iguales a los empleados para SMC, los objetivos de seguridad de los BVS son muy similares a los ya establecidos58,60,61: morbilidad, mortalidad y evaluación del órgano diana (miocardio distal) y órganos periféricos. Sin embargo, los BVS permiten –en mayor medida que los SMC– estudios de imagen no invasiva (RM, TC) o técnicas de imagen invasiva (ecografía intravascular [IVUS], tomografía de coherencia óptica [OCT]). Estas modalidades pueden aportar información en puntos temporales alternativos a los habituales e información intermedia previa al análisis histomorfométrico post mórtem. Esto es de especial relevancia, puesto que, en el caso de los BVS, son frecuentes los artefactos en la obtención de muestras post mórtem, fijación y procesado histológico, y pueden alterar los resultados finales. La valoración final de la biocompatibilidad y la seguridad de estos dispositivos sigue basándose en el estudio post mórtem, empleando microscopio electrónico de barrido o variables histomorfológicas (p. ej., endotelización, presencia de fibrina, infiltrados leucocitarios o inflamación). Complementariamente, en el caso de estas endoprótesis se debe considerar objetivos de eficacia que reflejen la restauración vascular. Entre otros, estos objetivos pueden ser la restauración de la respuesta vasomotora del segmento tratado y fenómenos de remodelado positivo tardío, utilizando SMC como controles.
- 5.
Integridad de la endoprótesis. La integridad de los dispositivos metálicos se evalúa eficazmente mediante angiografía in vivo o con radiografías de alta resolución post mórtem; sin embargo, la valoración de la integridad de los BVS puede necesitar modalidades alternativas: micro-TC u OCT con reconstrucción tridimensional. Puesto que la progresiva desaparición de la endoprótesis es una característica inherente al diseño de estos dispositivos para permitir la restauración funcional arterial, la valoración de la integridad de los dispositivos solo es pertinente durante la fase definida de revascularización.
La TRV tiene como objetivo fundamental eliminar la isquemia inducida por obstrucciones coronarias. Este objetivo se alcanza en este caso proporcionando soporte temporal de la pared arterial mientras se libera, en muchos casos, un fármaco antiproliferativo. Tanto el soporte o cobertura arterial como la supresión farmacológica de la hiperplasia neointimal se requieren solo un breve lapso, aproximadamente 3 meses, tras el cual la bioabsorción completa del dispositivo tiene lugar durante meses o años. El diseño adecuado de ensayos clínicos, enfocados tanto en eficacia como en seguridad, es un punto esencial para la aprobación comercial y la adopción de la terapia para su uso clínico.
Los objetivos clínicos deben incluir observaciones tanto a corto como a largo plazo. Deben incluir eventos clínicamente significativos, claramente definidos en protocolos de estudio manejados de forma independiente y cegada para asegurar su validez.
La TRV representa una potencial ventaja respecto a los SMC y los SFA: tras la reabsorción del dispositivo, la pared arterial aparece completamente reparada, lo que puede traducirse en remodelado vascular beneficioso con estabilización de la placa y regresión de la enfermedad. Los riesgos asociados con la trombosis tardía estarían significativamente disminuidos, puesto que el dispositivo desaparece y el vaso queda normalmente cicatrizado. El tratamiento antiplaquetario doble prolongado podría no ser necesario en este caso. A medida que la evaluación del dispositivo pasa desde el análisis in vitro a las evaluaciones preclínica y clínica, los objetivos analizados son cada vez más complejos13,14. Los potenciales beneficios de la TRV se reflejan en objetivos clínicos:
- 1.
Beneficios y objetivos clínicos. Mediante el análisis de los resultados de mortalidad e infarto de miocardio, se valoran beneficios como la reducción de los eventos adversos relacionados con isquemia, cicatrización vascular mejorada y eliminación de la trombosis. Los potenciales efectos beneficiosos en la vasculatura distal y la necesidad de nueva revascularización se analizan con los citados objetivos clínicos. La respuesta vasomotora recuperada no tiene actualmente un claro método de análisis: el análisis de la función endotelial aún no tiene una única metodología estándar. La valoración en cada paciente de la respuesta vasomotora está sujeta a importantes diferencias individuales e interindividuales. Los estudios iniciales han empleado agentes vasoactivos y vasoconstrictores (metergina y acetilcolina) para estimular la respuesta vasomotora y demostrar cambios en la luz arterial, que se analiza mediante angiografía cuantitativa61,62.
- 2.
Análisis de los riesgos mediante objetivos clínicos. La tasa de nueva revascularización evalúa riesgos como la liberación del fármaco demasiado rápida (efecto farmacológico subóptimo), la liberación farmacológica no homogénea (puede traducirse en reestenosis focal) y una duración inadecuada del efecto farmacológico (reestenosis tardía). Mediante el análisis de la mortalidad y la aparición de infartos de miocardio, podemos analizar riesgos como la estimulación de la agregación y la adhesión plaquetarias (trombosis del stent), la necrosis tisular (formación de cavidades y mala aposición), el daño endotelial (respuesta vasomotora anormal), el remodelado vascular (aparición de aneurismas vasculares) y reacciones de hipersensibilidad (inflamación crónica). Desde el punto de vista angiográfico, se recomienda que estos nuevos dispositivos presenten diámetros luminales mínimos o porcentajes de estenosis similares a los de SFA al final del seguimiento. Dada la naturaleza polimérica y temporal de estos dispositivos, la ganancia aguda variable hace que la pérdida tardía (late loss) sea un pobre marcador de reestenosis. La pérdida tardía en estos dispositivos es un parámetro variable con el tiempo que informa de la evolución de la hiperplasia neointimal. Puesto que la referencia del área del stent desaparece con el tiempo63, la evaluación angiográfica y por imagen intravascular es necesaria para diferenciar las contribuciones independientes del retroceso inherente al dispositivo, el remodelado del vaso y la formación neointimal.
Con la vigente demanda clínica de BVS y las metodologías de evaluación clínica en crecimiento, la creatividad en este terreno para encontrar la solución óptima se ha estimulado. Los aspectos clave de los productos actuales y los candidatos futuros se revisan a continuación.
Materiales y diseño de las endoprótesisSon varias las empresas que han desarrollado BVS coronarios, hasta el punto de llevar a cabo ensayos clínicos o en fase de preparación. La tabla 2 resume los distintos diseños y materiales. Los lectores familiarizados con la física de polímeros y el desarrollo de ingeniería observarán que la descripción química apenas provee información sobre una amplia variedad de atributos de los polímeros, como el peso molecular, su distribución, los grupos terminales, aditivos, grados de cristalinidad y morfología del polímero. Todos estos atributos pueden tener efectos determinantes en propiedades como la fuerza radial, el retroceso y la tasa de degradación in vivo. Esa información raramente está disponible y, en cualquier caso, está más allá del objetivo de este artículo. No obstante, se hace referencia a este detalle para aclarar la gran complejidad de estas endoprótesis con el objetivo de promover una reparación vascular completa.
| Empresa/dispositivo/año de implantación clínica | Material de la endoprótesis-diseño; recubrimiento y fármaco | Descripción |
| Kyoto Medical Planning Co./stent de Igaki-Tamai/2000 | Ácido poli(L)láctico (PLLA); sin fármaco | PLLA es un isómero semicristalino del ácido poliláctico, frecuentemente usado en el material médico bioabsorbible que necesita integridad estructural. La degradación depende de varios factores, pero se calcula en 18–24 meses. Se degrada mediante hidrolisis que genera como productos terminales agua y CO2. El stent alcanza el tamaño original mediante contraste caliente a 80°C para alcanzar las propiedades mecánicas deseadas |
| Abbott/BVS Cohorte A/2006 | PLLA; ácido poli(DL)láctico (PDLLA)/everolimus | Véase descripción de PLLA. PDLLA es una mezcla no cristalina de isómeros de PLA. Se ha diseñado para conseguir un perfil de liberación del fármaco idéntico al SFA XIENCE V™. Everolimus, fármaco antiproliferativo, es el agente empleado en él |
| Abbott/Absorb BVS/2009 | PLLA; PDLLA/everolimus | Véase descripciones de PLLA y de recubrimiento y fármaco. Único cambio respecto al BVS Cohorte A: diferente diseño de la endoprótesis |
| Biotronik/stent farmacoactivo bioabsorbible de magnesio [DRE(AMS)]/2005 | Aleación de magnesio; ácido poliláctico coglicólico (PLGA)/paclitaxel (AMS-3) o sirolimus (AMS-4) | El Mg es un oligoelemento esencial en la fisiología humana, como la síntesis de enzimas, y para el correcto funcionamiento vascular. El stent basado en Mg comparte las propiedades mecánicas de los SMC a corto plazo. Su fragilidad se reduce mediante la adición de tierras raras (7%) como el circonio. La tasa de degradación oscila en 1–12 meses. En el primer ensayo clínico (AMS-1), el stent perdía su fuerza radial en 1 mes y se degradaba completamente en 3 meses. El proceso de fabricación y la aleación empleada se han cambiado para enlentecer la degradación del DREAMS. Las siguientes generaciones de dispositivos DREAMS incorporan paclitaxel como fármaco antiproliferativo (AMS-3) en una matriz de PLGA o sirolimus (AMS-4). Además, AMS-4 tiene marcadores radioopacos en los extremos de la prótesis |
| REVA Medical Inc./ReZolve™stent coronario bioabsorbible/2007 | Con polímero de policarbonato basado en tiroxina con yodo para aumentar la radioopacidad; no aplicable, fármaco no utilizado en el primer ensayo (RESORB) | El policarbonato DTE se sintetiza de moléculas encontradas en el cuerpo humano, lo que garantiza su biocompatibilidad y aporta propiedades mecánicas robustas. La pérdida de la fuerza mecánica se calcula en 6–12 meses y se reabsorbe completamente en 12–24 meses. Los primeros ensayos clínicos se llevaron a cabo con un diseño de tipo slide and lock (bloqueo por dientes) para conseguir propiedades mecánicas como las de los SMC |
| REVA Medical Inc./ReZolve™ 2 stent coronario bioabsorbible/2007 | Con polímero de policarbonato basado en tiroxina con yodo para aumentar la radioopacidad; recubrimiento abluminal, 80μg de sirolimus | La siguiente generación (ReZolve™ 2) se basa en endoprótesis y polímero rediseñados para enlentecer la velocidad de degradación. Incorpora sirolimus con fármaco antiproliferativo |
| Elixir Medical/DESolve™/2011 | PLLA; PLLA+miolimus (3μg/mm). El dispositivo con marca CE libera novolimus (5μg/mm) | Véase descripción previa de PLLA. Se estima reabsorción completa en 1–2 años. Incluye marcadores radioopacos en los extremos de la endoprótesis. Tanto el miolimus como el novolimus son fármacos inhibidores de la mTOR |
| Arterial Remodeling Technologies (ART)/2012 | PDLLA; sin recubrimiento ni fármaco | Véase descripción previa de PDLLA. Se estima reabsorción completa en 18 meses |
| Biosensors International | PDLLA, diseño autoexpandible con vaina retirable; fármaco, biolimus A9 | Véase descripción previa de PDLLA |
| Sahajanand Medical Technologies | PLLA y PLLA heparinizado; heparina integrada en endoprótesis | Novedoso diseño que incorpora heparina en la endoprótesis |
| Bioabsorbable Therapeutics Inc./Stent BTI/empresa cerrada en 2009 | Ácido salicílico+PLA; sirolimus en polímero de ácido salicílico | Novedoso diseño que utiliza el ácido salicílico tanto en la endoprótesis como en el recubrimiento. Se estima reabsorción en 6 meses |
| OrbusNeich/Acute/planeada para 2014 | PLGA/PCL (policaprolactona)/PGA (poliglicólico); recubrimiento abluminal de sirolimus + tecnología de captura de células progenitoras endoteliales luminal | Enfoque terapéutico basado en el tratamiento diferencial abluminal o adluminal |
BVS: sistemas de endoprótesis bioabsorbibles farmacoactivas; PCL: policaprolactona; PDLLA: ácido poli(DL)láctico; PGA: ácido poliglicólico; PLLA: ácido poli(L)láctico; PLGA: ácido poliláctico coglicólico; SFA: stents farmacoactivos; SMC: stents metálicos convencionales.
Esta no es una lista completa de todos los dispositivos bioabsorbibles. Existen otros diseños que están en fase de desarrollo o pruebas iniciales: Tissue Gen desarrolla una endoprótesis basada en PLLA/PLGA que incorpora prostaglandina E1, y Cordis tiene un dispositivo basado en PLGA/PCL-PGA.
La física de polímeros y el desarrollo de ingeniería son fundamentales en el diseño de las endoprótesis, como también la mecánica de los polímeros, y su uso requiere hallar huecos en las leyes de propiedad intelectual. Todos estos factores tienen influencia en el diseño de las endoprótesis para que su función sea equivalente a la de las prótesis metálicas durante aproximadamente 3 meses, y luego pierda la fuerza mecánica y desaparezca benignamente al final de su vida útil.
Recubrimientos y fármacosEn la tabla 264–71 se resume una lista de recubrimientos y fármacos utilizados en los productos empleados en ensayos clínicos o preparados para tal fin. Los primeros dispositivos bioabsorbibles analizados en ensayos clínicos no utilizaban recubrimiento farmacológico. Alguno de los dispositivos actuales tampoco es farmacoactivo. Sin embargo, con base en las experiencias positivas de los SFA, el pensamiento dominante acepta que el tratamiento farmacológico es importante en las BVS para conseguir reducciones en la tasa de reestenosis inhibiendo la migración y el crecimiento de células musculares lisas en el interior del dispositivo. Las formulaciones farmacológicas que emplean los distintos productos abarcan fármacos antiinflamatorios y antiproliferativos o derivados de estos grupos que se han demostrado efectivos en los SFA metálicos (sirolimus, everolimus y paclitaxel). También se está desarrollando otro tipo de fármacos antiproliferativos o distintas formas de liberación, como los recubrimientos exclusivamente abluminales, tratamientos de la endoprótesis basados en la tecnología de captura de células progenitoras del endotelio (con el objetivo de atraer estas células para obtener un recubrimiento endotelial fisiológico) y productos derivados del ácido salicílico.
Resultados preclínicosVarias empresas con líneas de investigación en productos bioabsorbibles han alcanzado el punto de desarrollo necesario para probar sus dispositivos en ensayos clínicos en humanos. Antes de alcanzar este punto, los dispositivos han cumplido sus objetivos en el análisis preclínico: en la tabla 364–90 se refieren las empresas que han iniciado estudios preclínicos en el campo de los BVS. Las evaluaciones de seguridad preclínicas de estos dispositivos han supuesto una importante previsión de los resultados esperables en los ensayos clínicos, lo que ha condicionado su diseño. De hecho, el análisis preclínico de la seguridad de estos dispositivos hace especial hincapié en la biocompatibilidad y la hemocompatibilidad. De todos los dispositivos que se presentan en la tabla 3 –específicamente el stent Igaki-Tamai, la plataforma ABSORB BVS®, la endoprótesis reabsorbible de magnesio farmacoactiva (DREAMS) y el stent ReZolve®–, se ha demostrado la seguridad necesaria en los ensayos preclínicos. Esto incluye la aparición de una cobertura neointimal benigna sin datos de inflamación persistente, trombosis o embolización distal. De forma similar, alguno de los productos descritos en la tabla 2 (p. ej., BTI, Sahajanand) también ha mostrado resultados exitosos en la evaluación preclínica. La traducción clínica de estos resultados debería demostrarse en ausencia de trombosis y datos aceptables de reestenosis.
| Compañía/producto/iniciación clínica | Hallazgos | Notas/conclusiones |
| Kyoto Medical Planning Co./stent23,24,72,73 Igaki-Tamai/2000 | Arterias coronarias porcinas a 2, 6 y 16 semanas (n=15). Todos los stents de PLLA se implantaron con éxito, sin trombosis. Angiografía: sin diferencias significativas en el diámetro luminal mínimo o el porcentaje de diámetro de estenosis entre el PLLA y el stent de Palmaz-Schatz a 2 o 6 semanas. Histología: a 2, 6, y 16 semanas, no hay inflamación y hay mínima cobertura neointimal en los struts del stent de PLLA. La estructura se mantuvo durante 16 semanas | Seguridad preclínica demostrada en arterias coronarias porcinas a 16 semanas |
| Abbott/dispositivo BVS Cohorte A61,74–77 y BVS ABSORB | • Cohorte A. Seguridad demostrada en modelos de arterias coronarias porcinas y arterias iliacas de conejo desde el mes 1 al 48 y desde el mes 3 al 36, respectivamente. En ambos modelos, BVS demostró seguridad en todas las fases, incluidas supresión de formación neointimal y baja inflamación respecto a SMC y/o SFA metálicos. La evaluación por OCT en el implante a 1 mes y a 2, 3 y 4 años demuestra que la OCT no es capaz de evaluar la degradación de BVS• Cohorte B. Seguridad demostrada en arterias coronarias porcinas (3 años) y arterias iliacas de conejo, así como en arterias coronarias ovinas (28 días), incluidas baja inflamación y supresión neointimal comparables a las de XIENCE V™. Seguridad en el solapamiento también demostrada en arterias coronarias porcinas a 3 meses | Demostrada seguridad comparable tanto para el dispositivo BVS Cohorte A como para Absorb BVS en los modelos preclínicos. Queda establecida la seguridad de BVS Cohorte A a 4 años, con datos que son reflejo de los resultados clínicos: ausencia de trombosis del stent, > 97% de endotelización a 1 mes en arterias coronarias porcinas, equivalente clínicamente a 6 meses, y una integración benigna en la pared arterial ilustrada histológicamente y con OCT. Los estudios llevados a cabo con Absorb BVS con solapamiento demostraron asimismo seguridad a 3 meses en arterias coronarias porcinas. Están en marcha estudios de seguridad con Absorb BVS |
| Biotronik/stent metálico (Mg) de liberación de fármaco absorbible [(DRE)AMS]78–84/2005 | Arterias coronarias porcinas a 3, 28 y 90 días (n=18): | Colectivamente, los resultados preclínicos disponibles son prometedores, pues muestran biocompatibilidad durante la breve duración de la degradación (3 meses). Sin embargo, los resultados indican de manera continua que la degradación es demasiado rápida para evitar el recoil agudo, aunque este se podría corregir mediante la ralentización de la degradación. Se están evaluando dispositivos de próximas generaciones |
| • El área neointimal era significativamente menor en el segmento con AMS que en el segmento con stent de acero inoxidable, aunque ello no se tradujo en un incremento del área luminal | ||
| • El porcentaje de estenosis (área y diámetro) en los segmentos con AMS mejoraron significativamente a 3 meses comparado con 28 días | ||
| • El stent de aleación de Mg se degrada pronto (a los 56 días). A 28 días, los struts visibles por IVUS e histomorfometría eran más finos que los iniciales, y algunos de los del AMS mostraban corrosión temprana como se evidenció por radiografía | ||
| Arterias coronarias porcinas a 28, 52 y 90 días (n = 8): | ||
| • Descenso de la radioopacidad, andamiaje discontinuo y dispersión de struts en progresión temporal | ||
| • IVUS y OCT revelaron un descenso progresivo en la intensidad del reflejo de los struts | ||
| • Histológicamente, progresión en la degradación evidenciada por el incremento en la frecuencia y el grado de las grietas en los struts | ||
| • Todas las modalidades mostraron incremento en las áreas de stent, lumen y arteria en los segmentos implantados a 3 meses en comparación con 28 días | ||
| • Baja inflamación | ||
| DREAMS 2: la evaluación preclínica del dispositivo en modelo porcino demostró mayor endotelización y menor inflamación en los primeros 2 meses tras la implantación que DREAMS 1 | ||
| REVA Medical Inc./stent coronario bioabsorbible REVA85–89/2007 | Arterias coronarias porcinas: | |
| • «Los exámenes preclínicos en varios animales nos muestran al ReZolve como un dispositivo seguro y eficaz» | ||
| • James Anderson, de la Universidad de Case Western Reserve: «La evaluación histológica en arteria coronaria porcina de los stents de policarbonato DTE a 28 días reveló una respuesta de cicatrización normal con una reacción normal a cuerpo extraño, sin inflamación aguda y/o crónica» | ||
| • Remodelado positivo tardío in vivo demostrado con IVUS en coronarias porcinas del mes 12 al 55 tras implantación | ||
| Elixir Medical/DESolve™/201190 | Demostrada la seguridad en arterias coronarias porcinas a 270 días | |
| Arterial Remodeling Technologies (ART)/ART/2012 | Comportamiento comparado con el BMS MULTI-LINK™ (Abbott Vascular, Santa Clara, California, Estados Unidos) en modelo porcino y de conejo. Se implantaron más de 250 dispositivos. Mientras que en el grupo ART la pérdida tardía fue mayor en las primeras semanas, en lo sucesivo comenzó a disminuir gracias al remodelado positivo, y a 3 meses la pérdida tardía en el dispositivo ART era comparable a la observada en el BMS MULTI-LINK |
BVS: sistemas de endoprótesis bioabsorbibles farmacoactivas; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; PLLA: ácido poli(L)láctico.
Sin embargo, no todos los resultados primarios de estos dispositivos han sido aceptables. El BVS de magnesio original mostró resultados subóptimos, tanto clínicos como preclínicos, debido a una degradación demasiado rápida del producto con pérdida luminal tardía excesiva. Los ensayos preclínicos han demostrado que la degradación del dispositivo debe ser lo suficientemente gradual antes de perder su fuerza radial. Basándonos en el trabajo de distintos modelos preclínicos y apoyados en la evidencia clínica obtenida de los estudios con angioplastia con balón45,66–68, la fuerza radial necesaria para contrarrestar las fuerzas elásticas de la arteria y la tendencia inherente al retroceso debe mantenerse durante aproximadamente 3 meses.
Finalmente, la normalización de la respuesta vasomotora que completa los objetivos de la TRV, tal y como se observa en los primeros resultados clínicos en humanos, aún está por demostrar en los modelos preclínicos actualmente en curso. Los datos obtenidos de ambos campos, tanto preclínicos como clínicos, en el terreno de la fisiología vascular conducen al más puro concepto de investigación traslacional.
Resultados clínicosLos BVS con resultados en ensayos clínicos se resumen en la tabla 464–95. Algunos de estos resultados indican el suficiente soporte mecánico durante la primera fase de revascularización, lo que limita la aparición de reestenosis o remodelado. La versión inicial del BVS de magnesio se ha rediseñado para enlentecer su degradación y mantener la integridad mecánica durante al menos 3 meses. Distintas endoprótesis han mostrado un proceso de degradación adecuado que permite la recuperación de la respuesta vasomotora durante la fase de restauración, algo previamente no observado con el SMC. Este es el mejor marcador del que disponemos actualmente para demostrar que el vaso no restringido por la endoprótesis se comporta fisiológicamente como un vaso sano. El dispositivo de Igaki-Tamai ya dispone de datos de seguimiento clínico > 10 años y el Absorb BVS, > 5 años, y en ambos se demuestra la seguridad de esta tecnología bioabsorbible basada en ácido poliláctico24. Constituye así una evidencia de que la TRV es posible. No obstante, son necesarios datos adicionales para demostrar el valor añadido de esta terapia para los pacientes.
| Compañía/producto/iniciación clínica | Resultados clínicos | Notas/conclusiones |
| Kyoto Medical Planning Co./stent23,24,72,73,91 Igaki-Tamai/2000 | FIM (15 pacientes/25 dispositivos): | Además de este resumen de resultados clínicos, a los 9 años a un paciente le realizaron una TC multicorte y una angiografía por síntomas relacionados. IVUS y OCT mostraron una arteria ampliamente abierta en el lugar donde se había implantado el Igaki-Tamai. |
| • MACE: ninguno a 30 días | Los resultados demuestran el potencial a largo plazo para los dispositivos bioabsorbibles de PLLA. Como referencia histórica, la promesa de los SFA metálicos a principios de 2000 detuvieron el ulterior desarrollo de este sistema | |
| • Trombosis: ninguna a 30 días | ||
| • Nueva ICP: una a 6 meses | ||
| • IVUS: recoil insignificante a 1 día y expansión en el seguimiento | ||
| Estudio con 50 pacientes seleccionados: | ||
| • IVUS: sin struts a 3 años | ||
| • Estenosis: el 25% a 3 años (análisis angiográfico) | ||
| • TLR acumulativo (TVR), 16% (16%) a 1 año, 18% (22%) a 5 años y 28% (38%) a 10 años | ||
| Abbott/dispositivos BVS Cohorte A y BVS ABSORB61,76,91–95/2006; 2009 | Cohorte A FIM (n=30): | La evaluación por TC multicorte de los vasos tratados se ha demostrado factible: mayor participación que con angiografía coronaria invasiva y con resultados comparables. |
| • MACE: 3,4% a 3 años; sin nuevos MACE desde el mes 6 al 36; sin trombosis a 36 meses | La ecogenicidad del IVUS, la histología virtual y la OCT indican una bioabsorción al segundo o tercer año. | |
| • Recoil agudo: 7% | ||
| • Reducción del área luminal a 6 meses: 17% | ||
| • Pérdida tardía a 6 meses: 0,44mm | ||
| • Restauración de la vasomoción: aparente a 2 años (angiografía tras metergina o acetilcolina) | ||
| • Incremento de área luminal: de 6 a 24 meses: 18% | ||
| Cohorte B (n=101): | ||
| • MACE: 2,0% a 30 días | ||
| • Pérdida tardía a 6 meses y 2 años: 0,19 y 0,27mm respectivamente | ||
| • Incremento en el área del dispositivo respecto al inicial (7,5±1,2mm2) a 6 meses (7,7±1,3mm2) y 2 años (8,3±1,8mm2) | ||
| • MACE a 2 años: 6,8% | ||
| ABSORB Extend: | ||
| • Actualmente en reclutamiento | ||
| Biotronik/stent metálico (Mg) absorbible (AMS) y stent metálico (Mg) de liberación de fármaco absorbible [(DRE)AMS]78,79,84/2005 | PROGRESS-AMS FIM (63 pacientes/71 dispositivos): | La fuerza mecánica de AMS se pierde al mes. Esto, unido a la alta tasa de reestenosis en la lesión diana (25%) a 4 meses, indica que la degradación del dispositivo es demasiado rápida. |
| • MACE: ninguno a 4 meses | Estas observaciones fundamentan la necesidad de soporte completo al vaso durante 3 meses que es preciso en el modelo de cicatrización en fases. | |
| • Recoil inmediato: insignificante | Los estudios DREAMS en otras zonas anatómicas (p. ej., SFA) están en curso | |
| • TLR: 25% de reestenosis a 4 meses (IVUS) | ||
| Seguimiento a 12 y 28 meses (8 pacientes), IVUS: | ||
| • Degradación completa del dispositivo y durabilidad de 4 meses según indica IVUS | ||
| • Incremento del diámetro luminal desde los 4 meses, indicio de restauración vascular sana | ||
| BIOSOLVE, 1 FIM, 47 pacientes implantados: | ||
| • TLR a 6, 12, y 24 meses: 4,3, 4,7 y 10% respectivamente | ||
| • Pérdida tardía a 6 y 12 meses: 0,64 ± 0,50 y 0,52 ± 0,39mm respectivamente | ||
| REVA Medical Inc./stent coronario bioabsorbibleREVA85–89/2007 | RESORB FIM STUDY (25 pacientes): | El estudio RESTORE para la evaluación del ReZolve™ 2 está en marcha. El estudio RESTORE II se espera en 2013 |
| • Estenosis: 70% antes y 6% después del procedimiento | ||
| • Sin remodelado negativo (lamina elástica externaconstante) desde 4 a 6 meses | ||
| • TLR: 67% a 1 año | ||
| Elixir Medical/DESolveTM/201190 | DESolve I: | DESolve NX para la marca CE está en marcha |
| • Pérdida tardía a 6 meses: 0,19 ± 0,19mm | ||
| • TLR: 6,7% a 6 meses |
BVS: sistemas de endoprótesis bioabsorbibles farmacoactivas; FIM: primer estudio en humanos; IVUS: ecografía intravascular; MACE: eventos adversos cardiacos mayores; OCT: tomografía de coherencia óptica; PLLA: ácido poli(L)láctico; RM: resonancia magnética; SFA: stents farmacoactivos; TC: tomografía computarizada; TLR: revascularización de lesión diana; TVR: revascularización de vaso diana.
Como se ha descrito y se resume en las tablas 3 y 4, los datos preclínicos y clínicos iniciales apoyan las hipótesis médicas y de ingeniería que defienden los BVS como la cuarta revolución del ICP, dando paso a la era de la TRV. Estas endoprótesis de diseño altamente evolucionado han mostrado un comportamiento similar al de las prótesis metálicas durante la fase de revascularización, perdiendo progresivamente su integridad mecánica en los siguientes meses para permitir la recuperación de la respuesta vasomotora normal y finalizar con la completa reabsorción a través de mecanismos fisiológicos. Aunque el número de pacientes tratados aún es pequeño, los datos confirman la restauración de la fisiología arterial sin implantes permanentes, con el potencial beneficio a largo plazo de un vaso sano. Las posibilidades de complicaciones tardías, como trombosis del stent, inflamación persistente o reestenosis, están claramente limitadas, puesto que la endoprótesis desaparece. Aporta, además, beneficios adicionales en el sentido de permitir en mayor medida la realización de técnicas de imagen no invasivas, nuevas técnicas de revascularización o el acceso a las ramas laterales.
Aún son necesarios más datos para confirmar las evidencias presentes y determinar las estrategias óptimas de tratamiento y todavía quedan muchas preguntas en el terreno del diseño y su posterior aplicabilidad. ¿Se conseguirán grados de navegabilidad de los dispositivos similares a los de los SMC actuales para acceder a las anatomías más complejas? ¿Será posible tratar lesiones muy calcificadas? ¿Dispondremos de dispositivos especialmente diseñados para el tratamiento de bifurcaciones? El campo de aplicación de enfermedad vascular periférica es otro de los terrenos en los que se espera un mayor progreso en los próximos años, así como la aparición de endoprótesis autoexpandibles. Por lo tanto, parece este un campo de desarrollo apasionante en los próximos años.
AgradecimientosLos autores agradecen la compilación de datos de las empresas en el mercado1, así como la revisión del Dr. Serruys64,65. A Mikele Azpilicueta y Marta Uroz, por su inestimable ayuda editorial en el manejo de este artículo.
Conflicto de InteresesLos autores son empleados de Abbott Vascular.