Palabras clave
La enfermedad coronaria en pacientes diabéticos se asocia a un peor pronóstico que en los pacientes sin diabetes mellitus1. Existen varios factores que pueden contribuir a esta mayor morbimortalidad2,3; entre ellos, el desarrollo deficiente de nueva circulación colateral tras una oclusión coronaria.
Se ha descrito que el fenómeno de neovascularización en adultos es el resultado de la combinación de dos procesos, la angiogénesis (vasos nuevos formados a partir de vasos preexistentes) y la vasculogénesis (vasos nuevos formados a partir de células precursoras)4. Por otro lado, el trasplante de células madre ha mostrado un nuevo enfoque terapéutico prometedor, con el potencial de inducir neovascularización en pacientes «sin opción» a revascularización que sufren isquemia crónica5. Varios estudios clínicos con un pequeño número de pacientes han descrito el efecto beneficioso de la inyección transendocárdica de células mononucleares autólogas de médula ósea (CMNMO) en los pacientes con cardiopatía isquémica crónica en fase terminal5-7.
Como hemos comentado, se ha demostrado que el proceso angiogénico está alterado en los pacientes con diabetes mellitus8,9. Estudios in vitro indican que las células progenitoras endoteliales (CPE) presentan defectos funcionales en los diabéticos. Sin embargo, sigue sin conocerse si el efecto clínico del tratamiento con células madre es equivalente entre los pacientes diabéticos y aquellos sin diabetes.
Así, el objetivo de nuestro estudio fue comparar los datos clínicos y funcionales de pacientes diabéticos y no diabéticos con insuficiencia cardiaca crónica de origen isquémico en fase terminal que habían sido tratados con este tipo concreto de células madre.
Desde diciembre de 2001 a mayo de 2006, 26 pacientes consecutivos con cardiopatía isquémica terminal y sin opción a revascularización coronaria con técnicas convencionales fueron tratados con CMNMO como parte de dos ensayos clínicos coordinados por el Texas Heart Institute (Houston, Texas, Estados Uni-
dos). El primer ensayo se realizó en colaboración con el Hospital Procardiaco (Río de Janeiro, Brasil), y el segundo se llevó a cabo en el St. Luke Episcopal Hospital (Houston, Texas, Estados Unidos). Los criterios de inclusión y exclusión fueron similares en ambos estudios (fase I), y se han descrito previamente5. En resumen, se incluyó a los pacientes que presentaban enfermedad coronaria crónica con defectos de perfusión reversibles y detectables mediante tomografía computarizada por emisión monofotónica (SPECT) y una fracción de eyección del ventrículo izquierdo (FEVI) inferior al 45%. Además, tras la valoración de la angiografía coronaria, se consideró a todos los pacientes sin opción a revascularización tanto percutánea como quirúrgica. Este estudio cumple con los principios de la Declaración de Helsinki, fue aprobado por el comité ético de cada centro y todos los pacientes firmaron un consentimiento informado por escrito.
En este estudio se comparó la evolución de los pacientes diabéticos y aquellos sin diabetes. Para ello, se definió la diabetes mellitus de acuerdo con el informe de la Organización Mundial de la Salud10 y se incluyó a pacientes diabéticos tratados tanto con dieta como con tratamiento farmacológico.
Aspiración de médula ósea y administración transendocárdica de CMNMO
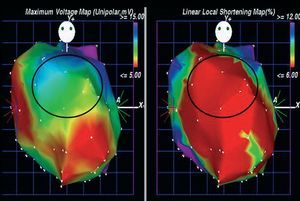
La aspiración de médula ósea se realizó mediante la técnica estándar5. Se utilizó la centrifugación y el gradiente de densidad de Ficoll para aislar la fracción mononuclear de la médula ósea5. Antes de la inyección de células, se realizó un mapeo electromecánico con NOGA para identificar el área específica de tratamiento (miocardio viable: voltaje unipolar ³ 6,9 mV) (fig. 1)5.
Fig. 1. Mapas electromecánicos de un paciente incluido en el estudio (proyección anteroposterior), utilizados para identificar el área específica de tratamiento: mapa de voltaje unipolar (izquierda) y mapa de acortamiento lineal local (derecha). La zona marcada (pared anterior) identificó miocardio viable (voltaje unipolar ³ 6,9 mV, asociado con actividad mecánica disminuida).
Posteriormente, se administraron 15 inyecciones de 0,2 ml cada una mediante el catéter de inyección NOGA MYOSTAR (Cordis Corporation, Miami Lakes, Florida, Estados Unidos).
Seguimiento clínico y evaluación funcional
Se realizó una evaluación clínica y funcional en el momento de la inyección y a los 6 meses de seguimiento. La FEVI y los volúmenes ventriculares se valoraron mediante ecocardiografía transtorácica, que fue interpretada por un laboratorio independiente y ciego a los datos de los pacientes. Se llevó a cabo una ergometría con consumo de oxígeno usando un protocolo estándar con incrementos de 0,5 millas/h inicialmente, una inclinación del 0% al 10% y una duración planificada de ejercicio de 10 min. Tanto la evaluación clínica como la funcional se han realizado mediante los mismos protocolos ya descritos5.
El análisis estadístico se realizó con el programa SPSS versión 12.0 (SPSS Inc., Chicago, Illinois, Estados Unidos). Los datos cuantitativos se mostraron como medianas (rango intercuartílico) y se compararon mediante pruebas no paramétricas. Las variables categóricas se expresaron como porcentajes y se compararon mediante la prueba exacta de Fisher. Se consideró significativo un valor de dos colas de p < 0,05.
Las características basales fueron similares entre ambos grupos (tabla 1), salvo con una tendencia hacia menor edad y mayor historia de infarto de miocardio previo en el grupo sin diabetes. El área y la localización de las inyecciones no fueron significamente diferentes entre los grupos (tabla 1).
A los 6 meses, 25 de los 26 pacientes habían completado el período de seguimiento. Un paciente rehusó seguir en el estudio y fue excluido del análisis. En total se inyectaron una mediana de 29,7 (28,2-30) millones de células, de las que el 2,2% (1,6%-2,8%) fueron células CD45lo CD34+; la viabilidad fue del 96,9% ± 3,8%. Las características de las CMNMO fueron similares entre ambos grupos (tabla 1), salvo por una tendencia hacia un aumento de las células natural killer (NK) en los pacientes sin diabetes, y una tendencia a un incremento ligero de la viabilidad de las células inyectadas en los pacientes diabéticos.
Los datos ecocardiográficos no mostraron diferencias significativas entre ambos grupos con respecto a la FEVI y los volúmenes telediastólicos (tabla 2). Sin embargo, se observó una disminución significativa en el volumen telesistólico en el seguimiento en comparación con el basal en los pacientes sin diabetes. A los 6 meses de seguimiento, se observó una mejora significativa tanto en la clase funcional de la New York Heart Association (NYHA) (basal frente a 6 meses, 3 [1,75-3] frente a 1 [1-2]; p = 0,04) como en la puntuación de angina de la clasificación canadiense (CCSAS, 3 [2-4] frente a 1 [1-1,5]; p = 0,04) en los pacientes sin diabetes. Por el contrario, los pacientes diabéticos no mostraron diferencias significativas en el seguimiento: clase NYHA, 3 (1-3) frente a 2 (2-2) (p = 1); CCSAS, 3 (3-3,75) frente a 2 (1,75-3,25) (p = 0,98).
Globalmente (diabéticos junto con no diabéticos), se produjo un aumento significativo en los valores del consumo de oxígeno (VO2máx) al comparar los valores basales con los de seguimiento (15,2 [10,9-18,4] frente a 19,3 [14,7-25,2]; p = 0,01) y en los equivalentes metabólicos (MET) (4,3 [3,1-5,3] frente a 5,3 [3,9-7,4]; p = 0,006). Sin embargo, cuando se separó a los pacientes en dos grupos (diabéticos y no diabéticos), sólo en los no diabéticos se observó un aumento significativo en los valores de VO2máx y de MET (tabla 2), mientras que no hubo cambios significativos en los diabéticos.
Este estudio clínico con células madre constituye la primera evidencia preliminar de que el tratamiento transendocárdico con CMNMO autólogas parece tener un menor efecto clínico y funcional en los diabéticos que en los pacientes sin diabetes con miocardiopatía isquémica crónica. Cabe pensar en varios mecanismos para explicar estos hallazgos. En primer lugar, la función de las CPE está deteriorada en los diabéticos. Tepper et al8 mostraron que en cultivo las CPE circulantes proliferan menos en diabéticos que en los pacientes sin diabetes. En segundo lugar, los monocitos, que desempeñan un papel importante en la angiogénesis y la arteriogénesis, también están alterados en los diabéticos. Waltenberger et al9 demostraron que los monocitos de pacientes diabéticos tienen una respuesta atenuada al VEGF en un análisis de migración celular. En este sentido, también hay pruebas sobre el aumento en la expresión miocárdica del VEGF, una reducción en la expresión de su receptor y un descenso en su transducción de señales en diabéticos11.
Otros mecanismos que se han propuesto para explicar la falta relativa de angiogénesis en los pacientes diabéticos son la presencia de productos avanzados finales de la glucosilación12 y la glucosilación de los factores de crecimiento circulantes, que reduce su función biológica13.
Aunque estudios previos tanto preclínicos como clínicos han mostrado que las CMNMO pueden contribuir a incrementar la angiogénesis y la perfusión en los pacientes con isquemia crónica5-7, los resultados de este estudio parecen indicar que los pacientes diabéticos tendrían una respuesta menos marcada y, por lo tanto, el beneficio de la terapia celular sería menor que en los pacientes no diabéticos. Sin embargo, se necesitan estudios prospectivos, a doble ciego y controlados con placebo que clarifiquen estos hallazgos.
Se trata de un estudio observacional que procede de dos ensayos clínicos en fase I con un número de pacientes pequeño. Como consecuencia, no está diseñado para detectar la eficacia y esto podría explicar las diferencias observadas en las características basales. Por consiguiente, los resultados obtenidos deben interpretarse con cautela. Sin embargo, hasta la fecha, no se ha publicado ningún trabajo que haya estudiado específicamente el efecto de la terapia de células madre en este subgrupo de pacientes de alto riesgo.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. E. Perin.
Stem Cell Center at the Texas Heart Institute.
St. Luke’s Episcopal Hospital. Houston, TX, Estados Unidos. Correo electrónico: eperin@heart.thi.tmc.edu
Recibido el 31 de mayo de 2007
Aceptado para su publicación el 2 de noviembre de 2007.