La estenosis aórtica degenerativa es la valvulopatía más frecuente. Aún no está claro cómo identificar a los pacientes asintomáticos con fracción de eyección del ventrículo izquierdo normal y alta probabilidad de eventos que por ello pudieran beneficiarse de una intervención valvular precoz. En este estudio se describe un protocolo de hemodinámica de esfuerzo para los pacientes asintomáticos con estenosis aórtica moderada o grave para evaluar su valor pronóstico para esta población.
MétodosEstudio prospectivo unicéntrico de una población de pacientes con estenosis aórtica moderada o grave asintomáticos. Los pacientes realizaron una ergoespirometría para confirmar la ausencia de síntomas en esfuerzo. Después los pacientes se sometieron a un cateterismo cardiaco derecho basal y de esfuerzo. Se definió evento como muerte o necesidad de reemplazo de válvula aórtica quirúrgico o percutáneo basado en las guías clínicas.
ResultadosSe sometió a 33 pacientes a cateterismo cardiaco derecho basal y de esfuerzo. El área valvular aórtica media fue de 1,08 cm2 y el gradiente aórtico medio, 39 mmHg. La presión arterial pulmonar media fue de 21 mmHg, con una presión de oclusión en la arteria pulmonar de 14 mmHg y un gasto cardiaco de 5,6 l/min. La presión pulmonar media en ejercicio máximo fue de 34 mmHg. Tras un seguimiento medio de 27 meses, 8 pacientes sufrieron un evento (24%). No hubo diferencias en las variables basales, el área valvular aórtica o los parámetros de ergoespirometría. Los pacientes con evento no tuvieron mayores presiones pulmonares o presiones de llenado en ejercicio máximo, pero el grupo con eventos mostró menor saturación de oxígeno en la arteria pulmonar en esfuerzo (mediana, el 48 frente al 57%; p=0,03).
ConclusionesEl cateterismo cardiaco de esfuerzo es seguro y factible en esta población. La saturación de oxígeno en la arteria pulmonar en esfuerzo podría identificar a un grupo de pacientes con un aumento del riesgo de eventos adversos graves.
Palabras clave
La estenosis aórtica degenerativa (EAD), que es ya la valvulopatía más frecuente, muestra una prevalencia creciente en las sociedades occidentales a causa del envejecimiento de la población1. En los pacientes sintomáticos, los únicos tratamientos eficaces son el reemplazo quirúrgico o el implante percutáneo de la válvula aórtica1. A pesar de su frecuencia, no está claro de qué forma se puede identificar a los pacientes asintomáticos con una fracción de eyección del ventrículo izquierdo normal pero con gran probabilidad de sufrir eventos clínicos. La realización de exploraciones seriadas y el seguimiento de los pacientes asintomáticos que presentan una estenosis aórtica de moderada a grave es el enfoque más comúnmente utilizado, pero algunos parámetros, como la hipertensión pulmonar grave, la rapidez de progresión hemodinámica de la estenosis y las altas concentraciones de péptidos natriuréticos1, apuntan a un pronóstico adverso y podrían decantar la balanza en favor de una intervención electiva temprana.
Aunque los síntomas inducidos por el ejercicio son la principal razón para intervenir a la mayoría de los pacientes, se utilizan parámetros no invasivos en reposo para establecer la indicación temprana de la cirugía para pacientes asintomáticos. Los resultados hemodinámicos no invasivos en esfuerzo se han relacionado con una mala evolución en varios trastornos cardiacos y en la estenosis aórtica asintomática2. Sin embargo, la evidencia existente respecto a su valor real es objeto de controversia, ya que las presiones pulmonares determinadas durante el ejercicio dependen no solo de la resistencia vascular pulmonar y de la presión telediastólica del ventrículo izquierdo, sino también del gasto cardiaco, que no suele determinarse durante la ecocardiografía de esfuerzo y cuya fiabilidad durante el esfuerzo no está clara. Se han observado presiones pulmonares en esfuerzo elevadas en la ecocardiografía de estrés incluso en individuos jóvenes sanos3 y los valores muestran una variabilidad bien documentada en comparación con lo observado en la hemodinámica invasiva4.
Se ha demostrado que el estudio hemodinámico invasivo aporta una información pronóstica exacta en una amplia variedad de trastornos cardiacos, en especial la insuficiencia cardiaca, pero no se dispone de información sobre la hemodinámica invasiva en esfuerzo y no se han estandarizado protocolos de ejercicio para el cateterismo cardiaco derecho (CCD). En este estudio, el objetivo es describir el protocolo para la hemodinámica en esfuerzo de pacientes realmente asintomáticos con una estenosis aórtica moderada o grave, y evaluar la utilidad pronóstica de los datos obtenidos de esa población.
MÉTODOSPoblación del estudioEn este estudio se utilizó un registro unicéntrico prospectivo de pacientes consecutivos con EAD valvular moderada o grave, detectada mediante ecocardiografía, que estaban asintomáticos. Se incluyó a los pacientes entre mayo de 2015 y abril de 2018. El estudio fue aprobado por el comité local de ética de investigación antes de la inclusión de pacientes. Se confirmó la ausencia de síntomas cardiovasculares en la visita de inclusión y se repitió la ecocardiografía para confirmar la presencia de EAD. Se excluyó a los pacientes con una reducción de la función sistólica del ventrículo izquierdo (< 50%), con otras valvulopatías graves o con otros trastornos cardiacos que contraindicaran la realización de una prueba de esfuerzo en cinta ergométrica. Tan solo se incluyó a pacientes de menos de 85 años que pudieran dar su consentimiento informado y realizar un ejercicio de caminar en la cinta ergométrica.
Según lo establecido en el protocolo, se realizó una ergoespirometría (CPET) de esfuerzo para confirmar la ausencia de síntomas durante el ejercicio o de descensos de la presión arterial u otros parámetros de CPET de mal pronóstico, según los criterios del investigador. En el plazo de 1 mes tras la realización de la CPET, se practicó a los pacientes un CCD en reposo y en esfuerzo. Se siguió a todos los pacientes cada 6 meses en una consulta especializada. Los eventos evaluados se definieron como la muerte, el reemplazo quirúrgico de la válvula aórtica o el implante percutáneo de la válvula aórtica según lo establecido en las guías de práctica clínica o la aparición de síntomas asociados con la estenosis aórtica junto con la planificación de una intervención.
Evaluación de la gravedad de la estenosis aórticaSe llevó a cabo una evaluación ecocardiográfica según lo establecido en las guías clínicas5. Se utilizó Doppler de onda continua para medir las velocidades transaórticas. Se calcularon los gradientes de presión transaórtica máximo y medio mediante la ecuación de Bernouilli simplificada. Se calculó el área valvular aórtica con la ecuación de continuidad. La estenosis aórtica se consideró grave si el área valvular era ≤ 1cm2.
ErgoespirometríaEn todos los pacientes se realizó una CPET con un dispositivo Mortara Xscribe (Mortara Instrument, Inc.; Milwaukee, Estados Unidos) y una cinta ergométrica Full Vision (Full Vision; Kansas, Estados Unidos). Los datos se procesaron con el programa informático Blue Cherry versión 1.2.2.2 de Geratherm Respiratory (Geratherm Respiratory GmbH; Bad Kissingen, Alemania). El protocolo de ejercicio (Naughton, Bruce modificado, Bruce o rampa) se eligió de forma individualizada según la movilidad y las comorbilidades del paciente y el criterio del investigador. Se indicó a los pacientes que realizaran el ejercicio hasta el agotamiento. Al final de cada estadio, se llevó a cabo una supervisión cuidadosa de la presión arterial mediante un esfigmomanómetro calibrado, y también se registraron continuamente la frecuencia cardiaca y el electrocardiograma de 12 derivaciones. Un cardiólogo experimentado realizó una supervisión estricta de todos los pacientes durante la exploración. La prueba se suspendía de inmediato si aparecían síntomas o cualquier otra complicación. Se analizaron los datos de consumo máximo de oxígeno (captación de oxígeno máxima [VO2]), porcentaje del VO2 estimado, cociente de intercambio respiratorio, pendientes VE/VCO2, VE/VO2, VE/VCO2, presencia de ventilación oscilatoria en el ejercicio, valor basal y valor máximo de la presión de CO2 teleespiratoria y reserva respiratoria.
Cateterismo cardiaco derecho en reposo y durante el ejercicioSe realizó un CCD con un catéter Swan-Ganz de calibre 6 Fr, a través de una vena cefálica con guía de fluoroscopia. Las mediciones se realizaron en reposo y después de un ejercicio en decúbito supino controlado con un dispositivo Cardio Step (Ergospect GmbH; Innsbruck, Austria) (figura 1 y vídeo 1 del material adicional) hasta el agotamiento o la aparición de síntomas, de tal manera que los pacientes intentaban alcanzar la misma carga de trabajo que en la CPET (vatios frente a VO2máx) según lo indicado por la evidencia disponible6. El protocolo de ejercicio incluyó un incremento escalonado de la resistencia cada 30 s y se indicó a los pacientes que mantuvieran un ritmo de 60 pasos por minuto. Durante la exploración se llevó un registro de la presión arterial y la electrocardiografía según la práctica habitual. Una vez realizadas las determinaciones basales de las presiones, la saturación de oxígeno en la arteria pulmonar (SO2ap) y el gasto cardiaco, los pacientes iniciaron un ejercicio en decúbito supino con el catéter de Swan-Ganz flotando en la arteria pulmonar (vídeo 1 del material adicional). Se registraron los valores de las presiones pulmonares en el ejercicio máximo, así como la SO2ap. Inmediatamente después de detenido el ejercicio, se desplazó el catéter para obtener la presión de oclusión en la arteria pulmonar y se retiró rápidamente hasta el ventrículo derecho y la aurícula derecha. Se calculó el gasto cardiaco basal con el método de Fick indirecto, ya que el objetivo era comparar la SO2ap en reposo y tras el ejercicio. El método de termodilución no se consideró adecuado para determinar el gasto cardiaco máximo, ya que la guía vigente recomienda realizar un mínimo de 3 determinaciones7, lo cual requiere un tiempo excesivo para que sea fiable la determinación del gasto cardiaco máximo.
Análisis estadísticoTodos los datos se registraron de manera prospectiva en una base de datos anonimizada. Con objeto de detectar los eventos, tan solo se analizó a los pacientes con un mínimo de 1 año de seguimiento tras la inclusión. Los resultados se expresan como media±desviación estándar, mediana [intervalo intercuartílico] o porcentaje, según proceda. Las diferencias estadísticas entre los grupos se evaluaron con la prueba de la U de Mann-Whitney o la prueba de la χ2, según procediera. Se consideraron significativos los valores de p <0,05. Todos los análisis estadísticos se realizaron con el programa SPSS versión 20.0 (SPSS, Inc.; Chicago, Illinois, Estados Unidos).
RESULTADOSEntre mayo de 2015 y abril de 2018, se practicó una CPET a 43 pacientes que cumplían los criterios de inclusión. De ellos, 5 (11,6%) presentaron síntomas durante el ejercicio y se los remitió a reemplazo quirúrgico o implante percutáneo de la válvula aórtica. En los otros 38 pacientes la CPET no mostró síntoma alguno y se programó un CCD basal y en esfuerzo. A 4 de estos pacientes no se llegó a realizarles la prueba debido a problemas en el acceso vascular (es decir, no fue posible obtener un acceso a través de la vena cefálica, ya que el protocolo no permitía ninguna otra vía de acceso) y en 1 paciente se realizó tan solo un CCD basal (la prueba en esfuerzo se canceló debido a la muy elevada presión arterial del paciente). De los 33 pacientes, 1 sufrió una fibrilación auricular transitoria durante la intervención, que fue la única complicación observada en este estudio.
Los datos iniciales se muestran en la tabla 1. La media de edad fue 74 años; la media de área de la válvula aórtica, 1,08cm2 y el gradiente aórtico medio, 39mmHg. Los pacientes mostraron una buena función en la CPET, con una media de VO2máx de 18,7 ml/kg/m2, que condujo a una media del 90% del VO2máx tras ajustar por edad y sexo (normal,> 80%).
Características basales de la cohorte total
| Edad (años) | 73,84±8,30 | Volumen telediastólico del VI indexado (ml/m2) | 62,90±18,01 |
| Varones (%) | 91 | Área AI (cm2) | 22,10±6,50 |
| Hipertensión (%) | 73 | Área AD (cm2) | 17,00±4,72 |
| Diabetes mellitus (%) | 15 | TAPSE (mm) | 24,02±3,16 |
| Dislipemia (%) | 60 | VO2máx (ml/min/m2) | 18,70±3,68 |
| Fumadores activos (%) | 6 | %VO2máx | 90,27±13,62 |
| Fibrilación auricular (%) | 3 | CIR | 0,99±0,08 |
| Enfermedad coronaria (%) | 9 | Pendiente VE/VCO2 | 33,32±4,87 |
| Ictus (%) | 6 | PETCO2 basal (mmHg) | 31,84±4,22 |
| Área de válvula aórtica (cm2) | 1,08±0,28 | PETCO2 máxima (mmHg) | 37,32±3,49 |
| Área de válvula aórtica indexada (cm2/m2) | 0,58±0,15 | IA de grado III, % | 21 |
| Gradiente medio de válvula aórtica (mmHg) | 39,02±12,78 | IM de grado III, % | 3 |
| Estenosis aórtica grave (%) | 48.5 | FEVI (%) | 65,30±6,54 |
| Volumen telediastólico del VI (ml) | 120,39±42,66 |
AD: aurícula derecha; AI: aurícula izquierda; CIR: cociente de intercambio respiratorio; FEVI: fracción de eyección del ventrículo izquierdo; IA: insuficiencia aórtica; IM: insuficiencia mitral; PETCO2: dióxido de carbono teleespiratorio; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; VI: ventrículo izquierdo; VO2: consumo máximo de oxígeno.
Los resultados se expresan en forma de media±desviación estándar y porcentaje.
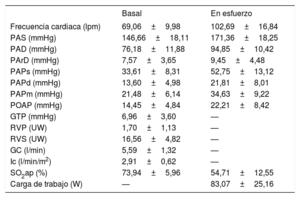
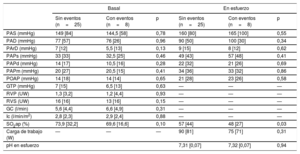
Los datos hemodinámicos basales y en esfuerzo se muestran en la tabla 2. La presión arterial pulmonar media fue de 21mmHg, con una media de presión de oclusión en la arteria pulmonar de 14mmHg y una media de gasto cardiaco de 5,6 l/min. La media de la carga de trabajo máxima fue de 83W y la presión arterial pulmonar media en el ejercicio máximo fue de 34mmHg. La media de la SO2ap basal fue del 74%, y se redujo a una media del 54% durante el ejercicio máximo.
Resultados basales y máximos del cateterismo cardiaco derecho en esfuerzo
| Basal | En esfuerzo | |
|---|---|---|
| Frecuencia cardiaca (lpm) | 69,06±9,98 | 102,69±16,84 |
| PAS (mmHg) | 146,66±18,11 | 171,36±18,25 |
| PAD (mmHg) | 76,18±11,88 | 94,85±10,42 |
| PArD (mmHg) | 7,57±3,65 | 9,45±4,48 |
| PAPs (mmHg) | 33,61±8,31 | 52,75±13,12 |
| PAPd (mmHg) | 13,60±4,98 | 21,81±8,01 |
| PAPm (mmHg) | 21,48±6,14 | 34,63±9,22 |
| POAP (mmHg) | 14,45±4,84 | 22,21±8,42 |
| GTP (mmHg) | 6,96±3,60 | — |
| RVP (UW) | 1,70±1,13 | — |
| RVS (UW) | 16,56±4,82 | — |
| GC (l/min) | 5,59±1,32 | — |
| Ic (l/min/m2) | 2,91±0,62 | — |
| SO2ap (%) | 73,94±5,96 | 54,71±12,55 |
| Carga de trabajo (W) | — | 83,07±25,16 |
GC: gasto cardiaco; GTP: gradiente transpulmonar; Ic: índice cardiaco; PAD: presión arterial diastólica; PAPd: presión arterial pulmonar diastólica; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; RVS: resistencia vascular sistémica; PArD: presión auricular derecha; PAS: presión arterial sistólica; POAP: presión de oclusión en la arteria pulmonar; RVP: resistencia vascular pulmonar; SO2ap: saturación de oxígeno en la arteria pulmonar.
Los resultados se expresan en forma de media±desviación estándar.
Después de una media de seguimiento de 27,6±7,8 meses, 8 pacientes habían sufrido un evento (24%): 2 pacientes fallecieron (1 sufrió una muerte súbita cardiaca; el otro, un shock cardiogénico días después de haber sido hospitalizado por una pancreatitis) y a 6 pacientes se les practicó reemplazo quirúrgico o implante percutáneo de la válvula aórtica a causa de la aparición de síntomas o disfunción del ventrículo izquierdo.
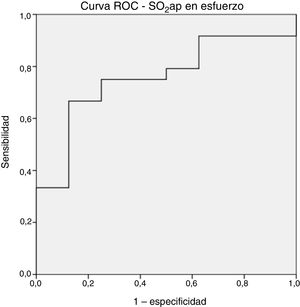
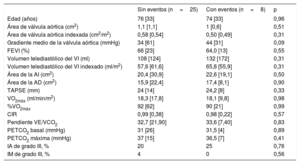
En la tabla 3 y la tabla 4 se presentan las comparaciones del grupo sin eventos con el grupo con eventos. No hubo diferencias estadísticamente significativas entre los 2 grupos en cuanto a las variables iniciales, el área de la válvula aórtica y los parámetros de CPET (tabla 3), si bien los pacientes que sufrieron un evento tendieron a presentar unos gradientes medios de válvula aórtica superiores. Tampoco hubo diferencias en la hemodinámica invasiva basal (tabla 4). Los pacientes con un evento no presentaron presiones pulmonares ni presiones de llenado derecho o izquierdo superiores después del ejercicio máximo, pero sí mostraron una SO2ap en esfuerzo significativamente inferior (mediana, el 48 frente al 57%; p=0,03), sin diferencias en la carga de trabajo (mediana, 75 frente a 90 W; p=0,31). Esta diferencia en la SO2ap máxima no se observó tras la estratificación en EAD grave o moderada según la clasificación ecocardiográfica (mediana, el 53 frente al 55%; p=0,49). La SO2ap en esfuerzo mostró unos resultados razonablemente buenos en el análisis de la curva ROC (figura 2), con un área bajo la curva de 0,76. Una SO2ap máxima <51% mostró una sensibilidad y una especificidad del 75%, mientras que una SO2ap máxima <54% tuvo una sensibilidad del 87,5% y una especificidad del 67%. La mediana de pH máximo en el ejercicio indicó una acidosis metabólica, sin que hubiera diferencias entre los grupos con y sin eventos, lo cual confirma que los pacientes superaban el umbral de anaerobiosis.
Características iniciales de los grupos con y sin eventos
| Sin eventos (n=25) | Con eventos (n=8) | p | |
|---|---|---|---|
| Edad (años) | 76 [33] | 74 [33] | 0,96 |
| Área de válvula aórtica (cm2) | 1,1 [1,1] | 1 [0,6] | 0,51 |
| Área de válvula aórtica indexada (cm2/m2) | 0,58 [0,54] | 0,50 [0,49] | 0,31 |
| Gradiente medio de la válvula aórtica (mmHg) | 34 [61] | 44 [31] | 0,09 |
| FEVI (%) | 66 [23] | 64,0 [13] | 0,55 |
| Volumen telediastólico del VI (ml) | 108 [124] | 132 [172] | 0,31 |
| Volumen telediastólico del VI indexado (ml/m2) | 57,6 [61,6] | 65,8 [55,9] | 0,31 |
| Área de la AI (cm2) | 20,4 [30,9] | 22,6 [19,1] | 0,50 |
| Área de la AD (cm2) | 15,9 [22,4] | 17,4 [8,1] | 0,90 |
| TAPSE (mm) | 24 [14] | 24,2 [8] | 0,33 |
| VO2máx (ml/min/m2) | 18,3 [17,8] | 18,1 [9,8] | 0,98 |
| %VO2máx | 92 [62] | 90 [21] | 0,99 |
| CIR | 0,99 [0,38] | 0,98 [0,22] | 0,57 |
| Pendiente VE/VCO2 | 32,7 [21,90] | 33,6 [7,40] | 0,83 |
| PETCO2 basal (mmHg) | 31 [26] | 31,5 [4] | 0,89 |
| PETCO2 máxima (mmHg) | 37 [15] | 36,5 [7] | 0,41 |
| IA de grado III, % | 20 | 25 | 0,76 |
| IM de grado III, % | 4 | 0 | 0,56 |
AD: aurícula derecha; AI: aurícula izquierda; CIR: cociente de intercambio respiratorio; FEVI: fracción de eyección del ventrículo izquierdo; IA: insuficiencia aórtica; IM: insuficiencia mitral; PETCO2: dióxido de carbono teleespiratorio; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; VI: ventrículo izquierdo; VO2: consumo de oxígeno.
Salvo otra indicación, los resultados se expresan en forma de mediana [intervalo intercuartílico].
Datos del cateterismo cardiaco derecho basal y en esfuerzo en los grupos con y sin eventos
| Basal | En esfuerzo | |||||
|---|---|---|---|---|---|---|
| Sin eventos (n=25) | Con eventos (n=8) | p | Sin eventos (n=25) | Con eventos (n=8) | p | |
| PAS (mmHg) | 149 [84] | 144,5 [58] | 0,78 | 160 [80] | 165 [100] | 0,55 |
| PAD (mmHg) | 77 [57] | 76 [26] | 0,96 | 90 [50] | 100 [30] | 0,34 |
| PArD (mmHg) | 7 [12] | 5,5 [13] | 0,13 | 9 [15] | 8 [12] | 0,62 |
| PAPs (mmHg) | 33 [33] | 32,5 [25] | 0,46 | 49 [43] | 57 [48] | 0,41 |
| PAPd (mmHg) | 14 [17] | 10,5 [16] | 0,28 | 22 [32] | 21 [26] | 0,69 |
| PAPm (mmHg) | 20 [27] | 20,5 [15] | 0,41 | 34 [36] | 33 [32] | 0,86 |
| POAP (mmHg) | 14 [18] | 14 [14] | 0,65 | 21 [28] | 23 [26] | 0,58 |
| GTP (mmHg) | 7 [15] | 6,5 [13] | 0,63 | — | — | — |
| RVP (UW) | 1,3 [3,2] | 1,2 [4,4] | 0,93 | — | — | — |
| RVS (UW) | 16 [16] | 13 [16] | 0,15 | — | — | — |
| GC (l/min) | 5,6 [4,4] | 6,6 [4,9] | 0,31 | — | — | — |
| Ic (l/min/m2) | 2,8 [2,3] | 2,9 [2,4] | 0,88 | — | — | — |
| SO2ap (%) | 73,9 [32,2] | 69,6 [16,6] | 0,10 | 57 [44] | 48 [27] | 0,03 |
| Carga de trabajo (W) | — | — | — | 90 [81] | 75 [71] | 0,31 |
| pH en esfuerzo | 7,31 [0,07] | 7,32 [0,07] | 0,94 | |||
GC: gasto cardiaco; GTP: gradiente transpulmonar; Ic: índice cardiaco; PAD: presión arterial diastólica; PAPd: presión arterial pulmonar diastólica; PAPm: presión arterial pulmonar media; PAPs: presión arterial pulmonar sistólica; PArD: presión auricular derecha; PAS: presión arterial sistólica; POAP: presión de oclusión en la arteria pulmonar; RVP: resistencia vascular pulmonar; RVS: resistencia vascular sistémica; SO2ap: saturación de oxígeno en la arteria pulmonar.
Los resultados se expresan en forma de mediana [intervalo intercuartílico].
Todas las especialidades médicas tienen como santo grial, entre otros, la capacidad de predecir el agravamiento clínico de los pacientes con trastornos crónicos, en especial cuando esta información puede significar un cambio importante en el tratamiento, como puede ser la cirugía. Las pruebas de esfuerzo en los pacientes con trastornos cardiovasculares crónicos parecen ser la forma más fisiológica de evaluar el estado clínico, de tal manera que el tratamiento clínico suele verse alterado por la detección de síntomas durante el ejercicio, y no en reposo, ya que esta situación es representativa de una fase más avanzada de progresión de la enfermedad. En la EAD, tan solo se recomiendan las pruebas de esfuerzo convencionales para desenmascarar síntomas y para detectar caídas de la presión arterial en algunos individuos seleccionados, y ello no forma parte del seguimiento ordinario de los pacientes con una EAD por lo demás asintomática1,8. Dado su valor pronóstico aceptado, la hemodinámica invasiva proporciona una determinación directa y exacta del gasto cardiaco, las presiones pulmonares y las presiones de llenado, y se utiliza ampliamente en cuidados intensivos y en el tratamiento de la insuficiencia cardiaca para orientar el tratamiento y la toma de decisiones clínicas en pacientes tanto estables como inestables9. La hemodinámica invasiva en esfuerzo se considera un método sumamente atractivo y fisiológico de evaluar el estado y el pronóstico de los pacientes, pero la falta de estandarización y de evidencia acerca de su significado clínico hacen que su papel haya quedado relegado al de una herramienta de investigación en determinados escenarios clínicos como la hipertensión pulmonar asociada a la esclerodermia y la insuficiencia cardiaca10,11.
En este estudio mostramos que el CCD en esfuerzo en pacientes realmente asintomáticos (con una capacidad de ejercicio normal en la CPET) con una estenosis aórtica moderada o grave es factible y seguro y que aporta una información útil y correlacionada con mala evolución clínica. En nuestra cohorte, una SO2ap máxima en menor esfuerzo mostró una asociación significativa con la aparición de eventos graves (muerte y necesidad de intervención) después de una media de seguimiento de alrededor de 2 años. La SO2ap en reposo es un parámetro biológico crucial en la evaluación del estado hemodinámico de la insuficiencia cardiaca y en los pacientes en estado crítico. La SO2ap está influida por el gasto cardiaco y la extracción de oxígeno periférica, que son 2 de los principales factores determinantes de la tolerancia al esfuerzo12. En nuestra cohorte, no hubo diferencias en la SO2ap en reposo entre los grupos con y sin eventos. La diferencia se observó tan solo en la SO2ap máxima, lo cual indica un menor rendimiento de la función cardiaca en el grupo con eventos, ya que no hubo diferencias en la carga de trabajo ni en otros parámetros basales. Aunque clásicamente la SO2ap máxima tras el ejercicio en cinta ergométrica se ha relacionado con una peor clase funcional12, esta es la primera vez que este parámetro se ha asociado con un peor resultado en un trastorno cardiaco concreto, incluida la EAD.
Aunque el grupo con eventos mostró unas presiones arteriales pulmonares en esfuerzo ligeramente superiores durante el ejercicio máximo, la diferencia no fue significativa. Es probable que el gasto cardiaco no aumentara en gran medida con el ejercicio en el grupo con eventos, lo cual es posible dado que la SO2ap es crucial para el cálculo del gasto con el método de Fick. Se puede plantear la hipótesis de que un menor gasto cardiaco durante el ejercicio en el grupo con eventos condujera a un aumento de las presiones pulmonares menor que el esperado. El gasto cardiaco puede aumentar hasta 5-8 veces en el momento del máximo ejercicio3, pero las limitaciones de la capacidad de vasodilatación pulmonar para acomodar esta cantidad de sobrecarga de volumen hacen que aumenten las presiones pulmonares. Esto explica por qué, en los deportistas de élite, se ha observado una hipertensión pulmonar incluso «grave» con la evaluación hemodinámica no invasiva3. Aunque la hipertensión pulmonar grave con el ejercicio se ha relacionado con una mala evolución clínica en determinados trastornos, y es probable que esta asociación sea correcta en muchos casos, este resultado debe interpretarse con precaución, ya que las presiones pulmonares más bajas podrían estar relacionadas con un resultado clínico aún peor si el gasto cardiaco o la función cardiaca son deficientes. Además, la relación entre las evaluaciones no invasiva e invasiva de las presiones pulmonares es débil4, lo cual indica que es preciso considerar con precaución la estimación no invasiva de las presiones pulmonares.
Pensamos que nuestro trabajo y los resultados son en esencia una prueba de concepto, es decir, una demostración de que la idea subyacente (la identificación de nuevos factores pronósticos en la EAD mediante la hemodinámica de esfuerzo) es posible, fiable y fisiológicamente razonable. Además, creemos que nuestros resultados podrían tener una posible aplicación práctica. En consecuencia, dado que este estudio se llevó a cabo en pacientes seleccionados y probablemente de una manera más sencilla de lo necesario, está justificada la realización de más estudios.
LimitacionesEn este estudio, que por lo demás es similar a otras experiencias descritas en la literatura médica, se incluyó a un reducido número de pacientes11. Este protocolo es muy exigente e incluye una técnica invasiva, y algunos pacientes se mostraron reacios a participar, a pesar de la aprobación de nuestro comité de ética. Lo ideal sería que una investigación como la presentada aquí se realizara con la inclusión de un dispositivo de consumo de oxígeno, como un CPET13. Este dispositivo permitiría comparar directamente el gasto cardiaco en esfuerzo con el método de Fick directo. Lamentablemente, por razones técnicas, no pudimos utilizar el dispositivo de CPET en el laboratorio de cateterismo. Aunque se ha utilizado la termodilución en el ejercicio máximo en otras experiencias descritas11, no consideramos que este enfoque fuera la mejor opción, por las razones ya indicadas. Aunque la carga de trabajo alcanzada fue relativamente baja (pero superior a la de experiencias previas11), muestra una buena correlación con el VO2máx alcanzado en la CPET, que fue normal (> 80%) para la edad y el sexo. Además, en comparación con el ejercicio en cicloergómetro, el realizado en cinta ergométrica alcanza una carga de trabajo y un grado de taquicardia superiores14, debido a la fatiga de las piernas, que puede ser aún más evidente con nuestro aparato de aumento escalonado en decúbito supino.
CONCLUSIONESEl CCD en esfuerzo es un método viable y seguro en pacientes con estenosis aórtica moderada-grave y grave realmente asintomáticos. La SO2ap máxima podría permitir la identificación de los pacientes con más riesgo de eventos adversos graves a medio plazo y es posible que resulte útil en determinadas situaciones clínicas.
FINANCIACIÓNEste trabajo ha sido financiado por una subvención del Instituto de Salud Carlos III (PFIS).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Algunos parámetros, como la hipertensión pulmonar grave, la rapidez de progresión hemodinámica de la estenosis y las altas concentraciones de péptidos natriuréticos, indican un pronóstico adverso y podrían decantar la balanza a favor de una intervención electiva temprana, pero no hay evidencia sólida al respecto.
- –
El cateterismo cardiaco derecho en esfuerzo en pacientes asintomáticos con una estenosis aórtica degenerativa moderada o grave es un método viable y seguro y proporciona una información útil y correlacionada con mala evolución.