El infarto de miocardio (IM) se puede reconocer por características clínicas, incluidos los hallazgos en el electrocardiograma (ECG), valores elevados de marcadores bioquímicos (biomarcadores) de necrosis miocárdica e imágenes; también se puede definir mediante la patología. Es una de las principales causas de mortalidad y discapacidad en el mundo. El IM puede ser la primera manifestación de enfermedad de las arterias coronarias (EAC) o puede ocurrir reiteradamente en pacientes con enfermedad establecida. La información sobre las tasas de IM puede facilitar datos útiles sobre la carga de la EAC en las poblaciones, sobre todo si los datos estandarizados se recogen de manera que se distinga entre incidentes y episodios recurrentes. Desde el punto de vista epidemiológico, la incidencia del IM en una población puede utilizarse como un indicador de la prevalencia de la EAC en esa población. El término «infarto de miocardio» puede tener implicaciones legales y psicológicas de importancia tanto para el individuo como para la sociedad. Es indicador de uno de los principales problemas de salud del mundo e indicador de resultado en ensayos clínicos, estudios observacionales y programas de garantía de calidad. Estos estudios y programas requieren una definición precisa y coherente del IM.
En el pasado, había un consenso general para el síndrome clínico designado como IM. En los estudios sobre la prevalencia de la enfermedad, la Organización Mundial de la Salud (OMS) definió el IM a partir de los síntomas y las anomalías en el ECG y las enzimas cardiacas. No obstante, el desarrollo de biomarcadores cardiacos específicos del tejido miocárdico cada vez más sensibles y de técnicas de imagen más sensibles ahora permite detectar cantidades muy pequeñas de necrosis o lesión miocárdica. Además, el manejo de pacientes con IM ha mejorado significativamente y ha resultado en menos necrosis y lesión miocárdica, a pesar de una presentación clínica similar. Por otra parte, parece necesario distinguir los distintos trastornos que pueden causar el IM, como por ejemplo el IM «espontáneo» y el «relacionado con el procedimiento». Por lo tanto, los médicos, otros proveedores sanitarios y los pacientes requieren una definición actualizada del IM.
En 2000, el Primer Grupo de Trabajo Global sobre IM presentó una nueva definición del IM, que implicaba que cualquier necrosis en el ámbito de la isquemia miocárdica debería calificarse de IM1. El Segundo Grupo de Trabajo Global sobre el IM perfeccionó aún más estos principios, lo que dio como resultado el «Documento de Consenso sobre la Definición Universal del Infarto de Miocardio» en 2007, que resaltaba los distintos trastornos que pueden desencadenar un IM2. Ese documento, aprobado por la Sociedad Europea de Cardiología (ESC), la American College of Cardiology Foundation (ACCF), la American Heart Association (AHA) y la World Heart Federation (WHF), ha tenido buena acogida en la comunidad médica y ha sido adoptado por la OMS3. No obstante, el desarrollo de pruebas (assays) todavía más sensibles para los marcadores de necrosis miocárdica exige una revisión más exhaustiva, especialmente cuando la necrosis se da en pacientes clínicamente enfermos tras someterse a intervención coronaria percutánea (ICP) o cirugía cardiaca. El Tercer Grupo de Trabajo Global sobre el IM ha continuado con los esfuerzos conjuntos de ESC/ACCF/AHA/WHF integrando estas perspectivas y nuevos datos en el documento actual, que ahora reconoce que se puede detectar cantidades muy pequeñas de necrosis o lesión miocárdica mediante marcadores bioquímicos y por técnicas de imagen.
Definición de infarto de miocardio
| Criterios de IAM |
| El término IAM se debe utilizar cuando haya pruebas de necrosis miocárdica en un contexto clínico coherente con isquemia miocárdica aguda. En esas condiciones, cualquiera de los criterios siguientes cumple el diagnóstico de IM: |
| • Detección de un aumento o descenso de los valores de biomarcadores cardiacos (preferiblemente cTn) con al menos un valor por encima del p99 del LRS y con al menos uno de los siguientes: |
| – Síntomas de isquemia |
| – Nuevos o supuestamente nuevos cambios significativos del segmento ST-T o nuevo BRIHH |
| – Aparición de ondas Q patológicas en el ECG |
| – Pruebas por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales en el movimiento de la pared |
| – Identificación de un trombo intracoronario en la angiografía o la autopsia |
| • Muerte cardiaca con síntomas de isquemia miocárdica y supuestas nuevas alteraciones isquémicas en el ECG o nuevo BRIHH, pero que se produjo antes de determinar biomarcadores cardiacos o antes de que aumentasen los valores de estos |
| • Se define arbitrariamente el IM relacionado con ICP por la elevación de cTn (> 5×p99 del LRS) en pacientes con valores basales normales (≤ p99 del LRS) o un aumento de los valores de cTn>20% si los basales son elevados y estables o descienden. Además, se necesita: a) síntomas de isquemia miocárdica; b) nuevos cambios isquémicos del ECG; c) hallazgos angiográficos coherentes con complicación del procedimiento, o d) demostración por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales en el movimiento de la pared |
| • La trombosis del stent asociada a IM si se detecta en la angiografía coronaria o la autopsia en el contexto de isquemia miocárdica y con un aumento o descenso de los títulos de biomarcadores cardiacos con al menos un valor>p99 del LRS |
| • El IM relacionado con la CABG se define arbitrariamente por la elevación de títulos de biomarcadores cardiacos (> 10×p99 del LRS) en pacientes con valores basales de cTn normales (≤ p99 del LRS). Además, se debe considerar diagnóstico de IM: a) nuevas ondas Q patológicas o nuevo BRIHH; b) nuevo injerto documentado angiográficamente o nueva oclusión de la arteria coronaria nativa, o c) pruebas por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales en el movimiento de la pared. |
| Criterios de IM previo |
| Cualquiera de los siguientes se ajusta al diagnóstico de IM previo: |
| • Ondas Q patológicas con o sin síntomas en ausencia de causas no isquémicas |
| • Prueba por imagen de una región con pérdida de miocardio viable adelgazada e incapaz de contraerse, en ausencia de una causa no isquémica |
| • Hallazgos patológicos de IM previo |
BRIHH: bloqueo de rama izquierda del haz de His; CABG: cirugía de revascularización aortocoronaria; cTn: troponinas cardiacas; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IM: infarto de miocardio; LRS: límite superior de referencia; p99: percentil 99.
El IM se define en patología como la muerte de células miocárdicas debido a isquemia prolongada. Tras la aparición de la isquemia miocárdica, la muerte celular histológica no es inmediata, sino que tarda algún tiempo en producirse, apenas 20min o menos en algunos modelos animales4. Pasan varias horas antes de que se pueda identificar necrosis miocárdica mediante examen macroscópico o microscópico post mortem. La necrosis completa de las células miocárdicas en riesgo requiere 2-4h o más, dependiendo de si hay circulación colateral a la zona isquémica u oclusión arterial coronaria persistente o intermitente, la sensibilidad de los miocitos a la isquemia, el acondicionamiento previo y la demanda individual de oxígeno y nutrientes2. Todo el proceso que resulta en un infarto curado suele tardar, como mínimo, 5-6 semanas. La reperfusión puede alterar la apariencia macroscópica y microscópica.
DETECCIÓN POR BIOMARCADORES DE LA LESIÓN MIOCÁRDICA CON NECROSISLa lesión miocárdica se detecta cuando las concentraciones sanguíneas de los biomarcadores sensibles y específicos, como troponinas cardiacas (cTn) o la fracción MB de la creatincinasa (CK-MB), aumentan2. Las cTn I y T son componentes del aparato contráctil de las células miocárdicas y se expresan casi exclusivamente en el corazón. Aunque las elevaciones de estos biomarcadores en la sangre reflejan una lesión que resulta en necrosis de las células miocárdicas, no indican el mecanismo subyacente5. Se han propuesto varias posibilidades para liberar las proteínas estructurales del miocardio, incluida la recuperación normal de las células miocárdicas, apoptosis, liberación celular de productos de degradación de la troponina, aumento de la permeabilidad de la pared celular, formación y liberación de ampollas membranosas y necrosis miocítica6. Independientemente de la biopatología, la necrosis miocárdica debida a isquemia miocárdica se designa como IM.
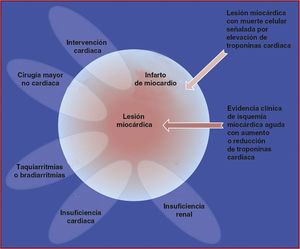
La evidencia histológica de la lesión miocárdica con necrosis también puede detectarse en condiciones clínicas asociadas a lesión miocárdica predominantemente no isquémica. Se puede detectar pequeñas cantidades de lesión miocárdica con necrosis, asociadas a insuficiencia cardiaca (IC), insuficiencia renal, miocarditis, arritmias, embolia pulmonar o procedimientos quirúrgicos coronarios o percutáneos sin incidentes. No se debe calificar estos casos como IM o una complicación de los procedimientos, sino como una lesión miocárdica, como se ilustra en la figura 1. La complejidad de las circunstancias clínicas a veces dificulta determinar dónde residen los casos individuales en los óvalos de la figura 1. En ese contexto, es importante distinguir las causas agudas de la elevación de la cTn —que requiere un aumento o una reducción de los valores de cTn— de los aumentos crónicos, que tienden a no cambiar de modo agudo. En la tabla 1 se muestra una lista de las circunstancias clínicas asociadas a valores elevados de cTn. Se debe describir en la historia del paciente las contribuciones multifactoriales que resultan en lesión miocárdica.
Esta ilustración muestra varias entidades clínicas: por ejemplo, insuficiencia renal, insuficiencia cardiaca, taquiarritmia o bradiarritmia, los procedimientos cardiacos o no cardiacos que pueden estar relacionados con lesión miocárdica con muerte celular marcada por la elevación de troponinas cardiacas. No obstante, estas entidades también pueden estar relacionadas con infarto de miocardio en caso de evidencia clínica de isquemia miocárdica aguda con aumento o descenso de troponinas cardiacas.
Elevaciones de los títulos de troponinas cardiacas debidas a lesión miocárdica
| Lesiones relacionadas con la isquemia miocárdica primaria |
| Rotura de placa |
| Formación de trombo intraluminal en la arteria coronaria |
| Lesiones por isquemia miocárdica relacionadas con el desequilibrio entre suministro y demanda |
| Taquiarritmias o bradiarritmias |
| Disección aórtica o enfermedad grave de la válvula aórtica |
| Miocardiopatía hipertrófica |
| Shock cardiogénico, hipovolémico o séptico |
| Insuficiencia respiratoria grave |
| Anemia grave |
| Hipertensión con o sin HVI |
| Espasmo coronario |
| Vasculitis o embolia coronaria |
| Disfunción endotelial coronaria sin EAC significativa |
| Lesiones no relacionadas con la isquemia miocárdica |
| Contusión cardiaca, cirugía, ablación, marcapasos o choques con desfibrilador |
| Rabdomiolisis con deterioro cardiaco |
| Miocarditis |
| Agentes cardiotóxicos como antraciclina o herceptina |
| Lesión miocárdica multifactorial o indeterminada |
| Insuficiencia cardiaca |
| Miocardiopatía por estrés (tako-tsubo) |
| Embolia pulmonar grave o hipertensión pulmonar |
| Sepsis y pacientes críticos |
| Insuficiencia renal |
| Afecciones neurológicas graves y agudas como ACV o hemorragia subaracnoidea |
| Enfermedades infiltrativas como amiloidosis o sarcoidosis |
| Ejercicio extenuante |
ACV: accidente cerebrovascular; EAC: enfermedad de las arterias coronarias; HVI: hipertrofia ventricular izquierda.
El biomarcador preferido, en general y para cada categoría específica del IM, es la cTn (I o T), que tiene una elevada especificidad del tejido miocárdico y una elevada sensibilidad clínica. La detección de un aumento o una reducción de las determinaciones es esencial para diagnosticar infarto agudo de miocardio (IAM)7. Una concentración de cTn aumentada se define como un valor que supera el percentil 99 de la población normal de referencia (límite superior de referencia [LRS]). Este percentil 99 discriminatorio se designa como el umbral de decisión para el diagnóstico de IM y se debe determinar para cada prueba específica con el control de calidad adecuado en cada laboratorio8,9. Se puede encontrar los valores del percentil 99 del LRS definidos por los fabricantes, incluidos los de muchos de los tests de alta sensibilidad en fase de desarrollo, en las indicaciones del prospecto de los tests o en publicaciones recientes10–12.
Los valores deben presentarse en nanogramos por litro (ng/l) o picogramos por mililitro (pg/ml) para formar números enteros. Los criterios para el aumento de los valores de cTn dependen de los tests, pero pueden definirse a partir del perfil de precisión de cada test, incluidos los tests de alta sensibilidad10,11. La precisión óptima, como describe el coeficiente de variación (CV) al percentil 99 del LRS para cada test, debe definirse como ≤ 10%. Una precisión mejor (CV ≤ 10%) permite tests más sensibles y facilita la detección de valores cambiantes13. El uso de tests que no cuentan con precisión óptima (CV>10% al percentil 99 del LRS) hace que sea más difícil determinar un cambio significativo, pero no produce falsos positivos. No se debe utilizar tests con CV>20% al percentil 99 del LRS13. Se reconoce que los problemas preanalíticos y analíticos pueden inducir valores elevados y reducidos de cTn10,11.
Se debe extraer muestras de sangre en la primera evaluación para medir la cTn y repetirlas a las 3-6h. Se necesitan muestras posteriores si ocurren más episodios isquémicos o cuando el timing de los síntomas iniciales no está claro14. Para establecer el diagnóstico de IM, se necesita un aumento o una reducción de los valores con al menos un valor por encima del umbral de decisión, combinado con una alta probabilidad pretest. Se necesita la demostración de un patrón que sube o baja para distinguir las elevaciones agudas de las crónicas en las concentraciones cTn asociadas a la cardiopatía estructural10,11,15–19. Por ejemplo, los pacientes con insuficiencia renal o IC pueden presentar elevaciones crónicas significativas de la cTn, que pueden ser marcadas, tal y como se observa en muchos pacientes con IM, pero no cambian de modo agudo7. No obstante, no es absolutamente necesario un patrón de subida o bajada para hacer el diagnóstico del IM si un paciente con elevado riesgo pretest acude bastante después del inicio de los síntomas; por ejemplo, cerca del umbral de la curva tiempoconcentración de cTn o de una parte de declive lento de esa curva, cuando la detección de un patrón cambiante puede resultar problemática. Los valores pueden mantenerse elevados durante 2 semanas o más tras la aparición de la necrosis miocítica10.
Los valores dependientes del sexo se pueden recomendar para los tests de troponina de alta sensibilidad20,21. Un valor de cTn elevado (> p99 del LRS), con o sin un patrón dinámico de valores o en ausencia de evidencias clínicas de isquemia, debe alentar la búsqueda de otros diagnósticos asociados a la lesión miocárdica como, por ejemplo, miocarditis, disección aórtica, embolia pulmonar o IC. La insuficiencia renal y otros estados de enfermedad crónica no isquémica, que pueden estar asociados a valores de cTn elevados, aparecen en la tabla 110,11.
En caso de que no haya una prueba de la cTn disponible, la mejor alternativa es la CK-MB (medida mediante un test de masa). Al igual que con la troponina, un valor de CK-MB elevado se define como un indicador>p99 del LRS, que se designa como el umbral de decisión para el diagnóstico de IM22. Se debe utilizar valores específicos por sexo22.
CARACTERÍSTICAS CLÍNICAS DE LA ISQUEMIA Y EL INFARTO MIOCÁRDICOSLa aparición de la isquemia miocárdica es el paso inicial en el desarrollo del IM y resulta de un desequilibrio entre el suministro y la demanda de oxígeno. En el ámbito clínico, la isquemia miocárdica generalmente puede identificarse a partir del historial del paciente y el ECG. Los posibles síntomas isquémicos incluyen varias combinaciones de molestias torácicas, de las extremidades superiores, mandibulares o epigástricas (al hacer esfuerzos o en reposo) o un equivalente isquémico como, por ejemplo, disnea o fatiga. La molestia asociada al IAM generalmente dura>20min. A menudo, la molestia es difusa, no localizada ni posicional ni afectada por el movimiento de la región, y puede estar acompañada de diaforesis, náuseas o síncope. No obstante, estos síntomas no son específicos de la isquemia miocárdica. En consecuencia, se puede diagnosticar erróneamente y atribuirlos a trastornos gastrointestinales, neurológicos, pulmonares o reumáticos. El IM puede ocurrir con síntomas atípicos (p. ej., palpitaciones o parada cardiaca) o incluso sin síntomas (mujeres, ancianos, diabéticos o pacientes postoperatorios o críticos)2. Se aconseja una evaluación exhaustiva de estos pacientes, sobre todo cuando haya un patrón de ascenso o descenso de los biomarcadores cardiacos.
CLASIFICACIÓN CLÍNICA DEL INFARTO DE MIOCARDIOPor el bien de las estrategias de tratamiento inmediatas, como la terapia de reperfusión, es práctica habitual atribuir IM a pacientes con molestias torácicas u otros síntomas isquémicos que sufren elevación del ST en dos derivaciones contiguas (véase la sección del ECG), como un «infarto agudo de miocardio con elevación del segmento ST» (IAMCEST). En cambio, cuando se atiende por primera vez a pacientes sin elevación del ST, se suele diagnosticarles «infarto agudo de miocardio sin elevación del segmento ST» (IAMSEST). En muchos pacientes con IM aparecen ondas Q (IM con onda Q), pero otros no (IM sin onda Q). Los pacientes sin valores altos del biomarcador pueden ser diagnosticados de angina inestable. Además de estas categorías, el IM se clasifica en varios tipos, basados en diferencias patológicas, clínicas y pronósticas, junto con distintas estrategias de tratamiento (tabla 2).
Clasificación universal del infarto de miocardio
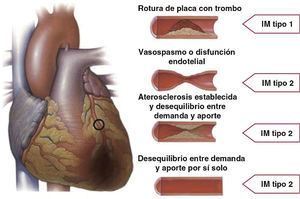
| Tipo 1: IM espontáneo |
| IM espontáneo relacionado con rotura de placa aterosclerótica, ulceración, fisura, erosión o disección que resulta en trombo intraluminal en una o más de las arterias coronarias y reducción del riego sanguíneo miocárdico o embolia plaquetaria distal con la consiguiente necrosis miocítica. El paciente podría tener EAC grave subyacente, pero en ocasiones hay EAC no obstructiva o no hay EAC |
| Tipo 2: IM secundario a desequilibrio isquémico |
| En caso de lesión miocárdica con necrosis en que un trastorno distinto de EAC contribuye al desequilibrio entre suministro y la demanda miocárdicas de oxígeno, p. ej., disfunción endotelial coronaria, espasmo de la arteria coronaria, embolia coronaria, taquiarritmias o bradiarritmias, anemia, insuficiencia respiratoria, hipotensión e hipertensión con o sin HVI |
| Tipo 3: IM que resulta en muerte cuando aún no se dispone de las determinaciones de biomarcadores |
| Muerte cardiaca con síntomas de isquemia miocárdica y supuestas nuevas alteraciones isquémicas en el ECG o nuevo BRIHH, pero que ocurre antes de que se pudiera tomar las muestras de sangre o el biomarcador cardiaco pudiese aumentar o, más raramente, sin haber determinado los biomarcadores cardiacos |
| Tipo 4a: IM relacionado con ICP |
| El IM relacionado con la ICP se define arbitrariamente por la elevación de los títulos de cTn>5×p99 del LRS en pacientes con valores basales normales (≤ p99 del LRS) o un aumento de cTn>20% si los valores basales eran elevados y estables o descienden. Además se necesita uno de los siguientes: a) síntomas de isquemia miocárdica; b) nuevos cambios isquémicos del ECG o nuevo BRIHH; c) pérdida angiográfica de permeabilidad de la arteria coronaria principal o una rama lateral, flujo lento o ausencia de flujo persistentes o embolización, o d) evidencia por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales del movimiento de la pared |
| Tipo 4b: IM relacionado con trombosis del stent |
| El IM relacionado con trombosis del stent se detecta mediante angiografía coronaria o autopsia en el contexto de isquemia miocárdica y aumento o descenso de los títulos de los biomarcadores cardiacos con al menos un valor>p99 del LRS |
| Tipo 5: IM relacionado con la CABG |
| El IM relacionado con la CABG se define arbitrariamente por la elevación de los títulos de los biomarcadores cardiacos>10×p99 del LRS en pacientes con valores basales de cTn normales (≤ p99 del LRS). Además, uno de los siguientes: a) nuevas ondas Q patológicas o nuevo BRIHH; b) nueva oclusión de la arteria coronaria nativa o injerto documentada angiográficamente, o c) evidencia por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales del movimiento de la pared |
BRIHH: bloqueo de rama izquierda del haz de His; CABG: cirugía de revascularización aortocoronaria; cTn: troponinas cardiacas; ICP: intervención coronaria percutánea; IM: infarto de miocardio; LRS: límite superior de referencia; p99: percentil 99.
Se trata de un episodio relacionado con rotura, ulceración, fisura, erosión o disección de una placa, con resultado de trombo intraluminal en una o más de las arterias coronarias, desencadenante de un menor flujo sanguíneo miocárdico o embolia plaquetaria distal, con posterior necrosis miocítica. Puede que el paciente tenga EAC grave subyacente, pero en ocasiones (5-20%) se puede hallar EAC no obstructiva o ninguna EAC en la angiografía, especialmente en mujeres23–25.
Infarto de miocardio secundario a un desequilibrio isquémico (infarto de miocardio tipo 2)En casos de lesión miocárdica con necrosis, en los que un trastorno distinto de EAC contribuye a un desequilibrio entre el suministro y la demanda de oxígeno miocárdico, se utiliza el término «IM tipo 2» (fig. 2). En los pacientes en estado crítico o los sometidos a cirugía (no cardiaca) mayor, pueden aparecer valores elevados de biomarcadores cardiacos, debido a los efectos tóxicos directos de las altas concentraciones de catecolaminas endógenas o exógenas circulantes. También, el vasospasmo coronario y la disfunción endotelial tienen el potencial de causar IM26–28.
Muerte cardiaca debida a infarto de miocardio (infarto de miocardio tipo 3)Los pacientes que sufren muerte cardiaca, con síntomas que indican isquemia miocárdica acompañados de supuestas nuevas alteraciones isquémicas en el ECG o nuevo bloque de rama izquierda del haz de His (BRIHH), pero sin valores de biomarcadores disponibles, constituyen un grupo de diagnóstico complicado. Estos individuos pueden fallecer antes de que se pueda tomar muestras de sangre de biomarcadores o antes de poder identificar biomarcadores cardiacos elevados. Si los pacientes se presentan con características clínicas de isquemia miocárdica o con supuestas nuevas alteraciones isquémicas en el ECG, se debe clasificarlos como pacientes que han tenido IM fatal, incluso en ausencia de evidencia del biomarcador cardiaco de IM.
Infarto de miocardio asociado a procedimientos de revascularización (infartos de miocardio tipos 4 y 5)El infarto o lesión miocárdica perioperatoria puede ocurrir en algunas fases de la instrumentación del corazón que se requiere durante los procedimientos de revascularización mecánicos, ya sea intervención coronaria percutánea (ICP) o cirugía de revascularización aortocoronaria (CABG). Se puede detectar valores de cTn elevados tras estos procedimientos, puesto que pueden ocurrir varios accidentes que resulten en lesión miocárdica con necrosis29–32. Es probable que la limitación de tal lesión sea beneficiosa para el paciente: no obstante, no está bien definido el umbral para un peor pronóstico, relacionado con un aumento asintomático de los valores de los biomarcadores cardiacos en ausencia de complicaciones operatorias33–35. Las subcategorías del IM relacionado con la ICP están relacionadas con la reestenosis y la trombosis del stent que pueden ocurrir tras el procedimiento primario.
DETECCIÓN ELECTROCARDIOGRÁFICA DEL INFARTO DE MIOCARDIOEl ECG es una parte integral del estudio clínico de diagnóstico de los pacientes con sospecha de IM y se debe realizarlo e interpretarlo inmediatamente (es decir, lograr este objetivo en 10min) tras la presentación clínica2. Los cambios dinámicos en las formas de onda del ECG durante los episodios agudos de isquemia miocárdica a menudo requieren realizar múltiples ECG, especialmente si el de la presentación inicial no es diagnóstico. Las grabaciones en serie en pacientes sintomáticos con ECG inicial no diagnóstico deben realizarse a intervalos de 15-30min o, si es posible, una grabación continua con ECG computarizado de 12 derivaciones. La recurrencia de los síntomas tras un intervalo asintomático supone una indicación para un rastreo repetido y, en pacientes con anomalías en el ECG en desarrollo, se debe realizar un ECG previo al alta hospitalaria como punto de referencia para futuras comparaciones.
Los cambios agudos o en curso de las formas de onda ST-T y ondas Q, si están presentes, pueden permitir al facultativo cronometrar el episodio, identificar la arteria relacionada con el infarto, estimar la cantidad de miocardio en riesgo y el pronóstico y determinar la estrategia terapéutica. Un cambio más pronunciado del segmento ST o una inversión de la onda T con compromiso de muchas derivaciones/territorios se asocia a mayor isquemia miocárdica y peor pronóstico. Otros signos del ECG asociados a la isquemia miocárdica aguda son arritmias cardiacas, retrasos en la conducción intraventricular y auriculoventricular y pérdida de amplitud precordial de la onda R. El tamaño de la arteria coronaria y la distribución de los segmentos arteriales, los vasos colaterales, la localización, el grado y la gravedad de la estenosis coronaria y los antecedentes de necrosis miocárdica pueden afectar a las manifestaciones electrocardiográficas de la isquemia miocárdica36. Por lo tanto, siempre hay que comparar el ECG de la primera asistencia médica con ECG anteriores si están disponibles. El ECG por sí solo suele ser insuficiente para diagnosticar el infarto o la isquemia miocárdica aguda, puesto que la desviación del ST puede observarse en otros trastornos, como la pericarditis aguda, la hipertrofia ventricular izquierda (HVI), el BRIHH, el síndrome de Brugada, la cardiomiopatía por estrés y patrones precoces de repolarización37. Una nueva elevación prolongada del segmento ST (p. ej.,>20min), especialmente cuando se asocia con depresión recíproca del segmento ST, generalmente refleja una oclusión coronaria aguda y resulta en lesión miocárdica con necrosis. Al igual que en la cardiomiopatía, las ondas Q también pueden ocurrir debido a una fibrosis miocárdica en ausencia de EAC.
Las anomalías en el ECG de la isquemia o el infarto miocárdicos pueden inscribirse en el segmento PR, el complejo QRS, el segmento ST o la onda T. Las primeras manifestaciones de la isquemia miocárdica suelen ser cambios en la onda T y el segmento ST. Una mayor amplitud hiperaguda de la onda T, con prominentes ondas T simétricas en al menos dos derivaciones contiguas, es una señal precoz que puede prenunciar la elevación del segmento ST. Se puede observar ondas Q transitorias durante un episodio de isquemia aguda o, raramente, durante el IAM reperfundido con éxito. La tabla 3 muestra los criterios de las ondas ST-T para el diagnóstico de la isquemia miocárdica aguda que puede o no resultar en IM. El punto J se utiliza para determinar la magnitud del cambio del segmento ST. La nueva, o supuestamente nueva, elevación del punto J≥0,1mV se requiere en todas las derivaciones menos en la V2 y V3. En los varones saludables de menos de 40 años, la elevación del punto J puede ser de hasta 0,25mV en las derivaciones V2 o V3, pero se reduce con la edad. Las diferencias de sexo requieren puntos de corte distintos para las mujeres, puesto que la elevación del punto J en las derivaciones V2 y V3 en mujeres sanas es menor que la de los varones38. El término «derivaciones contiguas» hace referencia a grupos de derivaciones como las anteriores (V1-V6), las inferiores (II, III, aVF) o las laterales/apicales (I, aVL). Las derivaciones suplementarias como V3R y V4R reflejan la pared libre del ventrículo derecho y V7-V9, la pared inferobasal. Los criterios de la tabla 3 requieren que el cambio del ST esté presente en dos o más derivaciones contiguas. Por ejemplo, elevaciones del ST≥0,2mV en la derivación V2 y≥0,1mV en la derivación V1 cumplirían los criterios de dos derivaciones contiguas anómalas en un varón de más de 40 años. No obstante, elevaciones del ST≥0,1 y<0,2mV observadas únicamente en las derivaciones V2-V3 de varones (o<0,15mV en mujeres) podrían ser un hallazgo normal. Hay que tener en cuenta que, ocasionalmente, la isquemia miocárdica aguda puede crear un cambio del segmento ST suficiente para cumplir los criterios en una derivación pero ser ligeramente menor que el cambio del ST requerido en una derivación contigua. Grados menores de desplazamiento del ST o una inversión de la onda T no excluyen la isquemia miocárdica aguda o IM en curso, puesto que una única grabación estática puede que no capture los cambios más dinámicos del ECG que se detectarían sólo con grabaciones en serie. La elevación del ST o las ondas Q diagnósticas en grupos de derivaciones contiguas son más específicas que la depresión del ST para localizar el lugar de la isquemia o la necrosis miocárdicas39,40. En pacientes cuya primera manifestación es dolor torácico isquémico con ECG inicial no diagnóstico, siempre se debe considerar las derivaciones suplementarias, así como las grabaciones de ECG en serie41,42.
Manifestaciones electrocardiográficas de isquemia miocárdica aguda (en ausencia de HVI y BRIHH)
| Elevación del ST |
| Nueva elevación del ST en el punto J en dos derivaciones contiguas con los puntos de corte: ≥ 0,1 mV en todas las derivaciones menos en V2-V3, en las que son de aplicación los puntos de corte siguientes: ≥ 0,2 mV en varones de edad≥40 años,≥0,25mV en varones menores de 40 años o≥0,15mV en mujeres |
| Depresión del ST y cambios de la onda T |
| Nueva depresión del ST horizontal o descendiente≥0,05 mV en dos derivaciones contiguas o inversión de onda T≥0,1 mV en dos derivaciones contiguas con una onda R prominente o cociente R/S>1 |
La evidencia electrocardiográfica de la isquemia miocárdica en la distribución de una arteria circunfleja izquierda a menudo se pasa por alto y se captura mejor utilizando derivaciones posteriores en el quinto espacio intercostal (V7 en la línea axilar posterior izquierda, V8 en la línea medio escapular izquierda y V9 en el extremo paraespinal izquierdo). Se recomienda la grabación de estas derivaciones en pacientes con alta sospecha clínica de oclusión circunfleja aguda (p. ej., ECG inicial no diagnóstico o depresión del segmento ST en las derivaciones V1-V3)41. Se recomienda un punto de corte de 0,05mV elevación del ST en las derivaciones V7-V9; la especificidad aumenta en el punto de corte de elevación del ST≥0,1mV, y es el que se debe utilizar para varones menores de 40 años. La depresión del ST en las derivaciones V1-V3 puede indicar isquemia miocárdica inferobasal (infarto posterior), sobre todo cuando la onda T terminal es positiva (elevación del ST equivalente), pero esto es inespecífico41–43. En pacientes con infarto inferior y sospecha de infarto de ventrículo derecho, se debe grabar las derivaciones precordiales derechas V3R y V4R, puesto que la elevación del ST≥0,05mV (≥ 0,1mV para varones menores de 30 años) ofrece criterios que respaldan el diagnóstico42.
Durante un episodio de molestias torácicas agudas, la seudonormalización de las ondas T previamente invertidas puede indicar isquemia miocárdica aguda. La embolia pulmonar, los procesos intracraneales, las anomalías electrolíticas, la hipotermia o la miocarditis y la perimiocarditis también puede resultar en anomalías en ST-T y se debe tenerlos en cuenta en los diagnósticos diferenciales. El diagnóstico del IM es más difícil en presencia de BRIHH44,45. No obstante, la elevación concordante del segmento T o un ECG anterior puede ser útil para determinar si hay IAM en ese contexto. En pacientes con bloqueo de rama derecha del haz de His (BRDHH), las anomalías en ST-T en las derivaciones V1-V3 son comunes, lo que dificulta valorar si hay isquemia en esas derivaciones; no obstante, cuando se hallan nuevas elevaciones del ST u ondas Q, se debe considerar isquemia o infarto miocárdicos.
INFARTO DE MIOCARDIO PREVIOComo se muestra en la tabla 4, las ondas Q o los complejos QS en ausencia de los factores de confusión de QRS son patognomónicos de un IM previo en pacientes con cardiopatía isquémica, independientemente de los síntomas46,47. La especificidad del diagnóstico del IM por ECG es mayor cuando las ondas Q ocurren en varias derivaciones o agrupaciones de derivaciones. Cuando las ondas Q se asocian con las desviaciones del ST o cambios de la onda T en las mismas derivaciones, la probabilidad de sufrir un IM aumenta; por ejemplo, pequeñas ondas Q≥0,02 s y<0,03 s que tienen una profundidad≥0,1mV indican IM previo si vienen acompañadas de ondas T invertidas en el mismo grupo de derivación. Se han utilizado otros algoritmos codificados validados para el IM, como el Código Minnesota y WHO MONICA en estudios epidemiológicos y ensayos clínicos3.
Cambios del ECG relacionados con infarto de miocardio previo
| Cualquier onda Q en las derivaciones V2-V3 ≥ 0,02 s o complejo QS en las derivaciones V2 y V3 |
| Onda Q ≥ 0,03 s y ≥ 0,1 mV de profundidad o complejo QS en las derivaciones I, II, aVL, aVF o V4-V6 en cualquiera de las dos derivaciones de un grupo de derivación contiguo (I, aVL; V1-V6; II, III, aVF)* |
| Onda R ≥ 0,04 s en V1-V2 y R/S ≥ 1 con onda T concordante positiva en ausencia de defecto de conducción |
*Se utilizan los mismos criterios para las derivaciones suplementarias V7-V9.
Los pacientes asintomáticos en quienes aparecen nuevos criterios patológicos de la onda Q para IM detectados durante un ECG de seguimiento o imágenes cardiacas que revelan evidencias de IM, no atribuibles directamente a un procedimiento de revascularización coronario, debe denominarse «IM silente»48–51. En los estudios, el IM silente con onda Q representa un 9-37% de todos los episodios de IM no mortales y se asocian a un riesgo de muerte significativamente mayor48,49. La mala colocación de la derivación o los factores de confusión del QRS pueden resultar en lo que parecen ser nuevas ondas Q o complejos QS al comparar con un rastreo previo. Por lo tanto, el diagnóstico de un nuevo IM silente con onda Q debe confirmarse repitiendo el ECG con la derivación colocada correctamente o mediante un estudio por imagen y centrando las preguntas en los potenciales síntomas isquémicos provisionales.
TRASTORNOS QUE CONFUNDEN EL DIAGNÓSTICO ELECTROCARDIOGRÁFICO DEL INFARTO DE MIOCARDIOUn complejo QS en la derivación V1 es normal. Una onda Q<0,03 s y<25% de la amplitud de la onda R en la derivación III es normal si el eje QRS frontal se encuentra entre –30° y 0°. Una onda Q también puede ser normal en aVL si el eje QRS frontal se encuentra entre 60° y 90°. Las ondas Q septales son ondas pequeñas y no patológicas<0,03 s y<25% de la amplitud de la onda R en las derivaciones I, aVL, aVF y V4-V6. Preexcitación, cardiomiopatía por estrés, dilatada u obstructiva, amiloidosis cardiaca, BRIHH, hemibloqueo anterior izquierdo, HVI, hipertrofia ventricular derecha, miocarditis, cor pulmonale agudo o hiperpotasemia puede tener relación con las ondas Q o los complejos QS en ausencia de IM. Las anomalías en el ECG que semejan isquemia o infarto miocárdicos se presentan en la tabla 5.
Escollos comunes del ECG en el diagnóstico del infarto de miocardio
| Falsos positivos |
| • Repolarización temprana |
| • BRIHH |
| • Preexcitación |
| • Síndromes de elevación del punto J: p. ej., síndrome de Brugada |
| • Pericarditis o miocarditis |
| • Embolia pulmonar |
| • Hemorragia subaracnoidea |
| • Trastornos metabólicos como hiperpotasemia |
| • Miocardiopatía |
| • Transposición de derivaciones |
| • Colecistitis |
| • Patrón juvenil persistente |
| • Mal posicionamiento de electrodos ECG precordiales |
| • Fenotiazina o antidepresivos tricíclicos |
| Falsos negativos |
| • IM previo con ondas Q o elevación persistente del ST |
| • Marcapasos ventricular derecho |
| • BRIHH |
BRIHH: bloqueo de rama izquierda del haz de His.
Las técnicas de imagen no invasivas desempeñan muchas funciones en pacientes con IM o sospecha de IM, pero esta sección se centra únicamente en el diagnóstico y la caracterización del IM. Las razones subyacentes son que la isquemia y la hipoperfusión miocárdica regional resultan en una cascada de episodios que incluyen disfunción miocárdica, muerte celular y curación mediante fibrosis. Por lo tanto, algunos parámetros de imagen importantes son la perfusión, la viabilidad del miocito, el engrosamiento, el movimiento y el grosor miocárdico y los efectos de la fibrosis en la cinética de agentes de contraste paramagnéticos o radioopacos.
Las técnicas de imágenes comúnmente utilizadas en el infarto agudo y crónico son la ecocardiografía, la ventriculografía con radio-nucleótidos, la escintigrafía de perfusión miocárdica (EPM) por tomografía computarizada por emisión monofotónica (SPECT) y la resonancia magnética (RM). La tomografía de emisión de positrones (PET) y la tomografía computarizada (TC) por rayos X son menos comunes52. Hay un solapamiento considerable en sus posibilidades, y en mayor o menor medida cada una de las técnicas puede evaluar la viabilidad, la perfusión y la función miocárdica. Únicamente las técnicas con radionucleótidos ofrecen una valoración directa de la viabilidad del miocito, debido a las propiedades inherentes de los trazadores utilizados. Otras técnicas ofrecen valoraciones indirectas de la viabilidad miocárdica, como la respuesta contráctil a la dobutamina mediante ecocardiografía o la fibrosis miocárdica mediante RM.
EcocardiografíaEl punto fuerte de la ecocardiografía es la valoración de la función y la estructura cardiacas, especialmente grosor, engrosamiento y movimiento miocárdicos. Los agentes ecocardiográficos de contraste pueden mejorar la visualización del borde endocárdico y pueden utilizarse para evaluar la perfusión miocárdica y la obstrucción microvascular. Las imágenes de Doppler tisular y la elastografía permiten cuantificar la función total y local53. Se han desarrollado agentes ecocardiográficos de contraste intravascular que actúan sobre procesos moleculares específicos, pero estas técnicas no se aplican todavía en el contexto del IM54.
Imágenes con radionucleótidosVarios trazadores con radionucleótidos permiten que los miocitos viables se vean directamente con las técnicas de imagen, entre otros los trazadores utilizados en SPECT con talio-201, tecnecio-99m MIBI y tetrofosmina y los trazadores utilizados en PET F-2-fluorodesoxiglucosa (FDG) y rubidio-8218,52. El punto fuerte de las técnicas con SPECT es que son los únicos métodos directos habitualmente disponibles para evaluar la viabilidad, aunque la resolución relativamente baja de las imágenes las sitúa en desventaja para detectar pequeñas áreas de IM. Los radiofármacos para SPECT comunes son también trazadores de perfusión miocárdica, por lo que las técnicas detectan fácilmente las áreas de IM y las anomalías de perfusión inducible. Las imágenes mediante gated-SPECT ofrecen una evaluación fiable de movimiento, engrosamiento y función general miocárdicos. Entre las técnicas con radionucleótidos que se están desarrollando y permiten valorar IM están las imágenes de inervación simpática con metayodobencilguanidina (MIBG) marcada con yodo-12355, imágenes de activación de la metaloproteasa de la matriz en la remodelación ventricular56,57 y una valoración refinada del metabolismo miocárdico58.
Resonancia magnéticaEl alto contraste del tejido de la RM cardiovascular ofrece una evaluación precisa de la función miocárdica y cuenta con una capacidad similar a la ecocardiografía en casos de sospecha de IAM. Se puede utilizar agentes de contraste paramagnéticos para evaluar la perfusión miocárdica y el aumento del espacio extracelular asociado a la fibrosis de IM previos. Estas técnicas se han utilizado en el contexto del IAM59,60, y las imágenes de fibrosis miocárdica mediante la captación de contraste tardío son capaces de detectar incluso pequeñas áreas de IM subendocárdico. También resulta de valor para detectar estados de enfermedad miocárdica que semejen IM, como la miocarditis61.
Tomografía computarizadaEl miocardio infartado es inicialmente visible como un área focal de menor mejoría del ventrículo izquierdo (VI), si bien las imágenes posteriores muestran hipermejoría, igual que con las imágenes tardías con gadolinio mediante RM62. Este hallazgo es clínicamente relevante, puesto que la TC con contraste mejorado puede realizarse en caso de sospecha de embolia pulmonar y disección aórtica o trastornos con características clínicas que se solapen con las del IAM, aunque la técnica no se utiliza habitualmente. También la evaluación por TC de la perfusión miocárdica es técnicamente factible, pero todavía no se ha validado por completo.
Aplicación de las técnicas de imagen en el infarto agudo de miocardioLas técnicas de imagen pueden ser útiles en el diagnóstico del IAM gracias a su capacidad para detectar anomalías en el movimiento de la pared o pérdida de miocardio viable en la presencia de valores de los biomarcadores cardiacos elevados. Si, por alguna razón, no se han medido los biomarcadores o se han normalizado, la demostración de nueva pérdida de viabilidad miocárdica en ausencia de causas no isquémicas cumple los criterios de IM. La función y la viabilidad normales tienen un valor predictivo negativo muy elevado y prácticamente excluyen el IAM63. Así, las técnicas de imagen son útiles para la clasificación temprana de los pacientes y el alta de pacientes con sospecha de IM. No obstante, si los biomarcadores se han medido en los momentos adecuados y son normales, excluyen IAM y prevalecen sobre los criterios de las técnicas de imagen.
El engrosamiento y el movimiento regional anómalos del miocardio pueden estar causados por IAM o uno o más trastornos, como IM previo, isquemia aguda, miocardio aturdido o hibernación. Los trastornos no isquémicos, como la miocardiopatía y las enfermedades inflamatorias o infiltrativas, también pueden resultar en pérdida local de miocardio viable o anomalía funcional. Por lo tanto, el valor predictivo positivo de las técnicas de imagen para detectar IAM no es alto, excepto si se puede excluir esos trastornos y no se detecta una nueva anomalía o se presupone que ha aparecido una anomalía en otras características del IAM.
La ecocardiografía ofrece una valoración de muchas causas de dolor torácico agudo no isquémicas, como miopericarditis, cardiopatía valvular, cardiomiopatía, embolia pulmonar o disección aórtica53. Es la técnica de imagen de elección para detectar complicaciones de IAM como rotura de la pared libre miocárdica, defecto septal ventricular agudo y regurgitación mitral secundaria a isquemia o rotura del músculo papilar.
Se puede utilizar imágenes con radionucleótidos para evaluar la cantidad de miocardio salvado mediante la revascularización aguda64.
Se inyecta un trazador al comienzo y se aplazan las imágenes hasta después de la revascularización, lo que ofrece un indicador del miocardio en riesgo. Antes del alta hospitalaria, una segunda inyección en reposo ofrece un indicador del tamaño final del infarto, y la diferencia entre las dos corresponde al miocardio que se ha salvado.
Aplicación de las técnicas de imagen en caso de presentación tardía del infarto de miocardioEn caso de presentación tardía tras sospecha de IM, una anomalía en el movimiento de la pared regional, el debilitamiento o un cicatriz en ausencia de causas no isquémicas proveen evidencia de un IM pasado. La alta resolución y la especificidad de la RM mejorada con gadolinio tardío para detectar fibrosis miocárdica la han convertido en una técnica muy valiosa. Especialmente la capacidad de distinguir entre fibrosis subendocárdica y otros patrones de fibrosis ofrece una diferenciación entre la cardiopatía isquémica y otras anomalías miocárdicas. Las técnicas de imagen también son útiles para la estratificación de riesgos tras un diagnóstico definitivo de IM. La detección de isquemia residual o distal o de disfunción ventricular ofrece indicadores potentes de resultados posteriores.
CRITERIOS DIAGNÓSTICOS DE INFARTO DE MIOCARDIO CON INTERVENCIÓN CORONARIA PERCUTÁNEA (INFARTO DE MIOCARDIO TIPO 4)El inflado del balón durante la ICP a menudo causa isquemia transitoria, esté o no acompañada de dolor torácico o cambios del ST-T. La lesión miocárdica con necrosis puede ser consecuencia de episodios perioperatorios reconocibles, solos o en combinación, como disección coronaria, oclusión de una arteria coronaria principal o una rama lateral, alteración del flujo colateral, flujo lento o ausencia de reflujo, embolización distal y obstrucción microvascular. Es posible que no se pueda prevenir la embolización del trombo intracoronario o partículas de placa aterosclerótica pese a estar en curso tratamiento adyuvante antiplaquetario y anticoagulante, dispositivos de protección y aspiración. Tales episodios inducen a la inflamación de los islotes miocárdicos circundantes de la necrosis miocárdica65. Se ha demostrado la presencia de nuevas áreas de necrosis miocárdica mediante RM tras la ICP66.
Se puede detectar si se ha producido lesión celular miocárdica con necrosis relacionada con el procedimiento determinando biomarcadores cardiacos antes del procedimiento y repitiéndolo a las 3-6h y, opcionalmente, con otra medición tras 12h. Sólo se puede interpretar el aumento de concentraciones como lesión miocárdica relacionada con el procedimiento si el valor de cTn previo a la intervención es normal (≥ p99 del LRS) o las concentraciones son estables o se reducen67,68. En pacientes con valores normales previos a la intervención, la elevación de los valores de los biomarcadores cardiacos por encima del p99 del LRS tras la ICP indican lesión miocárdica relacionada con el procedimiento. En estudios previos, las cifras de biomarcadores cardiacos (sobre todo CK-MB) aumentadas tras la intervención se asociaron con mal resultado69,70. No obstante, cuando las concentraciones de cTn son normales antes de la ICP y se vuelven anómalas tras la intervención, no está bien definido el umbral>p99 del LRS con el que es evidente el pronóstico adverso71 y es discutible que tal umbral exista siquiera72. Si está elevado un único valor basal de cTn, es imposible determinar si más aumentos se deben a la intervención o al proceso inicial que causa la elevación. En ese caso, parece ser que el pronóstico está determinado en gran medida por los valores de cTn previos a la intervención71. Estas relaciones probablemente pasen a ser incluso más complejas para los nuevos tests de alta sensibilidad de troponina70.
Se define como IM relacionado con la ICP (tipo 4a) el de pacientes sometidos a ICP con concentraciones de cTn basales normales (≤ p99 del LRS), elevaciones de cTn>5×p99 del LRS que ocurran a las 48h de la intervención, más: a) evidencia de isquemia prolongada (≥ 20min) como indica el dolor torácico persistente; b) cambios isquémicos del ST o nuevas ondas Q patológicas; c) evidencia angiográfica de una complicación limitante del flujo, como pérdida de permeabilidad en una rama lateral, flujo lento persistente, ausencia de reflujo o embolización, o d) evidencia por imagen de nueva pérdida de miocardio viable o nuevas anomalías regionales en el movimiento de la pared. Este umbral de valores de cTn>5×p99 del LRS se elige arbitrariamente según el juicio clínico y las implicaciones sociales del IM perioperatorio. Cuando un valor de cTn es≤5×p99 del LRS tras la ICP y el valor de cTn era previamente normal o cuando cTn>5×p99 del LRS en ausencia de hallazgos isquémicos, angiográficos o imágenes, se debe utilizar el término «lesión miocárdica».
Si los valores basales de cTn son elevados y estables o descienden, se requiere un aumento>20% para el diagnóstico del IM tipo 4a, como con el reinfarto. Datos recientes indican que retrasar la ICP tras un IM hasta que las concentraciones de biomarcadores estén cayendo o se hayan normalizado, si después vuelve a darse una elevación de los valores de biomarcadores cardiacos, puede tener significación a largo plazo. No obstante, se necesitan datos adicionales para confirmar este hallazgo73.
Una subcategoría del IM relacionada con la ICP es la trombosis del stent, como documentan la angiografía o la autopsia y un aumento o descenso de los valores de cTn>p99 del LRS (identificado como IM tipo 4b). Para poder estratificar la ocurrencia de la trombosis del stent en relación con el timing de la ICP, el Academic Research Consortium recomienda categorías temporales de «temprana» (0-30 días), «tardía» (31 días a 1 año) y «muy tardía» (> 1 año) para distinguir las probables diferencias en la contribución de los distintos procesos fisiopatológicos durante cada uno de estos intervalos74. En ocasiones, el IM ocurre con clínica de lo que parece ser una trombosis del stent; no obstante, en la angiografía se observa reestenosis sin evidencia de trombos (véase la sección sobre ensayos clínicos).
CRITERIOS DIAGNÓSTICOS DE INFARTO DE MIOCARDIO CON CIRUGÍA DE REVASCULARIZACIÓN CORONARIA (INFARTO DE MIOCARDIO TIPO 5)Durante la CABG, varios factores pueden resultar en lesión miocárdica con necrosis perioperatoria. Entre estos está el traumatismo miocárdico directo a partir de: a) colocación de las suturas o manipulación del corazón; b) disección coronaria; c) isquemia general o regional relacionada con la cardioprotección intraoperatoria inadecuada; d) eventos microvasculares relacionados con la reperfusión; e) lesión miocárdica inducida por generación de radicales libres de oxígeno, y f) fracaso en la reperfusión de áreas del miocardio no adyacentes a vasos injertables75–77. Estudios por RM indican que la mayoría de las necrosis en este ámbito no son focales, sino difusas y localizadas en el subendocardio78.
En pacientes con valores normales antes de la cirugía, cualquier aumento de los valores de los biomarcadores cardiacos tras CABG indica necrosis miocárdica, lo que implica que es probable que una mayor magnitud de las concentraciones de biomarcadores conlleve mal resultado. Ello se ha demostrado en estudios clínicos con CK-MB en los que las elevaciones 5, 10 y 20 veces el LRS tras la CABG se asociaron con peor pronóstico; de modo similar, se ha descrito mal resultado con valores de cTn elevados al cuartil o el quintil superior de las determinaciones79–83.
A diferencia del pronóstico, hay pocos artículos sobre el uso de biomarcadores para definir un IM relacionado con un episodio vascular primario en un injerto o vaso nativo en el contexto de CABG. Además, cuando el valor basal de cTn es elevado (> p99 del LRS), se observan valores de biomarcadores más altos tras la CABG. Por lo tanto, no se puede usar aisladamente los biomarcadores para el diagnóstico de IM en este contexto. Habida cuenta del impacto negativo en la supervivencia observado en pacientes con elevación significativa de las concentraciones de biomarcadores, este Grupo de Trabajo propone, por convención arbitraria, que los valores de cTn sean>10×p99 del LRS durante las primeras 48h tras la CABG a partir de un valor basal normal de cTn (≤ p99 del LRS). Además, se debe considerar diagnóstico de IM relacionado con la CABG (IM tipo 5): a) las nuevas ondas Q patológicas o un nuevo BRIHH; b) la reoclusión de la arteria coronaria nativa o del injerto documentada angiográficamente, o c) evidencia por imagen de nueva pérdida de miocardio viable o nuevas anomalías en el movimiento regional de la pared. La producción del biomarcador cardiaco es mucho más alta tras la sustitución de la válvula mediante CABG que mediante solo cirugía de bypass, y más con CABG con bomba que con CABG sin ella84. El umbral arriba descrito es más robusto para la CABG con bomba solamente. En cuanto a la ICP, se debe aplicar los principios provenientes de la definición universal de IM a la definición del IM tras más de 48h de la cirugía.
EVALUACIÓN DEL INFARTO DE MIOCARDIO EN PACIENTES SOMETIDOS A OTROS PROCEDIMIENTOS CARDIACOSLas nuevas anomalías del ST-T son comunes en los pacientes sometidos a cirugía cardiaca. Cuando aparecen nuevas ondas Q patológicas en territorios distintos de los identificados antes de la cirugía, se debe considerar IM (tipos 1 o 2), especialmente si se asocia con cifras elevadas de biomarcadores cardiacos, nuevas anomalías en el movimiento de la pared o inestabilidad hemodinámica.
Procedimientos nuevos como implantación transcatéter de válvula aórtica (TAVI) o clip mitral pueden causar lesión miocárdica con necrosis, ambas mediante traumatismo directo en el miocardio y creando isquemia regional de la obstrucción coronaria o embolización. Es probable que, de modo similar a la CABG, a más marcada la elevación de los valores de biomarcadores peor sea el pronóstico, pero no hay datos disponibles.
Se han propuesto criterios modificados para el diagnóstico del IM perioperatorio 72h o menos tras la implantación de válvula aórtica85. No obstante, dado que hay muy pocas pruebas, parece razonable aplicar al IM relacionado con el procedimiento los mismos criterios ya indicados para la CABG.
La ablación de las arritmias implica una lesión controlada con necrosis miocárdica aplicando calor o frío al tejido. El alcance de la lesión con necrosis puede evaluarse mediante un indicador de cTn; no obstante, una elevación de los valores de cTn en este contexto no debe calificarse como IM.
INFARTO DE MIOCARDIO ASOCIADO A PROCEDIMIENTOS NO CARDIACOSEl IM perioperatorio es la principal complicación vascular perioperatoria en cirugía no cardiaca mayor y tiene mal pronóstico86,87. La mayoría de los pacientes con IM perioperatorio no sufren síntomas isquémicos. Sin embargo, el IM perioperatorio asintomático está muy asociado muerte a los 30 días, iguel que el IM sintomático86. Por lo tanto, se recomienda el control sistemático de los biomarcadores cardiacos en pacientes de alto riesgo, tanto antes como 48-72h después de la cirugía mayor. La determinación de cTn de alta sensibilidad en muestras postoperatorias revela que el 45% de los pacientes tienen cifras>p99 del LRS y el 22%, elevación y un patrón al alza de los valores que indican necrosis miocárdica en curso88. Estudios de pacientes sometidos a cirugía no cardiaca mayor defienden firmemente la idea de que muchos de los infartos diagnosticados en este contexto se deben a un desequilibrio prolongado entre el suministro y la demanda de oxígeno miocárdicos, contra una EAC subyacente89,90. Junto con el aumento o la reducción de los valores de cTn, esto indica IM tipo 2. No obstante, un estudio patológico de pacientes con IM perioperatorio fatal demostró rotura de placa y agregación plaquetaria, que resultan en formación de trombos en aproximadamente la mitad de tales episodios91, es decir, IM tipo 1. Dadas las diferencias que probablemente haya en los abordajes terapéuticos de cada uno, son necesarios un examen exhaustivo y el juicio clínico.
INFARTO DE MIOCARDIO EN LA UNIDAD DE CUIDADOS INTENSIVOSLas elevaciones de cTn son comunes en pacientes ingresados en unidad de cuidados intensivos y se asocian con pronóstico adverso, independientemente del estado de la enfermedad subyacente92,93. Algunas elevaciones pueden reflejar IM tipo 2 debido a EAC subyacente y mayor demanda miocárdica de oxígeno94. Otros pacientes pueden tener elevados los valores de biomarcadores cardiacos por lesión miocárdica con necrosis inducida por catecolamina o efecto tóxico directo de las toxinas circulantes. Además, en algunos pacientes, puede producirse IM de tipo 1. Para el facultativo que atiende al paciente crítico con enfermedad grave de uno o varios órganos, suele ser un reto decidir un plan de acción ante valores de cTn elevados. En caso de que el paciente se recupere de la enfermedad crítica, se debe hacer uso del juicio clínico para decidir hasta qué punto está indicada una evaluación más exhaustiva de la EAC o la cardiopatía estructural95.
INFARTO DE MIOCARDIO RECURRENTEEl «IM incidente» se define como el primer IM del sujeto. Cuando las características del IM ocurren en los primeros 28 días tras un episodio incidente, no se cuenta como evento nuevo a efectos epidemiológicos. Si las características del IM ocurren en los 28 días siguientes al IM incidente, se considera IM recurrente3.
REINFARTOEl término «reinfarto» se utiliza para el IAM que ocurre a los 28 días de un IM incidente o recurrente3. El diagnóstico por ECG de sospecha de reinfarto tras un IM inicial podría confundirse por los cambios evolutivos iniciales en el ECG. Se debe considerar reinfarto cuando vuelve a ocurrir una elevación del ST≥0,1mV o aparecen nuevas ondas Q patognomónicas en al menos dos derivaciones contiguas, especialmente cuando se asocia con síntomas isquémicos durante 20min o más. La reelevación del segmento ST, no obstante, se puede observar también ante amenaza de rotura miocárdica, y debe motivar un examen diagnóstico adicional. La depresión del ST o el BRIHH por sí solos son hallazgos inespecíficos y no se debe utilizarlos para diagnosticar reinfarto.
Para los pacientes en quienes se sospecha reinfarto a partir de síntomas o signos clínicos tras un IM inicial, se recomienda determinar inmediatamente la cTn. Debe obtenerse una segunda muestra a las 3-6h. Si la concentración de cTn es elevada pero estable o en descenso al momento de sospecharse el reinfarto, el diagnóstico de este requiere un aumento≥20% del valor de cTn en la segunda muestra. Si la concentración inicial de cTn es normal, se aplican los criterios de nuevo IAM.
LESIÓN MIOCÁRDICA O INFARTO ASOCIADO A INSUFICIENCIA CARDIACAEn pacientes con síndrome de IC y según qué prueba se utilice, se puede hallar valores de cTn entre detectables y manifiestamente altos, indicativos de la lesión miocárdica con necrosis96. Utilizando tests de cTn de alta sensibilidad, en casi todos los pacientes con IC puede haber concentraciones de cTn mensurables, con un porcentaje significativo que supere el p99 del LRS, especialmente aquellos con síndrome de IC más grave, como una IC descompensada en fase aguda97.
Mientras que el IM tipo 1 es una causa importante de IC descompensada en fase aguda —y siempre debe considerarse en el contexto de la presentación aguda—, los valores de cTn elevados en un paciente con síndrome de IC por sí solos no establecen el diagnóstico de IM tipo 1 y, de hecho, es posible hallarlos en pacientes con IC no isquémica. Más allá del IM tipo 1, se han propuesto múltiples mecanismos para explicar las concentraciones de cTn entre mensurables y patológicamente elevadas en pacientes con IC96,97. Por ejemplo, el IM tipo 2 puede deberse a una mayor presión transmural, la obstrucción de pequeños vasos coronarios, disfunción endotelial, anemia o hipotensión. Además del IM de tipos 1 o 2, se ha demostrado experimentalmente apoptosis de los cardiomiocitos y autofagia debidas al estiramiento de la pared. La toxicidad celular directa secundaria a la inflamación, las neurohormonas circulantes, los procesos infiltrativos y tanto la miocarditis como la cardiomiopatía pueden aparecer con IC y una cifra anómala de cTn97. Aunque es prevalente y complica el diagnóstico de IM, la presencia, la magnitud y la persistencia de la elevación de cTn en la IC se acepta cada vez más como un factor independiente predictivo de resultados adversos tanto en el síndrome de IC aguda y crónica, independientemente del mecanismo y no se debe descartarlo como «falso positivo»97,98.
En el contexto de una IC que se presenta en descompensación aguda, siempre se debe determinar las cTn I o T inmediatamente y grabar un ECG con el objetivo de identificar o excluir el IM tipo 1 como el factor precipitante. En esta situación, se debe interpretar los valores de cTn elevados con un alto nivel de sospecha de IM tipo 1 en caso de observarse un aumento o descenso significativo del marcador o si se acompaña de síntomas isquémicos, nuevos cambios electrocardiográficos de isquemia o pérdida de la función miocárdica en las pruebas no invasivas. La anatomía de la arteria coronaria a menudo puede ser bien conocida; tal conocimiento se puede utilizar para interpretar los resultados de troponina anómalos. Si las arterias coronarias son normales, puede tratarse de un IM tipo 2 o un mecanismo no coronario de liberación de troponina97.
Por otro lado, cuando no se ha establecido la anatomía coronaria, reconocer un valor de cTn>p99 del LRS por sí solo no es suficiente para diagnosticar IAM debido a EAC ni permite identificar el mecanismo del valor de cTn anómalo. Así, se suele necesitar más datos como, por ejemplo, de estudios de perfusión miocárdica, angiografía coronaria o RM para entender mejor la causa de la determinación de cTn anómala. No obstante, puede ser difícil establecer la razón de las anomalías de cTn incluso después de esas exploraciones96,97.
APLICACIÓN DEL INFARTO DE MIOCARDIO EN LOS ENSAYOS CLÍNICOS Y PROGRAMAS DE GARANTÍA DE CALIDADEn los ensayos clínicos, el IM puede ser criterio de entrada o de resultado. Una definición universal de IM sería de gran beneficio para los estudios clínicos, puesto que permitiría un enfoque estandarizado para la interpretación y la comparación entre ensayos. La definición del IM como criterio de entrada (p. ej., «IM tipo 1» y «no IM tipo 2») determinará las características del paciente en el ensayo. En ocasiones se produce IM y la única explicación angiográfica es la reestenosis99–100. Este tipo de IM relacionado con la ICP puede denominarse «IM tipo 4c», definido como estenosis≥50% en la angiografía coronaria o una lesión compleja asociada a un aumento o descenso de los valores de cTn>p99 del LRS y ninguna otra EAC obstructiva significativa de mayor gravedad tras: a) despliegue inicialmente exitoso del stent, o b) dilatación de una estenosis de la arteria coronaria con angioplastia con balón (< 50%).
En estudios recientes se han empleado distintas definiciones del IM como criterio de resultado en el ensayo, lo que dificulta la comparación y la generalización entre ellos. La concordancia entre investigadores y autoridades reguladoras en lo que respecta a la definición de IM utilizada como resultado en estudios clínicos es de gran valor. La adaptación de la definición a un estudio clínico concreto puede ser adecuada en algunas circunstancias y debe tener un fundamento bien articulado. Por encima de todo, los investigadores deben garantizar que el ensayo ofrece datos exhaustivos de los distintos tipos de IM e incluye los límites de decisión del p99 del LRS de cTn u otros biomarcadores utilizados. Los múltiplos de los p99 del LRS pueden indicarse como se muestra en la tabla 6. Esto facilitará la comparación de los ensayos y metaanálisis.
Puesto que se puede utilizar distintos tests, como los más nuevos análisis de cTn de alta sensibilidad en ensayos clínicos multicéntricos a gran escala, es aconsejable aplicar de forma coherente el p99 del LRS. Esto no armonizará totalmente los valores de troponina en los distintos tests, pero mejorará la concordancia de los resultados. En los pacientes sometidos a procedimientos cardiacos, la incidencia de IM se puede utilizar como medida de calidad siempre que todos los centros que participen en el programa de garantía de la calidad apliquen una definición uniforme. Para ser eficaz y evitar sesgos, hay que elaborar para este tipo de evaluación un paradigma que armonice los distintos resultados de las pruebas de cTn en distintos sitios.
REPERCUSIONES POBLACIONALES DE ADAPTAR LA DEFINICIÓN DE INFARTO DE MIOCARDIOLa revisión de la definición de IM tiene una serie de repercusiones para los individuos y para la sociedad en su conjunto. Un diagnóstico provisional o final es la base para aconsejar al paciente sobre más pruebas diagnósticas, cambios en el estilo de vida, tratamiento y pronóstico. El grupo de pacientes con un diagnóstico particular es la base para establecer y planificar programas de asistencia sanitaria y asignar recursos.
Uno de los objetivos de la buena práctica clínica es alcanzar un diagnóstico definitivo y específico, respaldado por conocimientos científicos actuales. El enfoque de la definición del IM resumida en este documento alcanza este objetivo. En general, el significado conceptual del término IM no ha cambiado, aunque se han desarrollado nuevos métodos de diagnóstico sensibles para diagnosticarlo. De este modo, el diagnóstico de IAM es clínico y basado en los síntomas del paciente, los cambios del ECG y de marcadores bioquímicos muy sensibles, así como la información obtenida de varias técnicas de imagen. Es importante caracterizar el tipo de IM, así como el alcance del infarto, la función del VI residual y la gravedad de la EAC y otros factores de riesgo, en lugar de simplemente hacer el diagnóstico de IM. La información facilitada sobre el pronóstico del paciente y su capacidad para trabajar requiere más que la simple declaración de que el paciente ha sufrido un IM. Los distintos factores adicionales que se acaba de mencionar también son necesarios para tomar las decisiones sociales, familiares y laborales adecuadas. Se ha desarrollado una serie de escalas de riesgo para predecir el pronóstico tras un IM. La clasificación de las demás entidades pronósticas asociadas al IM debería llevar a que se reconsideren las entidades de codificación clínica actualmente utilizadas para los pacientes con el sinfín de trastornos que pueden resultar en necrosis miocárdica, con la consecuente elevación de los valores de biomarcadores.
Debería tenerse en cuenta que la modificación actual de la definición del IM puede conllevar consecuencias para los pacientes y sus familias en cuanto a estado psicológico, seguro de vida, carrera profesional, permisos de conducir y licencias de pilotos. El diagnóstico también conlleva implicaciones sociales respecto de la codificación relacionada con el diagnóstico, reembolsos hospitalarios, estadísticas de salud pública, bajas por enfermedad y certificados de discapacidad. Para superar este reto, los médicos deben estar adecuadamente informados de los criterios de diagnóstico modificados. Será necesario crear materiales educativos, y las guías de tratamiento deben adaptarse adecuadamente. Las sociedades profesionales y los planificadores sanitarios deben tomar medidas para facilitar la inmediata propagación de la definición revisada a médicos, otros profesionales sanitarios, administradores y población general.
PERSPECTIVAS GLOBALES DE LA DEFINICIÓN DE INFARTO DE MIOCARDIOLa enfermedad cardiovascular es un problema sanitario global. Comprender la carga y los efectos poblacionales de la EAC es de suma importancia. Cambiar los biomarcadores, los criterios y las definiciones clínicas añade retos a nuestra comprensión y nuestra capacidad para mejorar la salud de la población. Para los facultativos, la definición de IM tiene implicaciones terapéuticas inmediatas e importantes. Para los epidemiólogos, los datos suelen ser retrospectivos, por lo que una definición de casos homogénea es esencial para las comparaciones y los análisis de tendencias. Los estándares descritos en este informe son adecuados para los estudios de epidemiología. No obstante, para analizar las tendencias evolutivas es importante contar con definiciones coincidentes y cuantificar los ajustes cuando los biomarcadores u otros criterios diagnósticos cambien101. Por ejemplo, la determinación de cTn aumentó drásticamente el número de IM diagnosticables para los epidemiólogos3-102.
En los países con escasos recursos económicos, los biomarcadores cardiacos y las técnicas de imagen pueden no estar disponibles excepto en unos pocos centros, e incluso puede faltar la opción de grabar ECG. En estos entornos, la OMS indica que las pruebas con biomarcadores u otras pruebas diagnósticas de alto coste son inadecuadas para utilizarlas como criterio diagnóstico obligado3. La OMS recomienda usar la «Definición Universal de IM» de la ESC/ACCF/AHA/WHF en ámbitos sin escasez de recursos, pero recomienda estándares más flexibles en lugares con escasez de recursos3.
Los problemas culturales, financieros, estructurales y organizativos en los distintos países del mundo para el diagnóstico y el tratamiento del IAM requerirán constante estudio. Es esencial abordar la brecha entre los avances terapéuticos y de diagnóstico en este campo cada vez más amplio de la enfermedad cardiovascular.
AGRADECIMIENTOSEstamos muy agradecidos al personal del Departamento de Guías de Práctica Clínica de la ESC.
CONFLICTO DE INTERESESLos miembros del Grupo de Trabajo de la ESC, la ACCF, la AHA y la WHF han participado independientemente en la elaboración de este documento, basándose en su experiencia clínica y académica y aplicando un examen clínico y objetivo de toda la literatura disponible. La mayoría ha llevado y lleva a cabo su trabajo en colaboración con la industria y proveedores sanitarios privados y públicos (estudios de investigación, conferencias de formación, consultas), pero todos creen que tales actividades no han influido en su juicio. La mejor garantía de su independencia se encuentra en la calidad de su trabajo científico actual y pasado. No obstante, para garantizar la transparencia, sus relaciones con la industria y los proveedores sanitarios privados y públicos se muestran en la página web de la ESC (www.escardio.org/guidelines). Los gastos del Grupo de Trabajo/Comité de redacción y la elaboración de este documento corrieron a cargo, en su totalidad, de las sociedades anteriormente mencionadas.
El texto del CME (Continuing Medical Education) «Tercera definición universal del infarto de miocardio» está acreditado por el European Board for Accreditation in Cardiology (EBAC). El EBAC trabaja de acuerdo con los estándares de calidad del European Accreditation Council for Continuing Medical Education (EACCME), que es una institución de la European Union of Medical Specialists (UEMS). En cumplimiento de las guías del EBAC/EACCME, todos los autores que han participado en este programa han declarado cualquier conflicto de interés que pueda causar un sesgo en el artículo. El comité organizador es responsable de asegurar que todos los potenciales conflictos de interés relevantes al programa sean declarados a los participantes antes de las actividades del CME.
Las preguntas CME para este artículo están disponibles en: European Heart Journal (http://www.oxforde-learning.com/eurheartj) y la Sociedad Europea de Cardiologia (http://www.escardio.org/guidelines).