Durante muchos años, el ventrículo izquierdo ha sido el centro de atención e investigación en el campo cardiovascular, mientras quedaba en un segundo plano el ventrículo derecho. Sin embargo, el conocimiento de la disfunción del ventrículo derecho como el principal predictor pronóstico en la mayoría de las enfermedades cardiovasculares ha llevado a un creciente interés por una comprensión más detallada de la fisiología y la fisiopatología del ventrículo derecho, así como de su tratamiento. La función del ventrículo derecho puede verse afectada por numerosos mecanismos; uno de los principales es la sobrecarga de presión que ocurre en la hipertensión pulmonar, cuya causa más frecuente en nuestro medio son precisamente las enfermedades cardiacas izquierdas. Pero independientemente de la etiología de la hipertensión pulmonar, la función del ventrículo derecho determina el pronóstico de estos pacientes. Por analogía, muchas de las terapias utilizadas en insuficiencia cardiaca izquierda se emplean en la disfunción derecha, aunque sin evidencia consistente que respalde este uso. El presente artículo resume las bases fisiopatológicas del desarrollo de la insuficiencia cardiaca derecha, revisando la evidencia actual en el tratamiento de esta entidad donde el tratamiento de la congestión es esencial. Asimismo se analiza el papel de la modulación neurohormonal y, por último, se revisan las potenciales estrategias terapéuticas en desarrollo.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.
Palabras clave
El español Miguel Servet (Villanueva de Sigena, Aragón, 1511í1553), en su libro Christianismi Restitutio (1553), realizó la primera descripción detallada de la circulación pulmonar en Occidente, en contraposición a las teorías impuestas por Galeno (129-c. 201-216) siglos atrás. Más de 70 años después, el inglés William Harvey (1578í1657) publicó Exercitatio de motu cordis et sanguinis in animalibus, más conocido como De Motu Cordis. Considerado el padre de la fisiología moderna, demostró mediante experimentación la circulación pulmo-nar y a su vez deduciendo correctamente la recirculación de la sangre, al reconocer que ambos ventrículos están acoplados en serie1.
A pesar de estas descripciones iniciales, la investigación cardioívascular se ha centrado tradicionalmente en el ventrículo izquierdo (VI). De hecho, estudios experimentales de mitad del pasado siglo dudaban de la necesidad del ventrículo derecho (VD)2,3, considerando la insuficiencia cardiaca derecha (ICD) una complicación limitada a cardiopatías congénitas e hipertensión pulmonar (HP).
A principios de la década de los ochenta y con la introducción de nuevas técnicas de imagen, diferentes estudios profundizaron en el conocimiento de la fisiopatología del VD. Ahora sabemos que el VD puede disfuncionar por vías fisiopatológicas distintas del VI y a la vez desempeñar un papel central en el pronóstico de todo el espectro de la enfermedad cardiovascular.
Aspectos diferenciales del ventrículo derechoExisten notables diferencias en la embriología4, la anatomía5 y la fisiología de uno y otro ventrículo, aunque morfológica y funcionalímente están íntimamente vinculados.
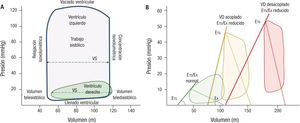
En condiciones normales, aunque los dos eyectan un mismo volu- men/latido, el trabajo desarrollado por el VD es una quinta parte del izquierdo, consecuencia de acoplarse a una circulación de baja resisítencia y elevada complianza. La baja presión a la que está sometida su cavidad determina menor tensión de pared y menor demanda de oxí- geno6. Evaluando las curvas presión-volumen se observa que la conítracción del VD tiene un aspecto trapezoidal, sin fases isovolumétri- cas sistodiastólicas bien definidas (figura 1A).
Representación esquemática de curvas de presión-volumen. A: comparación de las curvas de presión (P)-volumen (V) del ventrículo izquierdo (VI) y el ventrículo dereícho (VD) en condiciones hemodinámicas normales: curva rectangular del VI (azul) sobre la que se muestran las distintas fases del ciclo cardiaco, con las fases isovolumétricas de relajación y contracción, y curva trapezoidal del VD (verde) con ausencia de claras fases isovolumétricas; muestra un pico sistólico de menor presión que se produce antes del final de la eyección sistólica y con un mayor volumen estacionario. B: cambios en la relación presión-volumen en 3 estadios, situación hemodinámica normal (verde), hipertensión pulmonar (amarillo) y disfunción del VD (rojo); en las 2 primeras, la relación Ets/Ea se mantiene en límites normales, lo que indica un adecuado acoplamiento ventriculoarterial; en situación de disfunción del VD, el volumen está aumentado y la relación Ets/Ea está disminuida, lo que indica una situación de desacoplamiento; las líneas continuas reflejan la relación P-V telesistólica y su pendiente, la elastancia telesistólica del VD (Ets): a mayor pendiente, mayor elastancia; las líneas discontinuas representan elastancia arterial (Ea), medida como la pendiente de la línea recta que une la telesístole y la telediástole de la relación P-V (panel B, modificado con permiso de Journal of the American College of Cardioílogy). VS: volumen sistólico.
La insuficiencia del VD solo puede entenderse en relación con su carga o acoplamiento. Este término hace referencia a la medida de transferencia de energía ventriculoarterial resultado del cociente de la elastancia telesitólica (Ets) del VD y la elastancia arterial (Ea), ambas derivadas del análisis de las curvas presión-volumen7(figura 1B).
Definición y epidemiologíaLa ICD es un síndrome clínico, con signos y síntomas de IC, debido a una alteración estructural y/o funcional en cualquiera de los compoínentes que constituyen el sistema circulatorio cardiaco derecho, que determina un flujo sanguíneo pulmonar subóptimo y/o presiones venosas elevadas, en reposo o con el ejercicio. La disfunción del VD, en contraposición, es un componente (aunque mayor) de una entidad fisiopatológica que puede dar como resultado una ICD8. Es importante resaltar que las alteraciones estructurales y/o fisiopatológicas no se limitan al VD y que estas pueden permanecer quiescentes en reposo y solo manifestarse con el ejercicio.
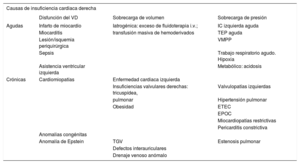
Etiología de la insuficiencia cardiaca derechaLas causas de ICD agudas o crónicas según su forma de presentaíción son variadas e incluyen miocardiopatías primarias, isquemia/infarto de miocardio, situaciones de sobrecarga de volumen asociadas con cardiopatías congénitas y/o valvulopatías y de sobrecarga de preísión por estenosis pulmonar o HP de diversas etiologías, incluida la secundaria a enfermedades del VI (tabla 1).
Etiología de la insuficiencia cardiaca derecha
| Causas de insuficiencia cardiaca derecha | |||
|---|---|---|---|
| Disfunción del VD | Sobrecarga de volumen | Sobrecarga de presión | |
| Agudas | Infarto de miocardio | Iatrogénica: exceso de fluidoterapia i.v.; | IC izquierda aguda |
| Miocarditis | transfusión masiva de hemoderivados | TEP aguda | |
| Lesión/isquemia periquirúrgica | VMPP | ||
| Sepsis | Trabajo respiratorio agudo. Hipoxia | ||
| Asistencia ventricular izquierda | Metabólico: acidosis | ||
| Crónicas | Cardiomiopatías | Enfermedad cardiaca izquierda | |
| Insuficiencias valvulares derechas: tricuspídea, | Valvulopatías izquierdas | ||
| pulmonar | Hipertensión pulmonar | ||
| Obesidad | ETEC | ||
| EPOC | |||
| Miocardiopatías restrictivas | |||
| Pericarditis constrictiva | |||
| Anomalias congénitas | |||
| Anomalía de Epstein | TGV | Estenosis pulmonar | |
| Defectos interauriculares | |||
| Drenaje venoso anómalo | |||
EPOC: enfermedad pulmonar obstructiva crónica; ETEC: enfermedad tromboembólica crónica; HAP: hipertensión arterial pulmonar; i.v.: intravenoso; IC: insuficiencia cardiaca; TEP: tromboembolia pulmonar; TGV: transposición de grandes vasos; VD: ventrículo derecho; VMPP: ventilación mecánica con presión positiva.
La HP, causa más frecuente de ICD, puede agruparse en 5 categorías que comparten manifestaciones clínicas y patológicas, así como opcioínes terapéuticas: hipertensión arterial pulmonar (HAP, grupo 1); HP secundaria a cardiopatías izquierdas (grupo 2); HP debidas a enfermeídades pulmonares crónicas/hipoxia (grupo 3); enfermedad pulmonar tromboembólica crónica (grupo 4), e HP de causas multifactoriales no aclaradas (grupo 5)9.
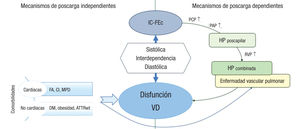
La HP del grupo 2 es con mucho la causa más prevalente en nuesítro medio10. Comparado con la HAP, los pacientes con HP por insufiíciencia cardiaca con fracción de eyección conservada (IC-FEc) presenítan un perfil clínico distinto, y son de más edad, mujeres, con historia de hipertensión arterial y en su mayoría obesos con síndrome meta- bólico11. La figura 2 resume de forma esquemática los mecanismos involucrados en el desarrollo de ICD en estos pacientes.
Esquema con los principales mecanismos propuestos de disfunción ventricular derecha. HP combinada hace referencia a hipertensión pulmonar precapilar y poscapilar combinada. ATTRwt: amiloidosis por transtirretina; CI: cardiopatía isquémica; DM: diabetes mellitus; FA: fibrilación auricular; HP: hipertensión pulmonar; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; MPD: marcapasos; PAP: presión arterial pulmonar; PCP: presión capilar pulmonar; RVP: resistencias vasculares pulmonares; VD: ventrículo derecho. Adaptado de Gorter et al.47.
La disfunción diastólica del VI y la pérdida de complianza auricular suponen una carga pulsátil en el lecho venoso pulmonar que condiíciona un aumento «pasivo» de la presión pulmonar. Este componente mecánico induce cambios de remodelado capilar y arterial con alteraíción de la integridad estructural y funcional vascular, desencadeínando mecanismos superpuestos que combinan deterioro en la reacítividad vascular y disfunción endotelial, con disminución de la disponibilidad de óxido nítrico y aumento de la expresión de la endo- telina-112. Una vez establecida la enfermedad vascular pulmonar, el incremento de la presión arterial pulmonar media (PAPm) ya no se justifica solo por la elevación de la presión capilar pulmonar (PCP)13.
Por lo tanto, el punto determinante será distinguir en qué fase de la enfermedad se encuentra el paciente: una fase inicial con un fenóímeno puramente pasivo o en un estado avanzado con enfermedad vascular establecida. En un intento por diferenciarlos se ha utilizado terminología muy variada. Estas definiciones poco claras han dejado paso progresivamente al término «HP desproporcionada». Aunque ampliamente extendida, no se sustenta en ningún criterio hemodiná-mico claro, y se asume que la HP se desarrolla de manera «desproporícionada» para una PCP elevada, pero dada la confusión que puede causar este término, se recomienda no utilizarlo11.
Recientemente se ha propuesto una nueva definición de HP para el grupo 2 (6.° Simposio Internacional de Hipertensión Pulmonar de 2018), reintroduciéndose la resistencia vascular pulmonar (RVP) como reflejo indirecto de la función del VD, así como por su valor proínóstico: a) HP poscapilar aislada: PAPm 3 20 mmHg, PCP > 15 mmHg y RVP < 3,0 UW, y b) HP combinada precapilar y poscapilar: PCP > 15 mmHg, PAPm 3 20 mmHg y RVP 3 3 UW14.
Se debe tener presente que, en pacientes con diagnóstico de IC-FEc e HP combinada, es posible objetivar normalizaciones de la PCP en
reposo, pero con persistencia de remodelado vascular. En este fenoítipo se incluye a pacientes con tratamiento diurético óptimo, en fibri- lación auricular y tras corrección de enfermedad valvular11. En estos casos, un aumento de la PCP puede quedar de manifiesto con el ejerícicio o sobrecarga hídrica9.
Ambos ventrículos están conectados en serie, pero también se interrelacionan en paralelo. Al compartir fibras musculares y el septo interventricular, cerca de un 30% del rendimiento del VD puede ser atribuido al VI. Esta contribución queda abolida en la estimulación por marcapasos del VD. Por otro lado, un 30-40% de la presión diastó- lica del VI está relacionada con fuerzas extrínsecas, como la presión del VD y la restricción del pericardio. Incluso ligeros aumentos en la PP conducen a un desplazamiento septal izquierdo con empeoraímiento de la complianza diastólica del VI. Estas interacciones pueden modular considerablemente la función del VD tanto en sístole como en diástole15.
Los pacientes con IC-FEc presentan una elevada prevalencia de enfermedad coronaria y, al igual que ocurre con la IC con fracción de eyección reducida (IC-FEr), se asocia con mayor deterioro de la funíción del VD16. Además, se ha documentado una reducción en la reserva miocárdica de flujo del VI en pacientes sin enfermedad coroínaria epicárdica independientemente de otros factores de riesgo17. La disfunción microvascular coronaria en estos pacientes podría ser un estadio precoz en la patogénesis de la IC-FEc, con igual repercusión en ambos ventrículos.
Diversas comorbilidades como hipertensión arterial, diabetes, enfermedades pulmonares, enfermedad renal crónica y la obesidad, tienen un impacto negativo a través de distintas vías sistémicas, como la inflamación y la disfunción endotelial. Aunque su estudio en IC-FEc se ha centrado tradicionalmente en el VI, es plausible considerar una afección conjunta del VD, con remodelado y disfunción de este.
Es de interés resaltar que la obesidad se ha relacionado con mayor grado de remodelado del VD y disfunción vascular pulmonar durante el ejercicio y que el mecanismo de interdependencia ventricular está aumentado en pacientes obesos con IC-FEc. La dilatación y disfunción del VD en la obesidad podrían estar relacionadas con un exceso de volumen circulante18.
EpidemiologíaLa disfunción del VD es un potente predictor de eventos en HAP, enfermedades pulmonares y enfermedades cardiacas izquierdas, incluida la IC-FEc. En esta, la asociación de disfunción del VD e HP multiplica por 7 el riesgo de muerte19.
La prevalencia de disfunción del VD e HP en la IC-FEc es muy variaíble y depende de la selección de pacientes incluidos, los criterios diagnósticos de IC-FEc, la definición de disfunción del VD y el punto de corte establecido, así como del método ecocardiográfico empleado. En el metanálisis de Gorter et al. que incluyó 34 estudios con 4.835 pacientes, se observó una amplia variabilidad en la prevalencia de disfunción del VD: el 31,2% (intervalo, 26-49%) para un TAPSE < 16 mm y del 12,7% (4-33%) para un acortamiento fraccional del área del VD < 35%20.
Aunque no se conocen bien los motivos específicos de muerte en la IC-FEc, la cardiovascular es la más frecuente, igualmente con imporítante variabilidad en las cifras según provengan de ensayos clínicos (60-70%) o de estudios epidemiológicos (50-60%). La mayoría se relaícionan con el progresivo desarrollo de HP, disfunción del VD y congesítión venosa que aboca al fallo multiorgánico21.
Tratamiento de la insuficiencia cardiaca derecha. descompensación agudaEn esta situación, el tratamiento debe orientarse a estabilizar al paciente aliviando la congestión (precarga), asegurar presiones de perfusión adecuadas, mejorar la contractilidad miocárdica y reducir la poscarga del VD.
Considerar que la ICD aguda es una situación dependiente de preícarga que requiere de volumen es demasiado simplista. Aunque podría ser razonable administrar un bolo de sueroterapia intravenosa (i.v.) en pacientes hipotensos, se debe tener presente que el exceso de volumen puede conducir a un mayor deterioro clínico, debido a dos factores fundamentalmente: a) disminución del gasto cardiaco (GC) derecho secundario a dilatación del VD con incremento de la insufiíciencia tricuspídea y la poscarga, con un aumento secundario de la tensión de la pared e isquemia asociada, y b) deterioro del llenado del VI, por interdependencia ventricular, que agrava la reducción del GC. En pacientes con ICD aguda secundaria a infarto agudo de miocardio, la sobrecarga de volumen no mejora el índice cardiaco, y produce aumentos significativos de PCP y presión media auricular izquierda22.
Tratamiento de la congestiónLa evaluación clínica de la volemia es fundamental en el trataímiento inicial de la ICD aguda. La monitorización hemodinámica puede ser de gran ayuda en caso de inestabilidad hemodinámica, si existen dudas sobre el grado de volemia o empeora la función renal con el tratamiento diurético23. En caso de presiones venosas centrales > 8-12 mmHg, el paciente se beneficiará de una descongestión más intensa hasta conseguir condiciones de carga intraventricular más favorables.
Una pieza clave son los diuréticos del asa. Estos presentan pronuníciadas curvas dosis-respuesta y alcanzan su umbral terapéutico a las dosis habitualmente utilizadas, lo que indica que el aumento de dosis por encima de este umbral no incrementará el efecto. Tras infusión i.v. de furosemida, el efecto natriurético se concentra en las primeras 2 h, por lo que dosis más altas producirán natriuresis adicional al manteíner la concentración por encima del umbral por periodos más largos. La curva dosis-respuesta está desplazada a la derecha en la ICD aguda y en la enfermedad renal crónica, lo cual indica una reducción en la natriuresis máxima conseguida que necesitará mayores dosis para conseguir el mismo efecto.
El inicio precoz del tratamiento diurético en pacientes con IC aguda se ha relacionado con una menor mortalidad hospitalaria24. De inicio, se recomienda administrar 20-40 mg de furosemida i.v. (consiíderar mayores dosis en enfermedad renal) o 1-2 veces la dosis oral total si el paciente ya tomaba diuréticos, con una evaluación precoz de la diuresis conseguida para identificar a los pacientes con escasa respuesta a ellos. En este caso y dada la seguridad de la administraíción de dosis altas de furosemida demostrada en el estudio DOSE- HF25, se prefiere intensificar la dosis antes de añadir este segundo fármaco.
Si el efecto es insuficiente (sodio en orina a las 2 h < 50-70 mEq/l o volumen de diuresis < 100-150 ml/h en las primeras 6 h), se puede doblar la dosis inicial y revaluar la respuesta a las 6 h. De esta forma se puede incrementar la dosis hasta alcanzar la máxima recomendada (furosemida 400-600 mg/24 h)26. El estudio DOSE-AHF no encontró diferencias entre la administración de furosemida en bolo respecto a infusión continua25. Es importante señalar que las infusiones contiínuas no se precedieron sistemáticamente de dosis de carga y que las dosis medias empleadas fueron más bajas de lo recomendado. Un reciente metanálisis ha mostrado que la infusión continua se asocia con una mayor reducción de peso, sin diferencias en cuanto a eventos adversos, comparada con la administración en bolos27. En conextos clínicos específicos, como la resistencia a diuréticos, el síndrome car- diorrenal y la ICD grave, la infusión continua se asocia con una mejor descongestión sin mayor incidencia de disfunción renal28.
Cuando a pesar de dosis máximas no se alcanza una diuresis óptima para conseguir la descongestión, se habla de resistencia a diuíréticos. Como los diuréticos del asa son el principal tratamiento diurético en la IC, el término resistencia a diuréticos es a menudo intercambiable. Esta situación es frecuente y se asocia con mayor morbimortalidad, cuyos factores relacionados son la congestión venosa renal y el daño renal agudo, la hipotensión arterial y el GC reducido29.
El tratamiento combinado diurético persigue el bloqueo secuen- cial de la nefrona mediante la adición progresiva de diuréticos con diferentes mecanismos de acción.
Las tiacidas actúan en el túbulo contorneado distal sobre los cotransportadores de sodio-cloro, lo que podría ayudar a superar el «fenómeno de frenada» o incremento en la reabsorción distal del sodio que se produce con el uso crónico de diuréticos del asa, por lo que serían especialmente útiles en estos pacientes. Este aumento de la natriuresis se produce incluso en enfermedad renal avanzada30. Aunque ampliamente utilizados, su evidencia científica es muy escasa. Con frecuencia inducen alteraciones hidroelectrolíticas, espeícialmente hipopotasemia, que es más pronunciada en estados de hiperaldosteronismo secundario como la IC.
Los inhibidores del receptor de mineralocorticoides a dosis no diuíréticas son uno de los pilares del tratamiento de pacientes con IC-FEr. Sin embargo, en el estudio ATHENA-HF las dosis diuréticas (100 mg) no aumentaron la diuresis tras 96 h de tratamiento, comparadas con dosis bajas (25 mg), aunque fueron seguras sin aumentar el riesgo de hiperpotasemia ni de insuficiencia renal31. Este efecto neutro podría justificarse por el retraso en el inicio de acción de la espironolactona (48-72 h).
La acetazolamida, inhibidor de la anhidrasa carbónica en el túbulo proximal, resulta especialmente útil en la alcalosis metabólica hipo- clorémica resultado del tratamiento agresivo con diuréticos del asa y tiacidas. Recientemente el estudio DIURESIS-CHF ha demostrado que la adición de acetazolamida en pacientes con IC aguda en riesgo de desarrollar resistencia diurética aumenta la respuesta natriurética especialmente en los pacientes con cifras basales de creatinina más altas32.
Se han ensayado diferentes estrategias farmacológicas en la resisítencia a diuréticos, como el empleo de bajas dosis de dopamina (2 pg/kg/min) o de nesiritida (0,005 pg/kg/min), con resultados des- alentadores33.
La administración simultánea de altas dosis de diuréticos del asa y suero salino hipertónico en bolos de pequeño volumen (100-150 ml) con diferentes concentraciones según la concentración sérica de sodio del paciente, podría promover una mayor natriuresis y mejorar la disfunción renal, aunque se requieren ensayos clínicos más robusítos que confirmen esta pauta34.
El daño renal agudo es un potencial efecto secundario del trataímiento diurético, que complica la asistencia a estos pacientes. Es práctica habitual la administración concomitante de fluidos i.v. a pacientes con IC congestiva tratados con diuréticos, con la idea de contrarrestar los posibles efectos deletéreos de una depleción intensa. Sin embargo, la administración de fluidos (p. ej., 1.000-1.500 ml/24 h) se ha relacionado con aumento de los síntomas congestivos y mayor riesgo de ingreso en unidades de cuidados intensivos, intubación, diáílisis y mortalidad35.
En caso de fracaso del tratamiento diurético, se pueden considerar técnicas de reemplazo renal como la ultrafiltración lenta continua o la hemofiltración venovenosa, con la precaución de que el ritmo de extracción de agua no supere la capacidad de difusión entre los espaícios extravascular e intravascular, lo que podría desencadenar o agravar el daño renal agudo. Evaluadas con resultados dispares en IC aguda izquierda, estas técnicas no se han estudiado en pacientes con ICD.
Terapias vasoactivasCon el objetivo de reducir la poscarga, no hay que olvidarse de corregir causas reversibles del aumento de las RVP, como la hipoxia y la acidosis.
Los vasodilatadores no selectivos, como el nitroprusiato i.v., consiíguen importantes mejorías hemodinámicas disminuyendo tanto las RVP como las sistémicas, lo que facilita la descongestión de ambas circulaciones36. En pacientes seleccionados, pueden ser una opción los vasodilatadores específicos pulmonares como el epoprostenol y el óxido nítrico.
Los inodilatadores (dobutamina, milrinona, levosimendán) tienen propiedades inotrópicas y vasodilatadoras: incrementan la contractiílidad y el GC con reducciones de volumen y presiones telediastólicas del VD. A su vez pueden inducir hipotensión, la cual es más frecuente si la precarga del VI está reducida. En este caso se recomienda añadir un vasopresor a la dosis mínima posible.
El levosimendán mejora la contractilidad del miocardio al sensibiílizar la troponina C de las fibras miocárdicas al calcio, con un efecto vasodilatador y cardioprotector mediado por la apertura de canales del potasio sensibles a adenosina trifosfato en la fibra muscular lisa y en la mitocondria37. Sus efectos hemodinámicos hacen del levosimen- dán un fármaco atractivo en la ICD, especialmente en la asociada con HP, que facilita el acoplamiento ventriculoarterial al aumentar el GC y reducir la PP y la PCP38.
Los vasopresores pueden ser necesarios para mantener una adeícuada presión de perfusión. La noradrenalina puede mejorar la preísión sistémica y la perfusión coronaria sin cambios en las RVP. La vasopresina es un vasoconstrictor puro que a bajas dosis tiene efecto vasodilatador coronario y pulmonar, así como efectos beneficiosos en el filtrado glomerular por vasoconstricción selectiva de la arteriola eferente. Sin embargo, no existen datos de su utilidad en ICD aguda39.
Si a pesar de los vasoconstrictores persiste una situación de inestaíbilidad hemodinámica, se debe considerar la asistencia mecánica car- diaca23.
Tratamiento de la insuficiencia cardiaca derecha crónicaLos pacientes con ICD frecuentemente requieren dosis de diurétiícos más altas por mayores activación neurohormonal y retención de sodio y líquido. Sin embargo, la dosis diurética debe ser dinámica y a la dosis mínima necesaria para mantener el estado euvolémico. En pacientes sin congestión, los diuréticos pueden inducir hipotensión sintomática y deterioro de la función renal. Tras una descompensaíción aguda, si el paciente estaba previamente con furosemida, se puede plantear el cambio a torasemida por su mayor biodisponibili- dad y absorción más predecible.
La restricción de sodio (< 3 g/día) y líquidos (1,5-2,0 l/día), espeícialmente en congestión refractaria con hiponatremia asociada, se consideran medidas razonables, aunque no existen estudios específiícos en estos pacientes que avalen estas recomendaciones23. Los pacientes obesos, especialmente ancianos con IC-FEc, se benefician de dietas hipocalóricas y programas de ejercicio aeróbico40.
Modulación neurohormonalLa activación neurohormonal es el principal mecanismo en el desarrollo y la progresión del proceso de remodelado del VI, y sus antagonistas son el pilar del tratamiento actual de la IC-FEr. De la misma manera, la ICD se asocia con activación neurohormonal, y la progresión de esta puede ser independiente de las RVP. Parece lógico que se deba tratar a los pacientes con disfunción biventricular según la vigente guía de IC-FEr. Sin embargo, a pesar del creciente conociímiento del papel de la activación neurohormonal en la patogenia de la ICD asociada con HP, existe escasa evidencia de la utilidad de estas técnicas en el tratamiento de la ICD.
Bloqueadores betaAunque se ha demostrado que reducen el riesgo de hospitalización y muerte en pacientes con IC-FEr, su papel en la ICD es cuestionable.
En pacientes con HAP, especialmente con disfunción grave del VD, el GC es muy dependiente de los cambios en la frecuencia cardiaca, por lo que en esta situación la recomendación actual es evitarlos salvo que sean necesarios por otras comorbilidades9. Esta recomendación se basa en comunicaciones sobre el efecto inotrópico y cronotrópico negativo, con resultado de hipotensión y disminución de la capacidad de ejercicio en pacientes con hipertensión portopulmonar tratados con propranolol y atenolol41. Sin embargo, la utilización de bloquea- dores beta (BB) en esta situación no es inusual y diferentes registros muestran que hasta un 25% de los pacientes con HAP y comorbilida- des asociadas reciben BB42, y señalan que una dosificación cuidadosa permite que se toleren sin que conlleve un peor pronóstico43. Igual que nunca se ha demostrado efecto beneficioso en cuanto a mortalidad con propranolol y atenolol en IC-FEr, no está claro que los efectos deletéreos comunicados puedan aplicarse a todos los BB. Recuérdese que en este grupo farmacológico existen importantes diferencias en términos de afinidad y selectividad de los receptores betaadrenérgi- cos, algunos con capacidad de bloqueo dual (alfa y beta), así como en su efecto antioxidativo y antiinflamatorio.
Los pacientes con HAP presentan una sobreactivación del sistema simpático que se relaciona con una mayor mortalidad44. Diferentes estudios clínicos unicéntricos de escasos pacientes han evaluado el impacto de los BB en la HP, con resultados contradictorios en térmiínos de mejoría de la fracción de eyección del VD, el índice cardiaco y los efectos en la capacidad de ejercicio45. El tipo y la dosis de BB y las diferencias en el perfil clínico de los pacientes podrían explicar estos resultados dispares de la literatura.
En pacientes con IC-FEc, la utilización de BB también está en discuísión, aunque datos de registros observacionales indican que podrían ser beneficiosos46.
Moduladores del sistema renina-angiotensina-aldosteronaComo en el caso de los BB, la experiencia con los moduladores del sistema renina-angiotensina-aldosterona (SRAA) en HP e ICD es escasa y su utilización continúa siendo controvertida. En ICD, preoícupa la posibilidad de inducir hipotensión sistémica como efecto adverso a pacientes predispuestos a eventos sincopales por tener ya un GC deteriorado.
Numerosos ensayos clínicos han investigado la inhibición del SRAA en la IC-FEc sin demostrar claros beneficios, por lo que no se recomienídan salvo por comorbilidad47. Sin embargo, datos observacionales indiícan que estos fármacos podrían ser beneficiosos en la IC-FEc48.
En pacientes con HAP, los antagonistas del receptor de mineralo- corticoides (ARM) son de utilidad en situaciones de congestión. Por otro lado, la combinación de ARM con tratamientos específicos (ambrisentán) parece que mejora la clase funcional, la capacidad de ejercicio y las concentraciones de NT-proBNP, como se desprende del análisis retrospectivo de los estudios ARIES-1 y ARIES-249. En la IC-FEc, el estudio TOPCAT evaluó el papel de la espironolactona, pero no demostró reducciones en la mortalidad cadiovascular, la muerte súbita recuperada o la hospitalización por IC50.
Del sacubitrilo-valsartán (SV), inhibidor dual de los receptores de la angiotensina II y la neprilisina, se ha demostrado que mejora signiíficativamente el pronóstico de los pacientes con IC-FEr51. Estudios iniíciales indican un papel relevante en la HP con ICD. Así, en un pequeño estudio retrospectivo en pacientes con cardiopatías congénitas del adulto e ICD, el SV se toleró bien y se asoció con mejoría en la clase funcional, especialmente en aquellos con HP52. Más recientemente un estudio experimental en ratas con HP e ICD ha mostrado que el SV reduce la presión sistólica y la hipertrofia y la dilatación del VD, efecítos aparentemente relacionados con cambios en la vasculatura pul- monar53.
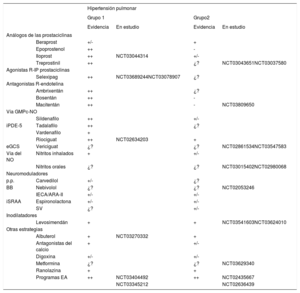
Tratamiento de la poscarga. vasodilatadores pulmonares específicosEl tratamiento específico de la HAP (tabla 2) ha evolucionado proígresivamente, aumentando su complejidad y la evidencia de su eficaícia. Los tratamientos dirigidos a reducir la poscarga del VD mediante vasodilatación específica pulmonar tienen un papel relevante, dada la sensibilidad del VD a los cambios en la poscarga, donde pequeños incrementos en la PAP se traducen en importantes reducciones en el VS. Se debe resaltar que estos fármacos tienen escaso efecto especíífico en el corazón.
Tratamiento farmacológico de la hipertensión pulmonar (HP)
| Hipertensión pulmonar | |||||
|---|---|---|---|---|---|
| Grupo 1 | Grupo2 | ||||
| Evidencia | En estudio | Evidencia | En estudio | ||
| Análogos de las prostaciclinas | |||||
| Beraprost | +/- | + | |||
| Epoprostenol | ++ | - | |||
| Iloprost | ++ | NCT03044314 | +/- | ||
| Treprostinil | ++ | ¿? | NCT03043651NCT03037580 | ||
| Agonistas R-IP prostaciclinas | |||||
| Selexipag | ++ | NCT03689244NCT03078907 | ¿? | ||
| Antagonistas R-endotelina | |||||
| Ambrixentán | ++ | ¿? | |||
| Bosentán | ++ | - | |||
| Macitentán | ++ | - | NCT03809650 | ||
| Vía GMPc-NO | |||||
| Sildenafilo | ++ | +/- | |||
| iPDE-5 | Tadalafilo | ++ | ¿? | ||
| Vardenafilo | + | ||||
| Riociguat | ++ | NCT02634203 | + | ||
| eGCS | Vericiguat | ¿? | ¿? | NCT02861534NCT03547583 | |
| Vía del NO | Nitritos inhalados | + | +/- | ||
| Nitritos orales | ¿? | ¿? | NCT03015402NCT02980068 | ||
| Neuromoduladores | |||||
| p.p. | Carvedilol | +/- | ¿? | ||
| BB | Nebivolol | ¿? | ¿? | NCT02053246 | |
| IECA/ARA-II | +/- | +/- | |||
| iSRAA | Espironolactona | +/- | +/- | ||
| SV | ¿? | +/- | |||
| Inodilatadores | |||||
| Levosimendán | + | + | NCT03541603NCT03624010 | ||
| Otras estrategias | |||||
| Albuterol | + | NCT03270332 | + | ||
| Antagonistas del calcio | + | +/- | |||
| Digoxina | +/- | +/- | |||
| Metformina | ¿? | ¿? | NCT03629340 | ||
| Ranolazina | + | + | |||
| Programas EA | ++ | NCT03404492 | ++ | NCT02435667 | |
| NCT03345212 | NCT02636439 | ||||
ARA-II: antagonistas del receptor de la angiotensina II; BB: bloqueadores beta; EA: ejercicio aeróbico; eGCS: estimuladores de la guanilato ciclasa soluble; GMPc: guanosina monofosfato cíclico; IECA: inhibidores de la enzima de conversión de la angiotensina; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; NO: óxido nítrico; SV: sacubitrilo-valsartán. Se diferencian los tratamientos aceptados para la HP del grupo 1 y los tratamientos ensayados para la HP del grupo 2, según la evidencia: (++) efecto beneficioso demostrado; (+) efecto beneficioso no bien establecido; (+/-) efecto neutro; (-) efecto deletereo; (?) efecto desconocido. Adaptado de Galié et al.9 y Gorter et al.47.
Están aprobados para el tratamiento de la HP de los grupos 1 y 4, donde se han demostrado mejorías sintomáticas, hemodinámicas y en el pronóstico de estos pacientes9, aunque no así para el resto de grupos de la clasificación de HP, incluida la HP del grupo 2.
Análogos de la prostaciclinaLa prostaciclina, producida por las células endoteliales, induce una potente vasodilatación en todos los lechos vasculares. Además, asocia actividad antiagregante con efectos citoprotectores y antiproliferati- vos.
Aunque se consideran primera línea de tratamiento de la HAP avanzada9, la evidencia actual desaconseja su utilización en HP del grupo 2. El estudio FIRST, en pacientes con IC-FEr avanzada, mostró un aumento de la mortalidad a pesar de mejorías en parámetros hemodinámicos como el índice cardiaco y la PCP54. Actualmente no hay datos con iloprost o treprostinil respecto a su beneficio en IC-FEc.
El beraprost fue el primer análogo oral de las prostaciclinas. En HAP mostró mejoría en la capacidad de ejercicio a 3-6 meses, pero sin mejoría hemodinámica ni beneficios a largo plazo9. En un estudio piloto prospectivo, Wang et al. evaluaron el beraprost en 25 pacientes con IC-FEc e HP asociada, y describen una reducción en la PAP sistó- lica y un aumento de la capacidad de ejercicio al año de iniciado el tratamiento55.
Vía de la endotelinaSe ha especulado sobre el papel de la endotelina-1 en la IC-FEc y el desarrollo de HP secundaria, contribuyendo en la disfunción endote- lial, alteración de la relajación y fibrosis miocárdica. Además, pacienítes estables con IC-FEc presentan cifras de endotelina-1 más altas47. Sin embargo, el bloqueo del receptor de endotelina en estos pacientes no aporta efectos beneficiosos e incluso podría ser deletéreo56. El estudio MELODY-1 evaluó específicamente el papel del macitentán en pacientes con HP combinada por enfermedad cardiaca izquierda. Tras 12 semanas de tratamiento, el macitentán no redujo las RVP, la PCP ni ningún otro parámetro exploratorio, aunque se asoció con mayor retención hídrica, especialmente en el primer mes57.
Vía de la guanosina monofosfato cíclico-guanilato ciclasa soluble-óxido nítricoEl guanosina monofosfato cíclico (GMPc) y su diana, la proteinci- nasa G (PKG) tienen efecto vasodilatador de la musculatura lisa con incremento del flujo sanguíneo. Los inhibidores de la fosfodiesterasa 5 (iPDE5) previenen la degradación de GMPc incrementando el efecto vasodilatador mediado por óxido nítrico (NO) endógeno tanto pulmoínar como sistémico.
El sildenafilo, un iPDE5 ampliamente utilizado en HAP, se ha evaíluado en la IC-FEc con resultados contradictorios. Guazzi et al. mosítraron marcadas mejorías hemodinámicas en pacientes con IC-FEc con dilatación grave y disfunción derecha58. Sin embargo, en el estuídio multicéntrico RELAX no se observó mejoría clínica ni en la capaciídad de ejercicio59. En la IC-FEc con HP predominantemente poscapiílar, Hoendermis et al. no encontraron mejoría hemodinámica con sildenafilo60. Está por evaluar si una adecuada selección de pacientes, con HP combinada, permitiría identificar a los que podrían benefiíciarse del tratamiento con sildenafilo.
Tras corrección exitosa de valvulopatía, con persistencia de HP, el tratamiento con sildenafilo debe evitarse, según los resultados del estudio SIOVAC, al asociarse con mayor tasa de eventos adversos61.
Riociguat, estimulador de la guanilato ciclasa soluble (eGCS), induce vasodilatación y posee propiedades antifibróticas, antiprolife- rativas y antiinflamatorias. Sus efectos hemodinámicos se han evaíluado en pacientes con IC-FEc e HP en un pequeño ensayo clínico de fase 2a. Pese a no cambiar de manera significativa la PAP media, se observaron efectos hemodinámicos favorables: aumento de VS e índice cardiaco con disminución significativa de la presión arterial sistólica, la resistencia vascular sistémica y el área diastólica final del VD, sin cambios en la PCP ni en las RVP62.
En otro ensayo clínico fase 2b, se evaluó la tolerabilidad y las dosis óptimas del eGCS vericiguat en pacientes con IC-FEc. Aunque no modificó las cifras de péptido natriurético y el volumen auricular izquierdo a las 12 semanas en comparación con el placebo, se asoció con una mejora en la calidad de vida63. Actualmente están en marcha diferentes ensayos clínicos de fase 3 con vericiguat para establecer la eficacia y la seguridad de este tratamiento.
Datos de ensayos clínicos y registros poblacionales han mostrado la ausencia de beneficio de los nitratos convencionales en el trataí
miento de la IC-FEc. Por el contrario, la administración de nitritos inorgánicos puede representar un tratamiento prometedor en estos pacientes. Estos aniones funcionan como reservorio para la producíción de NO en circunstancias de hipoxia, y pueden ser reducidos a NO por diferentes proteínas (p. ej., hemoglobina y mioglobina) en una reacción que se incrementa en situaciones de hipoxia o acidosis venosa, como ocurre durante el ejercicio47. La administración de nitriítos por diferentes vías, i.v. e inhalada, ha mostrado que reduce las preísiones pulmonares y las presiones de llenado biventriculares, basales
y con más intensidad durante el ejercicio64‘65. Sin embargo, en el ensayo clínico multicéntrico INDIE-HFpEF no mostró mejoría en la capacidad de ejercicio tras 12 semanas de administración de nitritos inorgánicos inhalados en pacientes con IC-FEc66.
Consideraciones finales y conclusionesLa ICD presenta una elevada prevalencia y se asocia con un peor pronóstico en la mayoría de las enfermedades cardiovasculares. Sin embargo, muchos de los conceptos básicos de la disfunción del VD conítinúan siendo malinterpretados, con el impacto que puede tener en la atención a estos pacientes, que continúa siendo subóptima. Por este motivo, es esencial seguir mejorando en el conocimiento de su fisiopa- tología, esclareciendo los mecanismos subyacentes al remodelado y la disfunción del VD, para poder desarrollar terapias específicas que mejoren la morbilidad y la mortalidad de esta entidad. Numerosos estudios en IC-FEc no han conseguido demostrar beneficio con diferenítes fármacos, algunos de los cuales han mostrado que mejoran parámeítros del VD tanto experimentales como en el contexto de HAP. Sería recomendable investigar si estos tratamientos pudieran tener efecto en la IC-FEc de pacientes seleccionados. La introducción de criterios de valoración de ICD estandarizados, que permitan distinguir la etiología de la ICD a través de biomarcadores o índices hemodinámicos, ayudará a un mejor enfoque terapéutico, así como el diseño de estudios prosípectivos para nuevos tratamientos. Defendemos un mayor enfoque de la IC en el lado derecho del corazón, que a menudo se descuida.
El VD también existe.
Conflicto de interesesNo se declara ninguno.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.