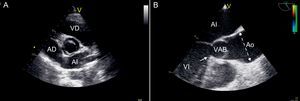
La válvula aórtica bicúspide (VAB) es la anomalía cardiaca congénita más común, con una incidencia de un 0,5-1,4% de la población. De forma esporádica, esta anomalía se transmite genéticamente según un patrón de herencia autosómico dominante, con un predominio en varones de 3:11. La VAB es una entidad clínicamente relevante, no sólo por las complicaciones relacionadas con la válvula (disfunción valvular, endocarditis infecciosa), sino también por su asociación con muchas anomalías vasculares como la dilatación aórtica2 (Figura 1).
Figura 1. Ecocardiograma de la válvula áortica biscúspide. A: ecocardiograma transtorácico en proyección paraesternal de eje corto de una válvula aórtica bicúspide de configuración anteroposterior. B: proyección en eje largo transesofágico que muestra la apertura sistólica anormal (doming) de una válvula aórtica biscúspide; se evidencia dilatación aórtica, que se inicia por encima de la unión sinotubular y alcanza su diámetro máximo en la porción media de la aorta ascendente tubular (línea de puntos), y estenosis subaórtica con un rodete fibroso a nivel de la porción septal del tracto de salida del ventrículo izquierdo (flecha). AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; VAB: válvula aórtica bicúspide; VD: ventrículo derecho; VI: ventrículo izquierdo.
La prevalencia registrada de dilatación aórtica asociada a VAB oscila entre el 33 y el 80%. Esta variación se atribuye a diferencias en los umbrales utilizados para definir la dilatación, los valores normales para edad y superficie corporal y la región de aorta analizada. Se han descrito diferentes tipos de aneurisma aórtico en función de la región afectada3, y la dilatación de la aorta ascendente media (dilatación aislada de la porción tubular de la aorta ascendente)4 es el patrón observado más frecuentemente. Se ha relacionado la edad y la morfología valvular con las dimensiones de la aorta ascendente (AoAsc), aunque el papel de la morfología no está claramente definido5, 6.
FisiopatologíaLa patogenia de la dilatación aórtica en pacientes con VAB mantiene una continua controversia entre dos teorías. Una de ellas defiende que la dilatación de la AoAsc podría ser consecuencia de la turbulencia del flujo sanguíneo, y que este efecto hemodinámico principal actuaría desde la vida fetal y resultaría en diferentes grados de degeneración aórtica inducida por estrés. Aunque esta hipótesis tiene la ventaja de contar con una simplicidad relativa, algunos estudios señalan que las alteraciones hemodinámicas por sí solas no serían la única causa de la dilatación aórtica en estos pacientes7. La segunda teoría sostiene como hipótesis la presencia de un defecto congénito inherente a la estructura aórtica. La asociación entre la estructura de los velos y la enfermedad de la AoAsc podría explicarse por patrones de desarrollo anormal de las células de la cresta neural, con anomalías estructurales que ocurrirían a nivel celular, y con independencia de la hemodinámica8. Esta teoría ha ido ganando popularidad en la última década y ha propiciado recomendaciones más agresivas en el tratamiento de la aorta proximal. Hay datos que respaldan la teoría predominante de la alteración congénita de la pared:
• En los pacientes con VAB normofuncionante (incluidos los niños), se ha observado un importante crecimiento de la aorta proximal en comparación con controles ajustados por edad. No obstante, una VAB «normofuncionante» es intrínsecamente estenótica, con un flujo no axial y turbulento aun en ausencia de gradiente de presión transvalvular. Este flujo es altamente excéntrico y origina patrones de flujo helicoidal anormales en la aorta proximal9. Estos patrones hemodinámicos anormales actúan durante largos periodos y pueden causar lesiones inducidas por estrés de manera asimétrica en la pared aórtica, con la posterior dilatación de los segmentos aórticos específicos.
• Se ha demostrado que los pacientes con VAB tienen una raíz aórtica y unos diámetros de AoAsc mayores que los pacientes con válvula aórtica tricúspide (VAT), incluso tras ajustar según la gravedad hemodinámica de las lesiones valvulares5. Sin embargo, aún no se ha analizado la excentricidad del jet que se produce a través de una VAB.
• La dilatación de la AoAsc puede ocurrir incluso tras la sustitución valvular aórtica (SVA)10.
• Una anomalía intrínseca de la pared se confirmaría si se demostraran alteraciones histopatológicas subyacentes a las complicaciones de AoAsc asociadas a VAB, a saber, la degeneración quística de la media. Este hallazgo patológico se ha observado en aortas de pacientes con VAB antes de que se formara aneurisma, y consiste en una reducción de los componentes de la matriz extracelular con aumento de las enzimas de degradación de la matriz11, 12, 13. Curiosamente, aunque ocurren cambios histológicos y biomoleculares similares en las aortas con VAB y síndrome de Marfan, la distribución de estos cambios difiere entre una afección y la otra, e incluso en los aneurismas por VAT (Tabla 1), lo que aboga por un papel principal de la hemodinámica en el desarrollo del remodelado reactivo de la pared aórtica.
Tabla 1. Histopatología de la degeneración quística de la media
Características Aneurisma de VAB Aneurisma de síndrome de Marfan Aneurisma de VAT Reducción de componentes de la MEC Aumento de apoptosis de CMLA: se reduce producción de proteínas de la MEC Fragmentación de la elastina: pérdida de soporte estructural y elasticidad Déficit de FB-1: desprendimiento de CMLA de la matriz de elastina y colágeno (interrupción de la matriz) Menor grado de cambios Aumentan las enzimas de degradación de la matriz Aumenta MPM-2Aumenta MPM-9Aumenta MPM2/TIMP-1 Aumenta MPM-12 Aumenta MPM-13 Distribución espacial de la DQM Asimétrico Circunferencial Confinado a la zona del aneurisma CMLA: células de músculo liso arterial; DQM: degeneración quística de la media; FB: fibrilina; MEC: matriz extracelular; MPM: metaloproteinasas de matriz; TIMP: inhibidor tisular de las metaloproteinasas; VAB: válvula aórtica bicúspide; VAT: válvula aórtica tricúspide.
• Por último, se ha señalado que la VAB tiene una elevada heredabilidad, y sus determinantes son casi totalmente genéticos. En grandes estudios familiares se ha documentado una prevalencia de VAB del 9% en familiares de primer grado (FPG) de sujetos con esta valvulopatía. Además, algunos estudios han demostrado dilatación de la raíz aórtica, aneurisma de aorta torácica o disección aórtica en hasta un tercio de los FPG de pacientes con VAB, tanto si tienen VAB como si no14, 15. Aunque se han propuesto múltiples localizaciones genéticas posibles para la VAB y los aneurismas de AoAsc, ninguna se ha establecido definitivamente como causa de la dilatación aórtica en VAB.
Se ha documentado dilatación aórtica en la infancia, lo que indica que este proceso tiene un comienzo temprano en la vida. La información sobre la tasa de progresión de la enfermedad aórtica relacionada con VAB es muy variable, con estudios que comunican entre unos 0,3 y 1,1mm por año7. En el Olmsted County Study, la prevalencia de la dilatación de AoAsc (> 40 mm) era del 15%, y en un subgrupo de pacientes con mediciones repetidas, la prevalencia aumentó al 39%16. Aunque existen numerosos factores de riesgo asociados a dilatación aórtica (presión arterial elevada, sexo masculino, valvulopatía significativa), la variable más importante posiblemente sea la edad. Los estudios, tanto pediátricos como en adultos, han concluido que, en comparación con los aneurismas asociados a VAT, los asociados a VAB crecen con más rapidez y aparecen a una edad significativamente más temprana6, 7. Además, la dilatación aórtica progresa más frecuentemente en pacientes con aortas de mayor tamaño basal.
Disección y rotura aórticaAunque la complicación aórtica más temida en pacientes con VAB es la disección, la incidencia real de esta complicación sigue siendo objeto de discusión. La prevalencia varía dependiendo de la cohorte estudiada, con una estimación general del 4%17, 18. Algunos informes procedentes de centros de referencia han señalado que el riesgo de disección aórtica era de 5 a 9 veces mayor en casos de VAB que de VAT, mientras que otros no han observado dicha asociación7, 19. Estudios recientes han obtenido riesgos inferiores. En la serie de Toronto20, la prevalencia de disección fue del 0,1% por paciente y año de seguimiento, y en el Olmsted County Study, el riesgo de disección aórtica en la cohorte a 25 años era del 0,5%21.
De hecho, los aneurismas de AoAsc asociados a VAB se disecan y se rompen en una banda de diámetros comparable a la de los aneurismas de otras etiologías (media, 60 ± 12; intervalo, 30-108mm)22. El incremento de riesgo de disección y rotura asociado a VAB se debe a la mayor prevalencia y tasa de dilatación aórtica, que tiene lugar a una edad significativamente más temprana que los aneurismas idiopáticos de AoAsc7, 19. Una comparación de pacientes con VAB y TAV demostró que, aunque los pacientes con VAB tenían mayor tasa de crecimiento aórtico (1,9 frente a 1,3mm/año), la incidencia de rotura y disección era similar7. Por lo tanto, a pesar de tasas de crecimiento más rápido, los eventos adversos ocurren con una frecuencia similar y con diámetros aórticos parecidos.
Los pacientes con síndrome de Marfan presentan mayor probabilidad a lo largo de la vida (40%) de disección aórtica que los pacientes con VAB. No obstante, dado que la VAB es unas 100 veces más común que el síndrome de Marfan, la VAB origina un número igual o superior de disecciones aórticas que el síndrome de Marfan22.
Diagnóstico y controlLa ecocardiografía transtorácica (ETT) es la principal técnica de imagen en el diagnóstico de VAB (Figura 1), ya que identifica a pacientes en los que la raíz aórtica o la AoAsc están dilatadas y valora su progresión con el tiempo. El intervalo de normalidad (AoAsc y diámetro de la raíz aórtica < 21 mm/m2) debe corregirse en función de la edad y el sexo. Estas mediciones por ETT se correlacionan estrechamente con las realizadas por tomografía computarizada (TC) con multidetectores23 y por resonancia magnética (RM)24, lo que indica que la ETT es una modalidad de imagen precisa. No obstante, la ETT estándar no permite visualizar toda la AoAsc y puede fallar en la detección del diámetro máximo, normalmente localizado en la porción proximal-media de la AoAsc. Se recomienda realizar RM o TC para evaluar toda la AoAsc cuando no se visualiza adecuadamente con ecocardiografía. Es también útil realizar una RM o TC de base tras el diagnóstico inicial de dilatación aórtica (≥ 45 mm), que serviría como medida de referencia para el seguimiento si se encontraran discrepancias entre ecocardiografías seriadas. La RM puede detectar y medir de forma precisa los aneurismas aórticos y confirmar la anatomía valvular, con lo que se evita la exposición al contraste y la radiación. Recientemente se ha demostrado la presencia de un flujo sistólico helicoidal anormal mediante RM de cuatro dimensiones, y el grado y la dirección de la excentricidad del jet pueden ser cruciales para determinar el riesgo de formación de aneurismas segmentarios9. La anatomía específica de la aorta puede definir cuál es el estudio de imagen óptimo. Por ejemplo, cuando los aneurismas afectan a la raíz aórtica, la RM es preferible a la TC, ya que esta muestra la raíz con peor calidad y es menos eficaz en la determinación de su diámetro. Si hay contraindicación para TC o RM, la ETE es una alternativa razonable, claramente superior a la ETT en la valoración de aneurismas localizados en la raíz aórtica (Figura 1), el arco aórtico y la aorta descendente. La combinación de ETE y angiografía por TC multicorte permite obtener toda la información necesaria si se prevé cirugía.
Cuando se detecta por primera vez un aneurisma de aorta torácica, no es posible determinar su tasa de crecimiento; por ello resulta apropiado obtener otro estudio de imagen a los 6 meses del estudio inicial. Si el tamaño del aneurisma permanece sin cambios, se puede proseguir con examen anual en la mayoría de los casos25. Esto también es aplicable tras SVA, ya que puede tener lugar una dilatación aórtica progresiva. El seguimiento debe considerarse a intervalos más cortos según las dimensiones aórticas, la tasa de crecimiento y la actividad física. En el caso de pacientes con VAB sin disfunción valvular significativa y diámetro aórtico normal, una ecocardiografía bianual podría ser suficiente.
Por último, se debe tener en consideración el estudio de los FPG de los pacientes con VAB para detectar anomalías de la válvula aórtica y dilatación de AoAsc. La ETT permite identificar con fiabilidad anormalidades cardiacas estructurales en estos individuos14, 26 (Figura 2). No obstante, se desconoce la historia natural de los FPG con una raíz aórtica levemente dilatada y VAT. Por ello, resultan necesarios estudios de seguimiento a largo plazo de esta población, tanto para determinar el ritmo de dilatación como para establecer la frecuencia de controles seriados de ETT, que detectarían la dilatación aórtica con suficiente antelación a la aparición de complicaciones14.
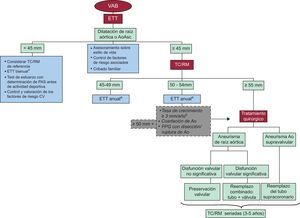
Figura 2. Algoritmo para la aproximación general del manejo y seguimiento de la dilatación aórtica en la válvula aórtica bicúspide. Ao: aorta; AoAsc: aorta ascendente; CV: cardiovascular; ETT: ecocardiografía transtorácica; FPG: familiares de primer grado; PAS: presión arterial sistólica; RM: resonancia magnética; TC: tomografía computarizada; VAB: válvula aórtica bicúspide.aConsidérese un seguimiento más estrecho si hay disfunción valvular asociada.bComparaciones seriadas de imágenes realizadas con la misma técnica y en un mismo nivel aórtico.
ManejoManejo médicoAdemás del seguimiento por imagen sistemático, los pacientes con VAB deben recibir información sobre el riesgo de disección y formación de aneurisma aórtico, así como de los síntomas de presentación de una disección aórtica aguda (Figura 2).
Se debe modificar la actividad física y el estilo de vida, pues los deportes competitivos, de alta intensidad y de contacto son potencialmente peligrosos y pueden desencadenar una disección aórtica o rotura en aortas con dilatación más que leve (45 mm)27.
Se debe someter los factores de riesgo cardiovascular asociados, como la hipertensión arterial, a un control agresivo en estos pacientes. Los bloqueadores beta deben administrarse para retrasar o prevenir la dilatación de la raíz aórtica en los pacientes con VAB (en ausencia de insuficiencia aórtica grave)25, 26. Sin embargo, la justificación de esta recomendación se basa en el efecto del tratamiento con bloqueadores beta en el síndrome de Marfan28, por lo que se debe confirmar en VAB mediante investigaciones futuras. Aunque algunos estudios han demostrado el beneficio del tratamiento con antagonistas de los receptores de la angiotensina II e inhibidores de la enzima de conversión de la angiotensina en pacientes con síndrome de Marfan29, 30, aún no hay datos que demuestren un beneficio similar de estas terapias en el aneurisma por VAB.
El tratamiento médico de la VAB no incluye estatinas, que podrían limitar la dilatación aórtica reduciendo la expresión de metaloproteinasas de matriz y mejorando la función endotelial por incremento de la óxido nítrico sintasa endotelial31. Un reciente ensayo aleatorizado y controlado con placebo sobre pacientes con estenosis aórtica leve o moderada ha demostrado que las estatinas no modifican los eventos relacionados con la válvula o la progresión de la estenosis aórtica31. Sin embargo, sólo un 5% de los participantes en el estudio tenían VAB. Se requiere de futuros estudios centrados en los efectos de las estatinas en la dilatación, la disección y la rotura de la AoAsc en pacientes con BAV.
CirugíaEl momento idóneo para la intervención de aorta en pacientes con VAB sin indicación de cirugía valvular sigue siendo incierto, debido a los pocos datos disponibles sobre la historia natural de la dilatación aórtica asintomática (Figura 2). El diámetro de la AoAsc es el parámetro más frecuentemente utilizado para valorar la dilatación aórtica y es el criterio principal para recomendar cirugía electiva en pacientes asintomáticos con aneurisma aórtico. Las guías vigentes proponen la cirugía de reparación de raíz aórtica o sustitución de AoAsc en pacientes con VAT si el diámetro de la raíz aórtica o de la AoAsc es ≥ 55 mm. Se debe utilizar fórmulas que incorporen la talla y el área de la sección aórtica en pacientes de corta estatura25, 32, 33. Se recomienda un límite inferior (≥ 50 mm) en pacientes con síndrome de Marfan y VAB. No obstante, según los recientes estudios de seguimiento a largo plazo, las diferencias entre ambas entidades son significativas. Los pacientes con VAB probablemente se encuentren entre los dos extremos de un espectro de condiciones representado por el síndrome de Marfan y el aneurisma de AoAsc degenerativo, y los criterios de tamaño para la intervención quirúrgica deben estar a medio camino entre los que se han establecido para ambas enfermedades (50 y 55 mm respectivamente). En el caso de los pacientes con factores de riesgo como la coartación aórtica, la estenosis aórtica grave o los FPG con antecedentes de rotura o disección aórtica, se recomienda la intervención quirúrgica cuando la AoAsc sea ≥ 50 mm y, en casos de SVA electiva, si es ≥ 45 mm. La tasa de crecimiento también se ha mostrado como un importante predictor de rotura. Tradicionalmente, se ha considerado una tasa de crecimiento de 10 mm/año como indicación para cirugía34. Pero los avances recientes de las técnicas de imagen cardiovascular han mejorado la reproducibilidad de las medidas seriadas. Por lo tanto, hay consenso general en aceptar una tasa de crecimiento > 3 mm/año como el umbral para indicar cirugía, siempre que las comparaciones se hayan realizado con precisión, empleando la misma técnica de imagen y al mismo nivel de la aorta. Por último, los beneficios de la intervención deben ponderarse cautelosamente frente al riesgo quirúrgico, tanto del paciente (edad, comorbilidades, etc.) como del centro. En los mejores centros, la mortalidad hospitalaria de la cirugía electiva de AoAsc en pacientes jóvenes sin comorbilidades es aproximadamente del 2%34, 35. Se debe tener en cuenta las características de los pacientes, el grado de disfunción valvular aórtica, la localización de la dilatación aórtica y el tipo de cirugía en el proceso de toma de decisiones.
Existen varias opciones quirúrgicas, y la elección depende de la localización del aneurisma, la extensión distal de la afección aórtica y el estado de anticoagulación deseado (Tabla 2)36, 37. Si se considera la reparación valvular o la cirugía de preservación valvular, se debe realizar ETE preoperatoria o intraoperatoria para definir la anatomía de los velos y la AoAsc38.
Tabla 2. Opciones quirúrgicas para la valvulopatía aórtica bicúspide
| Técnica quirúrgica | Consideraciones |
| Aortoplastia reductora con/sin wrapping sintético externo | • Generalmente no se recomienda (riesgo de dilatación progresiva)• Alternativa para pacientes con elevado riesgo quirúrgico (especialmente si los senos no están significativamente dilatados) |
| Sustitución de la raíz aórtica y AoAsc con reimplantación de ostium coronario (procedimiento de Bentall) | Técnica estándar en paciente con valvulopatía significativa y dilatación de la AoAsc |
| Sustitución de la válvula aórtica y reparación aórtica supracoronaria independiente | • Generalmente no se recomienda (riesgo de dilatación progresiva del seno)• Alternativa para pacientes mayores con estenosis de VAB, senos de tamaño normal y dilatación de la AoAsc supracoronaria |
| Sustitución aórtica con preservación valvular | Opción aceptable para los pacientes más jóvenes con VAB normofuncionante |
| Homoinjerto pulmonar | • Generalmente no se recomienda (riesgo de dilatación del homoinjerto)• Alternativa para niños, adolescentes y mujeres jóvenes que deseen gestar |
| Reparación valvular aórtica | Opción aceptable con rigurosa selección de candidatos adecuados |
AoAsc: aorta ascendente; VAB: válvula aórtica bicúspide.
La VAB tiene una elevada prevalencia de dilatación de AoAsc, obliga a control exhaustivo de la hipertensión y seguimiento periódico con técnicas de imagen. Una vez que el diámetro de la AoAsc alcanza los 45 mm, está indicada una ecocardiografía anual. Como alternativas, se puede considerar la RM o la TC, especialmente como estudio de referencia que servirá para posteriores comparaciones durante el seguimiento. Aunque los datos sobre la intervención profiláctica son escasos, apuntan a que la indicación electiva para reparar la dilatación aórtica asociada a VAB se establezca en umbral más alto, con diámetros de 50-55 mm, dependiendo de las características del paciente y la presencia de factores de riesgo, y de 45 mm en el caso de indicación concomitante de SVA.
Además, el cribado ecocardiográfico debe ofrecerse a los FPG de pacientes con VAB, ya que la probabilidad de detectar alteraciones aórticas o valvulares silentes es considerable, y el diagnóstico precoz puede reducir la morbilidad y la mortalidad asociadas a ellos.
Conflicto De InteresesNinguno.
Autor para correspondencia: Servei de Cardiologia, Hospital Vall d’Hebron, P.° Vall d’Hebron 119, 08035 Barcelona, España. aevangel@vhebron.net