La epidemiología, la microbiología y el diagnóstico de la endocarditis infecciosa (EI) han cambiado con rapidez en los últimos 50 años. Según se informó en el estudio del grupo International Collaboration on Endocarditis (ICE)1, la valvulopatía degenerativa y la presencia de prótesis valvulares eran las causas más frecuentes de EI (en las décadas de los sesenta y los setenta, la causa principal eran las lesiones reumáticas). Por otra parte, un estudio observacional muy reciente del EURO-ENDO ha destacado un cambio en la microbiología de la EI —los microorganismos causales más frecuentes son los estafilococos (44%), seguidos de los enterococos (15,8%), los estreptococos orales (12,3%) y Streptococcus gallolyticus (6,6%)—, y los enterococos ya no son la tercera causa de EI, tal como ocurría en la época del estudio del ICE, sino la segunda. Es probable que esto se deba a la proporción cada vez mayor de pacientes ancianos con comorbilidad y EI, lo que también hace que la EI sea una enfermedad de mal pronóstico2.
La permeabilidad del tracto digestivo y su inflamación, que son más frecuentes en la población anciana, explicarían la «fuga» de bacterias del tracto digestivo a la circulación sistémica y la posible existencia de enfermedades cardiovasculares y también autoinmunitarias3. Los enterococos son las bacterias más abundantes del tubo digestivo humano (intestino delgado y grueso) y representan el 1% de la flora fecal humana, donde Enterococcus faecalis y E. faecium son las 2 especies principales del género Enterococcus. En personas sanas, los enterococos desempeñan una función comensal/probiótica, pero en las personas ancianas, que padecen con más frecuencia disbacteriosis (desequilibrio de la microbiota sana del tubo digestivo humano), las bacterias pueden atravesar la mucosa del tubo digestivo e introducirse en la circulación. Una de las muchas formas que tiene la microbiota de mantener la homeostasis intestinal es estimulando las células caliciformes para que segreguen mucina, que es una capa gruesa que protege el epitelio del colon de los microbios intestinales. Cuando esta función comensal no se logra, las bacterias pueden pasar a la circulación y colonizar otras áreas del cuerpo y formar biofilms4. La disbacteriosis crónica asociada a otros factores, tales como la genética y los irritantes químicos procedentes de la dieta, induce inflamación crónica del colon y causa enfermedades colorrectales y displasia colorrectal, que puede evolucionar a cáncer colorrectal (CCR)5.
Los enterococos no son las únicas bacterias capaces de atravesar la mucosa del colon, S. gallolyticus —cuya presencia en el tubo digestivo humano no es habitual (un 2,5-15% de los humanos sanos)— también tiene esta propiedad. La bacteriemia causada por S. gallolyticus se ha estudiado exhaustivamente y se conoce bien su mecanismo de translocación y difusión. La translocación ocurre a través de las adhesinas que tiene en la superficie y permiten su adhesión a las células hospedadoras, mientras que en la difusión interviene la fimbria (expresión de Pil3), que se une al fibrinógeno plasmático. Una vez en el torrente circulatorio, la expresión de Pil1 se encarga de la unión al colágeno I (presente en la superficie de las válvulas cardiacas dañadas), desde donde coloniza el corazón6. Ya en la década de los setenta, se vio que la bacteriemia causada por S. gallolyticus se asociaba tanto con neoplasia colorrectal como con EI7.
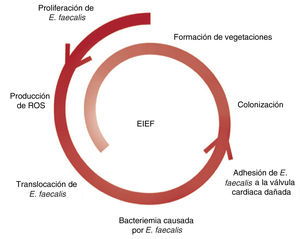
En cambio, del mecanismo de la bacteriemia causada por E. faecalis se sabe menos. Aunque la principal puerta de entrada de E. faecalis es el aparato genitourinario, se ha visto que la proliferación de E. faecalis estimula la producción de especies reactivas de oxígeno e induce inestabilidad genómica en las células del colon, lo que favorece las lesiones de la mucosa intestinal y la translocación de E. faecalis en la circulación8 (figura 1).
En favor de la hipótesis del tracto gastrointestinal como puerta de entrada de la bacteriemia causada por E. faecalis, en un estudio publicado en el 2017 por Pericàs et al. se investigó la relación entre la EI causada por E. faecalis (EIEF) y la neoplasia colorrectal. Los autores analizaron con qué frecuencia presentaban neoplasia colorrectal los pacientes con EIEF, cuya supuesta fuente de infección no se había determinado, y constataron un 50,8%. Del grupo de pacientes en los que se había identificado la puerta de entrada de la infección, solo se realizó colonoscopia a 6, y a 1 de ellos se le diagnosticó neoplasia colorrectal (16,7%); por lo tanto, no pudo extrapolarse ninguna conclusión para este grupo9.
En un artículo de Escolà-Vergé et al.10, publicado recientemente en Revista Española de Cardiología, los autores tenían por objetivo determinar la incidencia de enfermedad colorrectal en pacientes con EIEF, independientemente de la supuesta fuente de infección. Los argumentos de su estudio se basaban en el hecho de que el 5% de los pacientes con EI (de cualquier etiología) sufriría una infección concomitante con un mayor riesgo de mortalidad, y la razón sería una posible enfermedad colorrectal no diagnosticada (puerta de entrada de bacterias en la circulación). Si esta hipótesis es correcta, la realización de una colonoscopia que identificase y tratase la anterior causa de endocarditis reduciría el riesgo de recurrencia. En su estudio, los autores incluyeron todos los casos consecutivos (n = 103) con EIEF constatados en 4 centros de referencia (3 centros en España y 1 en Italia). Se clasificó a los pacientes según la supuesta fuente de infección en pacientes con «puerta de entrada desconocida» y pacientes con «puerta de entrada conocida». Solo se realizó la colonoscopia a 70 pacientes con EIEF (6 meses antes o después del diagnóstico de EIEF): los pacientes con una puerta de entrada desconocida fueron más numerosos que aquellos con una puerta de entrada conocida (el 64 frente al 36%).
Al comparar las características clínicas y demográficas entre los 2 grupos, se vio que las infecciones relacionadas con los cuidados sanitarios eran más frecuentes en los pacientes con una puerta de entrada conocida que en aquellos con puerta de entrada desconocida (el 83 frente al 29%; p < 0,001). Esta diferencia probablemente se deba a que los pacientes con una supuesta fuente de infección sufrían con mayor frecuencia insuficiencia renal crónica que los pacientes con una fuente de infección desconocida (el 30 frente al 21%). Además, se había tratado con mayor frecuencia con inmunosupresores y trasplante de hígado (el 15 frente al 6% y el 15 frente al 3%) a los pacientes con una supuesta fuente de infección.
Del subgrupo con una puerta de entrada desconocida, los autores observaron que en el 64% de los pacientes había hallazgos endoscópicos, mientras que en el subgrupo con una puerta de entrada conocida (que no fuera de origen gastrointestinal) solo el 44% los presentaba.
Como era de esperar, de los pacientes con EIEF con una supuesta fuente de infección gastrointestinal, se diagnosticó enfermedad colorrectal tras la colonoscopia al 88% de ellos y, sorprendentemente, en el 44% de los pacientes con una supuesta fuente de infección urinaria había hallazgos endoscópicos. En estos pacientes queda por saber si la puerta de entrada es el colon o las vías urinarias. Si se supone que la puerta de entrada son las vías urinarias, puede explicarse el alto porcentaje de hallazgos endoscópicos en este grupo por la incidencia relativamente alta de enfermedad colorrectal en este grupo de edad11.
El resultado del estudio es relevante porque, en total, el 60% de los pacientes con EIEF a los que se realizó la colonoscopia (incluidos los pacientes con una supuesta fuente de infección gastrointestinal) tenían hallazgos endoscópicos. Según las características histopatológicas, las observaciones colorrectales identificadas se clasificaron en neoplásicas y no neoplásicas. En teoría, cada una de las lesiones halladas en el colon podría representar una puerta de entrada (sin incluir los divertículos sin complicaciones ni las hemorroides sin complicaciones). La mayor parte de los hallazgos endoscópicos eran neoplásicos —el 83% adenomas colorrectales avanzados y no avanzados— y el 17%, no neoplásicos. Entre los pacientes con EIEF, el 50% padecía una enfermedad colorrectal neoplásica, porcentaje que es mayor que el del adenoma colorrectal observado en la población anciana general (el 33% de la población griega asintomática de más de 50 años11). Solo hubo 1 caso de CCR en el subgrupo de pacientes con una fuente de infección desconocida y ninguno en los pacientes con fuente de infección conocida. Escolà-Vergé et al. también examinaron las diferencias entre los grupos sin y con hallazgos endoscópicos para ver si en el primero los pacientes eran más jóvenes. No se observaron diferencias de edad estadísticamente significativas entre ambos grupos. No obstante, en el grupo con hallazgos endoscópicos la comorbilidad fue mayor (diabetes mellitus e insuficiencia renal crónica). Además, en el grupo de pacientes con hallazgos endoscópicos había más varones que en el grupo sin ellos (el 81 frente al 77%). Esta diferencia del 4%, que no era estadísticamente significativa, pudo deberse al hecho de que en los varones el riesgo específico de sufrir enfermedades colorrectales es mayor que en las mujeres12,13 y que las infecciones urinarias son la principal puerta de entrada en las mujeres de esta población (el porcentaje de pacientes con una supuesta fuente urinaria de infección era mayor en el grupo sin hallazgos endoscópicos que en el otro (el 29 frente al 15%). Esto es lo que indicaría el hecho de que en las mujeres sea mayor el riesgo de padecer infección de las vías urinarias14.
Una limitación del estudio son su diseño retrospectivo y el pequeño tamaño muestral. Además, el 80% de los pacientes con EIEF a los que se realizó una colonoscopia eran varones, lo que significa que solo se realizó colonoscopia a 16 mujeres: 7 sin hallazgos (44%) y 9 con hallazgos (56%). Es comprensible que un subgrupo de pacientes con EIEF extrapolados de una población con EI incluya a más varones, ya que la incidencia de EI en ellos es mayor que en las mujeres de edad similar (en el estudio de EURO-ENDO, solo el 30% son mujeres)2 y las enfermedades colorrectales son más frecuentes en varones que en mujeres13 (cuando la enfermedad colorrectal es la principal causa de EIEF).
Habría sido interesante conocer la supuesta fuente de infección de 9 mujeres que, lamentablemente, no pudo deducirse de las características demográficas mencionadas en las tablas del artículo. Los autores tuvieron que realizar el estudio considerando a las mujeres y los varones por separado. En varios estudios se ha especulado que las características de la EI son distintas entre sexos15.
Los autores también determinaron recaídas en todos los pacientes con EIEF a los que se dio un seguimiento mínimo de 3 meses. Solo se produjeron 2 recaídas, y ambas tuvieron lugar en el grupo de pacientes con hallazgos endoscópicos relevantes. Por lo tanto, la tasa de recaídas de los pacientes cribados con colonoscopia sería casi un 50% inferior a la de la población general (del 5-2,8%; 2/70 casos).
En conclusión, la EIEF es un buen factor de predicción de enfermedad colorrectal. Tratar las enfermedades colorrectales evitaría la recurrencia de EI. Así pues, este estudio ayudaría a impulsar estudios más amplios, que podrían dar lugar a cambios en las próximas directrices sobre la EIEF. Tales cambios beneficiarían a los pacientes con EIEF porque se les diagnosticaría y trataría antes la enfermedad colorrectal, lo que no solo evitaría la transformación maligna de esta, sino que también impediría la recurrencia de la endocarditis. Deberían llevarse a cabo más estudios para reducir la frecuencia de los enterococos cólicos y la puerta de entrada gastrointestinal, que actualmente es del 15,8%, tal como se informa en el estudio EURO-ENDO2.
CONFLICTO DE INTERESESLos autores no tienen ningún conflicto de intereses que declarar.
Este estudio fue financiado por una subvención de consolidación del Consejo Europeo de Investigación (ERC) (número de proyecto: 647197). C. Oury es directora de investigación de los Fondos Nacionales de Investigación Científica (FRS-FNRS, Bélgica). Nuestro agradecimiento también a Alexandre Hego por haber mejorado la calidad de la imagen representada en la figura 1.