En el presente artículo se comenta la recientemente publicada guía para el tratamiento de las dislipemia de la Sociedad Europea de Cardiología (ESC), junto con la Sociedad Europea de Aterosclerosis y con una contribución especial de la Sociedad Europea de Prevención Cardiovascular y Rehabilitación1. El Comité de Guías formó un grupo de trabajo compuesto por miembros de la Sociedad Española de Cardiología (SEC) para realizar los comentarios sobre estas.
A continuación, y siguiendo el mismo orden de apartados que ofrece la guía, se comentan sus aspectos más importantes.
PREVENCIÓNEn este apartado es de destacar que, por primera vez, la guía insiste en la importancia de las intervenciones poblacionales: cuanto menos se interviene en la población, más hay que hacerlo en el individuo y viceversa. Además, se destaca que la intervención poblacional sobre la modificación del estilo de vida es más coste-efectiva que los tratamientos farmacológicos. Todo ello se aborda en profundidad en la guía de prevención cardiovascular, que fue objeto del oportuno análisis y comentario2.
RIESGO CARDIOVASCULAREl riesgo SCORE se sigue manteniendo con grupos muy similares. Los cambios que se producen con respecto a la guía de 20113 están en línea con los propuestos por otras guías anteriores. Los cambios que aparecen en esta guía son (tabla 1):
- •
Pacientes con insuficiencia renal. En la categoría de muy alto riesgo, solo se incluye a los pacientes con insuficiencia renal (IR) grave: filtrado glomerular < 30ml/min; aquellos con IR moderada pasan a categoría de alto riesgo.
- •
Salen de la categoría de riesgo muy alto los pacientes diabéticos sin afección de órgano diana y sin otro factor de riesgo asociado, y pasan a la de alto riesgo. En esta categoría de alto riesgo entran los que tienen algún factor de riesgo vascular muy marcado (presión arterial ≥ 180/110mmHg o colesterol > 310mg/dl).
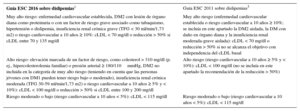
Objetivo terapéutico en la dislipemia: el cLDL. ¿Qué ha cambiado respecto a guías anteriores?
| Guía ESC 2016 sobre dislipemias1 | Guía ESC 2011 sobre dislipemias3 |
|---|---|
| Muy alto riesgo: enfermedad cardiovascular establecida, DM2 con lesión de órgano diana como proteinuria o con un factor de riesgo grave asociado como tabaquismo, hipertensión o dislipemia, insuficiencia renal crónica grave (TFG < 30 ml/min/1,73 m2) o riesgo cardiovascular a 10 años ≥ 10%: cLDL < 70 mg/dl o reducción > 50% si cLDL entre 70 y 135 mg/dl | Muy alto riesgo (enfermedad cardiovascular establecida o riesgo cardiovascular a 10 años ≥ 10%; se incluía en este apartado la DM2 aislada, la DM con daño en órgano diana y la insuficiencia renal moderada-grave aislada): cLDL < 70 mg/dl o reducción > 50% si no se alcanza el objetivo con independencia del cLDL basal |
| Alto riesgo: elevación marcada de un factor de riesgo, como colesterol > 310 mg/dl (p. ej., hipercolesterolemia familiar) o presión arterial ≥ 180/110mmHg, DM2 no incluida en la categoría de muy alto riesgo (teniendo en cuenta que las personas jóvenes con DM1 pueden tener riesgo bajo o moderado), insuficiencia renal crónica moderada (TFG 30-59 ml/min/1,73 m2) o riesgo cardiovascular a 10 años ≥ 5% y < 10%): cLDL < 100 mg/dl o reducción > 50% si cLDL entre 100 y 200 mg/dl | Alto riesgo (riesgo cardiovascular a 10 años ≥ 5% y < 10%): cLDL < 100 mg/dl (no se incluía en este apartado la recomendación de la reducción > 50%) |
| Riesgo moderado o bajo (riesgo cardiovascular a 10 años < 5%): cLDL < 115 mg/dl | Riesgo moderado o bajo (riesgo cardiovascular a 10 años < 5%): cLDL < 115 mg/dl |
cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; ESC: Sociedad Europea de Cardiología; TFG: tasa de filtrado glomerular.
Entre las novedades también destaca que se define mejor a los pacientes con eventos cardiovasculares previos o enfermedad cardiovascular documentada. Por otra parte, también se aborda el problema de la edad en la subestimación del riesgo de los pacientes jóvenes y en la necesidad de recalcular el riesgo de los pacientes que caen en «riesgo intermedio» cuando tienen otros factores, mencionados en la guía, que pueden incrementarlo. No obstante, la guía no señala con claridad qué factores concretos originan una reclasificación significativa del riesgo, por lo que sería aconsejable su uso para reclasificar a los pacientes de riesgo intermedio.
PARÁMETROS LIPÍDICOSEste apartado no ha cambiado prácticamente respecto a guías previas3. Recientes estudios sobre el colesterol unido a lipoproteínas de alta densidad (cHDL) alertan que esta es una molécula compleja con diferentes subfracciones y que la presencia de cHDL disfuncionante tendría más valor para la aparición de la ateroesclerosis que las propias concentraciones de cHDL. Se reconoce que los triglicéridos (TG) también son un factor de riesgo independiente, pero no aparecen en las recomendaciones de objetivos terapéuticos. Otra novedad de la guía es que aclara que no se recomienda el ayuno para el análisis del perfil lipídico.
OBJETIVOS TERAPÉUTICOSEste era uno de los apartados que se esperaban con mayor interés, tras el intensísimo debate que surgió con la publicación de las guías estadounidenses de finales de 20134. Lo cierto es que establecer un nivel concreto como objetivo de colesterol unido a lipoproteínas de baja densidad (cLDL) resulta arbitrario, puesto que el riesgo es continuo y se expresa por una línea de regresión. Los autores de la guía europea actual se detienen en justificar ese objetivo, que siguen colocando en 70mg/dl (para los sujetos de muy alto riesgo, que incluyen a aquellos en prevención secundaria), aunque aceptan genéricamente que lo mejor es reducir el cLDL lo más posible. En concreto, poner una cifra objetivo ayuda a la comunicación médico-paciente, a la adherencia y el cumplimiento e individualiza y personaliza el tratamiento. Además, existe un criterio adicional: si no hay objetivo, no es preciso el control, lo que desmotiva al paciente y al médico en alcanzarlo. La SEC en su momento5 ya se posicionó a favor de la directriz de la ESC, que sigue inalterable. Es importante saber que recientemente se ha hecho una actualización de las guías norteamericanas6 en la que se vuelve a hablar de objetivos de control de cLDL.
ESTILOS DE VIDA PARA MODIFICAR LOS LÍPIDOSLos hábitos de vida, y especialmente los factores dietéticos, cada vez tienen más importancia no solo para mejorar el perfil lipídico, sino también para prevenir o mejorar otros factores de riesgo cardiovascular, como la presión arterial y la glucemia. Asimismo, la evidencia disponible ha mostrado que determinados patrones de dieta pueden contribuir a la prevención de la enfermedad cardiovascular. La dieta mediterránea sube aún más escalones tras los resultados del estudio PREDIMED7 en la prevención primaria de la enfermedad cardiovascular en pacientes con alto riesgo cardiovascular, la mayor aportación científica española a esta guía. La dieta mediterránea suplementada con productos como el aceite de oliva virgen extra o los frutos secos (nueces, almendras, avellanas…) debe fomentarse cultural, comercial y sanitariamente. Aunque se recomienda el consumo genérico de pescado, especialmente azul, 2 veces por semana, los fracasos de los últimos estudios aleatorizados con omega3 en prevención secundaria desaconsejan suplementar con estos productos.
Aunque se describe que hay que sustituir parte de la grasa saturada por ácidos grasos poliinsaturados y monoinsaturados, se debería aconsejar que es mejor la sustitución de grasa saturada con monoinsaturada, especialmente la derivada del aceite de oliva virgen. Los ácidos grasos monoinsaturados también mejoran la sensibilidad a la insulina, disminuyen los triglicéridos y, a diferencia de los poliinsaturados, no disminuyen o pueden aumentar el cHDL. También se debería insistir en que, con los datos científicos disponibles, lo importante no es la cantidad de grasa que se consume, siempre que no sea superior al 35% de las calorías totales como recomienda las guía, sino su calidad.
En la prevención dietética de la enfermedad cardiovascular, merece destacar la importancia de disminuir la ingesta de ácidos grasos trans, cuya principal fuente son los ácidos grasos poliinsaturados parcialmente hidrogenados de origen industrial. Estos tienen un efecto negativo en el perfil lipídico, pueden contribuir a la aparición de diabetes mellitus y aumentan el riesgo cardiovascular.
Con respecto al consumo de alcohol, se recuerda que aumenta la concentración de triglicéridos, por lo que se debe recomendar a los sujetos con hipertrigliceridemia, aunque sea leve, que eviten consumirlo. También la guía destaca que una reducción moderada del peso cuando haya sobrepeso junto con actividad física regular es una medida muy eficaz para prevenir la diabetes tipo 2 y mejorar las anomalías metabólicas, incluidos el perfil lipídico y la resistencia a la insulina.
Las guías dedican cada vez más espacio a los suplementos dietéticos y los alimentos funcionales, lo que parece pertinente por su crecimiento exponencial en el mercado, el creciente interés de la población por su consumo y la presión publicitaria. La guía aclara que hay evidencia de que ciertos productos reducen la concentración de colesterol, especialmente los fitosteroles (2g diarios reducen el cLDL un 7-10%) o algunos de inspiración oriental, como la levadura roja de arroz (que posee una acción similar a las estatinas). Sin embargo, las evidencias, más allá de la reducción de lípidos, son escasas en cuanto a la eficacia para reducir eventos cardiovasculares, y tampoco hay estudios de seguridad a cierto plazo. Todo indica que su consumo irá en alza, por lo que sería muy deseable efectuar ensayos rigurosos.
FÁRMACOS PARA EL TRATAMIENTO DE LA HIPERCOLESTEROLEMIARespecto al tratamiento farmacológico de las dislipemias, las estatinas siguen siendo la piedra angular de la terapia hipolipemiante, lo que se ha corroborado una vez más en el último ensayo (HOPE 3, NCT00468923), que muestra la reducción de morbimortalidad con una estatina de alta potencia (rosuvastatina 10mg) en pacientes de riesgo cardiovascular intermedio.
Diversos metanálisis indican que el beneficio clínico de las estatinas es bastante independiente del tipo de estatina, pero está muy relacionado con la reducción de cLDL alcanzada y, por lo tanto, el tipo de estatina debería reflejar el objetivo de cLDL del paciente concreto. En esta guía se reproduce de nuevo la figura que se publicó ya en guías previas en relación con la diferente capacidad de reducción porcentual de cLDL que se consigue con las diferentes estatinas.
Además de recordar el mecanismo de acción, se revisan los principales efectos adversos de estos fármacos, como problemas musculares o hepáticos. En la guía actual se confirma la capacidad diabetogénica de las estatinas, ya señalada en la guía anterior3, el riesgo es mayor para los pacientes más añosos y aquellos que tienen otros factores de riesgo de diabetes. Pero no todas las estatinas son iguales. Así, la posibilidad de sufrir diabetes es mayor con las estatinas más potentes a las dosis más altas. Merece la pena destacar que la Agencia Española del Medicamento ha recogido en la ficha técnica que la pitavastatina no produce un aumento de nuevos casos de diabetes.
Un efecto adverso que previamente no se había documentado es el de las posibles complicaciones renales, aunque los autores reconocen que este aspecto este aún en debate. Se ha comunicado una frecuencia aumentada de proteinuria con todas las estatinas, aunque se ha analizado con mayor detalle con la rosuvastatina. En cuanto a la función renal, un reciente análisis Cochrane no ha observado efecto beneficioso de las estatinas en el aclaramiento de creatinina, pero tampoco efectos deletéreos. El último párrafo se dedica a recordar las posibles interacciones cuando se utilizan ciertas estatinas, principalmente las relacionadas con el metabolismo hepático por la vía del citocromo P450. El apartado de estatinas finaliza, como en guías previas, con las combinaciones de estatinas y fibratos, combinación que puede potenciar el riesgo de miopatía. Este riesgo es mayor con gemfibrozilo, por lo que debe evitarse esta combinación, y parece menor con fenofibrato, bezafibrato o ciprofibrato.
Nada nuevo que añadir respecto a guías previas sobre los secuestradores de ácidos biliares. No se han demostrado beneficios en estudios de morbimortalidad con estos agentes, y su principal limitación es la mala tolerabilidad debido a la elevada frecuencia de efectos adversos gastrointestinales. Al no haber habido ninguna novedad en los últimos años, el apartado dedicado a estos fármacos en la guía actual es idéntico al de guías previas.
Esta guía presenta de forma resumida los hallazgos beneficiosos del estudio IMPROVE-IT8, en el que se observa que la reducción de cLDL más allá de 70mg/dl es beneficiosa, sin efectos adversos añadidos, aun cuando el fármaco no sea una estatina. La baja incidencia de enfermedad coronaria con cifras bajas de cLDL en sujetos con defectos genéticos de la proteína inhibida por ezetimiba (NPC1L1), junto con los resultados del IMPROVE-IT respaldan la indicación de la ezetimiba en combinación con estatinas cuando estas no logran el objetivo de cLDL. Eso es un hito muy novedoso en la guía de 2016, que solo se apuntaba con cautela en guías previas.
En cuanto a los inhibidores de la PCSK9, se presentan como un abordaje terapéutico absolutamente novedoso. Ni siquiera se alude a ello en el apartado de perspectivas terapéuticas futuras de guías previas. Este nuevo tipo de abordaje se basa en la administración subcutánea de un anticuerpo monoclonal específico contra esta proteína (PCSK9), que a su vez inactiva al receptor de LDL. Los I-PCSK9 se administran cada 14 o 28 días, y la Food and Drug Association y la Agencia Europea del Medicamento tienen aprobada ya la comercialización de 2 presentaciones: evolocumab y alirocumab. En la guía se hacen comentarios sobre su extraordinaria potencia de reducción de cLDL, que puede situarse entre el 50 y el 70%, independientemente de que se dé a pacientes en tratamiento con estatinas u otros hipolipemiantes y de su baja incidencia de eventos adversos, y se apunta con tibieza que pueden reducir la trigliceridemia. Se exponen los potenciales candidatos a su administración que, de manera resumida, serían pacientes con cardiopatía isquémica, con alto riesgo cardiovascular o con hipercolesterolemia familiar heterocigota que no alcanzan los objetivos terapéuticos con dosis máximas de estatinas o que no las toleran. Es de resaltar, aunque sea circunstancialmente, que la aglutinación de varios estudios en fase III apunta claramente a una reducción de la morbimortalidad cardiovascular, lo que apuntalaría la idea de que reducciones importantes de cLDL, bajando bastante más allá de 70mg/dl, siguen añadiendo un beneficio cardiovascular, como ya indicaba el estudio IMPROVE-IT8, aunque ese plus de descenso se haga con otros fármacos que no sean las estatinas.
Próximamente se conocerán los resultados de estudios de morbimortalidad de estos agentes, lo que seguro obligará a reescribir las últimas guías clínicas ESC/EAS, siempre que los resultados sean tan importantes como se adivinan, aunque algunas experiencias con fármacos hipolipemiantes previos obligan a tener una razonable cautela al hacer estos comentarios.
Por otra parte, en esta guía se recoge la retirada de los preparados farmacéuticos con ácido nicotínico, ya que no solo no se demostró reducción de la morbimortalidad cardiovascular, sino que también desvelaban un aumento significativo de eventos adversos.
Las nuevas guías clínicas mencionan las potenciales combinaciones de fármacos: estatinas con inhibidores de la absorción de colesterol (ezetimiba) (recomendación IIa B), estatinas con secuestradores de ácidos biliares (resinas) (recomendación IIb C), resinas con inhibidores de la absorción de colesterol, estatinas con fitosteroles, aunque no hay ensayos clínicos que avalen el beneficio en la reducción de episodios cardiovasculares de estas 2 últimas combinaciones. Las principales novedades son que se mejoran los niveles de evidencia de la combinación estatinas + ezetimiba tras los resultados del estudio IMPROVE-IT8, que se recomienda con evidencia IIb C la combinación de antagonistas del PCSK9 cuando los objetivos de cLDL no se han alcanzado con dosis máximas toleradas de estatinas, combinadas o no con ezetimiba, lo que posiblemente mejore en la nueva edición de las próximas guías, tras la publicación inminente de los estudios de morbimortalidad con esas combinaciones, y que se abandona la recomendación de añadir ácido nicotínico a la terapia combinada.
FÁRMACOS PARA EL TRATAMIENTO DE LA HIPERTRIGLICERIDEMIAEn esta edición de la guía se insiste en el papel que desempeñan los TG como factor de riesgo cardiovascular, con una mayor asociación de la concentración de TG no en ayunas que en ayunas9. Datos recientes de estudios genéticos que utilizan un diseño de aleatorización mendeliana han concordado en relacionar tanto la concentración de TG no en ayunas como el colesterol residual con mayor riesgo de eventos cardiovasculares y mortalidad por todas las causas10. El colesterol residual, determinado como TG – (cHDL + cLDL), se considera como uno de los principales factores de riesgo de arterioesclerosis y eventos cardiovasculares11 y un marcador indirecto de los TG12.
La guía incluye una tabla de posibles causas de hipertrigliceridemia (HTG) muy completa, así como una definición y clasificación, y considera HTG leve o moderada cuando los valores de TG están entre 150 y 880mg/dl y HTG grave si son > 880mg/dl13. La HTG grave se asocia a una mutación monogénica y a un incremento del riesgo de pancreatitis.
Se sigue manteniendo como objetivo de TG en ayunas 150mg/dl, con una estrategia terapéutica similar a la de la anterior guía3. Se recomienda analizar antes de cualquier intervención las posibles causas y evaluar el riesgo cardiovascular total. El objetivo principal es reducir el cLDL con base en el riesgo cardiovascular, puesto que la evidencia de los beneficios de bajar los TG es escasa en comparación con la reducción de cLDL. No obstante, actualmente se recomienda una intervención en los estilos de vida de los sujetos con TG > 150mg/dl, y se recomienda el uso de fármacos solo para los pacientes con alto riesgo cardiovascular y TG > 200mg/dl (clase IIa, nivel B)14.
Las estatinas son el fármaco de primera elección, aunque desciende el nivel de evidencia (clase IIa, nivel B), y si no se consigue bajar de 200mg/dl, se añadiría fenofibrato (clase IIa, nivel C). También se podrían considerar los ácidos omega3 y los inhibidores de la PCSK9, aunque para estos no hay una indicación clara. No se consideran ya en esta guía la niacina ni los secuestradores de ácidos biliares dentro de la estrategia terapéutica.
Las estatinas más potentes a altas dosis (atorvastatina, rosuvastatina y pitavastatina) deben ser el tratamiento de elección. Aunque en los ensayos clínicos con fibratos se han encontrado algunos efectos beneficiosos, sobre todo en sujetos con TG elevados y valores de cHDL bajos, todavía no hay una evidencia clara del descenso de la mortalidad cardiovascular o total15. Por lo que respecta a los ácidos omega-3, hay evidencia de la reducción de los TG, pero no de los eventos cardiovasculares y la mortalidad16. Hay 2 ensayos en marcha, el REDUCEIT (NCT01492361) con 8.000 participantes y el STRENGTH (NCT02104817), con 13.000, que intentan valorar su eficacia en la reducción de eventos cardiovasculares. Los ácidos omega-3, en general, son seguros, aunque pueden incrementar el sangrado en sujetos con ácido acetilsalicílico/clopidogrel y recientemente se ha encontrado en un estudio asociación entre alta ingesta de omega-3 y cáncer de próstata17. Por último, en la combinación de estatinas y fibratos hay que monitorizar el riesgo de miopatías y evitar el uso de gemfibrozilo. Si los TG no se controlan con estatinas o fibratos, se puede añadir omega-3, una combinación segura y bien tolerada.
FÁRMACOS QUE MODIFICAN EL CHDLLas opciones terapéuticas para las personas con cHDL bajo son escasas. Con modificación de estilos de vida se puede llegar a una variación del 10%, pero se precisarían intervenciones farmacológicas para lograr los objetivos en la mayoría de los casos. No obstante, la guía enfatiza que no hay evidencia clara de que elevar las HDL repercuta en prevención del riesgo cardiovascular tras el resultado poco alentador con torcetrapib, evacetrapib y dalcetrapib. Actualmente solo queda en marcha el estudio REVEAL (NCT01252953) con anacetrapid (en fase III), que espera demostrar la eficacia y la seguridad de aumentar el cHDL.
Por último, continúa la investigación para buscar fármacos eficaces para aumentar el cHDL y la apolipoproteína A1 (apoA1) con objeto de reducir la progresión de la ateroesclerosis. El principal interés se centra en péptidos miméticos de apoA1, que además puede tener una amplia gama de actividades biológicas, incluidos efectos antiinflamatorios e inmunomoduladores. Sin embargo, los estudios genéticos indican que las bajas concentraciones de cHDL no son la causa de enfermedades cardiovasculares y esto puede poner en cuestión las posibilidades de estas opciones terapéuticas.
En esta guía se echa de menos unas recomendaciones más claras de las cifras de inicio de tratamiento farmacológico, así como un algoritmo que concrete cifras y pasos del tratamiento de la HTG y sobre todo del cHDL disminuido.
TRATAMIENTO DE LAS DISLIPEMIAS EN DIFERENTES SITUACIONES CLÍNICASLa guía anterior3 ya destacaba que las concentraciones plasmáticas de lípidos están determinadas en una elevada proporción por factores genéticos. En la actual se describe que la prevalencia es mayor que la anteriormente conocida. En sus formas más extremas, se manifiestan como hiperlipemias familiares. Entre estas destacan, por su frecuencia y su elevado riesgo cardiovascular, la hiperlipemia familiar combinada (HFC), con una prevalencia de al menos 1:100, y la hipercolesterolemia familiar (HF), con 1:250-300. Se calcula que ambas pueden ser la causa de hasta un 40% de la enfermedad coronaria prematura. La HFC se caracteriza por altas concentraciones de cLDL, TG o ambos y se asocia con frecuencia a diabetes tipo 2, hipertensión arterial y sobrepeso central. Por lo tanto, conocerlo es muy importante para que el médico pueda realizar un diagnóstico y tratamiento precoces18.
Aunque la anterior guía3 resaltaba la importancia de la HF, continúa existiendo un vacío en su detección y tratamiento. La guía actual presenta una mejor definición de los objetivos de tratamiento en cLDL, el empleo del tratamiento combinado (estatinas + ezetimiba) y de la disponibilidad de nuevos fármacos. La HF heterocigota es una causa genética frecuente de enfermedad cardiovascular prematura que afecta a la mitad de la familia, por lo que es crucial que los médicos tomen conciencia de la importancia de su diagnóstico y tratamiento precoces.
La guía describe en detalle los criterios clínicos para su diagnóstico, que se basan en cifras de cLDL elevadas en el sujeto y sus familiares, enfermedad coronaria prematura y xantomas. Sin embargo, se debería insistir en que los mencionados criterios clínicos solo sirven para diagnosticar al caso índice (primer caso identificado en la familia), pero no se deberían aplicar para la detección de otros familiares y especialmente en sujetos jóvenes. La vía más eficaz para identificar nuevos casos es el cribado en cascada de familiares de un caso índice.
Es bien conocida la enfermedad ateroesclerótica coronaria en la HF, pero falta información sobre la afección de otros territorios vasculares. Recientemente, un estudio español del registro SAFEHEART de HF ha demostrado que, aunque menos frecuente, también hay afección cerebrovascular y arteriopatía periférica en los pacientes con HF19,20.
Los inhibidores de la PCSK9, recientemente comercializados en España, pueden ser una alternativa para determinados pacientes con HF. Estos fármacos son muy eficaces y reducen el cLDL un 60% adicional a los pacientes en tratamiento con estatinas. Todavía están pendientes los estudios de morbimortalidad cardiovascular, por lo que se deberían limitar a los pacientes con HF y muy elevado riesgo cardiovascular o con el cLDL lejos de los objetivos a pesar del máximo tratamiento hipolipemiante o que no toleran las estatinas.
Finalmente, hay que destacar que la guía actual hace referencia explícita al anciano, y aproxima su tratamiento al del resto de la población. Como principales novedades respecto a recomendaciones previas, se incrementa el peso de evidencia a favor del uso de estatinas de la misma forma que para pacientes más jóvenes en prevención secundaria (I A), se relaja la recomendación de titular hipolipemiantes en ancianos (de I C a IIa C) y se valora el uso de estatinas en prevención primaria si hay factores de riesgo cardiovascular clásicos asociados (de IIb B a IIa B).
MONITORIZACIÓN DE LÍPIDOS Y ENZIMAS DE PACIENTES EN TRATAMIENTO HIPOLIPEMIANTEEn este apartado, la guía detalla con precisión las recomendaciones para el análisis sistemático de lípidos para valorar la eficacia del tratamiento del paciente y de enzimas para la monitorización de su seguridad. Las principales recomendaciones se recogen en la tabla 2. Es importante destacar que en esta guía se han modificado los valores de corte de elevación de la creatincinasa que contraindican el inicio del tratamiento o recomiendan modificarlo.
Recomendaciones para el análisis sistemático de lípidos y enzimas
| I. Perfil lipídico |
| 1. ¿Con qué frecuencia se debe monitorizar el perfil lipídico? |
| Antes de iniciar el tratamiento con fármacos hipolipemiantes, se debe hacer por lo menos 2 mediciones, con un intervalo de 1-12 semanas, excepto en situaciones en las que se debe iniciar el tratamiento inmediatamente, como en el SCA o los pacientes con muy alto riesgo |
| 2. ¿Con qué frecuencia se debe monitorizar los lípidos de un paciente después de comenzar el tratamiento hipolipemiante? |
| • 8 (± 4) semanas después de comenzar el tratamiento |
| • 8 (± 4) semanas después del ajuste del tratamiento hasta conseguir objetivos terapéuticos |
| 3. ¿Con qué frecuencia se debe monitorizar los lípidos una vez que un paciente ha alcanzado el objetivo terapéutico? |
| • Anualmente, a menos que haya problemas de adherencia u otras razones específicas para revisiones más frecuentes |
| II. Enzimas hepáticas y musculares |
| 1. ¿Con qué frecuencia se debe monitorizar las enzimas hepáticas: ALT en pacientes tratados con fármacos hipolipemiantes? |
| • Antes del tratamiento. |
| • 8-12 semanas después de comenzar el tratamiento o después de aumentar la dosis de fármacos hipolipemiantes |
| • Si el resultado de este control es normal, no se recomienda el control sistemático de ALT a partir de entonces |
| 2. Si las enzimas hepáticas están elevadas debido al tratamiento hipolipemiante: |
| Si ALT < 3 × LSN: |
| • Continuar con la terapia |
| • Volver a comprobar las enzimas hepáticas en 46 semanas |
| Si el valor se eleva a ≥ 3 × LSN: |
| • Detener el tratamiento hipolipemiante o reducir la dosis y volver a comprobar las enzimas hepáticas dentro de 46 semanas |
| • Reintroducción prudente de la terapia cuando los valores de ALT han vuelto a la normalidad |
| • Si ALT permanece elevada: descartar otras causas de elevación enzimática |
| 3. ¿Con qué frecuencia debe medirse la CK en pacientes que toman fármacos hipolipemiantes? |
| Antes de iniciar tratamiento: |
| • Si el valor basal de CK es 4 × LSN, no se debe iniciar terapia farmacológica |
| Durante el tratamiento: |
| • El control sistemático de la CK no es necesario |
| • Solo si el paciente refiere mialgias |
| Préstese mayor atención a la aparición de miopatía y elevaciones de CK en pacientes de riesgo: edad avanzada, con terapia concomitante que pueda interferir en el efecto de la terapia hipolipemiante, polimedicados, insuficiencia renal o hepática o atletas |
| 4. Si la CK está elevada debido al tratamiento hipolipemiante: |
| Revaluar indicación de tratamiento con estatinas |
| 4.1. Si ≥ 4 × LSN: |
| • Si CK > 10 × LSN: |
| Detener tratamiento durante 6 semanas |
| – Controlar la función renal y CK cada 2 semanas |
| – Descartar posibilidad de elevación de la CK transitoria por otras causas: sobreesfuerzo… |
| – Considerar la posibilidad de miopatía si CK se mantiene elevada |
| – Considerar terapia hipolipemiante combinada: estatina de menor potencia + ezetimiba u otro fármaco hipolipemiante |
| • Si CK < 10 × LSN, sin síntomas: |
| – Continuar con la terapia hipolipemiante |
| – Monitorizar CK |
| • Si CK < 10 × LSN, con síntomas presentes: |
| – Suspender estatinas |
| – Vigilar hasta la normalización CK |
| – Reintroducir estatinas a dosis bajas cuando se normalice la CK |
| • Considerar la posibilidad de elevación de la CK transitoria por otras causas: sobreesfuerzo… |
| • Considerar la posibilidad de miopatía si CK se mantiene elevada |
| • Considerar terapia hipolipemiante combinada: estatina de menor potencia + ezetimiba u otro fármaco hipolipemiante |
| 4.2. Si < 4 × LSN |
| • Si no hay síntomas musculares: |
| – Continuar con estatinas (informar al paciente sobre síntomas) |
| – Monitorizar CK |
| • Si hay síntomas musculares: |
| – Monitorizar síntomas y CK regularmente |
| • Si los síntomas persisten: |
| – Suspender estatina 2-4 semanas |
| – Revaluar los síntomas después de 6 semanas |
| – Revaluar indicación de tratamiento con estatinas |
| – Reintroducir la misma estatina u otra de menor potencia |
| – Introducir estatinas a dosis bajas, en días alternos o 12 veces por semana |
ALT: alanina aminotransferasa; CK: creatincinasa; LSN: límite superior normal; SCA: síndrome coronario agudo.
En este apartado se hace especial énfasis en la necesidad de que el paciente no solo logre cambios en el estilo de vida, sino que los mantenga en el tiempo y se adhiera a la medicación. Para esto insiste en la importancia de la comunicación del médico con el paciente. El médico debe informar al paciente de la importancia de lograr objetivos terapéuticos de cLDL por los beneficios que de este logro se obtienen. Se deben desarrollar habilidades de comunicación para llegar a convencer al paciente. Asimismo, se habla de dotar al paciente de herramientas que le permitan mantener un estilo de vida sano y un cumplimiento correcto de su tratamiento. Por último, se aconseja la creación de estructuras de comunicación que faciliten la adherencia al tratamiento.
CONFLICTO DE INTERESESL. Pérez de Isla, honorarios por consultoría, ponencias, realización de material didáctico, asesoría y pago de viajes a congresos científicos de MSD, AstraZeneca, Bayer, MSD, Amgen, Sanofi, Esteve, Ferrer y Aegerion. E. Galve, honorarios por consultoría y ponencias de Sanofi, Ferrer y AstraZeneca y pago de viajes a congresos científicos de Amgen. A. Castro Conde, honorarios por asesoría, consultoría, presentaciones y realización de material y pago de viajes a congresos científicos de Amgen, Sanofi y MSD. L.A. Álvarez-Sala, honorarios por presentaciones de Amgen y MSD.
Grupo de Trabajo de la SEC para la guía ESC 2016 sobre el tratamiento de las dislipemias, revisores expertos para la guía ESC 2016 sobre tratamiento de las dislipemias y Comité de Guías de la SEC.