Palabras clave
STENTS RECUBIERTOS
Durante el último año hemos asistido a una ampliación de las indicaciones de los stents recubiertos (drug-eluting stents [DES]) y a un aumento de su utilización. En España, en 2004 los DES representaron el 36% de los stents implantados, y se pasó de un consumo de 11.699 unidades en 2003 a 25.149 en 20041. A los DES previamente comercializados, el stent de sirolimus o rapamicina (SES, Cypher®) y el de paclitaxol (PES, Taxus®), se han añadido 2 más en 2005: el stent Janus® recubierto de tacrolimus y el stent Endeavour® recubierto de ABT 578 (familia de los limus).
Nuevas indicaciones. Indicaciones de alto riesgo
Superposición de stents. Enfermedad difusa
En el Congreso Europeo de Cardiología de 2005, el profesor Rothman analizó el efecto del solapamiento de stents en 4 grandes estudios con stent Cypher® (SIRIUS, E-SIRIUS, SVELTE, DIRECT), en los que hubo superposición de stents en el 25% de los procedimientos. La tasa de eventos cardíacos mayores (MACE) en el primer año se redujo del 31 al 7% (p < 0,001) y el infarto con onda Q del 4,6 al 1,5% (p = 0,03). Con el stent Taxus® los resultados fueron similares. En el estudio TAXUS V se implantaron stents superpuestos en el 33% de los pacientes, con una reducción de la reestenosis (del 58 al 27%; p < 0,001) en los tratados con PES2.
En el estudio TAXUS VI se evaluó el stent Taxus® en 448 pacientes con lesiones largas (18-40 mm), y se observó una reducción en la tasa de revascularización repetida (TVR) del 19 al 9%. En el mundo real, el grupo de Colombo ha publicado una serie de 66 pacientes con enfermedad difusa de la descendente anterior, en la que sólo 10 (15%) precisaron TVR3.
Enfermedad en vaso pequeño
Antes de la aparición de los DES, la utilidad del stent en el tratamiento de los vasos pequeños estaba en entredicho. En un metaanálisis de 11 estudios aleatorizados que comparaban balón y stent covencional4 en vasos pequeños, las tasa de reestenosis (el 26 frente al 34%), MACE (el 15 frente al 22%) y TVR (13 frente al 17%) fueron menores en los pacientes tratados con stent. En 2 estudios aleatorizados, el SES-SMART y E-SIRIUS, se ha demostrado que el SES también reduce la reestenosis en arterias pequeñas. El SES-SMART5 incluyó a 257 pacientes (vasos < 2,75 mm) con reducción de la reestenosis (del 53 al 10%), infarto (del 8 al 2%) y TVR (del 21 al 7%) en los pacientes tratados con SES. En el estudio SVELTE (vasos 2,25-2,75 mm), la tasa de reestenosis fue del 6,3%, con una pérdida tardía intra-stent de sólo 0,22 mm.
Lesiones en bifurcación
El intervencionismo coronario percutáneo (ICP) de lesiones en bifurcación es todavía un reto por asociarse tanto con peores resultados inmediatos como con una alta tasa de reestenosis. En un estudio aleatorizado de 86 pacientes se comparó la estrategia de utilizar 1 SES (vaso principal) o 2 SES (vaso principal y secundario) en el tratamiento de lesiones en bifurcación6. El estudio resultó difícil de interpretar por el elevado cruzamiento, y se constató una alta tasa de trombosis en el grupo de 2 SES (6%) y una reestenosis no diferente en el vaso principal (el 6 frente al 5%) y en el secundario (el 22 frente al 14%; p = NS) en los grupos finalmente tratados con 2 o 1 SES. Al utilizar la técnica crushing (aplastamiento de la parte proximal del stent del ramo secundario contra la pared del vaso principal, y terminar el procedimiento con inflado simultáneo de balón en ambos vasos) se han obtenido buenos resultados con tasas de reestenosis bajas, tanto en la rama principal como en la secundaria7.
Oclusiones totales
El tratamiento de las oclusiones totales crónicas (OTC) se asocia con una alta tasa de reestenosis. Aunque los primeros estudios con DES excluyeron este tipo de lesiones, recientemente un registro alemán ha publicado una tasa de reestenosis del 13%8 en una serie de 45 OTC tratadas con PES. En otro estudio9 se comparan los resultados de la implantación de un PES en 48 pacientes con OTC con los de un grupo macheado de pacientes tratados con stent convencional. Al año, las tasas de MACE (el 48 frente al 12%; p < 0,001), reestenosis (el 51 frente al 8%; p < 0,001) y reoclusión (el 23 frente al 2%; p < 0,001) fueron menores en los pacientes tratados con PES. Con el SES se han comparado los resultados de 60 pacientes con OTC tratados con SES con los de 120 tratados con stent convencional, y se observa una reducción de la reestenosis (del 32 al 2%) y de la reoclusión (del 6 al 0%) en los pacientes tratados con SES10.
Enfermedad de tronco principal izquierdo
Con la incorporación del stent convencional, la enfermedad del tronco coronario izquierdo (TCI) dejó de ser una contraindicación para el intervencionismo coronario, pero aunque el resultado inmediato era frecuentemente bueno, la tasa de reestenosis era elevada y a veces ésta se iniciaba con un episodio de muerte súbita. Aunque los primeros estudios con DES excluyeron el TCI, en la actualidad se conocen numerosas series con buenos resultados y hoy día es una práctica habitual en la mayoría de los laboratorios de hemodinámica. En el Thoraxcenter de Rotterdam se han comparado los resultados de 86 stents convencionales con 95 DES implantados en el TCI, en los que se observa una menor tasa de infarto (del 12 al 4%) y de TVR (del 23 al 6%)11 en los pacientes tratados con DES, datos que se confirman en la serie de TCI tratados con DES del grupo de Park et al12, en la que la tasa de reestenosis fue del 9%. A la vista de estos resultados, la utilización de DES en la ACTP del TCI parece ampliamente justificada.
Reestenosis intra-stent
La reestenosis intra-stent (RIS) es una nueva enfermedad creada por el ICP. Su tratamiento, sobre todo si es difusa, se asocia con una alta tasa (38% en estudio RIBS I) de segunda reestenosis, tanto si se trata con balón, como con stent convencional o aterectomía. La braquiterapia coronaria, aunque efectiva, precisa una infraestructura material y humana importante de la que disponen sólo en unos pocos centros. Por otra parte, la disminución de los casos de RIS en la era de los DES ha reducido el número de pacientes con RIS, lo que ha llevado a las compañías fabricantes de catéteres de ß-radiación a retirarlos del mercado en 2005. Con respecto a la eficacia de los DES en el tratamiento de la RIS, los datos habían sido contradictorios, ya que mientras Sousa encontró 1 solo caso (1/25) de reestenosis, tanto la en serie de Serruys como en el TAXUS III (28 pacientes tratados con PES, reestenosis del 16%, TVR del 21%) los resultados fueron peores. En el estudio ISAR-DESIRE13 300 pacientes con RIS fueron aleatorizados dilatación con balón, PES o SES, y se encontraron tasas de reestenosis del 33, 19 y 8%, respectivamente. En el estudio RIBS II14, en el que se incluyó a 150 pacientes aleatorizados a SES o balón, las tasas de reestenosis fueron del 11 y el 39% (p < 0,001), respectivamente. Por tanto, aunque en el contexto de la RIS, la tasa de reestenosis es más alta que en las lesiones de novo, sobre todo con el PES, la utilización sistemática de DES está suficientemente documentada.
Diabetes mellitus
Los pacientes diabéticos tienen una tasa muy alta de reestenosis. Los subgrupos de diabéticos de los estudios SIRIUS y TAXUS mostraron resultados más favorables con los DES que con los stents convencionales, aunque con tasas de reestenosis más altas que las de los pacientes no diabéticos. El estudio DIABETES I comparó el SES con el stent convencional en pacientes diabéticos, con una reducción de la tasa de reestenosis del 31 al 7%15. En el registro DIABETES II con stent Taxus®, la tasa de reestenosis (7%) fue similar a la del grupo Cypher® del DIABETES I, si bien la pérdida luminal fue considerablemente mayor (0,42 frente a 0,08 mm; p < 0,001). En el estudio ISAR-DIABETES16 se compararon los resultados del SES con el PES en un grupo de 250 diabéticos, y se encontró reestenosis del 7 y el 16%, respectivamente (p = 0,03), sin diferencias significativas en la TVR (el 6 frente al 12%; p = 0,19).
Angioplastia primaria
Desde el principio de la utilización de los DES se tuvo reticencia a utilizarlos en las lesiones con trombo por considerarlos potencialmente inductores de trombosis aguda o tardía debido al retraso en la reendotelización. Después de comunicaciones más o menos anecdóticas, disponemos ya de series de pacientes con infarto agudo de miocardio (IAM) tratados con DES. Cheneau et al17 han comparado los resultados de 153 pacientes consecutivos con angioplastia coronaria transluminal percutánea (ACTP) primaria con implantación de un SES con los de una serie de 504 pacientes consecutivos tratados con stent convencional. No se observaron diferencias con respecto al resultado inmediato, reduciéndose sin embargo la TVR del 10 al 1% (p = 0,014) en el grupo DES.
Injertos de safena
Los primeros estudios con DES también excluyeron los injertos de safena. Recientemente, en el estudio SECURE18 se incluyeron 76 puentes de safena tratados con DES con resultados satisfactorios, tanto clínicos como en la inhibición del crecimiento neointimal. El grupo de Colombo comparó la implantación de DES y stent convencional en dos grupos de pacientes consecutivos con enfermedad en puentes de safena, y se encontró una menor tasa de reestenosis (el 11 frente al 28%; p = 0,02) y TVR (el 3 frente al 20%; p = 0,003)19 en los pacientes tratados con DES.
Nuevos stents aprobados y pendientes de aprobación
El stent Janus® presenta unas celdillas en la pared externa que permiten que el tacrolimus entre en contacto sólo con la pared del vaso y no con la luz arterial. En el Congreso Europeo de Cardiología se presentaron los resultados clínicos a los 6 meses del estudio JUPITER II, que incluyó a 332 pacientes aleatorizados a stent Janus® o a otro de plataforma idéntica, pero sin fármaco. No se han comunicado trombosis tardías y la tasa de eventos adversos (en todos los casos TVR) fue del 10 y el 6% en los grupos control y tacrolimus, respectivamente.
El stent Endeavour® utiliza una plataforma de cromo-cobalto con un recubrimiento de ABT578 (acción similar al sirolimus). En el estudio ENDEAVOR I (seguridad y eficacia) se implantó un stent Endeavor® a 100 pacientes que tuvieron una tasa de eventos clínicos del 2% a los 12 meses. En el estudio ENDEAVOUR II se aleatorizó a 1.200 pacientes para recibir stent con o sin fármacos. Los resultados a los 12 meses mostraron una reducción de los MACE (del 16 al 8%) y la TVR (del 13 al 6%) en los pacientes tratados con stent Endeavour®.
Estudios comparativos entre los distintos stents recubiertos
Hasta este año no disponíamos de comparaciones directas entre diversos DES, ni se tenía información sobre las posibles diferencias entre distintos DES en determinados contextos clínico/anatómicos como la diabetes o la RIS. Los estudios REALITY, SIRTAX e ISAR-DIABETES comparan los SES y PES. En los 3 estudios, la pérdida tardía fue significativamente inferior con el SES que con el PES. La reestenosis angiográfica fue también menor en los últimos 2 estudios, pero estas diferencias sólo tuvieron traducción clínica en el SIRTAX. En el estudio TAXI (202 pacientes aleatorizados a SES o PES) no se demostraron diferencias en los MACE o la TLR20. El grupo de Rotterdam ha comparado los resultados del RESEARCH (508 pacientes consecutivos tratados con SES) con los del T-SEARCH (576 pacientes consecutivos tratados con PES) sin encontrar diferencias significativas en TLR (el 3,7 frente al 5,4%; p = 0,3)21. Recientemente se ha publicado un estudio aleatorizado y ciego con 1.012 pacientes tratados con SES o PES22. La tasa de MACE fue menor en el grupo SES (el 6 frente al 11%; p = 0,009) debido a una menor TVR (el 5 frente al 8%; p = 0,03); en un subgrupo de 540 pacientes con seguimiento angiográfico sistemático, la reestenosis del grupo SES fue menor (el 7 frente al 12%; p = 0,02). En un metaanálisis de 6 estudios que comparan SES y PES (3.669 pacientes), tanto la TLR (el 5 frente al 8%; p = 0,001) como la reestenosis (el 9 frente al 13%; p = 0,001)23 fueron menores con el SES. El estudio BASKET24 (806 pacientes) compara SES, PES y stent convencional en el «mundo real». Aunque el estudio no estaba diseñado para demostrar diferencias entre DES, parece haber una tendencia hacia una menor tasa de TLR con el SES (fig. 1).
Fig. 1. Resultados del estudio BASCKET. Eventos cardíacos a los 6 meses en pacientes tratados con stents convencionales, stents farmacoactivos (sirolimus o paclitaxel), stents de sirolimus y stents de paclitaxel. Tomada de Kaiser et al24.
En cuanto a la comparación de SES y PES en diversas situaciones clínicas, ya se han mencionado los resultados de los estudios DIABETES I y II y de ISAR-DIABETES, que demuestran menor pérdida luminal y menor tasa de reestenosis con el SES, aunque sin diferencias en los MACE, probablemente por razones de tamaño de muestra. Igualmente, en la RIS los resultados del ISAR DESIRE13 parecen confirmar unos mejores resultados con el SES que con el PES, en este caso con traducción clínica.
En lo que respecta a los pacientes con IAM, el grupo de Rotterdam comparó los resultados de 136 PES implantados en el IAM con 186 SES; tanto la supervivencia libre de eventos al año (el 90 frente al 85%) como la TVR (el 0 frente al 1,5%) fueron similares25.
No hay estudios comparativos con los nuevos stents, aunque están en marcha los estudios ENDEAVOUR III y IV que comparan el stent Endeavour® con el Cypher® y el Taxus®, respectivamente.
INTERVENCIONISMO CORONARIO EN LOS SÍNDROMES CORONARIOS AGUDOS
Estrategia invasiva frente a conservadora en el síndrome coronario agudo sin elevación del segmento ST
Durante el año 2005 se han publicado resultados interesantes que apoyan la utilización del intervencionismo precoz en el manejo de los síndromes coronarios agudos sin elevación del segmento ST (SCASEST). Aunque el seguimiento a 12 meses del estudio RITA 3 no había mostrado diferencias en cuanto a la incidencia de muerte o infarto en los grupos invasivo y conservador (intervencionismo guiado por isquemia), el seguimiento a 5 años ha evidenciado una mortalidad cardiovascular menor (el 10 frente al 7%; p = 0,03) en el grupo con manejo invasivo26.
El estudio ICTUS27 aleatorizó a pacientes con SCASEST de alto riesgo a una estrategia invasiva precoz frente a una estrategia conservadora. Los resultados al año no mostraron diferencias en el objetivo combinado de muerte, infarto o rehospitalización por angina. Sin embargo, los pacientes del grupo conservador tuvieron una estancia hospitalaria más larga y un mayor número de rehospitalizaciones por angina. Un hecho que se debe tener en cuenta es que un 54% de los pacientes del grupo conservador había sido revascularizado al final del seguimiento.
Tratamiento antitrombótico asociado al ICP en los SCASEST
En el terreno de los inhibidores de los receptores de la glucoproteína IIb/IIIa, el metaanálisis de Bavry et al28 con 6.750 pacientes demostró una mejoría en la supervivencia en pacientes sometidos a estrategia invasiva precoz (stent + inhibidores de la glucoproteína IIb/IIIa). Sin embargo, en el estudio ELISA II29, el empleo de tirofibán, añadido a aspirina y clopidogrel, no demostró beneficio clínico frente a la asociación de aspirina y clopidogrel.
En el campo de los fármacos antitrombina, el estudio REPLACE 2 publicado en 2004 demostró que durante el ICP la administración de bivalirudina (+ uso selectivo de inhibidores de la glucoproteína IIb/IIIa) era igualmente efectiva que la asociación heparina + inhibidores IIb/IIIa en cuanto a los MACE al año se refiere, pero con la ventaja de reducir el número de complicaciones hemorrágicas. Recientemente se han publicado los resultados del subgrupo de diabéticos del REPLACE-230 con resultados similares a los de la población general. Actualmente se encuentra en marcha el estudio ACUITY, que determinará el posible beneficio del uso de bivalirudina en el SCASEST.
La utilidad del fondaparinux (inhibidor específico del factor Xa) en comparación con enoxaparina se ha evaluado en 20.078 pacientes con SCASEST en el estudio OASIS 531, con resultados similares en ambos grupos en cuanto al total de MACE pero con reducción del número de hemorragias y de la mortalidad total al mes en el grupo fondaparinux.
Estrategias de repercusión en el infarto agudo de miocardio con elevación del segmento ST
Establecida en años anteriores la superioridad de la angioplastia primaria sobre la trombólisis en la reperfusión del IAM con elevación del segmento ST, las más recientes guías de actuación publicadas por la Sociedad Europea de Cardiología32 indican que la angioplastia primaria es el tratamiento de elección (indicación clase IA) en pacientes con IAM que acuden a centros con disponibilidad de ICP. La angioplastia primaria también es indicación IA para los pacientes que, al presentarse en un hospital sin ICP, lo hacen entre las 3-12 h del inicio del cuadro; de acuerdo con las guías, estos pacientes deberían ser trasladados de forma inmediata a un centro intervencionista para ICP. Sin embargo, los pacientes que acuden con menos de 3 h de evolución no precisan ser trasladados, ya que en esta situación las guías consideran que la trombólisis es tan eficaz como la angioplastia primaria. De forma novedosa, las guías otorgan una indicación de clase IA al cateterismo en las primeras 12 h del IAM tratado con éxito mediante trombólisis. Esta última indicación se basa en el resultado de los estudios SIAM III, GRACIA I33, LPLS34 y CAPITAL-AMI35. Estos últimos 2 estudios compararon una estrategia conservadora clásica de trombólisis y cateterismo si hay isquemia espontánea o inducida frente al cateterismo sistemático y la revascularización precoz (24 h). En el CAPITAL-AMI35, el ICP precoz tras TNK se asoció con una tasa menor de eventos isquémicos sin incremento de las complicaciones hemorrágicas. En el estudio alemán34, la trombólisis prehospitalaria seguida de ICP precoz se asoció con un menor tamaño del infarto y una mejor reperfusión tisular que el manejo conservador posfibrinólisis. Igualmente, el estudio aleatorizado DECOPI36 demostró que una estrategia invasiva algo más tardía (2-5 días) posfibrinólisis se asoció con una mejor función ventricular a los 6 meses, aunque con un coste económico mayor.
En cuanto a los pacientes con IAM > 12 h de evolución, el ensayo clínico BRAVE demostró una mejor evolución en los pacientes sometidos a cateterismo + ICP que en los no revascularizados de forma sistemática37.
Tratamiento antiplaquetario/antitrombótico asociado al ICP del IAM
En lo referente a la mejora de los resultados de la angioplastia primaria, diversos estudios han analizado el valor de diversas estrategias para disminuir el daño tisular, mejorar la función ventricular residual y reducir los MACE. En el plano farmacológico, el metaanálisis de De Luca et al38 demostró que el uso de abciximab con el ICP reducía la mortalidad a 30 días y a largo plazo. Otro antagonista de los receptores de la glucoproteína IIb/IIIa, el eptifibatide administrado en el servicio de urgencias, mejoraba del flujo de la arteria causante del IAM en la angiografía inicial39.
El empleo de adenosina IV antes de la trombólisis o la angioplastia primaria no demostró efectos beneficiosos respecto al placebo en el estudio AMISTAD-II40, aunque con la dosis más alta empleada (70 µg/kg/min) se observó una reducción significativa del tamaño del IAM.
Dispositivos de trombectomía y protección distal en el ICP del IAM
La microembolización y la macroembolización durante la angioplastia coronaria, y especialmente en el IAM, es indiscutida, y se dispone de estudios antiguos y recientes41 que lo demuestran. Los dispositivos de protección distal, bien oclusores o basados en filtros, despiertan un interés no sólo conceptual, sino que han demostrado su eficacia frente a la embolización. Paradójicamente, esa eficacia no se ha acompañado de un beneficio clínico, y se mantienen las dudas sobre la conveniencia de utilizarlos sistemáticamente en el ICP del IAM42. En el estudio aleatorizado PROMISE (200 pacientes), el empleo del dispositivo FilterWire EX® (Boston Scientific) no mostró beneficio en los MACE, los parámetros de flujo en la arteria causante o el tamaño del infarto. En el estudio EMERALD43, el Percosurge® (dispositivo de oclusión distal y aspiración) tampoco demostró un beneficio clínico ni angiográfico a pesar de demostrarse su efectividad en la extracción de partículas. Una posible respuesta a estos fracasos podría estar en el trabajo de Mizote et al44, en el que se analiza el beneficio del uso del dispositivo de protección distal en función de los datos angioscópicos (rotura o no de placa) y se encuentra (reducción del tamaño del IAM, resolución del segmento ST y mejor grado de perfusión miocárdica) en los pacientes que tenían rotura de placa.
En cuanto a los dispositivos extractores de trombo, en el estudio REMEDIA, el empleo del aspirador manual Diver® (Invatec, Brescia, Italia) se asoció con mejores resultados angiográficos y electrocardiográficos que cuando no se utilizaba el dispositivo45. En la misma dirección, el ensayo clínico X AMINE ST46 demostró una mejor resolución del ST tras la utilización del sistema de trombectomía X-Sizer® (eV3 White Bear Like, Minnesota).
Por tanto, en el momento actual, bien asentado el uso del stent y de los inhibidores de la glucoproteína IIb/IIIa, queda todavía por determinar si los dispositivos extractores de trombo son una herramienta útil y necesaria en el ICP del IAM.
AVACES EN EL DIAGNÓSTICO INTRACORONARIO
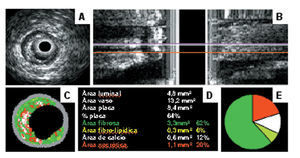
Si bien la ecografía intracoronaria (IVUS) no es una herramienta clínica indispensable en la mayoría de los procedimientos de intervencionismo coronario47, su contribución ha sido notable en la investigación de la fisiopatología, la progresión y la regresión de la enfermedad coronaria, así como en la evaluación de nuevos dispositivos en ICP. Probablemente, el campo de mayor actualidad en las técnicas de imagen intracoronaria es la caracterización de la placa de ateroma. Los avances técnicos nos permiten aproximarnos a una «histología in vivo», cuya utilidad clínica sería el poder identificar características de placa asociadas con inestabilización y alto riesgo de presentación de un síndrome coronario agudo. Recientemente, mediante el análisis espectral de la señal de radiofrecuencia emitida y recogida por la sonda de ecografía y su codificación en colores, se han obtenido imágenes que, definidas como «histología virtual» (fig. 2), han permitiendo correlacionar la composición de la placa de ateroma con el remodelado coronario48. Aunque las características morfológicas de la placa observadas por la ecografía intracoronaria tradicional siguen permitiendo correlacionar parámetros morfológicos con el resultado de distintos tratamientos49, cabe esperar que los resultados de los distintos estudios en marcha50 basados en las nuevas técnicas de histología virtual y palpografía permitan avanzar en la prevención y el tratamiento de la enfermedad coronaria.
Fig. 2. Diversas técnicas de estudio de una placa aterosclerótica: A. ecografía intravascular. Se aprecia una placa excéntrica fibrolipídica entre las 6 y las 12 con algunas zonas de calcificación en su interior. B. retirada automática con reconstrucción longitudinal. C. histología virtual con codificación en color. Las zonas verdes corresponden a placa fibrosa, las rojas a zonas lipídicas y las blancas a zonas con calcificación. D. composición de la placa por histología virtual. Se trata de una placa predominantemente fibrosa con algunas zonas de calficación y hasta un 20% de componente lipídico. E. representación gráfica de los diversos componentes de la placa.
La guía de presión ha mantenido su valor como método invasivo para valorar la significación funcional de determinadas lesiones. Una reserva fraccional de flujo > 0,75 identifica lesiones que no precisan tratamiento incluso en el TCI51, la enfermedad multivaso52 o en ramas colaterales «enjauladas» por el stent.
TERAPIA CELULAR
La terapia celular representa una nueva opción de tratamiento coadyuvante a la reperfusión coronaria, cuya utilidad se puede explicar por los siguientes mecanismos: a) diferenciación celular directa de células mononucleares de médula ósea a cardiomiocitos; b) crecimiento e incremento de miocitos viables residuales inducido por citoquinas; c) estimulación de células madre miocárdicas intrínsecas (residentes); d) inducción de fusión celular entre las células de médula ósea trasplantadas y los miocitos residentes; e) diferenciación celular de mioblastos autólogos de origen esquelético, y f) liberación de factores angiogénicos.
Aunque persisten dudas en relación con los mecanismos subyacentes, el concepto de regeneración miocárdica se ha introducido en el terreno clínico y se ha comprobado que la administración de células de la médula ósea por vía intracoronaria es factible y segura, pero sin demostración sólida de su efectividad. En 2004 se publicaron la experiencia del grupo de Valladolid53 (registro de 20 pacientes revascularizados y tratados con células mononucleares 13 días después del IAM con mejoría de la función ventricular a los 6 meses), el estudio BOOST54 (60 pacientes con IAM revascularizado aleatorizados a terapia celular o placebo con mejoría de la función ventricular en los pacientes con tratamiento activo) y el estudio MAGIC55 (27 tratados con terapia celular, factor de estimulación de los granulocitos o placebo con mejoría de la función ventricular en los tratados con terapia celular y una tasa inesperadamente alta de reestenosis en los tratados con factor de estimulación de los granulocitos).
En cuanto a la administración de factores de estimulación, la experiencia es también muy limitada56-58; la única complicación comunicada ha sido la rotura espontánea de bazo (1 paciente); no se ha confirmado el aumento de la reestenosis y en los 3 estudios mencionados se describe una mejoría en la función ventricular en comparación con los pacientes del grupo placebo.
En lo referente a la implantación de mioblastos, en el estudio POZNAN se ha usado la vía epicárdica para inyectar mioblastos de forma directa durante la cirugía y por vía transvenosa desde el sistema venoso coronario por vía percutánea59. Las arritmias graves han sido el principal problema de la implantación de mioblastos.
Estos datos son a todas luces preliminares y se precisan estudios bien diseñados que confirmen y sustenten los resultados apuntados en los apartados anteriores. Sin embrago, quedan muchas preguntas sin responder acerca del tipo de células que se debe trasplantar, los mecanismos de anidación que intervienen, la necesidad de dirigir las células y, lo más importante, el impacto clínico de esta terapia. La respuesta a estas preguntas sólo puede venir de la colaboración de los científicos básicos y clínicos de diversas disciplinas que, con la ayuda de nuevas técnicas tanto convencionales como moleculares, podrán establecer en los próximos años la utilidad real de esta novedosa y prometedora estrategia terapéutica.
INTERVENCIONISMO NO CORONARIO
Prótesis aórtica percutánea
Desde que Cribier realizó la primera implantación de una prótesis aórtica, la prótesis utilizada (Cribier-Edwards) sigue su lento proceso de evaluación (factibilidad, seguridad y eficacia), aunque se ha utilizado sólo en pacientes no considerados susceptibles de cirugía. En el último Congreso Europeo de Cardiología60 se presentaron los resultados de 41 procedimientos, en 30 de los cuales se consiguió implantar correctamente la prótesis y se obtuvo una mejoría hemodinámica y clínica sustancial. Conforme se tiene más experiencia, la tasa de éxito ha aumentado y la de complicaciones ha disminuido.
Se esta trabajando en otras prótesis que ya se han implantado en humanos, en concreto una de pericardio bovino montada en un stent autoexpandible de nitinol (Core-Valve)61 y otra (Percutaneous Technologies) también de pericardio bovino montada en un stent tubular expandible con balón62.
Recientemente se ha publicado un documento de consenso63 elaborado por las 2 sociedades de cirujanos y la de hemodinamistas americanos, en el que se sientan las bases de lo que debe ser una evaluación correcta de los nuevos procedimientos valvulares, tanto percutáneos como quirúrgicos.
Dispositivos de tratamiento de la regurgitación mitral
El papel de los procedimientos percutáneos sobre la válvula mitral, tanto los que tratan de reducir el tamaño del anillo como los que acercan los velos (edge to edge), está en período de investigación clínica64 inicial, sin que todavía pueda vislumbrarse su posible nicho terapéutico en el tratamiento de la regurgitación mitral.
Cierre de foramen ovale permeable
El foramen ovale permeable (FOP) es una entidad que afecta al 25% de la población adulta y al 50% de los pacientes con ictus criptogéntico, por lo que se ha supuesto una relación causal (no bien demostrada) entre el FOP y el embolismo cerebral. El número de cierres de FOP en Europa es muy variable, con un número de procedimientos muy alto en Alemania y muy bajo en España. El procedimiento es visto en general con entusiasmo por los cardiólogos intervencionistas y con cierto escepticismo por parte de muchos neurólogos. Hay varios dispositivos de cierre con una alta tasa de éxito y baja de complicaciones (1%) si bien hay casos de migración, trombosis y perforación. Las indicaciones están en debate65-67, faltan resultados a largo plazo y, sobre todo, faltan estudios aleatorizados que comparen el cierre percutáneo con el tratamiento anticoagulante convencional. Con la información actual, los pacientes jóvenes con ictus criptogenético y hipercoagulabilidad, problemas con la anticoagulación, recidiva en tratamiento anticoagulante o trombosis venosa profunda pueden considerarse candidatos al procedimiento, sobre todo si el FOP es de morfología tuneliforme, se asocia con aneurisma del septo y/o cortocircuito importante. El papel de la ecocardiografía es esencial en el control del procedimiento y cada vez se aprecian más las ventajas de la ecocardiografía intracardíaca. Otras posibles indicaciones de cierre del FOP son la migraña, el síndrome platipnea-ortodeoxia y el síndrome de descompresión en los practicantes del submarinismo, aunque en ninguna de ellas se ha probado de forma definitiva la utilidad del cierre.
Cierre de la orejuela
La utilidad del cierre de la orejuela izquierda en pacientes con ictus recurrente está siendo objeto de estudio desde que se dispone del dispositivo PLAATO, que aísla la orejuela de la circulación68. Tras un primer estudio de factibilidad69 se ha iniciado un estudio multicéntrico europeo con el dispositivo PLAATO que evaluará su utilidad para prevenir el ictus en pacientes con limitaciones para una correcta anticoagulación.
Ablación septal de la miocardiopatía hipertrófica
Se trata de una alternativa a la miomectomía quirúrgica indicada en pacientes con síntomas refractarios a pesar de tratamiento con bloqueadores beta y/o antagonistas del calcio. El candidato ideal para el procedimiento es un paciente severamente sintomático con importante hipertrofia septal (18-30 mm), movimiento sistólico anterior, gradiente significativo y cierto grado (no severo) de regurgitación mitral70. El número de procedimientos ha ido en aumento a pesar de la falta de estudios que los comparen con la cirugía. Aunque pueda parecer simple a primera vista, la técnica es compleja (requiere la localización precisa de la rama septal más apropiada por ecografía de contraste tras inyección supraselectiva de contraste ecocardiográfico) y pueden surgir complicaciones derivadas de la administración de alcohol en lugares inapropiados y de la propia necrosis septal producida (bloqueo AV transitorio en el 50% de los casos, definitivo en el 5-10%). Recientemente se han publicado los resultados a 6 años de 137 pacientes (74 varones, 56 mujeres, 51 ± 17 años) tratados en Baylor (1996-1999)71. La mortalidad del procedimiento fue del 1,5%, el pico de creatincinasa de 1676 ± 944 U y un 13% requirió marcapasos definitivo. Tras 6 años de seguimiento persistía la disminución del gradiente basal y provocado, así como la mejoría clínica, y se observó una mortalidad cardiovascular del 0,6% anual, por lo que se considera que en manos expertas la ablación septal es un procedimiento útil, eficaz y duradero en pacientes seleccionados.
TÉCNICAS NO INVASIVAS DE VISUALIZACIÓN DE LAS ARTERIAS CORONARIAS
El desarrollo tecnológico ha permitido la aplicación de diversas técnicas de imagen al estudio no invasivo de las arterias coronarias, de las cuales la tomografía computarizada (TC) multicorte es la que ha resultado de mayor utilidad. La TC multicorte utiliza una fuente móvil de rayos X, detectores móviles en rotación continua y una mesa de exploración también móvil. Se requiere la utilización de contraste angiográfico (100-120 ml), una frecuencia cardíaca lenta (pueden utilizarse bloqueadores beta) y un tiempo de apnea variable dependiendo del número de detectores. La resolución espacial de los equipos de 64 detectores se acerca a la de la coronariografía convencional (0,4 frente a 0,25 mm), pero la temporal es sensiblemente peor (165 frente a 6 ms). Esta técnica tiene la ventaja de proporcionar, además, información cuantitativa (número de placas, severidad) y cualitativa (características de las placas ateroscleróticas, vulnerabilidad) sobre la pared del vaso, información que no aporta la coronariografía invasiva más que con el uso combinado del IVUS. La valoración de las características de las placas requiere una definición o clasificación de los patrones «histológicos» de la TC multicorte y su correlación con los síndromes clínicos. En la actualidad, su disponibilidad en España está limitada a unos pocos centros (sólo 14 centros públicos disponen de TC de 16 detectores, ninguno de 64).
Desde el punto de vista de su capacidad para definir la anatomía coronaria, la TC multicorte de 64 detectores fue capaz de detectar el 73% de las lesiones > 50%, el 80% de las > 75%, el 88% de las presentes en segmentos proximales y el 91% de las que requieren revascularización, con una especificidad global del 97% en una población de pacientes con alta probabilidad de cardiopatía isquémica72. En otro estudio73, el valor predictivo positivo fue de 66% por segmento, del 80% por arteria y del 93% por paciente, con unos valores predictivos negativos del 98, 97 y 93% por segmento, arteria y paciente, respectivamente, datos similares a los observados en otras series74 pero superiores a los publicados con 16 detectores75. Tanto la sensibilidad como la especificidad son menores en poblaciones de bajo riesgo, en pacientes obesos, taquicárdicos, con calcificación coronaria intensa, stents y oclusiones totales con buena circulación colateral. Un hecho importante es la alta dosis de radiación recibida por el paciente (10-14 mSv), dosis varias veces mayor que la recibida en una coronariografía convencional76.
En cuanto a la utilidad clínica de esta modalidad diagnóstica, no parece apropiada en pacientes con alta probabilidad de cardiopatía isquémica y eventual requerimiento de revascularización (síndromes coronarios agudos o pacientes con angina típica y pruebas de isquemia positivas). En estos casos, un diagnóstico no invasivo previo llevaría a duplicar la dosis de contraste, multiplicar varias veces la dosis de radiación y retrasar la revascularización. Sin embargo, la técnica puede ser muy útil en pacientes con baja probabilidad de cardiopatía isquémica77 (pacientes con dolor torácico y pruebas de isquemia negativas, evaluación coronaria prequirúrgica en pacientes valvulares, evaluación precirugía mayor no cardíaca, miocardiopatías, arritmias o trastornos de la conducción de origen no isquémico, profesiones de riesgo, etc.). También podrá ser útil en el seguimiento postoperatorio de la permeabilidad de los injertos coronarios78 o de las lesiones dilatadas con stent79. Dada la alta dosis de radiación que conlleva, debería evitarse la vanalización de la exploración, su aplicación excesivamente liberal por parte del médico y la autoindicación por parte del paciente.
Por tanto, todo parece indicar que tanto la coronariografía invasiva como la no invasiva son 2 técnicas útiles aplicadas en distintos tipos de pacientes, la invasiva para los pacientes de alto riesgo y la no invasiva para los de bajo riesgo. En los de riesgo intermedio, como en tantas otras técnicas diagnósticas, será la disponibilidad lo que finalmente dirija el flujo de pacientes. Cabe esperar que la selección de pacientes de bajo riesgo para la TC multicorte reducirá el número de pacientes con coronarias normales sometidos a coronariografía convencional. En contrapartida, es posible que algunos pacientes sin indicación de coronariografía terminen haciéndosela tras una TC multicorte dudosa o falsamente positiva. En cualquier caso, es importante recordar que ninguna de ellas sustituirá la correcta evaluación clínica de los pacientes.
Correspondencia: Dra. R.A. Hernández Antolín.
Unidad de Hemodinámica. Hospital Clínico San Carlos.
Martin Lagos, s/n. 28040 Madrid. España.
Correo electrónico: rhernandez_antolin@hotmail.com