La asistencia de los pacientes con descompensación aguda de la insuficiencia cardiaca está cambiando gracias a la disponibilidad y el conocimiento de varios nuevos biomarcadores de la insuficiencia y otros que están apareciendo. Los patrones de referencia como biomarcadores en la insuficiencia cardiaca son el péptido natriurético tipo B y la fracción aminoterminal del propéptido natriurético tipo B, que desempeñan un papel importante en el diagnóstico, el pronóstico y el tratamiento de la insuficiencia cardiaca aguda descompensada. Los nuevos biomarcadores que se relacionan de manera creciente con los procesos de lesión miocárdica, activación neurohormonal y remodelado ventricular son prometedores para mejorar el diagnóstico y el pronóstico de los pacientes con insuficiencia cardiaca aguda descompensada. Entre ellos se encuentran la región media del propéptido natriurético auricular, la ST2 soluble, la galectina-3, la troponina de alta sensibilidad y la región media de proadrenomedulina. También se ha asistido a la aparición de biomarcadores para la evaluación de la insuficiencia cardiaca aguda descompensada que facilitan el diagnóstico diferencial de la disnea, como la procalcitonina (para la identificación de la neumonía aguda), así como de marcadores que predicen las complicaciones de la insuficiencia cardiaca aguda descompensada, como son los marcadores de la lesión renal. En este artículo se examina la fisiopatología y la utilidad de los biomarcadores establecidos y los nuevos biomarcadores surgidos para el diagnóstico clínico, el pronóstico y el tratamiento de la insuficiencia cardiaca aguda descompensada.
Palabras clave
La insuficiencia cardiaca aguda descompensada (ICAD) es un trastorno frecuente y heterogéneo que resulta difícil de diagnosticar y tratar. La evaluación y la identificación correcta de la ICAD en los pacientes con disnea (el síntoma cardinal de los pacientes afectados) pueden resultar difíciles1; cuando existen dudas acerca del diagnóstico, el riesgo es mayor. Además, el retraso en el diagnóstico de la ICAD se asocia a una mortalidad superior2. En consecuencia, la ICAD no es solo una morbilidad, sino que se asocia a unos gastos de asistencia sanitaria considerables. Son imprescindibles mejoras en la evaluación y el manejo del diagnóstico, sobre todo ante la incidencia y prevalencia crecientes de la insuficiencia cardiaca (IC) en la comunidad.
Aunque la base de la evaluación de la ICAD es, y deberá ser siempre, una historia clínica y una exploración física estándar, se ha demostrado que las pruebas complementarias que respaldan el juicio clínico mejoran la exactitud del diagnóstico y facilitan el pronóstico y el manejo de los pacientes. Para que resulten útiles, estas pruebas complementarias deben ser de acceso rápido, fáciles de interpretar, adicionales a las variables clínicas y otras pruebas objetivas, y tener una relación coste-efectividad favorable3. A este respecto, a lo largo de la última década han aparecido varios biomarcadores que facilitan el diagnóstico, la estratificación del riesgo y el manejo de la ICAD.
PÉPTIDOS NATRIURÉTICOSDe entre los biomarcadores utilizados en la ICAD, los péptidos natriuréticos son los mejor estudiados y validados, y constituyen el patrón de referencia con el que se comparan todos los demás marcadores. La utilidad del péptido natriurético tipo B (BNP) y de su forma inactiva, la fracción aminoterminal del propéptido natriurético tipo B (NT-proBNP), se refleja en su incorporación a las guías de práctica clínica para el diagnóstico de la IC, publicadas por el American College of Cardiology, la American Heart Association4, la Heart Failure Society of America5 y la Sociedad Europea de Cardiología6.
Tanto el péptido natriurético auricular (ANP) como el BNP se producen fundamentalmente en los miocitos de las aurículas y los ventrículos, respectivamente7, y se elaboran en respuesta a la distensión del miocito causada por una sobrecarga de volumen o de presión8. Mientras que el ANP se elabora previamente y se almacena en los gránulos del citosol del miocardiocito, el BNP se sintetiza de novo cuando se necesita. Después de una serie de pasos de procesamiento durante la síntesis, en ambos casos se produce un propéptido que es la forma previa al ANP y el BNP; tras los efectos de las enzimas proteolíticas corina y furina, los propéptidos (proANP y NT-proBNP) se fragmentan de los ANP y BNP maduros y se liberan al mismo tiempo como péptidos natriuréticos hormonales carboxiterminales biológicamente activos. Tal como se comentará, los propéptidos aminoterminales son fundamentalmente equivalentes a la determinación de los péptidos natriuréticos maduros biológicamente activos, que luego se fragmentan para la aplicación diagnóstica/pronóstica.
Aunque el ANP, el BNP y sus equivalentes de propéptidos aminoterminales se eliminan de forma pasiva por varios órganos, como los riñones, tras su liberación, el ANP y el BNP se unen también a los receptores de péptidos natriuréticos, lo que da lugar a la generación de guanosinmonofosfato cíclico, y conduce a una cascada de respuestas biológicas favorables que reflejan teleológicamente una «respuesta» frente a la alteración de la fisiología que se produce en la IC: debido a la activación de la guanilato ciclasa, tanto el ANP como el BNP desencadenan vasodilatación, natriuresis y diuresis. Además, ambos causan una reducción de los efectos del sistema renina-angiotensina-aldosterona, reducen la rigidez del miocardio y mejoran la lusitropía. Aparte de la eliminación pasiva y de la captación por receptores, las enzimas catalíticas en la circulación, en especial por la enzima neprilisina, también degradan rápidamente tanto el ANP como el BNP.
Los avances en el conocimiento de la biología de los péptidos natriuréticos han llevado al reconocimiento de la alta complejidad de su biología. Por razones que no son del todo claras, ahora se sabe que, a medida que se agrava la IC, un mayor porcentaje del BNP y el NT-proBNP circulantes corresponde al precursor peptídico sin fragmentar (proBNP); los ensayos del «BNP» y el «NT-proBNP» no permiten esclarecer si se está determinando el péptido libre o el precursor, ya que el péptido contiene las dos regiones reconocidas por los análisis. Es de destacar que el proBNP no tiene la misma capacidad que el BNP de desencadenar la formación de guanosinmonofosfato cíclico; así pues, los pacientes con valores altos de proBNP muestran un efecto, denominado «handicap de péptido natriurético», en el que, a pesar de las concentraciones altas de «BNP», no muestran los efectos del péptido maduro biológicamente activo9. Además, a través de los efectos de la neprilisina y otras enzimas, el BNP circula en forma de una mezcla de fragmentos con una degradación diversa, con un BNP de 32 aminoácidos relativamente poco maduro10.
Evaluación diagnósticaLos péptidos natriuréticos son una medida objetiva y reproducible, lo que hace que sean un instrumento de posible utilidad en la evaluación de los pacientes con IC sospechada o probada. Varios estudios importantes han demostrado la utilidad del BNP y el NT-proBNP, conjuntamente con el juicio clínico, para diagnosticar o descartar la ICAD11–13. Además, ambos péptidos natriuréticos han resultado útiles en la evaluación diagnóstica de la ICAD tanto en la ICFEr (IC con fracción de eyección reducida) como en la IC con fracción de eyección preservada (ICFEp)14, aunque con una ligera reducción de la sensibilidad en los pacientes con ICFEp debido a concentraciones de BNP y NT-proBNP generalmente inferiores en esos pacientes15.
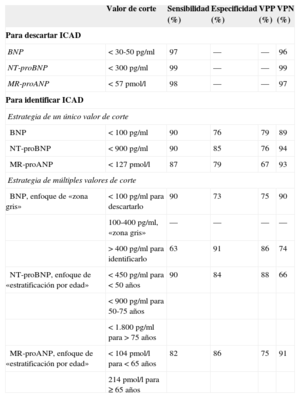
Los valores de corte propuestos para el uso diagnóstico del BNP y el NT-proBNP se muestran en la tabla 1. En el estudio Breathing Not Properly15, las concentraciones de BNP fueron mayores en los pacientes considerados con ICAD en comparación con los que no la presentaban (110 ± 225 frente a 675 ± 450 pg/ml) y hubo diferencias significativas en función de la gravedad de la IC según la New York Heart Association (p<0,001). Una concentración de BNP > 100 pg/ml tuvo una sensibilidad del 90%, una especificidad del 76% y una exactitud del 83% para diferenciar la IC de otras causas de disnea, y en comparación con la historia clínica, la exploración física, los análisis de laboratorio y la radiografía de tórax, el BNP fue el mejor predictor del diagnóstico final de IC (área bajo la curva [AUC] = 0,91; intervalo de confianza del 95% [IC95%], 0,90-0,93; p<0,001)11.
Valores de corte prouestos para los péptidos natriuréticos en la insuficiencia cardiaca aguda descompensada
| Valor de corte | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | |
|---|---|---|---|---|---|
| Para descartar ICAD | |||||
| BNP | < 30-50 pg/ml | 97 | — | — | 96 |
| NT-proBNP | < 300 pg/ml | 99 | — | — | 99 |
| MR-proANP | < 57 pmol/l | 98 | — | — | 97 |
| Para identificar ICAD | |||||
| Estrategia de un único valor de corte | |||||
| BNP | < 100 pg/ml | 90 | 76 | 79 | 89 |
| NT-proBNP | < 900 pg/ml | 90 | 85 | 76 | 94 |
| MR-proANP | < 127 pmol/l | 87 | 79 | 67 | 93 |
| Estrategia de múltiples valores de corte | |||||
| BNP, enfoque de «zona gris» | < 100 pg/ml para descartarlo | 90 | 73 | 75 | 90 |
| 100-400 pg/ml, «zona gris» | — | — | — | — | |
| > 400 pg/ml para identificarlo | 63 | 91 | 86 | 74 | |
| NT-proBNP, enfoque de «estratificación por edad» | < 450 pg/ml para < 50 años | 90 | 84 | 88 | 66 |
| < 900 pg/ml para 50-75 años | |||||
| < 1.800 pg/ml para > 75 años | |||||
| MR-proANP, enfoque de «estratificación por edad» | < 104 pmol/l para < 65 años | 82 | 86 | 75 | 91 |
| 214 pmol/l para ≥ 65 años | |||||
BNP: péptido natriurético tipo B; ICAD: insuficiencia cardiaca aguda descompensada; MR-proANP: región media del propéptido natriurético auricular; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Se ha demostrado que el NT-proBNP tiene también similares propiedades clínicas potentes. En el estudio PRIDE12, el NT-proBNP, utilizado con valores umbral específicos para la edad, mostró altas sensibilidad y especificidad en el diagnóstico de la ICAD. El NT-proBNP no solo fue el predictor independiente más potente de un diagnóstico final de ICAD (odds ratio [OR]=44; p<0,001), sino que su utilidad diagnóstica en combinación con el juicio clínico fue superior a las de la determinación del NT-proBNP y el juicio clínico por separado. Un análisis posterior del estudio International Collaborative of NT-proBNP mostró que las concentraciones séricas del NT-proBNP estaban correlacionadas significativamente con los síntomas de ICAD, y confirmó la importancia de la estratificación por edades para la exactitud diagnóstica: los valores de corte de 450, 900 y 1.800 pg/ml específicos para las edades<50, 50-75 y > 75 años, respectivamente, produjeron una sensibilidad del 90% y una especificidad del 84% para la ICAD, y un valor de corte independiente de la edad de menos de 300 pg/ml tuvo un valor predictivo negativo del 98% para descartar ICAD13.
La utilidad de los péptidos natriuréticos para una asistencia coste-efectiva en la disnea aguda ha sido evaluada en varios análisis. El NT-proBNP se examinó en el ensayo aleatorizado IMPROVE-CHF16, que mostró una mejora significativa en los costes (6.129-5.180 dólares/paciente; p=0,023) y un resultado superior asociado a la adición del NT-proBNP a la evaluación diagnóstica de los pacientes en un servicio de urgencias16. Mueller et al. presentaron resultados similares en el estudio BASEL17, en el que la asignación aleatoria a una estrategia diagnóstica que incluía el BNP se asoció a menos ingresos en la unidad de cuidados intensivos y menor coste que con la evaluación estándar. Mediante análisis con un marco analítico de decisión, en el estudio PRIDE Siebert et al18 demostraron una relación coste-efectividad sustancial asociada al empleo del NT-proBNP. En este análisis, la evaluación guiada por NT-proBNP se asoció a una reducción relativa del 1,6% en el riesgo de acontecimientos adversos graves y una reducción del 9,4% en los costes, que se traducía en un ahorro de 474 dólares/paciente en comparación con la evaluación clínica estándar. En un análisis de sensibilidad de la mortalidad, la determinación de NT-proBNP se asoció a una reducción relativa del 1,0% en la mortalidad posterior al alta. Es de destacar que el uso óptimo de la guía por NT-proBNP podría reducir el uso de ecocardiografía para pacientes hospitalizados en un 58%, evitar un 13% de las hospitalizaciones iniciales y reducir los días de hospitalización en un 12%.
Aunque el BNP y el NT-proBNP son instrumentos útiles para la evaluación diagnóstica de los pacientes con ICAD demostrada o sospechada, es preciso hacer algunas advertencias respecto a su uso. En aproximadamente un 20% de los pacientes, los valores de BNP o NT-proBNP se encuentran en una zona intermedia o «gris», en la que ni diagnostican ni descartan ICAD19. En tales circunstancias, debe aplicarse el juicio clínico para facilitar la identificación del diagnóstico correcto. A este respecto, nunca se debe usar los análisis de péptidos natriuréticos aisladamente: dan información adyuvante al juicio clínico y, aunque son extraordinariamente útiles para respaldar la sospecha clínica de ICAD, resultan de especial utilidad en circunstancias de indecisión clínica20. Ambos biomarcadores se ven influidos por determinadas características demográficas y estados de enfermedad (tabla 2), incluidas otras causas cardiacas y no cardiacas. Como ocurre con todo instrumento diagnóstico, el clínico debe conocer el diagnóstico diferencial de una elevación de BNP o NT-proBNP para interpretar correctamente los resultados21.
Factores que influyen en las concentraciones de péptidos natriuréticos
| Factores que reducen el BNP o el NT-proBNP |
| Obesidad |
| Edema pulmonar flash |
| Etiología de la insuficiencia cardiaca corriente arriba del ventrículo izquierdo (p. ej., insuficiencia mitral aguda, estenosis mitral) |
| Taponamiento cardiaco |
| Constricción pericárdica |
| Factores que aumentan el BNP o el NT-proBNP |
| Disfunción ventricular izquierda |
| Miocardiopatías hipertróficas |
| Miocardiopatías infiltrantes, como la amiloidosis |
| Miocardiopatías agudas, como el síndrome de discinesia (ballooning) apical |
| Inflamatorias, como la miocarditis y la quimioterapia |
| Valvulopatía cardiaca |
| Insuficiencia cardiaca previa |
| Arritmia |
| Fibrilación y flutter auriculares |
| Síndromes coronarios agudos |
| Fármacos |
| Cardiotoxicidad: antraciclinas y compuestos relacionados |
| Inhibidores de neprilisina: BNP solamente |
| Enfermedad pulmonar significativa |
| Síndrome de distrés respiratorio agudo, enfermedad pulmonar con insuficiencia cardiaca derecha, apnea obstructiva del sueño, hipertensión pulmonar |
| Embolia pulmonar |
| Edad avanzada |
| Disfunción renal |
| Anemia |
| Enfermedad crítica |
| Quemaduras |
| Ictus |
| Estados de alto gasto |
| Sepsis |
| Cirrosis |
| Hipertiroidismo |
BNP: péptido natriurético tipo B; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B.
En determinadas circunstancias, los resultados de BNP o NT-proBNP pueden ser inesperadamente altos. Aunque muchas de estas situaciones se explican por enfermedades cardiorrespiratorias estructurales subyacentes, es imprescindible recordar que no todas las elevaciones de uno u otro péptido están relacionadas con una IC izquierda aguda; de hecho, cuando está relacionada con la deformación, o strain, del ventrículo derecho, la elevación notable de BNP o NT-proBNP puede observarse en pacientes con tromboembolia pulmonar aguda22, un diagnóstico cuyo manejo incluye pasos considerablemente diferentes de los de la ICAD derivada de una IC izquierda. Aparte de estos ejemplos extremos, conviene resaltar situaciones más sutiles que se asocian a elevaciones de BNP o NT-proBNP moderadas. Entre ellas se encuentran la anemia, la edad avanzada y la insuficiencia renal.
Por lo que respecta a la edad, tanto el BNP como el NT-proBNP se ven afectados de manera similar, con valores superiores de ambos péptidos en los pacientes ancianos; esto está relacionado con una acumulación de cardiopatía estructural, incluida la falta de distensibilidad diastólica con la edad. Esta situación puede atenuarse algo empleando valores de corte del NT-proBNP ajustados por edad.
Dado que tanto el BNP como el NT-proBNP dependen por igual de la función renal para su eliminación23, las fases más avanzadas de disfunción renal muestran valores superiores de ambos péptidos. Esto está relacionado en parte con la reducción del aclaramiento, pero es importante señalar que refleja también las anomalías cardiacas prevalentes en los pacientes con disfunción renal, así como la expansión del volumen circulatorio relacionada con reducción de la tasa de filtrado glomerular. Entre las estrategias destinadas a mejorar la exactitud diagnóstica en la insuficiencia renal, se incluye el uso de valores de corte alternativos (tabla 1) o, en el caso del NT-proBNP, ajustados por edad, como ya se ha comentado.
En breve surgirá una nueva situación asociada a los valores de BNP superiores a lo esperado, que será el tratamiento con fármacos que inhiben la neprilisina. En el reciente ensayo PARADIGM-HF24, que constituye un verdadero hito, el uso de LCZ696 (un fármaco que contiene un inhibidor de la neprilisina) fue superior al enalapril en el tratamiento de los pacientes con IC crónica24. El tratamiento con LCZ696 produjo unas concentraciones de BNP significativamente superiores como parte del efecto terapéutico del fármaco25; el NT-proBNP no es un sustrato para la neprilisina, por lo que no se produjo un falso aumento. Dado que es probable que el uso del LCZ696 modifique sustancialmente el paisaje del tratamiento de la IC, conviene advertir a los clínicos de que el efecto del fármaco en las concentraciones de BNP no es cuantificable y, por consiguiente, la interpretación de las concentraciones de BNP en los pacientes así tratados puede ser extremadamente difícil. La interpretación adecuada del NT-proBNP no se ve dificultada por el uso de inhibidores de la neprilisina.
De hecho, se producen concentraciones inesperadamente bajas de BNP y NT-proBNP en el contexto de la ICAD, y la mayoría de las veces se observan en estados de IC con tensión en la pared inferior (p. ej., ICFEp), así como en la IC que afecta a estructuras cardiacas del lado derecho (p. ej., insuficiencia tricuspídea aislada) debido a que en esas cámaras hay menos miocardio. Además, es muy importante tener en cuenta que la obesidad se asocia a una tasa de falsos negativos de un 15-20% del BNP y el NT-proBNP en el contexto de la ICAD26. Se cree que esto se debe a una reducción de la liberación de estos péptidos en el contexto de mayor índice de masa corporal. Aunque los valores de ambos péptidos son habitualmente más bajos en la mayoría de los individuos con sobrepeso, no son «normales» en comparación con un individuo sano, y cuando están elevados ambos péptidos conservan su valor pronóstico27.
Recientemente, la región media de propéptido natriurético auricular (MR-proANP) ha surgido como un nuevo biomarcador prometedor para diagnosticar o descartar la ICAD; se ha observado que la MR-proANP es no inferior al BNP para el diagnóstico de la ICAD en el ensayo BACH28. En ese mismo estudio se observó también que la MR-proANP mejoró la exactitud diagnóstica en presencia de un valor de BNP situado en la zona gris (entre 100 y 500 pg/ml). En un análisis posterior del estudio PRIDE, las concentraciones de MR-proANP fueron superiores en los pacientes con ICAD (mediana, 329 frente a 58pmol/l; p<0,001) y se observó que el marcador era un factor independiente predictor de ICAD (OR=4,34; IC95%, 2,11-8,92; p<0,001), y era curiosamente aditivo al NT-proBNP en esta aplicación29. En la tabla 1 se presentan los valores de corte propuestos para MR-proANP. Además de mejorar el diagnóstico, MR-proANP parece prometedor para el pronóstico, más allá de lo que aporta el NT-proBNP y los factores de riesgo clínicos en los análisis de reclasificación neta, y los cambios de la MR-proANP a lo largo del tiempo parecen tener valor predictivo de la mortalidad30. Sin embargo, a diferencia de los resultados del estudio BACH, la MR-proANP presentó un valor inferior del AUC de características operativas del receptor, en comparación con el NT-proBNP en el diagnóstico de la ICAD (AUC=0,90; IC95%, 0,87-0,93; p<0,001 frente a AUC=0,94; IC95%, 0,92-0,96; p<0,001; p=0,001 para la diferencia). No está claro todavía si la MR-proANP se utilizará como único instrumento diagnóstico para la ICAD.
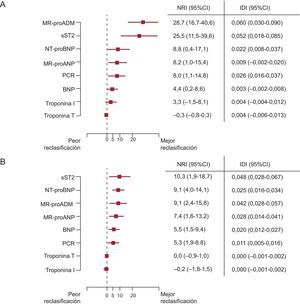
Pronóstico y manejoAparte de su valor en la evaluación diagnóstica de la ICAD, los péptidos natriuréticos, tanto individual como colectivamente, han resultado útiles en muchos estudios para estratificar el riesgo de rehospitalización o muerte de los pacientes con este diagnóstico1,13,31. Por ejemplo, en un estudio, la mediana de concentraciones de NT-proBNP fue superior en los pacientes que no sobrevivieron a los 76 días de seguimiento (mediana, 10.426 [intervalo intercuartílico, 5.611-23.818] pg/ml) en comparación con los que sí sobrevivieron (4.873 [2.204-10.897] pg/ml; p<0,001 para la diferencia); en este análisis, un valor de NT-proBNP > 5.180 pg/ml se asoció claramente con la mortalidad a corto plazo (OR=5,2; IC95%, 2,2-8,1). Es importante señalar que los datos de riesgo derivados del conocimiento del BNP o el NT-proBNP parecen ser sustancialmente aditivos con los de las variables clínicas, lo cual permite una reclasificación significativa del riesgo que va más allá de lo que aporta la información clínica (figuras 1A y B)32. Al igual que ocurre con la aplicación diagnóstica de la MR-proANP, parece que la información pronóstica aportada por la determinación de este péptido es aditiva respecto a la que proporciona el NT-proBNP29.
Reclasificación del riesgo que añaden los biomarcadores más allá de lo aportado por un modelo clínico para la mortalidad a 30 días (A) y la mortalidad a 1 año (B). BNP: péptido natriurético tipo B; IC95%: intervalo de confianza del 95%; IDI: integrated discrimination improvement; MR-proADM: región media de proadrenomedulina; MR-proANP: región media del propéptido natriurético auricular; NRI: net reclassification improvement; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B. Reproducido con permiso de Lassus et al32.
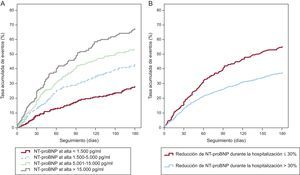
Mientras que un valor basal del péptido natriurético es útil para el pronóstico, se ha establecido sin ambigüedad que las variaciones de BNP o NT-proBNP en el curso de la hospitalización y antes del alta predicen de manera muy potente una evolución adversa; una reducción o un aumento insuficientes después del tratamiento de la ICAD se asocian a riesgo de rehospitalización o muerte. Muy recientemente, Salah et al34 han mostrado que tanto el porcentaje de reducción como la concentración final del marcador alcanzada tras el tratamiento de la ICAD predicen el riesgo de manera independiente (figura 2)33. Esto respalda una estrategia de supervisión durante la hospitalización con el uso de BNP o NT-proBNP, generalmente destinando dos determinaciones a la evaluación: basal para el diagnóstico y la estratificación del riesgo y una determinación posterior al tratamiento para la evaluación de la respuesta terapéutica34.
Riesgo de muerte o rehospitalización por insuficiencia cardiaca aguda descompensada en pacientes hospitalizados por insuficiencia cardiaca aguda descompensada en función de la concentración de la fracción aminoterminal del propéptido natriurético tipo B alcanzada al alta (A) o si se ha alcanzado un cambio del 30% en la fracción aminoterminal del propéptido natriurético tipo B al llegar al alta (B). NT-proBNP, fracción aminoterminal del propéptido natriurético tipo B. Reproducido con permiso de Salah et al33.
Se está tanteando la posible aplicación de los péptidos natriuréticos como «guía» durante el tratamiento intrahospitalario35; conceptualmente, puesto que los tratamientos para la ICAD causan una reducción de la concentración del péptido natriurético que es paralela a la mejora del riesgo, parece lógico asumir que una estrategia que conlleva una reducción marcada del BNP o el NT-proBNP como parte de los criterios de alta podría ser superior a una estrategia que no utilizara esta guía de biomarcadores. Este concepto todavía está pendiente de evaluación prospectiva; mientras no se disponga de estos datos, la lógica debe dictar la aceptación individual de este enfoque.
MÁS ALLÁ DE LOS PÉPTIDOS NATRIURÉTICOS EN LA INSUFICIENCIA CARDIACA AGUDA DESCOMPENSADAAunque el BNP y el NT-proBNP tienen una utilidad significativa en la evaluación y el manejo de los pacientes con ICAD, parece razonable prever que otros biomarcadores puedan aumentar su utilidad. Por ejemplo, como ya se ha señalado, la MR-proANP complementa la información diagnóstica y pronóstica dominante aportada por el BNP o el NT-proBNP. Sin embargo, aparte de los péptidos natriuréticos, hay nuevos biomarcadores, con unas características únicas respecto a las de los péptidos natriuréticos, que parecen prometedores para proporcionar una información biológica «ortogonal»3,36. En general, estos biomarcadores aportan una información cardiovascular pronóstica aditiva (o superior) a la de los péptidos natriuréticos o informan otros diagnósticos que se producen con frecuencia en los pacientes con ICAD, como infección respiratoria o disfunción renal.
ST2 solubleDespués de los péptidos natriuréticos, la ST2 soluble (sST2) es uno de los nuevos biomarcadores más importantes para la información pronóstica en los síndromes de IC y aporta una información pronóstica potente. La ST2 soluble es una proteína que está regulada al alza en los estados de strain mecánica de los miocitos cardiacos37 y de la que se ha demostrado que desempeña un papel importante en la hipertrofia y la fibrosis del miocardio. Esta proteína la liberan también las células endoteliales y puede intervenir en el desarrollo de aterosclerosis e hipertensión arterial38,39.
Los datos iniciales que respaldaron la determinación de la sST2 procedían del estudio PRIDE40. En ese análisis de 593 pacientes con disnea aguda, las concentraciones de sST2 fueron superiores en los pacientes con ICAD, pero el NT-proBNP tuvo un rendimiento superior al de la sST2 en el diagnóstico de la ICAD (AUC=0,94 frente a 0,80; p<0,001 para la diferencia). Sin embargo, las concentraciones de sST2 mostraron una intensa asociación con la gravedad de los síntomas de IC y fueron casi lineales respecto a la mortalidad a corto y largo plazo; los datos del estudio PRIDE ponen de manifiesto que las concentraciones de sST2 fueron el predictor más potente de la mortalidad a los 30 días, a 1 año y los 4 años, por encima de las del NT-proBNP y cualquier otro biomarcador examinado en el estudio, incluida la galectina-340. Shah et al29 mostraron que las concentraciones de sST2 de los pacientes del estudio PRIDE con datos de ecocardiografía disponibles se correlacionaban con una amplia variedad de anomalías cardiovasculares estructurales y funcionales, como un remodelado más adverso del ventrículo izquierdo, menor fracción de eyección del ventrículo izquierdo, peor distensibilidad diastólica y presiones arteriales pulmonares más altas.
Usando un análisis combinado, Rehman et al41 han ampliado posteriormente el conocimiento de la sST2 en la ICAD. Esos autores observaron nuevamente que los valores de la sST2 estaban correlacionados con la gravedad de la IC y señalaron que la sST2 es un potente predictor de la mortalidad de los pacientes con ICFEr e ICFEp; de hecho, en los pacientes con ICFEp, Manzano-Fernández et al42 demostraron después que la sST2 es superior al NT-proBNP para fines pronósticos. En una comparación con otros múltiples biomarcadores, Lassus et al32 han mostrado recientemente que la sST2 proporciona una reclasificación más potente que va más allá de las variables clínicas por lo que respecta a la mortalidad a 1 año tras la aparición de la ICAD (figuras 1A y B)32.
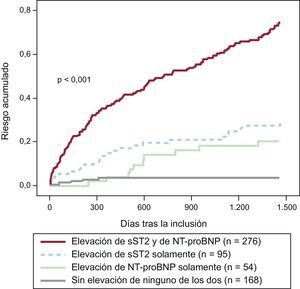
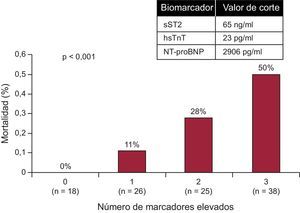
Como se ha indicado, la sST2 proporciona con frecuencia una información pronóstica que reemplaza la del BNP o el NT-proBNP; sin embargo, dado que la información aportada por la sST2 es fundamentalmente diferente de la de los péptidos natriuréticos, los dos biomarcadores proporcionan una información pronóstica aditiva/multiplicativa (figura 3). Aparte de los péptidos natriuréticos, la información pronóstica de la sST2 parece ser aditiva también con la de la troponina de alta sensibilidad (hsTn): en un análisis de 107 pacientes con ICAD, Pascual-Figal et al43 observaron que la sST2, la troponina T (TnT) de alta sensibilidad (hsTnT) y el NT-proBNP aportaban una información pronóstica de características únicas respecto a la muerte en un plazo de 2 años. Las concentraciones de sST2 (cada 10 ng/ml, hazard ratio [HR]=1,09; IC95%, 1,04-1,13; p<0,001), hsTnT (cada 0,1 ng/ml, HR=1,16; IC95%, 1,09-1,24; p<0,001) y el NT-proBNP (cada 100 pg/ml, HR=1,01; IC95%, 1,003-1,010; p<0,001) tuvieron valor predictivo respecto a un mayor riesgo de muerte. En modelos de remuestreo bootstrapping, cada biomarcador conservó su valor independiente predictor de mortalidad; entre los pacientes con los tres biomarcadores situados por debajo de los valores de corte óptimos en el momento de la presentación clínica inicial, no hubo muertes (0%) durante el seguimiento, mientras que un 53% de los pacientes con elevaciones de los tres biomarcadores habían fallecido. Para cada marcador elevado (de 0 a 3), el análisis ajustado indicó que se triplicaba el riesgo de muerte (HR=2,64; IC95%, 1,63-4,28; p<0,001). Los análisis de discriminación integrados indicaron que el uso de estos tres marcadores con un enfoque de multimarcadores mejoró exclusivamente la predicción de mortalidad.
Riesgo de muerte tras un ingreso por insuficiencia cardiaca aguda descompensada en función de la elevación de la ST2 soluble (> 35 ng/ml) y la fracción aminoterminal del propéptido natriurético tipo B (> 1.000 pg/ml) durante 4 años de seguimiento en el estudio PRIDE. NT-proBNP, fracción aminoterminal del propéptido natriurético tipo B; sST2: ST2 soluble.
Aunque la concentración basal de la sST2 en la ICAD aporta mucha información sobre el riesgo de ICAD, de la misma manera que las determinaciones secuenciales de BNP o NT-proBNP proporcionan una información pronóstica incremental en la ICAD, los datos que están apareciendo indican que la supervisión de las concentraciones de sST2 durante el tratamiento en el hospital puede proporcionar aún más información respecto al riesgo. Boisot et al44 fueron los primeros en presentar el valor de las muestras seriadas para la determinación de la sST2 en una cohorte de pacientes hospitalizados. En ese análisis, el porcentaje de cambio de la concentración de sST2 predijo la mortalidad a 90 días; es de destacar que los pacientes cuyos valores de ST2 disminuyeron en un 15,5% a lo largo de la hospitalización tuvieron una mortalidad del 7%, en comparación con el 33% de los pacientes cuyos valores de ST2 no se redujeron en un 15,5%. Posteriormente, en un pequeño ensayo de pacientes con ICAD hospitalizados en un estadio avanzado, cualquier valor de la sST2 > 104 ng/ml determinado durante las primeras 48h del ingreso en una unidad de cuidados intensivos fue potente predictor del riesgo de muerte, trasplante cardiaco o asistencia circulatoria mecánica (HR=5,53; p<0,001), y su utilidad fue superior a la del NT-proBNP, la galectina-3 o la troponina I de alta sensibilidad (hsTnI)45. En pacientes con ICAD de menor gravedad, Manzano-Fernández et al46 apuntan también que tanto la sST2 basal como en el día 4 de hospitalización son factores independientes predictivos de mortalidad, de tal manera que los pacientes con valores de sST2 por debajo de 76 ng/ml (basal) o de 46 ng/ml (día 4) tenían menor riesgo de muerte. De igual modo, Breidthardt et al47 señalaron que un cambio dinámico del valor de sST2 entre el ingreso y el alta es un predictor de mortalidad más potente que los valores basales solos en un grupo de 207 pacientes con ICAD. Todos esos resultados apuntan al valor de la determinación seriada de la sST2, en vez de solo la evaluación basal.
Curiosamente, en el estudio de Breidthardt47, el tratamiento con bloqueadores beta pareció atenuar el riesgo de muerte predicho por la elevación de la sST2. Estos resultados recuerdan los descritos anteriormente por Gaggin et al48, quienes señalaron el mayor valor de los bloqueadores beta en los pacientes con elevaciones de la concentración de sST2 en la IC crónica de pacientes ambulatorios. Recientemente, algunos datos han apuntado a que la elevación de la sST2 puede predecir también un efecto beneficioso específico de los antagonistas de los receptores mineralocorticoideos para los pacientes dados de alta recientemente tras una ICAD49. Considerados conjuntamente, estos datos indican que la supervisión de la sST2 no solo puede predecir el riesgo, sino que puede ser útil para facilitar la toma de decisiones terapéuticas. Esto último está pendiente de demostración.
A diferencia de los péptidos natriuréticos, las concentraciones de sST2 no se ven afectadas por la edad, el índice de masa corporal o la disfunción renal, lo cual es una ventaja considerable respecto al BNP y el NT-proBNP50. La determinación de la sST2 está limitada actualmente a un laboratorio central de enzimoinmunoanálisis, que ha obtenido aprobación de las autoridades reguladoras de Europa, Asia y Estados Unidos. Es muy probable que en el futuro la sST2 desempeñe un papel importante en la evaluación y el manejo de la ICAD basados en el empleo de biomarcadores.
Galectina-3La galectina-3 es un péptido soluble que secretan los macrófagos activados, que secretan colágeno, y es un importante mediador en la fase inicial del proceso que conduce a la fibrosis, incluida la cardiaca51. En un modelo de rata, la infusión de galectina-3 en el pericardio llevó a remodelado cardiaco y riesgo de muerte52. La tinción para la galectina-3 en las autopsias o biopsias cardiacas muestra habitualmente la presencia de la proteína en el intersticio de los ventrículos remodelados de los pacientes con IC. Es posible realizar determinaciones de las concentraciones de galectina-3 en la circulación de los pacientes con IC, lo que puede aportar una información pronóstica importante; en general, la galectina-3 tiene más valor pronóstico cuando se determina en la ICAD que cuando se usa en síndromes de IC crónica.
El primer estudio de determinación de galectina-3 en ICAD fue el PRIDE53. En ese análisis de 559 pacientes, una concentración más alta de galectina-3 fue un potente predictor independiente de mortalidad a 60 días y rehospitalización por IC. Un análisis posterior de Shah et al54 de 115 pacientes con disnea aguda observó que una mediana de galectina-3 superior a 15,0 era un significativo factor predictivo de la mortalidad a 4 años, de manera independiente de los marcadores ecocardiográficos de la gravedad de la enfermedad, y tenía valor aditivo respecto a la potencia pronóstica del NT-proBNP. De igual modo, De Berardinis et al55 mostraron que la galectina-3 tiene valor pronóstico en la ICAD complementario al de la estimación de las presiones de llenado mediante análisis de vector de bioimpedancia. La galectina-3 puede ser igual de útil (o más) para la estratificación del riesgo de ICFEp en comparación con el de ICFEr56; por ejemplo, en un estudio de pacientes con ICFEp, las concentraciones de galectina-3 > 13,8 ng/ml fueron un predictor significativo del riesgo tras un ajuste por edad, tasa de filtrado glomerular estimado (TFGe), anemia, diabetes mellitus, sodio en suero, concentración de BNP, clase funcional de la New York Heart Association y nitrógeno ureico en sangre respectivamente (HR=1,43; IC95%, 1,07-1,91; p=0,015).
A pesar de estos resultados optimistas, la galectina-3 tiene menos valor pronóstico en los estados de IC más crónicos, y algunos estudios ponen en duda su papel incluso en la ICAD57. Los resultados de la determinación de galectina-3 deben interpretarse con precaución en presencia de anticuerpos humanos antirratón y de factor reumatoide, así como en pacientes a los que ya se ha tratado con anticuerpos monoclonales de ratón, con trastornos autoinmunitarios conocidos o con hiperglobulinemia (como en el caso del mieloma múltiple), ya que todas estas situaciones pueden interferir con la determinación58. Además, la disfunción renal socava de manera importante la exactitud pronóstica de la galectina-3, hasta el punto de poner en duda si el impulsor clave de las concentraciones de este biomarcador es la fibrosis renal, en vez de la fibrosis cardiaca59. La evidencia actual es insuficiente para respaldar un uso habitual de la galectina-3 en la ICAD, debido en gran parte a la escasez de estudios con la potencia estadística suficiente y los resultados contradictorios de los estudios de cohorte60. Serán necesarios nuevos estudios para determinar el valor pronóstico de la galectina-3 en la ICAD.
Troponina de alta sensibilidadCuando un paciente presenta una ICAD, las guías de práctica clínica y las declaraciones de consenso recomiendan la determinación de la hsTn61; esto tiene como principal objetivo determinar la posible presencia de un infarto de miocardio de tipo 1 como desencadenante de la ICAD. Está bien establecido que hay múltiples mecanismos que explican la elevación de las concentraciones de hsTn en los pacientes con ICAD, entre ellas el infarto agudo de miocardio; sin embargo, un aumento o una disminución de la hsTn en este contexto no asegura que haya un infarto de tipo 1. No obstante, conocer la elevación de la hsTn en el contexto de la ICAD aporta una información pronóstica importante, como antes, y puede desempeñar un papel importante dentro de un enfoque de multimarcadores para la evaluación de los síndromes de IC, con independencia de cuál sea su mecanismo.
En comparación con los análisis de troponina convencionales, los métodos de hsTn detectan la necrosis miocárdica de manera sustancialmente superior en los pacientes con IC y tienen un valor pronóstico adicional, que suele aportar información aditiva a la de los péptidos natriuréticos y otros biomarcadores como la sST2.
Más allá del estudio antes citado que respalda el uso de la hsTnT en la evaluación pronóstica de la ICAD43 (figura 4), otros estudios indican la utilidad pronóstica de este biomarcador en la ICAD. En un estudio de 202 pacientes con ICAD sin infarto agudo de miocardio, la hsTnT se detectó en un 98% de los participantes (en comparación con el 56% con la determinación basada en el método de TnT convencional); con independencia de la TnT convencional, una concentración de hsTnT superior a 20 pg/ml permitió identificar un riesgo de muerte significativamente superior (HR=4,7; IC95%, 1,6-13,8; p=0,005). Es importante señalar que la hsTnT proporciona una información pronóstica incremental útil cuando los resultados del análisis convencional son normales62.
En los pacientes con insuficiencia cardiaca aguda descompensada, una estrategia de multimarcador que incluía los valores de fracción aminoterminal del propéptido natriurético tipo B, ST2 soluble y troponina T de alta sensibilidad aportó un valor pronóstico independiente, con reclasificación del riesgo. hsTnT: troponina T de alta sensibilidad; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B; SST2: ST2 soluble. Reproducido con permiso de Pascual-Figal et al43.
Por ejemplo, en un estudio, la hsTnT fue especialmente útil en los pacientes cuya TnT convencional fue<0,03 ng/ml (el valor de corte más bajo con una imprecisión < 10%). De igual modo, en los pacientes con TnT convencional inferior al límite de referencia superior convencional, Parissis et al63 observaron que la hsTnT aportaba una información pronóstica incremental.
Por lo que respecta a la supervisión de los valores, las determinaciones seriadas de la concentración de hsTn64 pueden aportar información sobre la respuesta al tratamiento y el riesgo de eventos adversos futuros, en comparación con lo que proporciona la determinación basal sola. En un análisis realizado en 100 pacientes con ICAD, la hsTnT disminuyó globalmente del día 1 al día 3 (p=0,04), pero esta reducción se debió a la mejora de las concentraciones del biomarcador en el grupo de pacientes que volvieron a alcanzar la compensación; en el subgrupo de pacientes que seguían estando descompensados, no se observaron diferencias significativas en la hsTnT del día 1 al día 3 (p=0,96). De igual modo, las tendencias desfavorables en los valores de hsTnI entre la situación basal y el alta pueden identificar a los pacientes con mayor riesgo de eventos futuros65. En ese análisis precomercial de un método de hsTnI, 144 pacientes con ICAD fueron objeto de seguimiento desde el ingreso hasta 90 días después del alta. Un valor de hsTnI al alta mayor o igual a 23,25 ng/l y BNP mayor o igual a 360 pg/ml se asociaron a un aumento del riesgo de muerte y rehospitalización (p=0,003). Los pacientes con valores crecientes de la hsTnI durante el tratamiento presentaron un aumento de la mortalidad en comparación con los pacientes con valores de hsTnI estables o decrecientes (p=0,047). Por último, un cambio favorable en las concentraciones de hsTnT puede predecir la respuesta al tratamiento con determinados fármacos para la ICAD, como la serelaxina66.
Región media de proadrenomedulinaLa adrenomedulina (ADM), que se aisló inicialmente de células de feocromocitoma humano de la glándula suprarrenal, es una hormona peptídica con propiedades natriuréticas, vasodilatadoras e hipotensoras, que se expresa en muchos sistemas de órganos y tejidos, incluidos los tejidos cardiovascular, renal, pulmonar, cerebrovascular, gastrointestinal y endocrino67. Los valores de ADM en suero están aumentados en la IC68 y muestran una correlación con el empeoramiento de la función sistólica, con el consiguiente aumento de las presiones arteriales pulmonares y la disfunción diastólica69. Las concentraciones plasmáticas de ADM están aumentadas también en la hipertensión y la enfermedad renal crónica. La infusión de ADM en pacientes con o sin IC produjo una reducción de la presión arterial media, un aumento de la frecuencia cardiaca, un aumento del índice cardiaco y una disminución de la presión capilar pulmonar enclavada. En concreto, en los pacientes con IC, la infusión de ADM redujo también la concentración plasmática de aldosterona. En general, estos resultados apuntan a un mecanismo beneficioso, probablemente compensatorio, de la ADM en los pacientes con IC70.
Se ha evaluado un método de análisis para detectar la región media de proadrenomedulina (MR-proADM); este es un parámetro sustitutivo estable para la valoración de la ADM madura, y proporciona una información pronóstica útil, en especial a corto plazo. Por ejemplo, en el estudio BACH de pacientes con disnea aguda, la MR-proADM fue mejor que el BNP y que el NT-proBNP en la predicción de la mortalidad a 14 días y mejoró la predicción del riesgo de muerte a 90 días cuando se utilizó conjuntamente con los péptidos natriuréticos71. En el estudio PRIDE29, la MR-proADM tuvo valor independiente pronóstico de muerte, con una reclasificación del riesgo a 1 año (HR=2,70; p < 0,001) y a 4 años (HR=1,51; p=0,03). En un análisis multinacional, la MR-proADM añadió una información pronóstica considerable, que iba más allá de lo obtenido con un modelo clínico para el riesgo a 30 días; sin embargo, su valor a 1 año fue menos robusto que el de otros marcadores como los péptidos natriuréticos o la sST2 (figura 1)32. Aunque hay pocos datos sobre la MR-proADM después del tratamiento de la ICAD, la información preliminar indica una reducción significativa después del tratamiento adecuado de la IC72. Se necesitan nuevos estudios para determinar el papel de la MR-proADM como guía para el tratamiento de la IC.
ProcalcitoninaLos trastornos respiratorios pueden confundirse con la ICAD y viceversa. Un tratamiento incorrecto para la IC en un paciente con neumonía puede conllevar mayor riesgo, mientras que no detectar una infección es también igualmente grave. Por último, los trastornos respiratorios son una causa frecuente de descompensación de la IC y ambos diagnósticos pueden coexistir; en este contexto, el pronóstico puede ser peor. Mientras que los péptidos natriuréticos facilitan la identificación diagnóstica de la ICAD, la disponibilidad de un biomarcador que facilitara el diagnóstico correcto de la infección grave en los pacientes con disnea sería muy bien recibida. La procalcitonina (PCT) es una proteína que está regulada al alza en los estados inflamatorios, sobre todo los relacionados con patógenos bacterianos73; la PCT, pues, puede ser útil para facilitar la evaluación diagnóstica de la infección respiratoria.
En un análisis del estudio BACH, Maisel et al74 mostraron que un modelo de diagnóstico con PCT tenía un AUC para el diagnóstico de la neumonía de 0,723; al igual que ocurre con cualquier biomarcador, la PCT no es una prueba que se realice sola, y la combinación de las estimaciones realizadas por el médico de la probabilidad de una neumonía con los valores de PCT aumentó la exactitud a más del 86%. Es de destacar que algunos de los participantes en el estudio que presentaban ICAD y PCT > 0,21 ng/ml tuvieron peor evolución si no recibían tratamiento con antibióticos (p=0,05), mientras que los pacientes con concentraciones de PCT < 0,05 ng/ml tuvieron mejor evolución si no se les administraba tratamiento antibiótico (p=0,05), lo cual respalda el concepto de basar el uso de antibióticos en la determinación de PCT74. En un estudio posterior realizado por investigadores de Suiza, se observó que el uso de PCT en comparación con la asistencia estándar para descartar infección bacteriana en pacientes con IC que acudían a un servicio de urgencias redujo las muertes y los ingresos en la unidad de cuidados intensivos, con valores del 4 frente al 20% (diferencia absoluta, 16,0%; IC95%, –28,4% a –3,6%; p=0,01) y redujo la exposición a los antibióticos (media, 3,7 ± 4,0 frente a 6,5 ± 4,4; diferencia, –2,8; IC95%, –4,4 a –1,2; p < 0,01) a los 30 días75.
En el análisis del estudio BACH, los pacientes con ICAD y neumonía validada fueron los que presentaron valores de PCT más altos; es de destacar que, en un amplio análisis de 4.698 pacientes de China, los que presentaban IC simple tenían valores de PCT significativamente superiores que los controles sanos (0,13 frente a 0,04μg/l, p < 0,01), mientras que los pacientes con infecciones bacterianas complicadas por una ICAD tenían unos valores de PCT significativamente superiores que los pacientes con infección simple (0,45 frente a 0,28μg/l; p < 0,01). Así pues, los resultados de las determinaciones de PCT deben interpretarse según la gravedad de la IC del paciente76. Estos resultados resaltan la necesidad de nuevos estudios al respecto.
Biomarcadores renalesLa función renal es una variable pronóstica importante en los pacientes con ICAD. Tanto si son anormales en la situación basal como si empeoran tras la aparición de una ICAD, las alteraciones de parámetros de la función renal, como el nitrógeno ureico en sangre, la creatinina sérica o la TFGe, se asocian de manera potente resultado adverso en la ICAD77,78.
Más recientemente, se han examinado nuevos biomarcadores para estimar la función renal, como la cistatina C o la BTP (proteína traza beta), para determinar su capacidad de predicción de la mortalidad en la ICAD79. En un estudio de 220 participantes con ICAD, un 53% falleció o reingresó a causa de la ICAD durante el seguimiento. Los pacientes con una evolución adversa presentaron valores de BTP superiores (1,04 [0,80-1,49] frente a 0,88 [0,68-1,17] mg/l; p=0,003) y cistatina C (1,29 [1,00-1,71] frente a 1,03 [0,86-1,43] mg/l; p=0,001). Tanto la BTP (HR=1,41; IC95%, 1,06-1,88; p=0,018) como la cistatina C (HR=1,50; IC95%, 1,13-2,01; p=0,006) fueron significativos factores predictivos de la evolución de los pacientes, mientras que la creatinina sérica, la TFGe y el nitrógeno ureico en sangre dejaron de ser significativos.
Tanto la cistatina C como la BTP tienen la ventaja respecto a la creatinina sérica de que son más sensibles en las formas más leves de disfunción renal y, por consiguiente, aportan una evaluación más precisa del riesgo. De hecho, en este análisis, en los pacientes con TFGe > 60ml/min/1,73 m2, la elevación de las concentraciones de BTP y cistatina C se asoció en ambos casos a un riesgo significativamente superior de eventos clínicos adversos (p < 0,05). No es de extrañar que los investigadores hayan descrito recientemente que una ecuación de la CKD-EPI80 basada en la cistatina C para la TFGe haya resultado superior a una ecuación basada en la creatinina sérica para valorar el pronóstico en la ICAD.
Más allá de la estimación de la función renal, recientemente se han propuesto diversos biomarcadores de posible utilidad para identificar la lesión renal. A este respecto, se han examinado en la ICAD la lipocalina asociada a la gelatinasa neutrofílica (NGAL), la N-acetil-beta-D-glucosaminidasa y la molécula de lesión renal-1. Aparte de su utilidad para el pronóstico en ese contexto, conocer el riesgo de lesión renal aguda podría ser útil para evitar la exposición a sustancias nefrotóxicas, como el contraste intravenoso o ciertos fármacos nefrotóxicos.
Maisel et al81 estudiaron a 186 pacientes con ICAD y determinaron la NGAL al ingreso; los participantes en el estudio que presentaron eventos tenían valores de NGAL superiores que los que no (134 frente a 84 ng/ml; p < 0,001). El AUC de características operativas del receptor para la predicción de los eventos fue mayor con la NGAL (0,72) que con el BNP (0,65), la creatinina sérica (0,57) o la TFGe (0,55). En los análisis multivariables, la NGAL predijo los eventos (p=0,001), mientras que ni la creatinina sérica ni la TFGe fueron significativas.
Además de ser un predictor del riesgo, la determinación de la NGAL puede usarse para predecir la aparición de un EFR (empeoramiento de la función renal) durante la hospitalización. Los investigadores del GREAT82 han descrito recientemente que la elevación de la NGAL en combinación con elevación de uno de los péptidos natriuréticos (BNP o NT-proBNP) se asoció a la aparición de EFR durante la hospitalización por ICAD; en la regresión logística, la combinación de elevación de un péptido natriurético y la NGAL produjo OR=2,79 y OR=3,11 (p < 0,04 en ambos casos) para la NGAL más el BNP o el NT-proBNP respectivamente. No resulta extraño, puesto que el EFR debido a un síndrome cardiorrenal de tipo 1 se asocia habitualmente a una congestión más grave; así pues, sería de prever que la determinación conjunta de un marcador de lesión renal más un péptido natriurético fuera más útil que cualquiera de ellos por sí solo para el pronóstico de esta temida complicación83. Además de predecir el EFR durante la hospitalización, la NGAL predijo también la mortalidad intrahospitalaria84.
La N-acetil-beta-D-glucosaminidasa y la molécula de lesión renal-1 son biomarcadores urinarios. Aunque se ha demostrado que ambos predicen la mortalidad por cualquier causa y la variable combinada de mortalidad y rehospitalización por IC en los pacientes con IC crónica, independientemente de la TFGe85, algunos datos recientes del GREAT86 han puesto en duda su utilidad en la evaluación de la ICAD. Serán necesarios más datos sobre el posible papel de estos biomarcadores en la ICAD.
CONCLUSIONESAdemás del valor diagnóstico y pronóstico de los péptidos natriuréticos para el diagnóstico, la selección inicial y posiblemente el tratamiento de la ICAD, han surgido otros varios biomarcadores que pueden ser útiles al médico clínico. Aun cuando se encuentran en la fase inicial de su aplicación, en algunos estudios se ha demostrado que varios de estos biomarcadores tienen significativas capacidades predictivas en la ICAD de pacientes con ICFEr e ICFEp; de entre estos biomarcadores, la sST2 parece ser el más prometedor, puesto que no solo añade información pronóstica considerable a la de los péptidos natriuréticos, sino que también permite realizar una supervisión del riesgo y puede aportar una información importante para el tratamiento. La hsTn parece también prometedora, aunque no se han identificado aún las opciones de toma de decisiones terapéuticas en los pacientes con elevación de la hsTnT o la hsTnI. Sin embargo, debe realizarse siempre la determinación de la hsTn de un paciente con ICAD, fundamentalmente para identificar el infarto de miocardio de tipo 1 como causa de la descompensación de la IC. Otros biomarcadores no dan resultados suficientes (p. ej., la galectina-3) o requieren más datos antes de que se pueda respaldar su empleo (p. ej., la MR-proADM). Más allá de los biomarcadores cardiacos, hay varios marcadores novedosos que pueden ser útiles para respaldar la toma de decisiones clínicas en un servicio de urgencias; por ejemplo, la PCT parece ser un candidato potente para identificar correctamente neumonía en los pacientes con disnea y puede ser útil para decidir el uso de antibióticos. Los marcadores de la función renal y los marcadores de la lesión renal pueden ser útiles no solo para el pronóstico, sino también para facilitar la toma de decisiones terapéuticas, identificando a los pacientes con mayor probabilidad de obtener un efecto beneficioso o sufrir daño con ciertas intervenciones terapéuticas, como la exposición a medios de contraste intravenosos. Tal como ha ocurrido antes con los péptidos natriuréticos, serán necesarios más estudios para determinar el papel del tratamiento guiado por biomarcadores, pero el potencial de los biomarcadores de continuar mejorando la asistencia de los pacientes con ICAD es sustancial.
FINANCIACIÓNEl Dr. Januzzi cuenta con la financiación parcial de la Desanctis Clinical Scholar Endowment y la Hutter Family Chair in Medicine.
CONFLICTO DE INTERESESJ.L. Januzzi ha recibido subvenciones significativas de Siemens, Thermo-Fisher y Singulex; pequeños ingresos por consultoría de Roche Diagnostics, DiaDexus, Critical Diagnostics, Sphingotec y Novartis, e ingresos significativos por su participación en comités de validación de parámetros clínicos de Boeringer Ingelheim, Novartis y Amgen.