Palabras clave
INTRODUCCION
El síndrome aórtico agudo (SAA) se define por un proceso agudo de la pared aórtica que cursa con un debilitamiento de la capa media, lo que conlleva un riesgo de rotura aórtica y otras complicaciones. Está constituido por tres entidades: la disección aórtica, el hematoma intramural y la úlcera penetrante1. Su incidencia es de unos 30 casos por millón de habitantes al año, de los cuales el 80% son disecciones, el 15% hematomas intramurales y el 5%, úlceras penetran-tes2,3. La aorta ascendente está afectada en el 60% de los casos (tipo A) y respetada en el 40% (tipo B). Afecta principalmente a hombres (70%), con una media de edad de 60 años (International Registry of Acute Aortic Dissection [IRAD])4. En la última década, los avances en las técnicas de imagen han facilitado de forma significativa el diagnóstico del SAA y han aportado información fundamental para el conocimiento de la evolución de esta enfermedad. Por otra parte, el desarrollo de nuevas técnicas quirúrgicas y la aparición del tratamiento intravascular han modificado la estrategia terapéutica y, probablemente, el pronóstico.
DIAGNOSTICO
Presentación clínica y datos exploratorios
El diagnóstico precoz de esta enfermedad es fundamental para mejorar el pronóstico, ya que la mortalidad de la evolución natural en las primeras 24 h es del 20% y a los 7 días, del 62%5. Para conseguir un diagnóstico precoz es importante identificar los signos y síntomas de la enfermedad. El dolor está presente en el 96% de los SAA. Hay varias características típicas de este dolor4: a) es brusco y alcanza rápidamente su máxima intensidad; b) con frecuencia es lancinante y se localiza en la región centrotorácica, si está afectada la aorta ascendente, o en la región interescapular, si está afectada la aorta descendente, y c) puede ser migratorio en el 25% de los casos, o se irradia a las mandíbulas, el epigastrio, la región lumbar o las extremidades inferiores. Por otra parte, la presentación inicial con síncope es relativamente frecuente (15%)6. En más del 30% de los pacientes diagnosticados finalmente de SAA se sospechan inicialmente otras enfermedades, como un síndrome coronario agudo, una pericarditis, un embolismo pulmonar, una enfermedad osteoarticular de columna o incluso una colecistitis. Uno de los errores diagnósticos más trascendentes es confundir la disección de la aorta con un infarto de miocardio, sobre todo si se indica tratamiento trombolítico. Este error se realiza si no se tiene en cuenta que el electrocardiograma evidencia patrones de necrosis miocárdica en el 10% y signos de isquemia en el 15% de los casos4. Por otra parte, aunque clásicamente se considera que la radiografía de tórax es siempre anormal, series recientes evidencian que puede ser estrictamente normal hasta en el 20% de los pacientes y que puede haber ensanchamiento mediastínico en el 60%4.
Los antecedentes clínicos son importantes para sospechar un SAA, ya que el 75% de los pacientes es hipertenso, el 20% está previamente diagnosticado de otra enfermedad aórtica y cada vez se describen más casos asociados con valvulopatía aórtica o secundarios a iatrogenia4. Por otra parte, algunas enfermedades genéticas, como el síndrome de Marfan o el síndrome de Ehlers-Danlos, nos deben hacer sospechar el SAA. El hematoma intramural afecta a pacientes con más factores de riesgo arterioscleróticos y mayor edad que la disección aórtica y se localiza en el 70% de los casos en la parte, aorta descendente7.
En la exploración física puede evidenciarse hipotensión severa o shock en el 15% de los casos, un soplo de regurgitación aórtica en el 40% de las disecciones tipo A y un déficit de pulsos en el 20% de los SAA8.
Técnicas de imagen
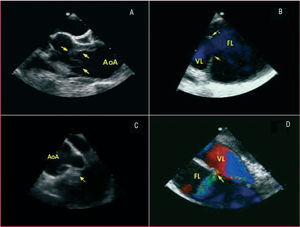
El papel de las técnicas de imagen ha ido cambiando de forma sustancial en los últimos años. Hasta hace 15 años era habitual la práctica de una aortografía con finalidad diagnóstica. Posteriormente se comprobó que con esta técnica se obtenía un 20% de diagnósticos falsos negativos, en especial en disecciones trombosadas y hematomas intramurales. Un metaanálisis publicado recientemente9 pone de manifiesto que la exactitud diagnóstica es prácticamente similar (95-100%) para la tomografía computarizada (TC), la ecocardiografía transesofágica (ETE) y la resonancia magnética (RM). La mayoría de las limitaciones se debe más a errores en la interpretación que hace el explorador que a la misma técnica. En las series actuales, la TC es la técnica de imagen más utilizada (70%)10, principalmente por su gran disponibilidad, exactitud y rapidez11. Su principal limitación es la presencia de insuficiencia renal. La ETE tiene ventajas sobre la TC en que permite identificar con más frecuencia la localización y el tamaño de la puerta de entrada12,13, definir la dinámica de flujos de la verdadera y falsa luz, establecer los mecanismos y la gravedad de la insuficiencia aórtica14 y valorar la presencia de taponamiento y la función ventricular (fig. 1).
Fig. 1. Ecocardiografía transesofágica en la disección de aorta. A. Íntima disecada en aorta ascendente (flechas). B. Puerta de entrada grande (flechas) en el arco aórtico distal. C. Prolapso de la íntima disecada a través de la válvula aórtica. D. Puerta de comunicación secundaria entre la verdadera y falsa luz. AoA: aorta ascendente; FL: falsa luz; VL: verdadera luz.
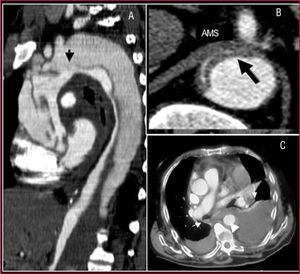
No obstante, es inferior a la TC en la visualización de toda la aorta, el diagnóstico de sangrado periaórtico y la afectación de los troncos arteriales (fig. 2). En el 10% de las disecciones aórticas, el desgarro principal está localizado en aorta abdominal, por lo que no son visibles por ETE. La utilización de contraste permite demostrar que el flujo de la falsa luz es retrógrado. Nuestro grupo demostró que los falsos positivos de disección en la aorta ascendente secundarios a reverberaciones de la pared de la aorta podían evitarse con un correcto análisis del movimiento y la localización de la íntima mediante modo M15.
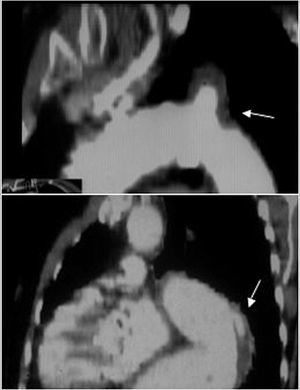
Fig. 2. Tomografía computarizada (TC) en la disección aórtica. A. TC helicoidal en la que se observa una disección de tipo A que se inicia en la raíz aórtica y termina en la aorta abdominal con una trombosis total de la falsa luz. La flecha señala la localización de la puerta de entrada. B. Severa compresión de la verdadera luz que dificulta el llenado de la arteria mesentérica superior. C. Derrame pleural y hemomediastino (flechas) secundario como complicación de un hematoma intramural (cabeza de flecha). AMS: arteria mesentérica superior.
La imagen armónica ha mejorado la sensibilidad de la ETE en la visualización de la íntima disecada, pero no permite nunca descartar definitivamente un SAA. Como técnica complementaria es muy útil, ya que diagnostica el taponamiento cardiaco y cuantifica la regurgitación aórtica. La mejor combinación para un correcto diagnóstico de la disección aórtica aguda y sus complicaciones es la realización de una TC y una ecocardiografía transtorácica16 (tabla 1). En las disecciones de aorta ascendente debería realizarse la ETE cuando haya importantes dudas diagnósticas por la TC o cuando la inestabilidad hemodinámica haga desaconsejable trasladar al paciente. En cualquier caso, debe sedarse intensamente el paciente y controlar las constantes hemodinámicas durante el procedimiento.
El síndrome de mala perfusión visceral o periférica es una complicación con una alta morbimortalidad17. Aunque la ecocardiografía puede ser útil para el diagnóstico de la disección de los troncos supraaórticos, el tronco celiaco y la arteria mesentérica superior, la TC facilita esta información de forma mucho más exacta. Por otra parte, esta técnica es insustituible para el diagnóstico de la afectación de las arterias renales e iliacas. Hay dos tipos de afectación de la circulación de los troncos arteriales: su disección o la obstrucción dinámica de la íntima disecada sobre el ostium de los troncos arteriales que salen de la aorta18 (fig. 2B). La diferenciación entre ambos mecanismos tiene implicaciones terapéuticas importantes. Las arterias coronarias pueden estar afectadas por la disección de la raíz de aorta. No obstante, la ETE es suficiente para este diagnóstico13.
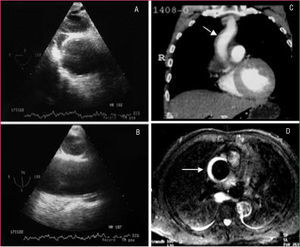
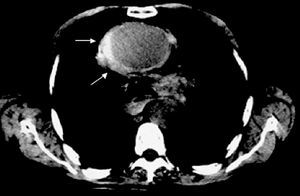
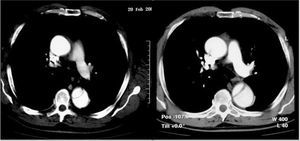
Aunque la RM es la técnica más exacta para el diagnóstico del SAA19, su uso está cuestionado en la fase aguda en pacientes con síntomas o con inestabilidad hemodinámica en los que es necesario efectuar un estricto seguimiento y cuya accesibilidad terapéutica es obligada. Su uso estaría justificado en pacientes asintomáticos y estables en los que el diagnóstico de SAA no quede establecido por las otras técnicas como, por ejemplo, en el hematoma intramural. A diferencia de la disección aórtica, en el hematoma intramural el sangrado de los vasa vasorum puede ser muy progresivo y en el 15% de los casos la primera técnica de imagen no evidencia el sangrado de pared, mientras que la segunda técnica practicada al cabo de 24-48 h diagnostica el hematoma intramural7 (fig. 3). Debe recordarse que el diagnóstico de hematoma intramural por TC se realiza sin contraste, ya que la señal hipointensa de la pared es lo que indicará el diagnóstico11 (fig. 4). En la fase hiperaguda, el sangrado de pared tiene una intensidad isodensa en T1 e hiperintensa en T2. A las 24-48 h, tanto T1 como T2 muestran una señal hiperintensa2.
Fig. 3. Desarrollo progresivo de un hematoma intramural de aorta ascendente. La ecocardiografía transesofágica practicada a las 14 h del dolor no pone de manifiesto alteraciones en la aorta ascendente valorada en un corte transversal (A) y longitudinal (B). La tomografía computarizada helicoidal (C) practicada a los 2 días muestra un mínimo engrosamiento en la aorta ascendente (flecha) que no se consideró significativo. La resonancia magnética practicada a los 5 días reveló un claro hematoma intramural por la señal hiperintensa en T2 (flecha).
Fig. 4. Hematoma intramural en la aorta ascendente (flechas) diagnosticado mediante tomografía computarizada sin contraste.
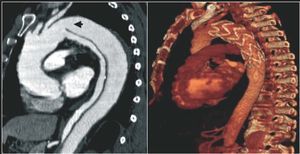
La úlcera aórtica penetrante es la entidad del SAA de la que se dispone de menos información. El diagnóstico por técnicas de imagen puede corresponder a diversos procesos con etiopatogenias y pronósticos diferentes. Las técnicas de imagen con contraste, como la angiografía y la TC, al permitir visualizar la protrusión de una úlcera desde la luz de la aorta, son las que tienen mayor sensibilidad diagnóstica (fig. 5). No obstante, la ETE es la técnica de elección para clasificar los diferentes tipos de úlceras en relación con su etiopatogenia y permite diferenciar entre las placas ulceradas que se observan por encima de la íntima y las úlceras arterioscleróticas que penetran en la capa media y con frecuencia deforman la adventicia. Finalmente, tanto la TC como la ETE son de gran utilidad en el diagnóstico de la imágenes de úlcera-like que se observan en la evolución del hematoma intramural aórtico como consecuencia de una disección localizada20.
Fig. 5. Úlceras aórticas diagnosticadas por tomografía computarizada localizadas al inicio de la aorta descendente. La imagen superior corresponde a una úlcera arteriosclerótica y la imagen inferior, a una úlcera-like por disección localizada en la fase subaguda de un hematoma intramural.
En resumen, la TC es la técnica de imagen con mayor disponibilidad durante las 24 h del día en la mayoría de centros hospitalarios y tiene una excelente exactitud diagnóstica (tabla 2). Si se confirma el diagnóstico de disección de tipo A, debería practicarse una ecocardiografía transtorácica para valorar la presencia y la etiología de la insuficiencia aórtica, y descartar el taponamiento cardiaco. Inmediatamente antes de la cirugía, si es posible con el paciente ya anestesiado, es importante la práctica de una ETE que confirme los hallazgos previos y localice la puerta de entrada de la disección. Esta técnica es de gran ayuda intraoperatoriamente y, en todo caso, debería realizarse siempre después del tratamiento quirúrgico. Sólo en los casos en los que la información de la TC es dudosa estaría indicada la ETE con finalidad diagnóstica. Si la clínica del paciente es muy sospechosa y hay factores cardiovascu lares predisponentes sin que la primera técnica de imagen sea diagnóstica, debería repetirse una técnica de imagen, a ser posible una RM, a las 48-72 h del cuadro clínico.
Biomarcadores
En los últimos años se están investigando diversos biomarcadores que pueden facilitar el diagnóstico del SAA. El D-dímero ha demostrado su utilidad en el diagnóstico del SAA, especialmente después de las primeras 6 h. Una de sus principales limitaciones es que no permite realizar el diagnóstico diferencial con el tromboembolismo pulmonar21. Los marcadores de las cadenas pesadas de la miosina tienen altas sensibilidad y especificidad en las primeras 6 h, pero disminuyen su utilidad a las 12 h del inicio de los síntomas22. La investigación del comportamiento de estos y otros nuevos biomarcadores, como la homocisteína o las metaloproteinasas, puede modificar la estrategia diagnóstica de los SAA en los próximos años y ser de gran ayuda para realizar el diagnóstico diferencial entre los síndromes que se acompañan de dolor torácico, como el síndrome coronario agudo y el tromboembolismo pulmonar.
EVOLUCION EN LA FASE AGUDA. VARIABLES PRONOSTICAS
Disección aórtica de tipo A
Diversos estudios han confirmado la mayor mortalidad precoz de la disección aórtica de tipo A respecto a la de tipo B4,5,8. A pesar de los avances diagnósticos y terapéuticos, la mortalidad durante la hospitalización en la disección de tipo A sigue siendo alta (> 30%)4,23. El hecho de que dos tercios de los pacientes de este registro con disección de tipo A fueran remitidos desde hospitales comarcales indica que la mortalidad real puede ser superior al 40%, ya que los pacientes más inestables que fallecen en los centros comarcales o durante el traslado no están incluidos. La presencia de complicaciones como el taponamiento cardiaco, la afectación de alguna arteria coronaria, el compromiso de la circulación cerebral o la insuficiencia cardiaca por regurgitación aórtica severa implican muy mal pronóstico8. Así, en el registro del IRAD, la hipotensión/shock/taponamiento, la insuficiencia renal, el inicio brusco del dolor, el déficit de pulsos y la edad > 70 años fueron variables predictoras independientes de mortalidad23. La presencia de hematoma periaórtico es más frecuente en las disecciones de tipo A que en las de tipo B (el 26 frente al 19%) y es un predictor independiente de mortalidad (el 33 frente al 20%; p < 0,001)24.
La disección aórtica de tipo A es una emergencia quirúrgica, aunque algunos autores25 consideran que las disecciones de tipo A retrógradas trombosadas tienen mejor pronóstico que las anterógradas, tanto en la fase aguda (mortalidad del 15 frente al 38%) como a los 5 años de seguimiento (mortalidad del 15 frente al 43%). Estos autores25 recomiendan tratar médicamente las disecciones tipo A retrógradas trombosadas y quirúrgicamente las disecciones retrógradas con flujo. Esta estrategia puede ser útil en pacientes con edad superior a 75 años o con comorbilidad.
Disección aórtica de tipo B
La mortalidad a los 30 días de los pacientes con disección de tipo B no complicada es cercana al 10%4. Por el contrario, en los pacientes con mala perfusión visceral o periférica, insuficiencia renal o signos de rotura contenida, la mortalidad supera el 30%17,18. Los datos del IRAD26 pusieron de manifiesto que el 12% de los pacientes con disecciones de tipo B presentaba hipotensión o shock, en el 16% de los pacientes el diámetro aórtico era superior a 60 mm, en el 19% había hematoma periaórtico y en el 22%, afectación de vasos arteriales con mala perfusión, principalmente en las arterias iliacas, mesentéricas o renales. La mortalidad hospitalaria fue del 13%. Un modelo de riesgo de mortalidad mostró como la tríada de alto riesgo hipotensión/shock, ausencia de dolor torácico en la presentación clínica y afectación de las ramas arteriales. Estas variables definían una mortalidad del 3, el 36 y el 71%27, según si estaban presentes 1, 2 o 3 de los factores de riesgo. Sin duda, la situación de inestabilidad hemodinámica con severa hipotensión o shock fue lo que implicó mayor riesgo. En otros estudios se ha puesto de manifiesto que la edad, el compromiso hemodinámico y la isquemia periférica son las variables con peor pronóstico en la disección aórtica de tipo B28.
Hematoma intramural y úlcera penetrante
El hematoma intramural tiene una evolución muy dinámica y puede reabsorberse, progresar a una disección clásica o localizada o presentar una rotura contenida en los primeros días de evolución29,30. La mortalidad precoz depende esencialmente de la localización y es más elevada cuando afecta a la aorta ascendente31. Sin embargo, hay una importante disparidad en los resultados publicados, ya que la mortalidad del hematoma de tipo A tratado médicamente es del 36% en un metaanálisis de publicaciones europeas y americanas3, e inferior al 10% en la mayoría de las efectuadas por grupos asiáticos32,33. Es probable que en las series asiáticas, la sensibilidad en el diagnóstico del hematoma intramural sea muy superior, ya los hematomas intramurales representaron el 20-30% de los SAA, mientras en el IRAD fue de sólo el 5%7. La inclusión de hematomas menos importantes podría justificar un perfil más benigno y con menor riesgo de complicaciones.
Aunque la estrategia terapéutica en el hematoma intramural de tipo A debería ser la misma que para la disección aórtica34, algunos estudios han señalado que ciertos datos morfológicos implican un perfil más benigno que el de la disección. Estos datos morfológicos son: el diámetro máximo de la aorta < 50 mm, el grosor del hematoma < 11 mm y la ausencia de disección localizada32-36. En pacientes estables y con estos datos morfológicos podría iniciarse el tratamiento con bloqueadores beta y plantear la cirugía no urgente en las mejores condiciones quirúrgicas. En cualquier caso, la edad y el estado general del paciente son variables a considerar ya que a medio plazo es probable que pueda repetirse el sangrado de la pared de aorta y no evolucionar de forma benigna.
El hematoma intramural de aorta de tipo B debería ser tratado médicamente, excepto en casos con una importante dilatación de la aorta (> 60 mm), signos de rotura aórtica inminente o mala evolución clínica y hemodinámica. Es bien conocido que la incidencia de hematoma periaórtico y derrame pleural es superior en el hematoma intramural que en la disección35. El diagnóstico de estas complicaciones por sí mismas no es una indicación de tratamiento quirúrgico si no muestran progresión o no se acompañan de otros factores de mal pronóstico.
La úlcera arteriosclerótica penetrante aórtica aguda y sintomática tiene un riesgo igual o superior de rotura a la disección aórtica aguda o al hematoma intramural37. Al igual que el hematoma intramural, se localiza con mucho más frecuencia en la aorta descendente. En algunos casos, la úlcera arteriosclerótica evoluciona a aneurisma sacular o fusiforme38. En nuestra experiencia, la mayoría de úlceras arterioscleróticas penetrantes en la fase aguda se diagnostican en el contexto de un hematoma intramural. Sin embargo, no es excepcional el diagnóstico de esta entidad en pacientes asintomáticos.
TRATAMIENTO EN LA FASE AGUDA
Tratamiento médico
Los pacientes con disección aórtica deben recibir tratamiento inmediato para controlar el dolor y disminuir la presión arterial sistólica < 110 mmHg. Para ello suele utilizarse sulfato de morfina y bloqueadores beta intravenosos (metoprolol, propanolol o labetalol). Si los bloqueadores beta están contraindicados se pueden usar antagonistas del calcio, como verapamilo o diltiazem intravenoso. En pacientes con una marcada inestabilidad hemodinámica debería plantearse la intubación, la ventilación mecánica y la práctica de una ETE. En los casos en que se diagnostique un taponamiento importante debe intentarse una pericardiocentesis con la evacuación sólo parcial del líquido para evitar un aumento del sangrado aórtico, y realizar la cirugía de forma urgente.
Disección de tipo A
En la disección aórtica de tipo A debe indicarse tratamiento quirúrgico urgente, a menos que haya contraindicaciones formales, especialmente si se han establecido lesiones cerebrales o viscerales graves e irreversibles. El propósito de la cirugía es evitar la rotura aórtica o las complicaciones con riesgo vital, como el taponamiento o la regurgitación aórtica masiva. Cuando la disección se extiende al arco aórtico es difícil conseguir una reparación completa. La mortalidad quirúrgica, aun en centros de excelencia, es alta (15-35%)4,23,24,39. En algunas series, la mortalidad quirúrgica es muy baja, pero casi siempre se debe a que se selecciona el paciente o hay una demora entre los síntomas y la cirugía superior a las 48 h. La principal limitación del tratamiento quirúrgico urgente de la disección de tipo A puede ser la experiencia del cirujano. Sin duda, se trata de una cirugía compleja que exige una alta experiencia quirúrgica que no siempre puede ofrecer el equipo de guardia.
En el tratamiento quirúrgico es recomendable instaurar la circulación extracorpórea con perfusión arterial anterógrada, aunque sea por vía axilar derecha, confirmando por ETE que se perfunde la verdadera luz. La perfusión femoral retrógrada no está exenta de complicaciones, con embolización de material ateromatoso, extensión de la disección o incluso mala perfusión de los órganos. La cirugía bajo parada circulatoria total implica la utilización de métodos de protección minuciosos, con hipotermia profunda y perfusión cerebral selectiva, por vía anterógrada o retrógrada. Las paradas circulatorias superiores a 40 min sin perfusión cerebral pueden conllevar complicaciones cerebrales. Por ello, en la actualidad se ha ido imponiendo cada vez más la asociación de técnicas de perfusión cerebral con hipotermia anterógrada. En un estudio reciente publicado por Ehrlich et al39, de un total de 167 pacientes intervenidos entre 1987 y 2001, el 31% falleció o presentó déficit neurológico permanente, relacionándose únicamente con la inestabilidad hemodinámica (odds ratio [OR] = 6,0). Por otra parte, en el 16% hubo lesiones neurológicas transitorias que se relacionaron con la edad superior a 60 años y la enfermedad coronaria asociada40.
El tratamiento quirúrgico consiste fundamentalmente en excluir la puerta de entrada de la disección, con sustitución de la aorta ascendente y el arco aórtico si es preciso, efectuando previamente la reparación y reconstrucción de la aorta distal. Siempre debe intentarse la reparación de la raíz aórtica con conservación de la válvula aórtica usando la técnica de resuspensión de David. No obstante, si las lesiones anatómicas de la raíz son muy importantes, para evitar reintervenciones es mejor efectuar su sustitución completa con un tubo valvulado con reimplantación de las coronarias. La anastomosis de la parte más distal del tubo protésico con la pared de la aorta ascendente es adecuada siempre que no haya una puerta de entrada en el arco. En alrededor de un 30% de los casos la puerta de entrada se localiza en el arco, y en estos casos debería reemplazarse el arco hasta más allá de la puerta de entrada. La sustitución del arco puede disminuir la persistencia de la falsa luz permeable distal del 80 al 40%. Si hay un aneurisma en la aorta descendente proximal, disecada o no, la extensión de una trompa de elefante desde el arco es una buena opción41. En un procedimiento posterior se puede conectar distalmente una prótesis tubular colocada en la aorta descendente, o hacer procedimientos simultáneos en los que se combine la cirugía de la aorta ascendente y el tratamiento intravascular en la aorta descendente42. Debe destacarse el papel de la ETE para optimizar los resultados de las diversas estrategias quirúrgicas. La técnica proporciona una información precisa de la localización de la puerta de entrada, la etiopatogenia de la insuficiencia aórtica y la afectación del arco distal y la aorta torácica descendente.
Disección de tipo B
El tratamiento de la disección de tipo B no complicada es el control adecuado de la presión arterial y los factores de riesgo cardiovascular. El tratamiento quirúrgico está indicado cuando aparece alguna de las complicaciones que ponen en peligro la vida del paciente: inestabilidad hemodinámica, dolor intratable, expansión rápida del diámetro aórtico, hematoma mediastínico o periaórtico con signos de rotura inminente de la aorta, o la aparición de signos de mala perfusión de las ramas arteriales vitales. La mortalidad en la fase aguda de los pacientes con isquemia renal es del 50-70% y con isquemia mesentérica, del 80-90%43. La revisión de la literatura científica demuestra que la mortalidad quirúrgica en la disección de tipo B es muy alta (28-65%)42 y, además, alrededor de un tercio de los pacientes (30-35%) tienen riesgo de paraplejía. En el registro IRAD44, el 17% de las disecciones de tipo B precisó tratamiento quirúrgico, y la mortalidad hospitalaria fue del 29%.
En recientes años, el tratamiento intravascular se ha desarrollado de forma importante. En 1999, Dake et al45 y Nienaber et al46 publicaron simultáneamente la experiencia inicial del tratamiento intravascular en la disección de tipo B. Los objetivos de este procedimiento son cerrar la puerta de entrada, excluir el flujo de la falsa luz y evitar la evolución hacia la dilatación aneurismática y la posterior rotura de la aorta. Si consideramos el exceso de mortalidad quirúrgica en pacientes con mala perfusión de las ramas arteriales, en especial cuando no se actúa precozmente, el tratamiento intravascular estaría claramente indicado cuando hay una obstrucción estática o dinámica de uno de los troncos arteriales47-48. En la estática, la obstrucción puede solucionarse mediante la colocación de un stent en el origen del vaso, y en las dinámicas, con la descompresión de la falsa luz con el cierre de la puerta de entrada. En las disecciones de tipo A, la restauración precoz de la reperfusión de órganos vitales permite estabilizar al paciente, por lo que se puede realizar una reparación quirúrgica con mayores posibilidades de éxito.
El tratamiento intravascular no sólo puede ayudar a disminuir de forma drástica la mortalidad de la disección de tipo B complicada, sino que es probable que cambie la historia natural de esta enfermedad, al favorecer el adecuado remodelado de la aorta y la disminución de la dilatación progresiva de la falsa luz. La mortalidad es < 10% y el riesgo de paraplejía, < 3%, por lo que se ha planteado el beneficio de cerrar la puerta de entrada de la disección de forma sistemática en todos los pacientes que se encuentran en la fase subaguda de la disección. En nuestra opinión, esta opción no es aconsejable en todos los casos, ya que cerca del 50% de los pacientes presenta una buena evolución a largo plazo.
La indicación de la fenestración percutánea está po co establecida, y menos desde que se dispone del tratamiento intravascular. En pacientes con isquemia arterial por compresión de los ostium arteriales por la falsa luz es importante descomprimir la falsa luz, bien cerrando la puerta de entrada con la implantación de un stent o, si esto no es posible, realizando una fenestración en la aorta infrarrenal que genere una puerta de descarga de la falsa luz. La fenestración intravascular con balón está especialmente indicada para tratar situaciones de isquemia mesentérica47 en las que el tratamiento intravascular no es posible. La ecografía intravascular puede ser de gran ayuda para obtener óptimos resultados con esta técnica.
Hematoma intramural y úlcera aórtica
El tratamiento del hematoma intramural es bastante superponible al de la disección aórtica. En el hematoma de aorta ascendente, el tratamiento es quirúrgico, aunque si no hay complicaciones, como persistencia del dolor, sangrado periaórtico o úlcera aórtica, puede operarse en las mejores condiciones quirúrgicas en las primeras 24-72 h. En los pacientes mayores de 75 años o con comorbilidad podría plantearse el seguimiento próximo con técnicas de imagen hasta evidenciar la reabsorción del hematoma. En los hematomas de aorta descendente, el tratamiento de elección es el médico. La evolución con disección localizada que condiciona imágenes de úlcera-like no es por sí misma una indicación de tratamiento quirúrgico o intravascular. Por el contrario, la presencia de una dilatación brusca importante con signos de rotura inminente y sangrado periaórtico en un paciente con persistencia del dolor obliga a plantear el tratamiento intravascular. Este tratamiento puede realizarse con buenos resultados cuando los extremos de la endoprótesis se implantan sobre la pared aórtica sana y no sobre el hematoma, ya que podría favorecer la rotura intimal en una pared aórtica debilitada.
El tratamiento de la úlcera arteriosclerótica penetrante sintomática en la fase aguda debería ser similar al de los otros síndromes aórticos agudos, dado el riesgo de rotura aórtica49. Fuera de la fase aguda, el tratamiento dependerá del patrón de evolución, según los síntomas, la dilatación progresiva o el resangrado de la pared aórtica. Cuando no se disponía del tratamiento intravascular, la cirugía implicaba un riesgo no despreciable en pacientes arterioscleróticos y seniles, y no era infrecuente observar que muchas úlceras aórticas permanecían totalmente estables a corto-medio plazo. No obstante, creemos que en las úlceras de un tamaño considerable, sobre todo si se van dilatando o generan resangrados en la pared de la aorta diagnosticados por resonancia magnética, estaría indicado el tratamiento intravascular.
EVOLUCION Y TRATAMIENTO A LARGO PLAZO
El tratamiento médico después de la fase aguda es fundamental. El correcto control de la presión arterial está asociado con una supervivencia libre de rotura aórtica a los 5 años del 96%, en comparación con un 61% en el grupo con mal control42. Otro aspecto importante es el seguimiento con técnicas de imagen para valorar la aparición de una nueva disección o la formación de aneurismas en otros segmentos de la aorta. La incidencia de estas recurrencias puede ser casi del 25%, y algunas de ellas evolucionan con complicaciones, como rotura y muerte por sangrado. El seguimiento debería implicar una ETE o RM antes del alta hospitalaria, y una técnica de imagen a los 6 y 12 meses, y posteriormente de forma anual, si el paciente permanece estable y asintomático. La ETE y la RM aportan información funcional de gran valor pronóstico, y la TC permite un correcto seguimiento de los diámetros aórticos.
Disección de tipo A
A pesar de que la cirugía cambia de forma importante la historia natural de la disección aórtica de tipo A, los supervivientes del tratamiento quirúrgico pueden desarrollar complicaciones. Éstas pueden estar esencialmente relacionadas con una reparación quirúrgica insuficiente que favorece una dilatación progresiva de la raíz, con o sin insuficiencia aórtica asociada, o ser secundarias a la persistencia de flujo en la falsa luz de la aorta distal al tubo protésico. La incidencia de persistencia de flujo en la falsa luz distal al tubo protésico varía entre el 79 y el 90%50,51 y, aunque no puede considerarse una complicación, la morbilidad y mortalidad a largo plazo relacionadas con esta circunstancia son altas51. La supervivencia libre de complicaciones en las disecciones de tipo A operadas es del 84% a los 5 años cuando la falsa luz está totalmente trombosada y del 63% cuando se evidencia flujo en la falsa luz51. Por lo tanto, la eliminación de la puerta de entrada, no sólo la reparación de la aorta ascendente, tiene una gran importancia en el planteamiento de la intervención quirúrgica. En el registro IRAD, la mortalidad a los 3 años fue del 10% y las variables predictoras de mortalidad fueron la edad, la presencia de otra enfermedad arteriosclerótica o la cirugía cardiaca previa a la disección52.
Disección de tipo B
La supervivencia a largo plazo de la disección de tipo B se ha considerado similar a la de la disección de tipo A operada, y es del 75% a los 5 años5,8. El tratamiento médico adecuado con bloqueadores beta es fundamental para evitar complicaciones. Con la disminución de la presión arterial y la dp/dt, los bloqueadores beta retrasan la dilatación de la aorta. La dosis de estos fármacos debería aumentarse progresivamente hasta alcanzar el control de las cifras tensionales, con valores < 130/80 mmHg. En algunos estudios de seguimiento de la disección de tipo B, el riesgo de rotura aórtica a los 3-5 años fue del 18-30%, y la necesidad de tratamiento quirúrgico, del 20-30%53-55. Los factores predictivos de esta evolución fueron la edad, la enfermedad pulmonar obstructiva crónica, la hipertensión arterial y el diámetro máximo basal de la aorta55. En un interesante estudio, Kato et al56 demostraron que el diámetro aórtico > 40 mm en la fase aguda y la presencia de un puerta de entrada permeable en la aorta torácica eran marcadores del desarrollo de un aneurisma de la falsa luz (> 60 mm). En este grupo de pacientes, el 30% tenía una aneurisma de la aorta a los 3 años de seguimiento (fig. 6). Marui et al57 comprobaron que el 67% de los pacientes con diámetro aórtico > 40 mm y falsa luz permeable evolucionaban hacia una intensa dilatación o rotura aórtica a los 5 años de seguimiento, mientras que esto sólo sucedía en el 6% de los pacientes que no tenían ninguna de estas 2 variables en la fase aguda. La alta incidencia de trombosis total de la falsa luz indica que en estos estudios se incluyeron hematomas intramurales, los cuales tienen un patrón evolutivo diferente.
Fig. 6. Seguimiento de una disección de tipo B mediante tomografía computarizada. La imagen de la izquierda corresponde al estudio realizado al alta del síndrome aórtico agudo y la imagen de la derecha corresponde al estudio realizado a los 12 meses. Obsérvese la marcada dilatación de la aorta disecada.
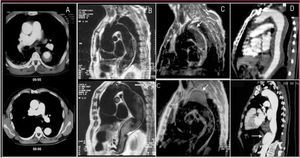
Aunque el tratamiento intravascular es mucho más útil en la fase subaguda de la disección (fig. 7), si se detecta una dilatación importante de la aorta > 60 mm o un crecimiento > 3 mm/año debería plantearse su realización fuera de la fase precoz. Estudios recientes demuestran que el tratamiento intravascular en la disección de aorta descendente es seguro y ofrece mejores resultados que la cirugía42,58. En el registro del IRAD, la mortalidad al año y a los 3 años fue del 90 y el 78%, con cifras similares en los grupos con tratamiento médico, quirúrgico o intravascular. Las variables que se relacionaron con la mortalidad fueron la presencia de otra enfermedad arteriosclerótica, la insuficiencia renal, el derrame pleural o la hipotensión/ shock en la fase aguda53.
Fig. 7. Izquierda: la tomografía computarizada practicada en la fase aguda evidencia una disección de tipo B con puerta de entrada grande (flecha) y moderada compresión de la verdadera luz (VL). Debido a que presentaba signos de mala perfusión distal con persistencia de dolor abdominal, se realizó un tratamiento intravascular. Derecha: tomografía computarizada practicada al año del episodio agudo con un remodelado completo de la disección de tipo B.
Hematoma intramural y úlcera aórtica
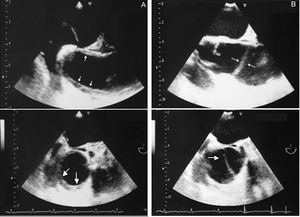
El pronóstico a largo plazo del hematoma de tipo A es mejor que el de la disección aórtica . En la serie de Kaji et al59 de 30 hematomas de aorta ascendente se observó una resolución total del hematoma en el 40% y no hubo mortalidad en un seguimiento de 4 años. En nuestra experiencia31, 2 de 8 pacientes tratados médicamente evolucionaron hacia una disección no complicada después de los 3 meses de seguimiento (fig. 8). Por tanto, es obligado realizar un seguimiento cada 2 o 3 meses con técnicas de imagen durante el primer año.
Fig. 8. Ecocardiografía transesofágica en la que se visualiza la aorta ascendente en corte longitudinal (superior) y transversal (inferior). Hematoma intramural (A) en la aorta ascendente (flechas) que evoluciona a disección a los 3 meses (B). Las flechas señalan la íntima disecada.
En las series asiáticas, el hematoma de aorta descendente también tiene un mejor pronóstico que la disección, y la supervivencia a los 5 años es del 97% en el hematoma intramural frente al 79% en la disección de aorta descendente60. En nuestra serie, la mortalidad de los pacientes con hematoma aórtico fue del 19% a los 3 meses y del 34% a los 5 años, muy parecida a la de otros grupos no asiáticos31. A diferencia de la disección aórtica, en que la mayoría de complicaciones se produce durante la fase aguda del evento, el hematoma intramural puede presentar diversas evoluciones, con posibles complicaciones durante la fase subaguda y en los primeros 6 meses. Por dicho motivo, es fundamental realizar al menos una o dos técnicas de imagen antes del alta hospitalaria y en la fase subaguda. Pocos trabajos han valorado la evolución morfológica del hematoma intramural a medio-largo plazo. En nuestra serie38 de 50 hematomas intramurales seguidos por técnicas de imagen, la evolución fue muy dinámica, principalmente en los primeros 6 meses: el hematoma intramural regresó sin complicaciones en el 34% de los casos, progresó a disección en el 36%, a disección clásica en el 12% y a disección localizada en el 24%, y evolucionó hacia aneurisma fusiforme o sacular en el restante 30% (fig. 9). Es excepcional la rotura aórtica si el diámetro máximo es < 60 mm y no se produce un nuevo resangrado de la pared aórtica. Uno de los hallazgos más llamativos de la evolución del hematoma intramural es la evolución con disección localizada. Esta lesión parece, según el tamaño, una úlcera aórtica o un seudoaneurisma. Estas imágenes han sido consideradas por muchos autores como complicaciones graves del hematoma intramural36, pero en realidad algunas desaparecen sin complicaciones y otras tienden a dilatarse38.
Fig. 9. Diferentes tipos de evolución de un hematoma de aorta descendente. Las imágenes de la parte superior corresponden al episodio agudo y las de la parte inferior corresponden al final del seguimiento. A. Reabsorción total sin complicaciones a los 14 meses del episodio agudo. B. Dilatación fusiforme de toda la aorta descendente a los 5 años de seguimiento. C. Aneurisma sacular de 70 mm (flechas) a los 8 años de seguimiento después de varios episodios de sangrado asintomático visualizados por resonancia magnética. D. Disecciones localizadas con formación de seudoaneurismas 6 años después del episodio agudo.
Dada la evolución tan dinámica del hematoma intramural y si consideramos que un 15-20% de los pacientes muere por rotura aórtica en los primeros 5 años, es recomendable realizar un seguimiento muy próximo a los 3, 6 y 12 meses, y posteriormente cada año, hasta la total reabsorción del hematoma intramural. Si la evolución muestra un incremento progresivo del diámetro aórtico o del grosor del hematoma con signos de resangrado en la pared de la aorta, estaría indicado el tratamiento quirúrgico o intravascular.
CONCLUSIONES
El SAA sigue teniendo una alta mortalidad a pesar de los avances diagnósticos y terapéuticos de la última década. El mejor conocimiento de la historia natural y las variables pronósticas de esta enfermedad debe ser de gran ayuda para indicar la estrategia terapéutica más adecuada. Sin embargo, la sospecha clínica precoz y la experiencia del cirujano continúan siendo los aspectos fundamentales que se relacionan con la mortalidad en la fase aguda. La introducción del tratamiento intravascular ha abierto nuevas perspectivas en el tratamiento del síndrome aórtico agudo que afecta a la aorta descendente; es una excelente opción para el tratamiento precoz de las complicaciones y consigue en la mayoría de casos un remodelado aórtico que puede modificar la historia natural y mejorar el pronóstico de esta enfermedad.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. A. Evangelista Masip.
Servei de Cardiologia. Hospital Universitari Vall d'Hebron.
P.o Vall d'Hebron, 119-129. 08035 Barcelona. España.
Correo electrónico: aevangel@vhebron.net