Full English text available from: www.revespcardiol.org/en
INTRODUCCIÓNDada la extraordinaria variedad de facetas estructurales, clínicas y terapéuticas que tiene la miocardiopatía hipertrófica (MCH), no es infrecuente que su abordaje diagnóstico y manejo global constituyan con frecuencia un verdadero reto. De igual modo, factores como el creciente interés por las miocardiopatías hereditarias, la utilidad clínica de las pruebas genéticas y el uso creciente de la resonancia magnética cardiovascular (RMC) han contribuido a ampliar el espectro en continua expansión de la MCH.
Este editorial se centra en ciertos aspectos de la MCH que van más allá del clásico aumento de grosor de la pared del ventrículo izquierdo (VI) y la dicotomía de si hay o no una obstrucción del infundíbulo de salida del VI (ISVI). Así pues, la MCH probablemente sea el trastorno cardiovascular que presente diferencias fenotípicas y hemodinámicas más amplias; su riesgo de muerte súbita cardiaca (MSC) asociada ha sido y continuará siendo objeto de investigación y debate. Por último, el tratamiento invasivo de los pacientes con síntomas a causa de gradientes intraventriculares siempre deberá tener en cuenta las anomalías estructurales que afectan a los aparatos valvular y subvalvular.
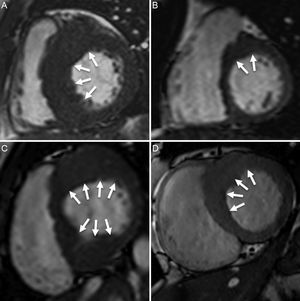
FENOTIPO Y NOMENCLATURAAunque la expresión fenotípica de la MCH puede caracterizarse por cualquier localización de la hipertrofia, la forma de presentación principal es una agrupación de varios segmentos hipertrofiados contiguos. En consecuencia, los especialistas tienden a centrarse en el diagnóstico de la enfermedad junto con la forma en que se distribuye la hipertrofia. Así, el fenotipo septal asimétrico es, con mucho, la forma principal de MCH1. Sin embargo, existen considerables diferencias en la forma en que la hipertrofia afecta al tabique interventricular, que van desde una afección única de segmentos del tabique hasta la afección más frecuente de varios segmentos septales junto con otras paredes del VI (figura 1). Desde el punto de vista clínico y de investigación, es correcto emplear el término MCH septal asimétrica cuando hay afección de al menos un segmento septal a nivel de la base o la parte media del ventrículo, que muestra una asimetría significativa respecto a la mayoría de los segmentos de la pared lateral del VI. Sin embargo, también es posible prácticamente cualquier otro fenotipo, como el apical, apical con extensión a la parte media del ventrículo, concéntrico simétrico y lateral asimétrico. Sin embargo, con independencia de cuál sea la expresión fenotípica, la ausencia de antecedentes familiares de la enfermedad y en especial la detección de casos con una forma de presentación clínica infrecuente debe considerarse con precaución, y es preciso descartar la presencia de procesos infiltrantes.
Miocardiopatía hipertrófica septal asimétrica. A: afección significativa del tabique. B: afectación leve del segmento anteroseptal (flechas). C: afección significativa de los segmentos anterior, anteroseptal, inferoseptal e inferior. D: afección moderada de los segmentos anterior y anteroseptal.
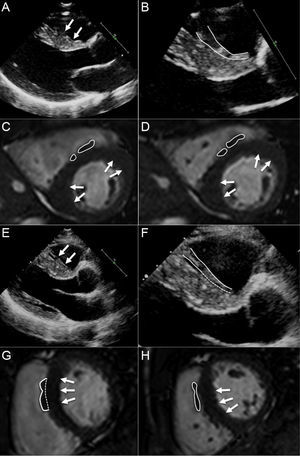
Asumiendo que la MCH septal asimétrica constituye el reto diagnóstico más frecuente con el que se enfrentan los cardiólogos en los casos en los que los resultados de las técnicas de imagen no son claros, resulta crucial recordar conceptos como el grosor máximo de la pared del VI. Los datos de cohortes amplias han puesto de manifiesto que el valor medio del grosor máximo de la pared del VI en la MCH es de aproximadamente 21–22mm1. Además, la desviación estándar correspondiente (± 5 o ± 6)1 implica que la mayoría de los pacientes tiene al menos 1 segmento ≥ 15 mm. Diversas situaciones pueden conducir a un aumento del grosor de la pared del VI, entre ellas hipertensión sistémica, estenosis aórtica, corazón de atleta y amiloidosis cardiaca, lo cual es motivo de preocupación en el diagnóstico diferencial. Sin embargo, es extremadamente infrecuente que alguna de estas situaciones remede el grado de hipertrofia que suele observarse en la MCH, incluido el valor medido del grosor máximo de la pared del VI. Esta declaración se basa en dos aspectos que conviene comentar. En primer lugar, la determinación del grosor de la pared del VI debe evitar incluir las trabéculas septomarginales del ventrículo derecho (figura 2). Al excluir la estructura del lado derecho, es infrecuente observar un grosor de la pared del VI de más de 15 mm en el tabique interventricular de los deportistas o de los pacientes con hipertensión, estenosis aórtica o amiloidosis. En segundo lugar, la medición correcta del grosor de la pared del VI en los casos dudosos de MCH depende de la experiencia. En general, la curva de aprendizaje de esta labor puede reducirse al mínimo con un abordaje de la MCH mediante múltiples técnicas de imagen, incluida la ecocardiografía laterolateral y el análisis de la RMC (figura 2).
A: sospecha de trabéculas septomarginales (flechas). B: imagen ampliada del tabique basal en el que se confirman las trabéculas septomarginales (delimitadas en blanco). C y D: imagen de resonancia magnética cardiovascular del mismo paciente que confirma las trabéculas septomarginales (delimitadas en blanco); la miocardiopatía hipertrófica se confirma mediante la detección de un aumento del grosor en los puntos de inserción del ventrículo derecho (flechas). E: sospecha de trabéculas septomarginales (flechas). F: imagen ampliada del tabique basal, en el que las trabéculas septomarginales están íntimamente relacionadas con el tabique en la región más basal (delimitado en blanco). G y H: imagen de resonancia magnética cardiovascular del mismo paciente que confirma las trabéculas septomarginales y su relación con el tabique anterior (delimitado en blanco); la miocardiopatía hipertrófica se confirma mediante la detección del aumento del grosor en el tabique anterior e inferior (flechas).
La información clínica y ecocardiográfica registrada en la historia clínica suele describir la MCH como obstructiva o no obstructiva. Esta dicotomía deriva de los nombres que se han utilizado históricamente para designar esta enfermedad. Se ha demostrado que la mayoría de los pacientes con MCH acaban presentando una obstrucción intraventricular, sea en reposo (alrededor de una tercera parte) o durante el ejercicio (alrededor de una tercera parte)2. Sin embargo, entre las posibles razones de que no haya gradientes intraventriculares y de que se describan muchos casos como de MCH no obstructiva se encuentran el hecho de que la MCH la deben probar ecografistas expertos, de los que no siempre se dispone, la frecuente imposibilidad de examinar a los pacientes para buscar una posible obstrucción en el momento de máximo esfuerzo (en vez de usar maniobras o fármacos en pruebas de provocación) y la naturaleza de la propia obstrucción, que presenta amplias diferencias en cuanto al gradiente cuantificado (según el contexto hemodinámico, la arritmia, el estado de volumen y la posición corporal). Esta nomenclatura se mantiene a menudo en los pacientes durante largos periodos, si no permanentemente. En consecuencia, teniendo presente la epidemiología de la obstrucción intraventricular izquierda en la MCH, con frecuencia deberá sospecharse la posibilidad de una obstrucción, que nunca se descartará en el seguimiento ordinario de los pacientes. Se recomienda precaución cuando la historia clínica previa incluye un estado no obstructivo, que hace referencia a un único momento concreto en el curso de la enfermedad.
EVALUACIÓN DEL RIESGO DE MUERTE SÚBITA CARDIACALa evaluación del riesgo de MSC en la MCH ha sido objeto de un extraordinario interés y debate entre los expertos a lo largo de varias décadas. Buena prueba de ello es que los clínicos siguen afrontando regularmente situaciones complicadas respecto a la evaluación del riesgo, que son difíciles de encuadrar en las recomendaciones de los expertos y las guías de práctica clínica. La raíz del problema de esta larga controversia está en la baja tasa de MSC que caracteriza la MCH. Así, es prácticamente imposible llevar a cabo un estudio epidemiológico suficientemente grande para evaluar, con una estratificación del riesgo, variables específicas de todas las áreas de la cardiología, es decir, evaluación clínica y electrocardiografía y sustrato arrítmico, factores hemodinámicos, resultados estructurales en las técnicas de imagen, genética, etc. Aunque esclarecer situaciones específicas y analizar el valor real de factores concretos queda fuera del ámbito de este artículo, hay algunos aspectos que permiten situar en perspectiva la evaluación del riesgo en esos pacientes.
Como se ha señalado antes, dada la baja tasa de episodios, los factores de riesgo más clásicos intervienen en función de una asociación simple con la MSC según lo descrito en las décadas de los años ochenta y noventa. Posteriormente, en estudios más amplios se utilizaron los factores seleccionados inicialmente para establecer la base del riesgo de MSC en la MCH3. Aunque generalmente se ha aceptado este enfoque, no se debe olvidar que la falta de estratificación del riesgo puede tener su origen en esta selección sesgada de los posibles factores de riesgo. Esto se pone claramente de manifiesto en la reciente incorporación de nuevos aspectos de la evaluación del riesgo, como el tamaño de la aurícula izquierda y el gradiente del ISVI, al tiempo que otros aspectos, como la respuesta de la presión arterial durante el ejercicio, han perdido fundamento.
Un enfoque razonable para la evaluación del riesgo es tener presente la información previa que podría haber pasado inadvertida. A finales de los años noventa se demostró ya que el tamaño de la aurícula izquierda desempeñaba algún papel en la predicción del riesgo de MSC4, pero solo recientemente ha habido una aceptación formal de esta observación en el manejo de los pacientes. El grosor máximo de la pared del VI se considera un parámetro relevante. Su papel en la evaluación del riesgo se basa en un estudio de comienzos de los noventa5. En ese estudio, tanto el grosor máximo de la pared del VI como el índice de grosor de la pared, un parámetro que cuantificaba el grado total de hipertrofia del VI, mostraron una asociación clara con la MSC en pacientes con MCH. Sin embargo, tan solo el grosor máximo de la pared del VI continuó siendo un parámetro que tener en cuenta. Está justificado el estudio del grado de hipertrofia del VI en la estratificación del riesgo en función de esos datos históricos y de la disponibilidad actual de una cuantificación más fácil y exacta con el empleo de la RMC6. Por último, aunque la determinación del grosor máximo de la pared del VI ha mostrado una buena reproducibilidad, tradicionalmente se ha recomendado precaución en los pacientes con una hipertrofia intensa7, en los que un simple número podría tener implicaciones terapéuticas importantes. Los mencionados son algunos ejemplos de la importancia que tiene un conocimiento profundo del campo al evaluar el riesgo de MSC en los pacientes con MCH.
La historia de la investigación sobre los factores de riesgo de la MSC en la MCH pone de manifiesto el carácter cambiante de la propia estratificación del riesgo. Aún queda trabajo importante por hacer para esclarecer la fisiopatología que subyace a una posible relación entre la MSC y los parámetros que muestran una variación significativa, como el gradiente del ISVI; ¿es un marcador del riesgo o un factor de riesgo? De igual modo, ¿tienen el mismo significado los gradientes a nivel medio del ventrículo? Además, resulta difícil no aceptar la caracterización del tejido mediante la RMC, es decir, el tipo y la cantidad de fibrosis miocárdica, como un aspecto crucial en la evaluación del riesgo de estos pacientes. En la actualidad parece razonable cuando menos considerar la RMC como árbitro para los casos limítrofes. Es probable que la definición de la forma de cuantificar la fibrosis y su estandarización sean útiles finalmente para establecer cuándo y cómo debe usarse la RMC. Por otro lado, un valor decreciente de la fracción de eyección en los pacientes con MCH tiene importantes implicaciones pronósticas8. A este respecto, un análisis avanzado de la función del VI, es decir, el estudio de la mecánica miocárdica, podría ser clave para comprender el solapamiento y las diferencias reales entre la disfunción sistólica y la presencia de una fibrosis miocárdica significativa. Como observación final, la MCH es una entidad arrítmica y, en vez de buscar múltiples marcadores de riesgo posibles, los avances en este campo se centran en examinar el sustrato subyacente, es decir, la fibrosis y la desorganización. La investigación básica y traslacional centrada en la histología y la electrofisiología es fundamental para introducir nuevas perspectivas en el campo clínico.
En resumen, la toma de decisiones respecto a la prevención primaria de la MSC en la MCH puede ser difícil. Probablemente un abordaje individualizado de la evaluación del riesgo sea la mejor asistencia que los clínicos puedan proporcionar a sus pacientes. Sin embargo, este enfoque requiere recomendaciones expertas, en las que el riesgo estimado estará más próximo al riesgo real y se incluirá el valor real de los factores de riesgo bien conocidos y no tan bien conocidos en el proceso de estratificación del riesgo.
ANOMALÍAS ESTRUCTURALES APARTE DE LA HIPERTROFIALa definición de la MCH se ha caracterizado siempre por las referencias a la hipertrofia del VI. Además, hay un subgrupo frecuente de términos que pueden hallarse en las definiciones de la MCH, como espectro, amplia gama o diversos, lo que ilustra la gran diversidad que presenta esta entidad. Aunque estos adjetivos hacen referencia principalmente a la variedad estructural de las expresiones fenotípicas en la MCH, el amplio espectro de estos hallazgos podría corresponder a un espectro comparable de anomalías hemodinámicas, manifestaciones clínicas y opciones de tratamiento. Pueden observarse otras características aparte de la hipertrofia, y sus posibles implicaciones respecto al manejo de los pacientes es lo que hace que este trastorno sea extraordinariamente fascinante.
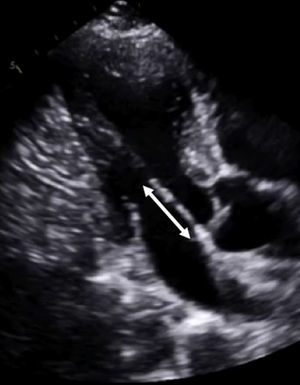
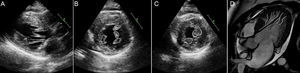
Empezar con las valvas de la válvula mitral y pasar luego al aparato subvalvular podría ser útil para identificar las alteraciones de los pacientes con una MCH sospechada o confirmada. Las valvas anterior y posterior de la válvula mitral tienen a menudo un aspecto alargado en las exploraciones de imagen9 (figura 3). Se ha señalado que la elongación de la valva no se asocia a la magnitud de la hipertrofia, por lo que constituye un componente primario de la enfermedad9. En consecuencia, esta observación es relevante por lo que respecta a los exámenes de detección sistemática de familiares y al seguimiento de los casos dudosos. Además, aunque en general se acepta que intervienen múltiples factores en la obstrucción del ISVI, una valva anterior de la válvula mitral significativamente larga junto con un ISVI estrecho deben llevar a realizar una búsqueda cuidadosa de un gradiente interventricular importante cuando no se registra con facilidad en reposo.
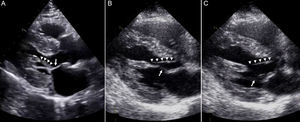
En el aparato subvalvular, la fijación anómala de la mayor parte del haz de cuerdas tendinosas en el cuerpo y la base de las valvas mitrales es a veces muy notable en los casos confirmados de MCH. La presencia de esta inserción especial en la valva anterior de la válvula mitral se asocia a menudo a un movimiento sistólico de las cuerdas tendinosas hacia delante. Con menor frecuencia se observa la inserción anómala del músculo papilar (MP) anterolateral directamente en la valva anterior de la válvula mitral10 (figura 4A). Esta anomalía se asocia invariablemente a la presencia de gradientes del ISVI a nivel ventricular medio o significativos, a causa del desplazamiento anterior del MP anterolateral. Otros factores, como las conexiones tendinosas accesorias del MP al tabique, pueden contribuir también a generar un desplazamiento hacia delante y un gradiente sistólico (figuras 4B y C). La anomalía que se observa con mayor frecuencia en el aparato subvalvular probablemente sea el desplazamiento apical del punto de inserción del MP en la pared del VI11. Además de las anomalías antes mencionadas, esta inserción apical facilita finalmente la proximidad del MP anterolateral al tabique en todo el espacio que va hasta las valvas mitrales, con lo que crea un contexto favorable a los gradientes intraventriculares.
A: inserción anómala del músculo papilar anterolateral (puntas de flecha) directamente en la valva anterior de la válvula mitral (flecha) en un paciente con diagnóstico de miocardiopatía hipertrófica septal asimétrica. B y C: conexión tendinosa anómala (puntas de flecha) del músculo papilar al tabique; las flechas indican la inserción normal del haz de cuerdas tendinosas en las valvas mitrales.
Por último, otra observación relevante estrechamente relacionada con el aparato subvalvular podría ser la presencia de haces de músculo del VI que se extienden del vértice al nivel ventricular medio o basal de la pared anterior o septal del VI12 (figura 5). Estos haces accesorios se observan generalmente en pacientes a los que se practica una miectomía quirúrgica12. De hecho, se ha demostrado que con frecuencia están unidos al MP anterolateral a nivel apical, lo cual parece facilitar nuevamente el desplazamiento anterior del MP anterolateral y su proximidad al tabique.
A: sospecha de haz muscular apical-basal (línea discontinua); las líneas continuas indican los extremos del músculo papilar. B: músculo papilar posteromedial y anterolateral bífido (líneas continuas) y sospecha de haz muscular apical-basal (línea discontinua). C: músculo papilar anterolateral fusionado en el origen del haz muscular apical-basal (líneas continuas y discontinuas); un segundo haz muscular en posición anterior (línea discontinua). D: imagen de resonancia magnética cardiovascular del mismo paciente que confirma un haz muscular apical-basal principal, con haces secundarios (líneas discontinuas); a nivel apical, el haz principal se fusiona con el músculo papilar anterolateral (línea continua).
Las diversas anomalías estructurales que se han comentado no se han abordado adecuadamente en estudios bien diseñados para poner de manifiesto su prevalencia y su papel independiente en pacientes con MCH sintomáticos. En nuestra experiencia, se da al menos una de estas observaciones en la mayor parte de los casos de MCH (más del 80%; datos no publicados). Evidentemente, la definición de su papel en la obstrucción del ISVI y a nivel medio del VI es crucial, puesto que es improbable que la ablación septal con alcohol sea totalmente efectiva para obtener una resolución. En cambio, el abordaje quirúrgico parece ser más apropiado en este contexto13. Así pues, las valvas mitrales largas, con un punto de contacto entre valva y septo bajo requieren una miectomía amplia, a veces acompañada de una intervención sobre la válvula mitral, es decir, una reconstrucción o plicatura de la valva. La inserción anómala de las cuerdas tendinosas y los MP en las valvas plantea la cuestión de si la obstrucción resultante debe abordarse también con una intervención en el aparato subvalvular, aparte de la operación de miectomía. De igual modo, parece razonable eliminar quirúrgicamente los factores que favorecen el desplazamiento anterior del MP anterolateral, es decir, la extirpación de las conexiones y los haces musculares10,12, o la liberación parcial del punto de inserción del MP en la pared del VI10,12.
CONCLUSIONESDado que la MCH tiene múltiples facetas, su abordaje diagnóstico y su tratamiento justifican la existencia de áreas especializadas en los centros médicos cardiovasculares. Sin embargo, es deseable un conocimiento global de la enfermedad, que incluya tanto las características más importantes como los aspectos menos conocidos, para facilitar la detección y el seguimiento de los pacientes con MCH fuera de los centros con un conocimiento experto de la materia. En última instancia, es probable que muchos de estos aspectos estén relacionados con contextos clínicos específicos, la estratificación del riesgo de MSC y la evaluación de las necesidades de ciertos tratamientos invasivos.
CONFLICTO DE INTERESESNinguno.