Durante más de una década, la doble terapia con ácido acetilsalicílico y clopidogrel se ha considerado el estándar para el tratamiento antiagregante oral en el intervencionismo coronario percutáneo. Sin embargo, un porcentaje importante de pacientes continúa presentando eventos isquémicos en el seguimiento con este régimen. Este hecho ha llevado al desarrollo de nuevos y más potentes fármacos bloqueadores del receptor P2Y12 como el prasugrel y el ticagrelor, que han mostrado una eficacia superior a la del clopidogrel en pacientes con síndrome coronario agudo, fundamentalmente en quienes se practicó intervencionismo coronario. El objetivo del presente artículo es aportar una visión general del estado actual del conocimiento sobre los fármacos antiagregantes orales en el intervencionismo coronario, comentando su eficacia en complicaciones propias del intervencionismo, como la reestenosis y la trombosis del stent, así como la evidencia disponible sobre la duración óptima del doble tratamiento antiagregante en estos pacientes.
Palabras clave
Las plaquetas son un elemento fundamental en el desarrollo de la aterosclerosis y las complicaciones aterotrombóticas derivadas de ella. Por lo tanto, los fármacos antiagregantes plaquetarios son fundamentales en el tratamiento y la prevención de eventos isquémicos recurrentes en los pacientes afectos de síndrome coronario agudo (SCA) o sometidos a intervencionismo coronario percutáneo (ICP)1–3. En lo que se refiere a los fármacos antiplaquetarios administrados por vía oral, se ha demostrado la eficacia de la combinación de ácido acetilsalicílico (AAS) y un inhibidor del receptor plaquetario de adenosindifosfato (ADP) P2Y12 (el clopidogrel es el fármaco más usado de este grupo) en esta situación4–8.
Durante más de una década, la doble terapia antiagregante con AAS y clopidogrel se ha considerado de referencia en el tratamiento antiagregante oral en SCA e ICP. Sin embargo, un número importante de pacientes continúa sufriendo eventos isquémicos en el seguimiento con este régimen terapéutico, lo que se debe en parte a la gran variabilidad interindividual de respuesta al tratamiento con clopidogrel; además, hay amplia evidencia de la asociación de pobre respuesta a dicho fármaco en presencia de eventos isquémicos9,10. Este hecho ha llevado en los últimos años al desarrollo de nuevos fármacos bloqueadores del receptor P2Y12 de administración oral, como el prasugrel y el ticagrelor, con un efecto más rápido, más potente y con menor variabilidad10. La eficacia de estos agentes en el SCA, fundamentalmente en pacientes a los que se practicaba ICP, se ha demostrado recientemente en ensayos clínicos a gran escala11,12, por lo que se han autorizado para uso clínico y se ha incluido su recomendación en las actualizaciones más recientes de las guías de práctica clínica13–16. El objetivo de este artículo es aportar una visión general del estado actual de conocimiento sobre los fármacos antiagregantes orales en el contexto del ICP, comentando su eficacia en complicaciones propias del intervencionismo, como la reestenosis y la trombosis del stent, y la evidencia disponible sobre la duración óptima del doble tratamiento antiagregante en estos pacientes.
Fármacos antiagregantes orales disponibles en el intervencionismo coronario percutáneoÁcido acetilsalicílicoEl AAS bloquea de manera irreversible la enzima ciclooxigenasa (COX) 1 mediante la acetilación selectiva de un residuo de serina en la posición 529 (Ser529), inhibiendo la formación de tromboxano A2 (TxA2), un mediador potente de la fase de activación plaquetaria17. Diversos ensayos clínicos a gran escala han demostrado la eficacia de AAS en el seno de los SCA18,19.
Aunque la dosis óptima de AAS ha sido objeto de debate, se recomienda generalmente el uso de una dosis baja (≤150mg/día) debido al incremento, dependiente de la dosis, del riesgo de sangrado, especialmente gastrointestinal, mientras que no se ha evidenciado aumento en la eficacia con el aumento de la dosis20–22. Estos resultados coinciden con los obtenidos en el ensayo clínico CURRENT/OASIS-7 (Clopidogrel optimal loading dose Usage to Reduce Recurrent EveNTs- Organization to Assess Strategies in Ischemic Syndromes), en el que se aleatorizó a 25.087 pacientes con SCA con una coronariografía programada a recibir una dosis alta o estándar de clopidogrel, con una aleatorización abierta a dosis altas (300–325mg/día) o bajas (75–100mg/día) de AAS. Aunque no se encontraron diferencias significativas en eficacia o seguridad a los 30 días entre ambas dosis de AAS, se evidenció una tendencia hacia el aumento de las hemorragias gastrointestinales en el grupo que recibió dosis altas de AAS (el 0,38 frente al 0,24%; p=0,051)23. Las guías de práctica clínica recomiendan la administración de AAS con una dosis inicial de 162–325mg, seguida de una dosis diaria de 75–162mg.
Actualmente ninguno de los fármacos inhibidores de la vía del TxA estudiados ha demostrado una eficacia superior a la del AAS, que por lo tanto aún no tiene alternativa en la doble terapia antiagregante empleada en SCA o ICP24.
Inhibidores del receptor P2Y12Entre los inhibidores del receptor plaquetario de ADP P2Y12 actualmente autorizados para uso clínico en SCA o ICP, están los pertenecientes al grupo de las tienopiridinas y el ticagrelor.
Existen tres generaciones de tienopiridinas actualmente disponibles: la ticlopidina, el clopidogrel y el prasugrel. Las tienopiridinas son antagonistas indirectos (profármacos que precisan de biotransformación hepática para convertirse en su metabolito activo) que inhiben de manera irreversible el receptor plaquetario de ADP P2Y12, implicado en la amplificación de la fase de agregación plaquetaria y la estabilización del agregado plaquetario10,25. Debido al bloqueo irreversible del receptor P2Y12, los efectos de las tienopiridinas persisten durante toda la vida de la plaqueta (7–10 días).
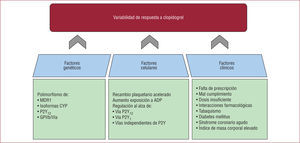
Tras su aparición en 1997, el clopidogrel sustituyó rápidamente a la ticlopidina, fundamentalmente por su mejor perfil de seguridad, especialmente en cuanto a hemotoxicidad26. Dado que el clopidogrel presenta un inicio de acción lento, se necesita una dosis de carga (generalmente 300 o 600mg) para acortarlo cuando se requiere una inhibición plaquetaria rápida, como en el contexto de un SCA o un ICP27. En el ICP se ha generalizado el uso de una dosis de carga de 600 mg, pues tiene un efecto más rápido y potente que la de 300mg28, seguida de una dosis de mantenimiento de 75mg/día. A pesar del beneficio clínico obtenido con el uso de clopidogrel combinado con AAS4–8, un importante porcentaje de pacientes sigue sufriendo eventos isquémicos en el seguimiento. Esta eficacia limitada se debe en parte a la gran variabilidad interindividual de respuesta al tratamiento con clopidogrel, a la que contribuyen múltiples mecanismos (fig.). Una «respuesta pobre» al clopidogrel está claramente asociada con la presentación de eventos isquémicos29–32. En general, estos datos enfatizan la necesidad de usar nuevas estrategias antiagregantes que consigan un bloqueo más potente del receptor P2Y12 con menos variabilidad de respuesta, especialmente en pacientes de alto riesgo, como aquellos con un SCA sometidos a ICP.
Múltiples factores están involucrados en la variabilidad de la respuesta a clopidogrel, y se puede agruparlos en tres categorías: genéticos, celulares y clínicos. ADP: adenosindifosfato; CYP: citocromo P450; GP: glucoproteína; MDR: transportador de resistencia a múltiples fármacos. Reproducida con permiso de Angiolillo et al10.
Una de las estrategias propuestas para superar el problema de la variabilidad de respuesta es el uso de una dosis más alta de clopidogrel, ya que se ha demostrado en estudios farmacodinámicos que consigue un efecto antiplaquetario más potente que las dosis habituales33–35. El ensayo CURRENT/OASIS-7 evaluó la eficacia de una dosis alta (carga de 600mg seguida de 150mg/día durante 1 semana, y después 75mg/día hasta el día 30) frente a la dosis estándar (dosis de carga de 300mg seguida de 75mg/día durante 1 mes) de clopidogrel en pacientes con SCA (n=25.087) para quienes se programaba una coronariografía en las primeras 72h tras su llegada al hospital. En la población total del estudio, no se objetivó un beneficio del régimen con dosis altas de clopidogrel23 (tabla 1). Sin embargo, en el subgrupo de pacientes a los que se practicó ICP (n=17.263), el uso de una dosis alta de clopidogrel se asoció con un descenso en la tasa de eventos isquémicos a los 30 días (el 3,9 frente al 4,5%; hazard ratio [HR]=0,85; intervalo de confianza del 95% [IC95%], 0,74–0,99; p=0,039), a expensas de un aumento en el riesgo de hemorragias mayores según la definición del estudio (el 1,6 frente al 1,1%; HR=1,41; IC95%, 1,09–1,83; p=0,009)36.
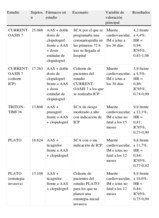
Ensayos clínicos que han evaluado la eficacia de la doble terapia antiagregante con AAS y un inhibidor oral del receptor P2Y12 en pacientes con SCA o ICP.
| Estudio | Sujetos, n | Fármacos en estudio | Escenario | Variable de valoración principal | Resultados |
| CURRENT-OASIS 7 | 25.086 | AAS + doble dosis de clopidogrel frente a AAS + dosis estándar de clopidogrel | SCA por el que se programaba una coronariografía en las primeras 72h tras su llegada al hospital | Muerte cardiovascular, IM e ictus a los 30 días | 4,2 frente a 4,4%; HR = 0,94; IC95%, 0,83-1,06 |
| CURRENT-OASIS 7 (cohorte ICP) | 17.263 | AAS + doble dosis de clopidogrel frente a AAS + dosis estándar de clopidogrel | Cohorte de pacientes del estudio CURRENT-OASIS 7 a los que se realizaba ICP | Muerte cardiovascular, IM e ictus a los 30 días | 3,9 frente a 4,5%; HR = 0,86; IC95%, 0,74-0,99 |
| TRITON-TIMI 38 | 13.608 | AAS + prasugrel frente a AAS + clopidogrel | SCA de riesgo moderado a alto con indicación de ICP | Muerte cardiovascular, IM e ictus no fatal a los 15 meses | 9,9 frente a 12,1%; HR = 0,81; IC95%, 0,73-0,90 |
| PLATO | 18.624 | AAS + ticagrelor frente a AAS + clopidogrel | SCA con o sin indicación de ICP | Muerte cardiovascular, IM e ictus no fatal a los 12 meses | 9,8 frente a 11,7%; HR = 0,84; IC95%, 0,77-0,92 |
| PLATO (estrategia invasiva) | 13.108 | AAS + ticagrelor frente a AAS + clopidogrel | Cohorte de pacientes del estudio PLATO para los que se planeó una estrategia inicial invasiva | Muerte cardiovascular, IM e ictus no fatal a los 12 meses | 8,9 frente a 10,6%; HR = 0,84; IC95%, 0,75-0,94 |
AAS: ácido acetilsalicílico; CURRENT-OASIS-7: Clopidogrel Optimal Loading Dose Usage to Reduce Recurrent Events/Optimal Antiplatelet Strategy for Intervention trial; ICP: intervencionismo coronario percutáneo; IM: infarto de miocardio; PLATO: Platelet Inhibition and Outcomes; SCA: síndrome coronario agudo; TRITON-TIMI 38: Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel.
Otra de las estrategias empleadas para superar el problema de la «resistencia» al clopidogrel ha sido el desarrollo de nuevos fármacos bloqueadores del receptor P2Y12 como el prasugrel y el ticagrelor, que tienen en común un efecto más rápido, más potente y con menos variabilidad que el clopidogrel9,10. La eficacia de estos fármacos en el SCA, fundamentalmente en pacientes a los que se practica ICP, se ha demostrado en ensayos clínicos a gran escala11,12,37, por lo que se han autorizado para uso clínico y se ha incluido su recomendación en las guías actuales de práctica clínica13,16.
El prasugrel, como todas las tienopiridinas, es un profármaco de administración oral que requiere biotransformación hepática para dar lugar a un metabolito activo, que es el que ejerce un bloqueo irreversible del receptor P2Y1210. La principal diferencia farmacológica con el clopidogrel estriba en que la conversión en metabolito activo del prasugrel es más eficiente, por lo que, dada la equipotencia de los metabolitos activos del prasugrel y el clopidogrel, produce mayor inhibición plaquetaria que este, además de ser más rápida y con menos variabilidad, incluso cuando se compara con dosis altas de clopidogrel38,39.
El ensayo TRITON-TIMI 38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel-Thrombolysis in Myocardial Infarction) comparó la eficacia y la seguridad de prasugrel (dosis de carga de 60mg seguida de dosis de mantenimiento de 10mg/día) con clopidogrel a dosis estándar (300 mg seguido de 75mg/día) en 13.608 pacientes con un SCA de riesgo moderado a alto e indicación de ICP11. Se demostró la mayor eficacia del prasugrel al conseguir una reducción relativa del 19% (el 9,9 frente al 12,1%; HR=0,81; IC95%, 0,73–0,90; p < 0,001) en las tasas de la variable de valoración principal (combinación de muerte cardiovascular, infarto de miocardio no mortal e ictus no mortal) durante un periodo de seguimiento de 15 meses. El beneficio clínico del prasugrel se derivó fundamentalmente de una reducción muy marcada de los infartos de miocardio no mortales, de los que aproximadamente el 60% fueron periprocedimiento. Además, de los pacientes que habían sufrido un evento inicial no mortal, los eventos recurrentes (muerte inclusive) se redujeron significativamente en los pacientes que recibieron prasugrel40. Por otro lado, el uso de prasugrel se asoció con un discreto aumento del riesgo de hemorragias mayores según criterios TIMI no relacionadas con revascularización coronaria (el 2,4 frente al 1,8%; p=0,03), que ocurrieron principalmente durante la fase de mantenimiento del tratamiento11. Al realizar un análisis de beneficio clínico neto combinando las variable de eficacia (prevención de eventos isquémicos) y de seguridad (hemorragias), se demostró la superioridad del prasugrel (el 12,2 frente al 13,9%; HR=0,87; p=0,004) respecto al clopidogrel. El beneficio del prasugrel fue particularmente importante en los subgrupos de pacientes con un infarto agudo de miocardio con elevación del segmento ST (IAMCEST)41 y en los diabéticos42, y no se evidenció aumento del riesgo de hemorragia en estos subgrupos. Por el contrario, en pacientes con antecedente de ictus, el prasugrel tuvo efecto clínico neto lesivo, mientras que en los pacientes de bajo peso (< 60kg) o edad avanzada (≥ 75 años), la eficacia de ambos fármacos fue similar11.
El uso clínico de prasugrel está aprobado para pacientes con SCA a los que se practica ICP, con una dosis de carga de 60mg seguida de 10mg/día como dosis de mantenimiento. Dado que en el ensayo TRITON-TIMI 38 era necesario conocer la anatomía coronaria antes de administrar el fármaco, con la excepción de los pacientes con IAMCEST, para quienes el pretratamiento estaba permitido, las guías recomiendan que en pacientes con síndrome coronario agudo sin elevación del ST (SCASEST) se administre prasugrel tras conocer la anatomía coronaria13–16.
El ticagrelor es el primer fármaco desarrollado de un nuevo grupo, las ciclopentiltriazolopirimidinas, que inhibe de manera directa (sin necesidad de un metabolito activo) y reversible el receptor P2Y12. Destacan entre sus características farmacológicas un rápido inicio de acción, una inhibición de la agregación plaquetaria superior a la obtenida con el clopidogrel y una desaparición rápida de su efecto (3–4 días) debido a su reversibilidad y una semivida corta, por lo que requiere dos tomas al día43,44. Aproximadamente el 30-40% de su efecto se atribuye a metabolitos activos generados en el hígado.
El ensayo PLATO (Platelet Inhibition and Patient Outcomes) comparó la eficacia y la seguridad del ticagrelor (dosis de carga de 180mg seguida de dosis de mantenimiento de 90mg dos veces al día) con la del clopidogrel (dosis de carga de 300–600mg seguida de 75mg/día) en 18.624 pacientes con un SCA, con o sin elevación del segmento ST12.
En ese estudio, el tratamiento con ticagrelor se asoció con una reducción significativa de las tasas de la variable de valoración principal (muerte por causa cardiovascular, IAM o ictus no mortal) tras un periodo de seguimiento de 12 meses (el 12,3 frente al 10,2%; HR=0,84; IC95%, 0,77-0,92; p=0,0001). Este beneficio se derivó principalmente de una reducción en las tasas de muerte cardiovascular (el 4 frente al 5,1%; HR=0,79; p=0,001) e infarto de miocardio (el 5,8 frente al 6,9%; HR=0,84; IC95%, 0,75-0,95; p=0,005). Es de resaltar que el beneficio observado con ticagrelor se ha repetido en diferentes subgrupos, incluidos los pacientes en que se optó inicialmente por una estrategia no invasiva45, los pacientes en los que se planeó una estrategia invasiva inicial46 y aquellos en que se realizó cirugía de revascularización47. En lo referente al riesgo hemorrágico, el ticagrelor no aumentó los sangrados mayores según los criterios de una definición establecida por el protocolo del estudio (el 11,6 frente al 11,2%; p=0,43), pero sí incrementó las tasas de hemorragias mayores no relacionadas con revascularización coronaria (el 4,5 frente al 3,8%; p=0,03), que también fueron mayores al aplicar la definición TIMI (el 2,8 frente al 2,2%; p=0,03)12, que fue la usada en el ensayo TRITON antes descrito. En el ensayo PLATO se detectaron otros efectos secundarios atribuidos a acciones del ticagrelor o sus metabolitos en lugares distintos de su diana terapéutica (receptor P2Y12), incluido un aumento de la frecuencia de disnea, un porcentaje superior de pausas ventriculares y una elevación de las concentraciones de creatinina y ácido úrico durante el tratamiento. Sin embargo, aún no se ha demostrado que estos efectos secundarios tengan impacto clínico significativo48,49.
El ticagrelor se ha aprobado para uso clínico en pacientes con SCA, tanto los tratados médicamente como en los que se realiza ICP, y se debe administrar una dosis de carga de 180mg seguida de 90mg cada 12h como dosis de mantenimiento13,15,16. Cabe recordar que se debe evitar que los pacientes que reciben ticagrelor tomen AAS a dosis de 75–100mg/día, por la pérdida de eficacia del ticagrelor observada con dosis superiores de AAS.
Complicaciones propias del intervencionismo coronarioReestenosis del stentLa reestenosis, o reducción en el diámetro luminal tras ICP (reestenosis binaria angiográfica), se define como un estrechamiento luminal ≥ 50% y es el resultado del daño en la pared arterial tras implantación del stent, con la consiguiente proliferación del tejido neointimal. Aunque los stents liberadores de fármaco (SLF) han reducido de manera muy importante la incidencia de reestenosis, no han sido capaces de eliminarla por completo y continúa siendo un problema significativo tras ICP50. Estudios histopatológicos en humanos han demostrado que, tras la implantación de un stent coronario, la ulterior formación de trombo y el proceso inflamatorio agudo se siguen de una proliferación de células musculares lisas, lo que resulta en el crecimiento neointimal que da lugar a la reestenosis51,52.
Las plaquetas tienen una función esencial en la generación temprana del trombo y la formación más tardía de neoíntima, resultado del daño arterial producido tras la colocación del stent. Se ha descubierto que el receptor P2Y12 se expresa también en las células musculares lisas y puede estar involucrado en la respuesta inflamatoria arterial producida tras un daño causado, por ejemplo, por la implantación de un stent53. Además, la vía iniciada en el receptor plaquetario P2Y12 se encuentra implicada sustancialmente en la formación de tejido neointimal, lo que indica que una inhibición potente de dicho receptor antes y durante el ICP podría resultar beneficiosa para reducir la incidencia de reestenosis54. Sin embargo, pese a los hallazgos prometedores de los estudios preclínicos, los resultados de los estudios clínicos que han evaluado el efecto de la respuesta inhibitoria plaquetaria mediada por clopidogrel (un bloqueador del receptor P2Y12) en las tasas de reestenosis no han proporcionado ninguna evidencia firme al respecto55. En lo que respecta a otros inhibidores del receptor P2Y12, un estudio reciente en modelo murino ha evidenciado que el uso de ticagrelor antes y durante 4h tras producirse un daño arterial inhibe de manera importante la formación de neoíntima, además de reducir la formación del trombo56. Queda por determinar si este posible efecto beneficioso del ticagrelor tiene una correlación clínica en las tasas de reestenosis y si se debe a la inhibición del P2Y12 o de otras dianas («off-target effects»).
Por último, cabe señalar que el único agente antiplaquetario del que se ha demostrado de manera consistente una reducción en las tasas de reestenosis es el cilostazol, un inhibidor de la fosfodiesterasa III57. Pese a tener un efecto antiagregante relativamente débil, el cilostazol sí posee un efecto antiproliferativo específico y reduce la proliferación de células musculares lisas. El efecto beneficioso del cilostazol en la reducción de reestenosis clínica, tanto en stents metálicos como en SLF, se ha demostrado en diversos estudios prospectivos aleatorizados y metaanálisis58–60 y muestra un beneficio particular en los pacientes diabéticos.
Trombosis del stentLa trombosis del stent puede ocurrir con stents tanto metálicos como SLF y, aunque infrecuente, es una complicación sumamente importante del ICP debido a sus graves consecuencias, con incidencias de muerte relacionada del 20–40% y de infarto de miocardio del 50–70%61. La etiopatogenia de la trombosis del stent es multifactorial e incluye factores relacionados con el stent, el paciente, el procedimiento y las características de las lesiones61. Entre los factores relacionados con el paciente, están los relacionados con el tratamiento antiagregante (abandono prematuro, mala respuesta al fármaco, etc.).
El infarto debido a trombosis del stent tiene características diferentes de las del que se produce de novo en el vaso nativo, y se asocia con mayor carga trombótica, mayor frecuencia de embolización distal y menores tasas de reperfusión exitosa62. Esta mayor carga trombótica en la trombosis del stent hace que el tratamiento antiagregante y su duración (véase la sección siguiente) cobren una gran importancia en este contexto, y se debe ponderar adecuadamente el balance riesgobeneficio de una doble antiagregación prolongada en cada caso particular.
Entre las opciones de doble tratamiento antiagregante (combinación de AAS y un inhibidor del receptor P2Y12) disponibles actualmente, las estrategias terapéuticas que consiguen un efecto antiplaquetario más potente han mostrado un beneficio importante a la hora de reducir las tasas de trombosis del stent comparadas con la doble terapia con AAS y clopidogrel a dosis estándar, como se detalla a continuación.
En el ensayo CURRENT/OASIS 7, el uso de dosis altas de clopidogrel consiguió una reducción del 32% en las tasas de trombosis del stent definitiva o probable (el 1,6 frente al 2,3%; HR=0,68; IC95%, 0,55- 0,85; p=0,001), según definiciones del Academic Research Consortium (ARC), y del 46% en las de trombosis del stent definitiva (el 0,7 frente al 1,3%; HR=0,54; IC95%, 0,39-0,74; p=0,0001) en el seguimiento a los 30 días (trombosis precoz del stent) comparado con dosis estándar. Considerando la incidencia de trombosis del stent definitiva, se obtuvieron diferencias significativas a favor del grupo de dosis alta de clopidogrel en el día 2 y para el intervalo de 3-10 días, lo que indica un beneficio tanto de la dosis de carga como de la de mantenimiento. Además, los resultados fueron coincidentes entre los pacientes que recibieron SLF y los de stents metálicos36.
La población del ensayo TRITON-TIMI 38 incluía a pacientes con un SCA de riesgo moderado-alto con indicación de ICP, por lo que se planteó un subanálisis predefinido para evaluar el impacto de prasugrel en la prevención de la trombosis del stent63. En ese estudio, el 94% (n=12.844) de los pacientes recibieron al menos un stent, con un uso similar de stents metálicos y SLF en los brazos de prasugrel y clopidogrel. El prasugrel redujo de manera muy marcada la incidencia de trombosis del stent cualquiera que fuera la definición ARC empleada. En concreto, el uso de prasugrel disminuyó la incidencia de trombosis del stent definitiva o probable en un 52% (el 1,13 frente al 2,35%; HR=0,48; IC95%, 0,36-0,64; p < 0,0001) a los 15 meses de seguimiento. Esta reducción se produjo tanto con stents metálicos (el 1,27 frente al 2,41%; HR=0,52; IC95%, 0,35-0,77; p=0,0009) como con SLF (el 0,84 frente al 2,31%; HR=0,33; IC95%, 0,15-0,73; p < 0,0001). Además, el beneficio del prasugrel se observó en la trombosis del stent tanto precoz (< 30 días tras el implante, el 0,64 frente al 1,56%; HR=0,41; IC95%, 0,29-0,59; p < 0,0001) como tardía (> 30 días tras el implante, el 0,49 frente al 0,82%; HR=0,60; IC95%, 0,37-0,97; p=0,03)63.
La eficacia del ticagrelor en la prevención de la trombosis del stent se evaluó en la cohorte de pacientes (n=10.298) del ensayo PLATO a los que se practicó ICP46. En dicha cohorte, el tratamiento con ticagrelor se asoció con una disminución de las tasas de trombosis del stent definitiva (el 1,3 frente al 2,0%; HR=0,64; IC95%, 0,46–0,88; p=0,0054) y definitiva o probable (el 2,2 frente al 3%; HR=0,73; IC95%, 0,57– 0,94; p=0,0142) a los 12 meses, comparado con el tratamiento con clopidogrel. La reducción en trombosis del stent definitiva o probable fue más importante con los stents metálicos (el 2,2 frente al 3,1%; HR=0,67; IC95%, 0,50–0,91; p=0,0092) que con los SLF (el 2,3 frente al 2,5%; HR=0,90; IC95%, 0,56-1,45; p=0,658), con los que no se llegó a alcanzar la significación para ninguna de las definiciones ARC. El diseño del estudio permitía la aleatorización tras haber recibido una dosis de carga de clopidogrel, y se observó que la reducción de trombosis del stent definitiva en el grupo de ticagrelor se mantenía, independientemente de haber recibido una precarga de clopidogrel de 600mg46.
Duración de la doble terapia antiagreganteSegún las guías de práctica clínica actuales, para los pacientes con un SCA a los que se practica ICP, la doble terapia antiagregante con AAS y un inhibidor del receptor P2Y12 (están aceptados clopidogrel, prasugrel o ticagrelor) debe mantenerse durante 12 meses como mínimo, independientemente del tipo de stent que se implante. En cambio, en el ICP electivo sólo está aceptada la combinación de AAS y clopidogrel, y se recomienda administrarla durante 12 meses tras la implantación de un SLF y durante 1 mes como mínimo e idealmente hasta 12 meses en el caso de stent metálico13–16. Asimismo, se recomienda individualizar la duración de la terapia, que se puede continuar más de 12 meses para pacientes tratados con SLF dependiendo de su riesgo o recortarla para pacientes con elevado riesgo de sangrado13–16. No obstante, cabe recordar que la recomendación de mantener 12 meses la doble terapia antiagregante con los SLF es empírica y no se basó inicialmente en ningún estudio prospectivo aleatorizado, sino en un consenso basado en ensayos aleatorizados que evaluaron estrategias de tratamiento con clopidogrel5,6 y estudios observacionales que indicaban menor riesgo de muerte e infarto de miocardio con una duración larga de la doble terapia64,65. Además, en los primeros trabajos realizados con los SLF de primera generación, la duración de la doble terapia fue de 3 meses para los stents de sirolimus66 y 6 meses para los stents de paclitaxel67.
Los estudios observacionales que han evaluado la duración de la doble antiagregación y su asociación con eventos isquémicos en pacientes sometidos a ICP han establecido firmemente que la interrupción precoz de la doble terapia antiagregante se asocia claramente con trombosis del stent cuando dicha interrupción se produce en los primeros 6 meses de tratamiento, mientras que mantenerla durante más de 6 o 12 meses no se asocia con una reducción de la trombosis del stent tardía o muy tardía61,68. Estos datos indican que el beneficio observado de mantener a largo plazo la doble antiagregación podría estar más relacionado con la prevención de eventos isquémicos (o de reducción de sus recurrencias) debidos a progresión de la arteriosclerosis en pacientes de alto riesgo que con la trombosis del stent.
Hay pocos datos disponibles procedentes de estudios aleatorizados. Recientemente se han publicado los resultados del estudio EXCELLENT (the Efficacy of Xience/Promus Versus Cypher to Reduce Late Loss After Stenting), que comparó la eficacia de la doble terapia antiagregante durante 6 meses frente a 12 meses tras la implantación de SLF (con una segunda aleatorización a stents liberadores de everolimus frente a stents liberadores de sirolimus). Pese a que la pauta corta (6 meses) resultó no inferior a la estándar (12 meses) en la variable principal del estudio (combinado de muerte cardiovascular, infarto de miocardio o revascularización dirigida por isquemia del vaso diana) a los 12 meses, el ensayo no permite extraer conclusiones definitivas debido a la presencia de varias limitaciones, entre ellas la falta de potencia estadística porque la incidencia de la variable de valoración primaria fue menor que la esperada. Además, se evidenció una tendencia a más trombosis del stent con la pauta de 6 meses (el 0,9 frente al 0,1%; HR=6,02; IC95%, 0,72–49,96; p=0,10)69. En ese estudio se observó que la incidencia de efectos adversos fue similar con ambas pautas de tratamiento entre los pacientes con stents con everolimus, lo que respalda la idea de que la duración de la doble terapia antiagregante podría ser diferente según el tipo de SLF empleado, considerando que al parecer los SLF de segunda generación presentan un perfil de seguridad más favorable que los de primera generación61,68.
Los resultados del estudio PRODIGY (Prolonging Dual Antiplatelet Treatment after Grading Stent-induced Intimal Hyperplasia Study), que comparaba una duración de la doble antiagregación de 24 frente a 6 meses, se presentaron en el congreso de la Sociedad Europea de Cardiología 2011. En los resultados presentados no se encontraron diferencias en la eficacia de ambas pautas en la reducción de eventos isquémicos, aunque sí se evidenció un aumento en la incidencia de sangrados mayores en el grupo que prolongó la doble antiagregación 24 meses70.
Siguen siendo necesarios estudios prospectivos aleatorizados diseñados específicamente para evaluar la duración óptima de la doble terapia antiagregante. Actualmente están en marcha varios estudios que evalúan diferentes pautas de duración del tratamiento (tabla 2), cuyos resultados, una vez estén disponibles, aportarán más luz a este importante aspecto. También será necesario evaluar, ya que todavía no hay datos al respecto, cuál sería la duración óptima del tratamiento con los nuevos inhibidores del receptor P2Y12, prasugrel y ticagrelor, con los que se ha demostrado eficacia superior que con clopidogrel en la prevención de eventos isquémicos en pacientes con SCA.
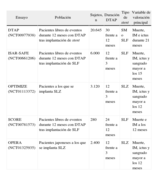
Estudios en marcha que evalúan diferentes pautas de duración de la doble terapia antiagregante en pacientes a los que se practica intervencionismo coronario.
| Ensayo | Población | Sujetos, n | Duración DTAP | Tipo de stent | Variable de valoración principal |
| DTAP (NCT00977938) | Pacientes libres de eventos durante 12 meses con DTAP tras implantación de stent | 20.645 | 30 frente a 12 meses | SM o SLF | Muerte, IM e ictus durante 21 meses |
| ISAR-SAFE (NCT00661206) | Pacientes libres de eventos durante 12 meses con DTAP tras implantación de SLF | 6.000 | 12 frente a 3 meses | SLF | Muerte, IM, ictus y sangrado mayor a los 15 meses |
| OPTIMIZE (NCT01113372) | Pacientes a los que se implanta SLZ | 3.120 | 12 frente a 3 meses | SLZ | Muerte, IM, ictus y sangrado mayor a los 12 meses |
| SCORE (NCT00781573) | Pacientes libres de eventos durante 12 meses con DTAP tras implantación de SLF | 280 | 24 frente a 12 meses | SLF | Muerte e IM a los 12 meses |
| OPERA (NCT01325935) | Pacientes japoneses a los que se implanta SLZ | 2.400 | 12 frente a 3 meses | SLZ | Muerte, IM, ictus y sangrado mayor a los 12 meses |
DTAP: doble terapia antiagregante plaquetaria; IM: infarto de miocardio; SLF: stent liberador de fármaco; SLZ: stent liberador de zotarolimus; SM: stent metálico.
A pesar del beneficio clínico de la combinación de AAS y clopidogrel en el ICP, un importante porcentaje de pacientes sufren eventos isquémicos en el seguimiento. En los últimos años se han desarrollado nuevos fármacos inhibidores del receptor P2Y12, como el prasugrel y el ticagrelor, con un efecto más rápido y más potente y con menos variabilidad que el clopidogrel. Estos nuevos fármacos han mostrado una eficacia superior a la de clopidogrel en pacientes con SCA, especialmente en quienes se practica ICP, lo que ha motivado su inclusión en las guías de práctica clínica. Aún no hay datos que aporten evidencia clara de la asociación entre inhibición plaquetaria y reestenosis clínica. Sin embargo, sí hay importante evidencia, procedente de ensayos clínicos a gran escala, de que una inhibición plaquetaria potente contribuye a prevenir la trombosis del stent, y se han demostrado reducciones importantes en la trombosis precoz y tardía con prasugrel y ticagrelor, comparados con clopidogrel. En lo referente a la duración de la doble terapia antiagregante tras el ICP, las recomendaciones actuales no se basan en estudios prospectivos aleatorizados, sino en un consenso basado en ensayos que evaluaron estrategias de tratamiento con clopidogrel y estudios observacionales. Actualmente están en marcha diversos ensayos clínicos que evalúan diferentes pautas de duración de la doble terapia antiagregante, que aportarán una importante información sobre este aspecto una vez sus resultados estén disponibles.
José Luis Ferreiro ha recibido honorarios por ponencias de Astra Zeneca, Eli Lilly Co. y Daiichi Sankyo, Inc. Los demás autores: ninguno.