La hipertensión pulmonar tromboembólica crónica (HPTEC) se produce por una oclusión de los vasos pulmonares por coágulos de sangre organizados. La HPTEC es una variante frecuente de la hipertensión pulmonar1. En Estados Unidos hay unos 2.500 nuevos casos2 al año y se calcula que la prevalencia es de unos 3 casos de HPTEC de cada 100 casos de embolia pulmonar (unos 20 por millón). La HPTEC es una complicación a largo plazo de la embolia pulmonar sintomática, con una incidencia acumulada del 1-5% en los 2 años siguientes al episodio2-5. Además, alrededor del 40% de los casos de HPTEC tiene su origen en un tromboembolismo venoso asintomático1,6.
Patogenia y pronóstico
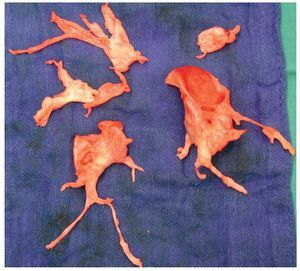
La patogenia de la HPTEC no está clara1. Aunque la HPTEC se considera un trastorno secundario a tromboembolismo venoso (TEV), no se dan los factores de riesgo plasmáticos tromboembólicos clásicos. En cambio, están presentes algunos factores de riesgo para el TEV recurrente, como un factor VIII elevado7 y anticuerpos anticoagulantes/antifosfolipídicos del lupus8. El sexo masculino no es generalmente un factor de riesgo para la HPTEC y, de hecho, en Japón, hay un predominio del sexo femenino9. Además, no se ha identificado una base genética de la HPTEC. A diferencia de la hipertensión arterial pulmonar (HAP), que afecta a vasos de menos de 300 μm, la HPTEC afecta principalmente a vasos grandes10 y, por lo tanto, se puede tratar quirúrgicamente11. En la figura 1 se presenta una pieza quirúrgica característica, que corresponde a un molde del lecho vascular pulmonar, formada por endotelio, células de músculo liso, fibroblastos y un trombo reciente.
Fig. 1. Imagen representativa de la endarterectomía pulmonar tal como se aprecia en un 40% de los pacientes. La imagen muestra la pieza operatoria correspondiente a un molde del árbol arterial pulmonar. Esta pieza corresponde a un caso de enfermedad de tipo II.
Se ha observado que el tipo quirúrgico de HPTEC tiene influencia en el pronóstico12, de la siguiente forma: tipo I, presencia de un trombo central (mortalidad quirúrgica, 2,1%); tipo II, engrosamiento de la íntima, red fibrosa y bandas dentro de las arterias lobulares (mortalidad quirúrgica, 5,3%); tipo III, oclusiones en las ramas segmentarias y subsegmentarias (mortalidad quirúrgica, 5%), o tipo IV, trombos muy distales (mortalidad quirúrgica, 25%).
Jamieson et al describieron un predominio del sexo femenino en la enfermedad de tipo III13. En Japón, hay más mujeres que varones afectados y la enfermedad se asocia al HLA-B*5201 y al HLADPB1*020214. Los datos recientes han ampliado estas observaciones y ponen de manifiesto que las pacientes con HPTEC de Japón son de edad avanzada y presentan una menor incidencia de trombosis venosa profunda, menos episodios embólicos agudos, mejor función cardiaca, menor presión parcial de oxígeno y más trombos periféricos. Además, en Japón las mujeres con HPTEC presentan menos mejoría tras el tratamiento quirúrgico que los varones.
La HPTEC es un trastorno complejo que incluye un proceso de remodelado vascular de los grandes vasos poco conocido, consecuencia de un embolismo pulmonar sintomático o asintomático y una arteriopatía pulmonar clásica1,15 que afecta a las arteriolas y los vasos precapilares de diámetro < 200 μm. Datos recientes indican que la incidencia de la enfermedad de pequeños vasos puede ser mayor en los pacientes con otros trastornos médicos asociados16, como las derivaciones ventriculoauriculares para el tratamiento de la hidrocefalia, la esplenectomía, la enfermedad inflamatoria intestinal, las enfermedades malignas de bajo grado y el tratamiento sustitutivo tiroideo. Según indican observaciones recientes, la interpretación mecánica de la HPTEC como una enfermedad causada por la obliteración de las arterias pulmonares centrales a causa de un proceso trombótico clásico puede ser demasiado simplista17. Nosotros hemos planteado la hipótesis de que el embolismo pulmonar pueda seguirse de un proceso de remodelado pulmonar que se modifique por efecto de las infecciones18, los fenómenos inmunitarios8, el tratamiento sustitutivo tiroideo y las enfermedades malignas.
La insuficiencia cardiaca derecha y la muerte son consecuencias de la HPTEC si los pacientes no reciben tratamiento19. Se han identificado variables hemodinámicas con valor predictivo pronóstico20,21.
En las últimas décadas se ha considerado la endarterectomía pulmonar (EAP) como el mejor tratamiento de este trastorno, con una mortalidad perioperatoria de tan sólo un 4-10%, una excelente calidad de vida y, en los casos favorables, una normalización de la capacidad de ejercicio y frecuentemente también de los parámetros hemodinámicos en reposo6. Sin embargo, según los datos actuales de los grandes centros de EAP, una parte significativa de los pacientes no son adecuados para la EAP o muestran una falta de mejoría o recurrencia de la hipertensión pulmonar22. La enfermedad de pequeños vasos concomitante es un factor predictivo pronóstico, en pacientes con o sin EAP16 y, teóricamente, constituye un objetivo terapéutico para el tratamiento farmacológico de la HAP clásica17.
Factores asociados
La esplenectomía, las derivaciones ventriculoauriculares, la enfermedad inflamatoria intestinal y la osteomielitis crónica se asocian a una mayor incidencia y un peor pronóstico de la HPTEC16. En una reciente base de datos retrospectiva en la que participaron tres centros europeos de EAP entre 1996 y 2007, se compararon los datos de 687 pacientes con HPTEC en el momento del diagnóstico con los encontrados en pacientes con hipertensión arterial pulmonar precapilar no tromboembólica de dichos centros. Se observó una asociación más frecuente con la HPTEC en los casos de derivaciones ventriculoauriculares y de marcapasos infectados —odds ratio (OR) (intervalo de confianza [IC] del 95%), 76,40 (7,67-10.351); p < 0,001—, esplenectomía (OR = 17,87 [1,56-2.438]; p = 0,017), TEV previo (OR = 4,52 [2,35-9,12]; p < 0,001), TEV recurrente (OR = 14,49 [5,40-43,08]; p < 0,001), grupos sanguíneos distintos de 0 (OR = 2,09 [1,12-3,94]; p = 0,019) y anticuerpos anticoagulantes/antifosfolipídicos del lupus (OR = 4,20 [1,56-12,21]; p = 0,004). Por otra parte, surgieron como nuevos factores de riesgo para la HPTEC el tratamiento sustitutivo tiroideo (OR = 6,10 [2,73-15,05]; p < 0,001) y los antecedentes de enfermedades malignas (OR = 3,76; p = 0,005). Considerados conjuntamente, los resultados de esta base de datos europea confirmaron el conocimiento previo sobre los factores de riesgo para la HPTEC e identificaron el tratamiento sustitutivo tiroideo y los antecedentes de enfermedades malignas como nuevos factores médicos asociados a ella. El tratamiento con levotiroxina aumenta las concentraciones de factor de Von Willebrand y acorta la formación del trombo plaquetario in vitro medida con el tiempo de oclusión inducida por colágeno-adrenalina, con lo que aumenta posiblemente la trombogenicidad23.
Recientemente, un registro multicéntrico prospectivo de casos incidentes no ha confirmado la influencia negativa de la esplenectomía aislada en los resultados, independientemente de la operabilidad del paciente24, si bien el número de pacientes con antecedentes de esplenectomía fue tan sólo un 6,7% y no se incluyeron en el análisis otros trastornos asociados. Las supervivencias a 1 y 3 años después del diagnóstico fueron del 82 y el 70% para los pacientes con una enfermedad no quirúrgica y el 88 y el 76% para los pacientes tratados quirúrgicamente (p = 0,023). Se observó una mejora funcional inicial en los pacientes con una enfermedad no quirúrgica, pero este efecto no persistió a los 2 años. Sin embargo, se observaron mejoras funcionales y hemodinámicas significativas en los pacientes tratados quirúrgicamente, con un aumento de la distancia recorrida en 6 min de 105 m (p < 0,001) a los 3 meses24. Los datos presentados ponen de manifiesto la importancia de identificar a los pacientes con esta enfermedad que cada vez es más susceptible de tratamiento.
Se está llevando a cabo un registro multicéntrico prospectivo europeo de HPTEC que permitirá aclarar la incidencia, el diagnóstico, el tratamientos y la evolución de los pacientes con HPTEC que actualmente se diagnostican en Europa25.
Diagnóstico
Los síntomas de HPTEC son intermitentes y se producen cuando resulta afectado más del 60% de la circulación pulmonar. La intolerancia al ejercicio y la disnea son síntomas frecuentes, junto con la fatiga, el dolor torácico, el síncope recurrente durante el ejercicio o al toser, la hemoptisis y el vértigo. La evolución de la HPTEC es episódica, con periodos prolongados denominados de «luna de miel», en los que los síntomas son leves o inexistentes10. En general, el curso es menos insidioso que el de la hipertensión arterial pulmonar19.
La diferencia alveoloarterial de oxígeno aumenta en una fase temprana de la enfermedad, posteriormente la presión parcial de oxígeno disminuye y aumenta la presión parcial de dióxido de carbono.
Un defecto de un segmento importante en la gammagrafía de ventilación/perfusión (V/Q) lleva al diagnóstico. No es necesario realizar una gammagrafía de ventilación si la radiografía de tórax es normal.
La ecocardiografía transtorácica (ETT) es un instrumento diagnóstico importante, y sirve de método de detección sistemática. La tomografía computarizada (TC) espiral con contraste intravenoso es un método diagnóstico importante y muy preciso. Además de las afecciones vasculares, puede evaluarse el estado del parénquima pulmonar.
Es necesario efectuar determinaciones de la resistencia arterial pulmonar, el índice cardiaco y la presión auricular media para valorar la gravedad de la enfermedad, la operabilidad y el pronóstico.
Angiografía pulmonar
Debe realizarse una angiografía pulmonar antes de la intervención quirúrgica. Tan sólo en centros muy experimentados, con acceso a los escáneres de TC multicorte de última generación, se puede intentar el diagnóstico sin angiografía pulmonar. Los recesos vasculares, incrementos y cambios súbitos del tamaño vascular junto con la oclusión vascular son signos angiográficos característicos26. Los cambios bruscos del tamaño de los vasos pulmonares con bandas, redes y recesos son observaciones características de la HPTEC, como también lo son los vasos centrales dilatados, con un adelgazamiento irregular de la circulación periférica y la oclusión vascular segmentaria completa.
Operabilidad
La EAP es una opción realista para la curación12. Parece claro que la operabilidad es una valoración específica de cada centro de HPTEC y está sujeta a importantes variaciones entre las distintas instituciones. Es preciso tener en cuenta diversos criterios:
1. Presencia de hipertensión pulmonar sintomática, con determinación invasiva de la presión arterial pulmonar (PAP) media, que debe tener un valor > 25 mmHg.
2. Evaluación diagnóstica después de al menos 3 meses de anticoagulación oral efectiva.
3. Signos indicativos de la presencia de trombos accesibles quirúrgicamente según la angiografía pulmonar y/o la TC de última generación, u oclusión unilateral completa de la arteria pulmonar principal.
4. Una relación de la resistencia vascular pulmonar (< 1.200 din × cm × s-5) y una masa esperada del trombo que hagan plausible una reducción > 50% de la resistencia vascular pulmonar (PVR) tras la EAP.
5. Perfil de riesgo preoperatorio que permita la operación:
- PVR < 1.000 din × cm × s-5.
- Ausencia de comorbilidades graves.
- Suficiente parénquima pulmonar funcional.
- Resistencia proximal elevada27 (experimental).
- Ausencia de trastornos médicos asociados28.
- Disminución de la PAP media de al menos un 10% tras la administración de NO inhalado durante un cateterismo cardiaco derecho diagnóstico29.
- Perfil favorable de biomarcadores (proteína transportadora de ácidos grasos libres de tipo cardiaco < 3 ng/ml30, dimetilarginina asimétrica < 0,6 μmol/l31).
- Consentimiento informado del paciente.
- Ausencia de enfermedad unilateral aislada.
- Sexo masculino si el paciente es japonés9.
- Cociente de escotadura < 1 (intervalo desde el inicio del flujo sistólico arterial pulmonar hasta la desaceleración máxima del flujo sistólico [t1] dividido por el intervalo desde la desaceleración máxima del flujo sistólico hasta el final del flujo sistólico arterial pulmonar [t2])32.
Técnicas quirúrgicas y resultados
La función cardiopulmonar en pacientes con HPTEC puede normalizarse mediante una EAP. La intervención comporta la resección del tejido obstructivo fibroso organizado incorporado en las arterias pulmonares, durante parada circulatoria bajo hipotermia profunda. Las tasas de mortalidad descritas en pacientes tratados con endarterectomía pulmonar oscilan entre el 4 y el 24%, y dependen de la localización anatómica del trombo más proximal. La operación no es una embolectomía, sino una verdadera endarterectomía. Tras la incisión en la arteria pulmonar intrapericárdica proximal, se establece el plano correcto para la endarterectomía y se sigue circularmente hasta las ramas arteriales lobulares, segmentarias y subsegmentarias de cada lóbulo. Generalmente se puede completar la endarterectomía en un pulmón con unos 20 min de parada circulatoria. A continuación se realiza una reperfusión y luego otro periodo de parada circulatoria para la endarterectomía contralateral. Con el empleo de periodos de parada cardiaca más cortos y con el uso de un forro para el enfriamiento de la cabeza, se ha reducido al mínimo el compromiso cerebral. La morbilidad perioperatoria se da principalmente por el edema de reperfusión, la neumonía y la hemorragia12. En alrededor de un 10% de los pacientes se practican simultáneamente otras intervenciones de cirugía cardiovascular12. Tanto la historia natural de la enfermedad20,21 como los resultados quirúrgicos dependen en gran medida de la hemodinámica. Una resistencia vascular pulmonar preoperatoria superior a 1.000 din × cm × s-5 aumenta el riesgo operatorio. Una resistencia vascular pulmonar postoperatoria > 500 din × cm × s-5 tiene valor predictivo para identificar mal pronóstico a largo plazo20.
Tratamiento médico
La HPTEC tiene un mal pronóstico, y más de la mitad de los pacientes con una PAP media > 50 mmHg no sobreviven más allá de 1 año después del diagnóstico20. Se cree que la hemodinámica pulmonar y la PVR son factores cruciales, puesto que su reducción significativa tras la cirugía se asocia a un aumento de la supervivencia, y los valores preoperatorios elevados comportan un riesgo significativo de mortalidad quirúrgica13. A pesar de los avances alcanzados con la EAP, se considera inoperable hasta a un 50% de los pacientes y alrededor del 24% experimenta una hipertensión pulmonar persistente o recurrente tras la EAP22.
Los estudios histopatológicos de los cambios vasculares que se producen en la HPTEC han identificado lesiones vasculares similares a las que se observan en la hipertensión arterial pulmonar idiopática (HAPI)33. Estos datos han sido el fundamento para plantear un tratamiento farmacológico de la HPTEC.
En la actualidad, parecen justificadas las siguientes indicaciones para el tratamiento médico de la HPTEC:
- Enfermedad distal inoperable.
- Comorbilidades que se consideren de alto riesgo para la cirugía.
- Como puente para la EAP o el trasplante en pacientes de alto riesgo.
- Hipertensión pulmonar persistente o residual tras la EAP.
El ensayo BENEFIT es el único estudio que ha utilizado las medicaciones habitualmente empleadas en la HAP en pacientes con HPTEC y ha tenido una potencia estadística suficiente para detectar una diferencia estadística entre los pacientes tratados y los controles. Este estudio tenía unas bases sólidas. Varios ensayos no controlados en pacientes con HPTEC habían indicado que el bosentán era eficaz para mejorar la capacidad de ejercicio y la hemodinámica34-36. Además, en modelos animales de HPTEC también se había demostrado un remodelado vascular mediado por la endotelina37. Finalmente, en pacientes con HPTEC se había observado un aumento de las concentraciones de endotelina y la expresión del receptor de ETB38.
En el estudio BENEFIT se incluyó a pacientes con HPTEC inoperable o hipertensión pulmonar persistente/recurrente tras una EAP (más de 6 meses después de la EAP). Las variables de valoración coprincipales independientes fueron el cambio de la PVR (expresado en porcentaje del valor basal) y el cambio de la distancia recorrida en 6 min respecto a la situación basal, tras 16 semanas de tratamiento con bosentán o con placebo. Las variables de valoración secundarias fueron el cambio de la clase funcional de la OMS y de otros parámetros hemodinámicos respecto a la situación basal. Se incluyó en el estudio a un total de 157 pacientes, que fueron asignados aleatoriamente a placebo (n = 80) o bosentán (n = 77). Se demostró un efecto estadísticamente significativo del tratamiento con bosentán respecto a placebo, en cuanto a la PVR, con una disminución del 24,1% respecto al valor basal (IC del 95%, -31,5 a -16; p < 0,0001). La resistencia pulmonar total (efecto del tratamiento, -193 din × cm × s-5; IC del 95%, -283 a -104; p < 0,0001) y el índice cardiaco (efecto del tratamiento, 0,3 l × min-1 × m-2; IC del 95%, 0,14-0,46; p = 0,0007) mostraron mejoría. El efecto medio del tratamiento en la prueba de 6 min de marcha fue de +2,2 m (IC del 95%, -22,5 a 26,8; p = 0,5449). El tratamiento con bosentán fue bien tolerado. Este estudio ha demostrado un efecto positivo del tratamiento con bosentán sobre la hemodinámica en esta población de pacientes. Sin embargo, no se observó mejoría alguna en la capacidad de ejercicio.
Conclusiones
La HPTEC es un trastorno vascular pulmonar «doble», con un remodelado vascular de la organización del trombo en los vasos principales, que puede tratarse mediante una EAP, junto con una arteriopatía pulmonar de pequeños vasos, que es el principal objetivo de los tratamientos vasodilatadores clásicos. Sin embargo, serán necesarios nuevos ensayos para definir el papel y las variables de valoración adecuadas para evaluar el tratamiento médico en los pacientes con HPTEC.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. I. Lang.
Professor of Vascular Biology. Department of Internal Medicine II. Division of Cardiology. Medical University of Vienna.
Währinger Gürtel 18-20. 1090 Vienna. Austria.
Correo electrónico: irene.lang@meduniwien.ac.at