La cardiopatía isquémica es la causa más importante de morbimortalidad en los países occidentales y la angina de pecho, la manifestación clínica más frecuente. La presencia de angina se asocia con una peor calidad de vida y un mayor riesgo de eventos cardiovasculares. A mayor gravedad de la angina, mayor es el riesgo. Por lo tanto, un objetivo terapéutico para los pacientes con cardiopatía isquémica crónica debería ser reducir la carga de angina. Existen diferentes grupos farmacológicos para el control de la angina (bloqueadores beta, antagonistas de los canales del calcio, ranolazina, nitratos, ivabradina, trimetazidina, nicorandil). Salvo en los pacientes con insuficiencia cardiaca y fracción de eyección reducida o tras un infarto agudo de miocardio reciente, en quienes los bloqueadores beta tienen demostrado beneficio pronóstico, en el resto de los casos los fármacos antianginosos mejoran los síntomas pero no el pronóstico. Sin embargo, cada uno de ellos tiene un mecanismo de acción diferente y un impacto distinto en las variables hemodinámicas. Por lo tanto, el tratamiento farmacológico antianginoso, en monoterapia o en combinación, debería ajustarse en función de las características clínicas de cada paciente. La revascularización coronaria debería reservarse a los pacientes con cardiopatía isquémica crónica que continúen sintomáticos a pesar del tratamiento farmacológico, así como aquellos con anatomía coronaria de alto riesgo. En la presente actualización se revisan los diferentes tratamientos antianginosos disponibles y se realiza una aproximación individualizada sobre su uso en la práctica clínica.
Palabras clave
La cardiopatía isquémica es un proceso patológico que se caracteriza por el acúmulo progresivo de placas ateroscleróticas a nivel de las arterias epicárdicas. Se trata de un proceso dinámico, que puede progresar, estabilizarse o incluso remitir, dependiendo del tratamiento que reciba el paciente (cambios en el estilo de vida, tratamiento antitrombótico, control de factores de riesgo cardiovascular, revascularización coronaria, etc.)1. Por lo tanto, se trata de un proceso crónico, en el que pueden alternarse periodos de aparente «estabilidad», en el que el paciente puede incluso encontrarse asintomático, con otros de descompensación, como en el síndrome coronario agudo1.
La angina de pecho es la manifestación más común de la cardiopa- tía isquémica2. Se define típicamente como: a) una molestia recurrente, generalmente de tipo opresivo, retroesternal, que se puede irradiar a cuello, mandíbula, ambos brazos (más frecuentemente izquierdo) o epigastrio; b) que suele precipitarse por el ejercicio físico o el estrés emocional, y c) que mejora con el reposo o con nitratos de acción corta en pocos minutos. Sin embargo, en ocasiones se puede presentar de manera atípica como disnea, malestar digestivo, etc., más frecuentemente en el paciente anciano o diabético1–5. Por otra parte, preocupa particularmente en caso de que la angina se produzca con más frecuencia, disminuya el umbral de esfuerzo, tenga una mayor duración u ocurra sin causa aparente2,6,7.
Es difícil determinar la prevalencia real de la angina crónica de esfuerzo debido a que, para su definición, no se han tenido en cuenta los mismos criterios en los diferentes registros. Asimismo, hay que considerar que el diagnóstico es puramente clínico y se basa en características subjetivas (calidad del dolor, duración, factores precipitantes, etc.), lo que dificulta aún más la obtención de datos concretos. Además, la prevalencia puede variar en función de otros factores, como la edad de la población analizada, el tratamiento farmacológico, la revascularización coronaria, o las comorbilidades, entre otros3. Aun con todas estas limitaciones, se estima que aproximadamente 10 millones de adultos en Estados Unidos presentan angina crónica estable8. Se calcula que la prevalencia de angina en los países occidentales se sitúa en torno a 30.000-40.000 casos/millón de habitantes9. En España, el estudio OFRECE mostró una prevalencia de angina de cerca del 3% de los pacientes de 40 o más años10. Sin embargo, la prevalencia aumenta con la edad. Así, en un trabajo se estimó que la prevalencia variaba del 4-7% de los pacientes de 40-79 años, cifra que superaba el 10% a partir de los 80 años7,8. También existen diferencias entre sexos: se ha objetivado que la prevalencia es del 5-7% de las mujeres de 45-64 años y aumenta hasta el 10-12% a los 65-84 años, mientras que en los varones es del 4-7% y del 15-14% respectivamente3,11. Esta mayor prevalencia de angina en las mujeres frente a los varones se ha confirmado en un metanálisis de más de 25.000 casos de angina de 31 países diferentes12. Y es que, aunque en general las mujeres tengan menos enfermedad coronaria obstructiva que los varones, tienen una mayor prevalencia de disfunción microvascular coronaria13. Los datos disponibles indican una incidencia anual de angina de pecho del 1% de los varones de 45-65 años en los países occidentales, que es ligeramente superior en las mujeres3. Además, en la mujer la enfermedad coronaria conlleva más mortalidad y riesgo de insuficiencia cardiaca que en el varón14.
No obstante, se espera que tanto la incidencia como la prevalencia de angina aumenten en los próximos años, como consecuencia del envejecimiento de la población, el aumento de los factores de riesgo cardiovascular y el mejor tratamiento de los eventos cardiovasculares agudos3.
Importancia de controlar la anginaLa cardiopatía isquémica es la causa más importante de mortalidad y discapacidad en los países occidentales6. De hecho, se estima que en Europa se producen más de 4 millones de muertes anuales por enfermedad coronaria, más del 80% en mayores de 65 años3,15. Los pacientes con angina «estable» tienen un riesgo anual de muerte alrededor del 1-2,5% y un riesgo de infarto de miocardio o muerte del 3-4%3,7,11. Y es que los pacientes con angina están en mayor riesgo de eventos cardiovasculares. Así, en el registro REACH, con más de 26.000 pacientes con cardiopatía isquémica crónica, los que tenían angina presentaban mayor riesgo de eventos cardiovasculares (muerte cardiovascular, infarto de miocardio o ictus), insuficiencia cardiaca, revascularización coronaria u hospitalización cardiovascular que los que no tenían angina tras 4 años de seguimiento (tabla 1).)16. Más recientemente, en el estudio ISCHEMIA, que incluyó a 5.179 pacientes con enfermedad coronaria estable e isquemia moderada o grave, la presencia de angina se asoció con mayor riesgo de complicaciones cardiovasculares17.
Riesgo de eventos cardiovasculares en función de la presencia de angina (frente a ausencia) en el registro REACH
| Evento | HR bruta (IC95%) | p | HR ajustada* (IC95%) | p |
|---|---|---|---|---|
| ECV, IM o ictus | 1,19 (1,11-1,27) | < 0,001 | 1,06 (0,99-1,14) | 0,11 |
| ECV | 1,12 (1,02-1,23) | 0,02 | 0,95 (0,86-1,05) | 0,33 |
| IM | 1,16 (1,02-1,31) | 0,03 | 1,14 (1,00-1,31) | 0,06 |
| Ictus | 1,37 (1,21-1,55) | < 0,001 | 1,19 (1,04-1,37) | 0,01 |
| Insuficiencia cardiaca | 1,42 (1,30-1,54) | < 0,001 | 1,17 (1,06-1,28) | 0,002 |
| Hospitalización CV | 1,38 (1,31-1,46) | < 0,001 | 1,29 (1,21-1,38) | < 0,001 |
| Revascularización coronaria | 1,15 (1,06-1,24) | 0,001 | 1,23 (1,13-1,34) | < 0,001 |
ECV: enfermedad cardiovascular; IM: infarto de miocardio; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Ajustado por edad, sexo, hábito tabáquico, diabetes, índice de masa corporal, eventos isquémicos (≤ 1 frente a > 1 al año), enfermedad polivascular, insuficiencia cardiaca, fibrilación/flutter auricular, ácido acetilsalicílico, estatinas y región.
Tabla realizada con datos de Eisen et al.16.
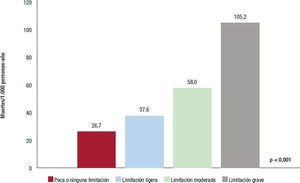
No solo es importante la presencia de angina, sino también su gravedad (grado de limitación), ya que a mayor limitación, peor pronóstico (figura 1).)18. Asimismo, una gran carga de isquemia detectada en las pruebas de imagen de estrés, una escasa capacidad de esfuerzo o una contractilidad miocárdica disminuida también se asocian con mayor riesgo de eventos adversos19–22. Sin embargo, un adecuado tratamiento y una mayor adherencia disminuyen el riesgo de complicaciones en el paciente con enfermedad coronaria3.
Supervivencia en función de las limitaciones físicas debidas a la angina. Figura elaborada con datos de Mozaffarian18.
Por otra parte, la presencia de angina se asocia con un empeoramiento claro de la calidad de vida de los pacientes. En el estudio AVANCE, que incluyó a 2.024 pacientes con cardiopatía isquémica crónica, aproximadamente la mitad se encontraban asintomáticos (menos de 1 episodio de angina a la semana en el último mes), el 39% reportabla 1-3 episodios a la semana y el 11%, más de 3. En el 66% se había realizado previamente revascularización, y el 59% de ellos presentaban angina recurrente23. Por desgracia, en numerosas ocasiones el clínico subestima los efectos de la angina en la calidad de vida de los pacientes, lo que podría tener implicaciones pronósticas importantes al no optimizarse suficientemente el tratamiento24.
No es de extrañar, por tanto, la elevada cantidad de recursos de salud que precisan los pacientes con angina de pecho, lo que se asocia con un elevado coste sanitario25,26. En consecuencia, el tratamiento sintomático de la angina de pecho debe considerarse uno de los objetivos principales en el abordaje del paciente con cardiopatía isquémica crónica.
Por otra parte, los pacientes con enfermedad coronaria presentan numerosas comorbilidades (tabla 2), más frecuentes en los pacientes con angina, que es necesario tener en cuenta a la hora de ajustar el tratamiento, ya que pueden determinar la selección del fármaco antianginoso ante la aparición de reacciones adversas, interacciones medicamentosas o contraindicaciones27.
Perfil clínico de los pacientes con cardiopatía isquémica crónica en función de la presencia de angina. Datos del registro CLARIFY27
| Angina | No angina | p | |
|---|---|---|---|
| Características biodemográficas | |||
| Edad (años) | 63,0 | 64,5 | < 0,001 |
| Varones | 71,5 | 79,3 | < 0,001 |
| Factores de riesgo cardiovascular | |||
| Dislipemia | 78,8 | 73,9 | < 0,001 |
| Hipertensión tratada | 78,5 | 68,9 | < 0,001 |
| Diabetes | 28,6 | 29,2 | 0,332 |
| Fumador activo | 15,0 | 11,8 | < 0,001 |
| Enfermedad cardiovascular | |||
| Infarto de miocardio | 62,5 | 59,2 | < 0,001 |
| Antecedentes familiares de cardiopatía isquémica | 35,4 | 26,6 | < 0,001 |
| Sedentarismo | 14,6 | 16,6 | < 0,001 |
| Enfermedad arterial periférica | 13,0 | 9,0 | < 0,001 |
| Ictus | 5,3 | 3,7 | < 0,001 |
AF: antecedentes familiares. Los datos expresan n (%).
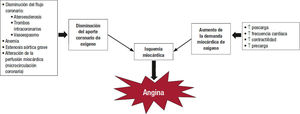
Para un óptimo tratamiento de la angina, es necesario conocer sus mecanismos fisiopatológicos (figura 2). La angina de pecho ocurre cuando el aporte de oxígeno al miocardio es insuficiente para cubrir la demanda (los miocitos no tienen suficiente oxígeno para la oxidación mitocondrial), lo que conduce a la isquemia miocárdica.
La causa más frecuente es la reducción del flujo sanguíneo coronario debido a obstrucciones de las arterias epicárdicas por placas de ateroesclerosis que hacen que, ante un aumento de la demanda de oxígeno (p. ej., un esfuerzo físico), el aporte sea insuficiente3,7. En la cardiopatía isquémica crónica, la ateroesclerosis se produce por la acumulación de lipoproteínas en el espacio subintimal de las arterias coronarias, junto con un aumento de la respuesta inflamatoria y el estrés oxidativo, proceso que puede progresar a lo largo de los años y produce un remodelado concéntrico arterial, calcificaciones y estenosis focales. Sin embargo, en ocasiones estas placas se pueden romper o erosionar, con lo que se facilita la formación de trombos ricos en plaquetas y ocasiona el síndrome coronario agudo7,28,29. En los pacientes con angina por enfermedad de las arterias coronarias epicárdicas, varios factores contribuyen a aumentar la demanda miocárdica de oxígeno, entre los que se encuentran la frecuencia cardiaca, la presión arterial, el estrés parietal, la hipertrofia cardiaca y la contractilidad miocárdica, mientras que el flujo sanguíneo coronario, que depende de la integridad de las arterias coronarias y la capacidad de la sangre para transportar el oxígeno (hemoglobina), son los principales determinantes de una adecuada liberación de oxígeno3,7. En condiciones normales, el aumento de la demanda de oxígeno se consigue mediante un incremento en el flujo sanguíneo coronario, lo que se ve alterado en pacientes con ateroesclerosis coronaria. Asimismo, en la isquemia miocárdica se produce un aumento de la glucolisis anaeró- bica y de las concentraciones de hidrógeno, potasio y lactato en el territorio isquémico, lo que conduce a una acidosis que compite con el calcio y produce alteraciones en el sarcolema y, en último término, en la contractilidad miocárdica durante el periodo de isquemia3,7.
No obstante, la angina no solo puede ocurrir por un aporte insuficiente de oxígeno por una obstrucción coronaria. En pacientes sin estenosis coronaria, los síntomas de angina pueden deberse a hipertensión arterial grave, miocardiopatía hipertrófica, estenosis aórtica grave, anemia o taquicardia, entre otros, condiciones que disminuyen la reserva de flujo coronario y producen isquemia miocárdica3. Asimismo, también puede observarse una perfusión miocárdica disminuida en el caso de alteraciones de la microcirculación coronaria, más frecuente en las mujeres, probablemente como consecuencia de una disfunción de las células endoteliales7,30,31.
Fármacos antianginososEn el abordaje terapéutico del síndrome coronario crónico, existen varios fármacos de los que se ha demostrado que mejoran la morbi- mortalidad cardiovascular, entre los que se incluyen los fármacos antitrombóticos, los inhibidores del sistema renina-angiotensina y el tratamiento hipolipemiante. Junto a estos, también deben considerarse los fármacos antianginosos para mejorar los síntomas. En la actualidad existen numerosos fármacos de los que se ha demostrado que mejoran el control de la angina en la práctica clínica. A continuación se resumen las características más importantes.
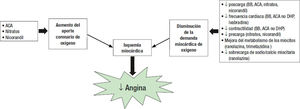
Bloqueadores betaLos bloqueadores beta reducen la carga de angina al disminuir la frecuencia cardiaca, la contractilidad miocárdica, la poscarga y, en consecuencia, la demanda miocárdica de oxígeno y el tiempo hasta la aparición de angina en esfuerzo1–3. Parece que la disminución de la frecuencia cardiaca sería el mecanismo más importante, al aumentar el tiempo de diástole y así mejorar la perfusión coronaria y el aporte de oxígeno3. Sin embargo, no todos los bloqueadores beta son iguales, ya que existen diferencias relevantes en cuanto a su cardioselec- tividad (selectividad por los receptores β1), actividad simpaticomi- mética y acción vasodilatadora. Por ejemplo, el nebivolol se asocia con una menor bradicardia en comparación con otros bloqueadores beta y presenta una mejor tolerabilidad. No obstante, en términos generales parece que su eficacia clínica antianginosa es similar1-4,32-34. Desafortunadamente, una proporción considerable de pacientes sufren efectos secundarios de los bloqueadores beta o no los toleran (tabla 3 y tabla 4, figura 3)53,54. En caso de que la frecuencia cardiaca siguiese elevada a pesar del tratamiento con bloqueado- res beta, se podría añadir ivabradina al tratamiento. Con ello se conseguiría una mayor reducción de la frecuencia cardiaca con mejor tolerabilidad58.
Efecto de los fármacos antianginosos en diferentes parámetros hemodinámicos
| Flujo coronarioa | Presión arterial | Frecuencia cardiaca | Retorno venoso | RVP | Contractilidad miocárdica | |
|---|---|---|---|---|---|---|
| Bloqueadores beta | ||||||
| No cardioselectivos | - | ↓ | ↓ | - | ↑/- | ↓ |
| Cardioselectivos | - | ↓ | ↓ | - | - | ↓ |
| Con acción vasodilatadora | - | ↓ | ↓b | - | ↓ | ↓ |
| Antagonistas de los canales del calcio | ||||||
| DHP | ↑ | ↓ | ↑/- | - | ↓ | ↑/- |
| No DHP | ↑ | ↓ | ↓ | - | ↓ | ↓ |
| Nitratos de acción prolongada | ↑ | ↓ | c↑/-d | ↓ | ↓/- | - |
| Ivabradina | - | ↓/-e | ↓ | - | - | - |
| Ranolazina | - | - | - | - | - | - |
| Trimetazidina | - | - | - | - | - | - |
| Nicorandil | ↑ | ↓ | ↑ | ↓ | ↓/- | - |
↑: aumento; ↓: disminución; -: efecto neutro; DHP: dihidropiridínicos; RVP: resistencias vasculares periféricas.
Se dispone de pocos datos de pacientes con hipotensión leve o moderada, por lo que debe usarse con precaución en ellos. No emplear si hay hipotensión grave. Tabla elaborada con datos de Tarking39, Koruth40, Tardif41, Tagliamonte42, Gloeker43, Glezer44, Fox45, Salazar46, Rayner47, Savarese48, Meiszterics49, Marzilli50, The IONA Study group51 y Shen52.
Efectos secundarios, contraindicaciones y precauciones con los fármacos antianginosos
| Fármacos | Efectos secundarios | Contraindicaciones y precauciones |
|---|---|---|
| ACA no DHP | Bradicardia, bloqueo auriculoventricular, hipotensión, inotrópico negativo, edema periférico, rubor, cefalea, hiperplasia gingival, estreñimiento (verapamilo > diltiazem) | Contraindicaciones: bradicardia o trastorno de conducción avanzado, síndrome del seno enfermo, insuficiencia cardiaca con disfunción del ventrículo izquierdo Precauciones: hipotensión, tratamiento concomitante con sustratos de CYP3A4, inotrópico negativos (bloqueadores beta, inhibidores de los canales del sodio) o fármacos bradicardizantes |
| ACA DHP | Edema periférico, rubor, cefalea, taquicardia refleja, fatiga, hiperplasia gingival | Contraindicaciones: shock cardiogénico, estenosis aórtica grave, miocardiopatía hipertrófica obstructiva, hipotensión Precauciones: insuficiencia hepática avanzada, tratamiento concomitante con sustratos de CYP3A4 |
| Nitratos | Rubor, cefalea, hipotensión, hipotensión ortostática, taquicardia refleja, síncope, metahemoglobinemia | Contraindicaciones: miocardiopatía hipertrófica, estenosis aórtica grave, tratamiento concomitante con inhibidores de la fosfodiesterasa-5 Precauciones: mantener tiempo libre de nitratos de larga duración 10-14 h diarias para evitar taquifilaxia, tratamiento concomitante con bloqueadores alfaadrenérgicos |
| Bloqueadores beta | Bradicardia, bloqueo auriculoventricular, intolerancia al ejercicio, fatiga, efecto inotrópico negativo, hipotensión, enmascaramiento de síntomas de hipoglucemia (temblor, taquicardia), disfunción eréctil, broncoespasmo, depresión, estreñimiento, fenómeno de Raynaud (bloqueadores beta no selectivos) | Contraindicaciones: bradicardia o trastorno de conducción avanzado, shock cardiogénico, asma, enfermedad vascular periférica grave, insuficiencia cardiaca descompensada, angina vasoespástica Precauciones: diabetes (si hay antecedentes de hipoglucemia), EPOC (si hay componente broncorreactivo), tratamiento concomitante con fármacos bradicardizantes |
| Ivabradina | Fosfenos, cefalea, mareo, bradicardia, bloqueo cardiaco, fibrilación auricular | Contraindicaciones: bradicardia, infarto agudo de miocardio, hipotensión grave (< 90/50 mmHg), enfermedad del nódulo sinual, insuficiencia cardiaca aguda o inestable, angina inestable, enfermedad hepática grave, embarazo, combinación con verapamilo o diltiazem Precauciones: edad avanzada, enfermedad renal grave, tratamiento concomitante con inhibidores potentes de CYP450 o CYP3A4 o con fármacos que prolongan el intervalo QT |
| Ranolazina | Náuseas, debilidad, astenia, cefalea, estreñimiento, prolongación del intervalo QT | Contraindicaciones: enfermedad renal grave o hepática moderada o grave, tratamiento concomitante con inhibidores potentes de CYP3A4 o antiarrítmicos Ia o III (diferentes de la amiodarona) Precauciones: ajuste de dosis cuidadoso en pacientes con enfermedad renal leve o moderada o hepática leve, tratamiento concomitante con inhibidores moderados del CYP3A4 y la glucoproteína-P o con fármacos que prolongan el intervalo QT |
| Trimetazidina | Vómitos, diarrea, alteraciones del movimiento, malestar gástrico, náuseas, erupción cutánea, prurito, cefalea | Contraindicaciones: alergia, enfermedad de Parkinson, temblores, trastornos del movimiento, enfermedad renal grave Precauciones: daño renal moderado, edad avanzada |
| Nicorandil | Cefalea, rubor, mareo, debilidad, náuseas, hipotensión, úlceras orales, anales o gastrointestinales | Contraindicaciones: empleo de inhibidores de la fosfodiesterasa-5, shock cardiogénico, insuficiencia cardiaca aguda, hipotensión Precauciones: empleo concomitante con antiinflamatorios no esteroideos |
ACA: antagonistas de los canales del calcio; DHP: dihidropiridlnicos. Tabla elaborada con datos de Knuuti1, Ferrari2, Balia3, Joshi7, Pascual35, Preston36, Boden37, Rousan38,Tarking39, Koruth40, Fox45, Salazar46, Rayner47, Savarese48, Meiszterics49, Marzilli50, The IONA Study group51, Shen52, Bangalore53, Bertero54, Tardif55, Wei56 y Husted57.
El objetivo terapéutico sería ajustar la dosis de bloqueadores beta para conseguir una frecuencia cardiaca de 55-60 Ipm en reposo. En caso de que hubiese que suspender el tratamiento con bloqueadores beta, debe hacerse de manera escalonada para evitar un efecto rebote1,59. La combinación de bloqueadores beta con antagonistas de los canales del calcio dihidropiridínicos o nitratos de acción prolongada sería útil para reducir la taquicardia refleja asociada con estos grupos farmacológicos1. Sin embargo, la combinación con antagonistas de los canales del calcio no dihidropiridínicos solo debe realizarse bajo control médico. También podría ser útil aprovechar la realización de ergometrías o pruebas funcionales para comprobar la respuesta cronotropa al esfuerzo, pues en algunos pacientes el exceso de tratamiento o de efecto con los bloqueadores beta podría empeorar la angina y la tolerancia al esfuerzo.
El tratamiento con bloqueadores beta se ha demostrado beneficioso para el pronóstico de los pacientes con insuficiencia cardiaca y fracción de eyección reducida o con infarto de miocardio reciente (< 1 año), pero no en el resto de los pacientes con cardiopatía isquémica crónica, para quienes solo mostrarían un beneficio sinto- mático1,60-62.
Antagonistas de los canales del calcioLos mecanismos principales de los antagonistas de los canales del calcio para reducir los síntomas de angina incluyen la vasodilatación y la reducción de las resistencias vasculares periféricas mediante el bloqueo de los canales L del calcio del músculo liso vascular y del miocardio. No obstante, es importante destacar que constituyen un grupo heterogéneo de fármacos y que pueden clasificarse en dihidropiridíni- cos (amlodipino, lercanidipino, manidipino, etc.) y no dihidropiridíni- cos (diltiazem y verapamilo). Los primeros tienen una mayor selectividad vascular, aumentan el aporte de oxígeno y disminuyen la poscarga, mientras que los segundos reducen la frecuencia cardiaca, aumentan el tiempo de la diástole y son inotrópicos negativos (figura 3. Los efectos de los antagonistas de los canales del calcio en los parámetros hemodinámicos se resumen en la tabla 3 y los efectos secundarios y las contraindicaciones principales, en la tabla 4. El empleo de los antagonistas de los canales del calcio tampoco se ha asociado con una reducción de los eventos cardiovasculares en los pacientes con cardio- patía isquémica crónica1-4,35-37. Junto con los nitratos, están especialmente indicados en la angina vasoespástica1. Es importante destacar que tanto el verapamilo como el diltiazem se metabolizan vía el cito- cromo P-450 CYP3A4, al igual que ivabradina. A diferencia de la combinación de bloqueadores beta con ivabradina, que es beneficiosa, el tratamiento concomitante con verapamilo o diltiazem e ivabradina no está recomendado, dado que aumentan la concentración plasmática de ivabradina y producen una reducción adicional de la frecuencia cardiaca, por lo que esta combinación está contraindicada63. Tampoco se recomienda el empleo de verapamilo o diltiazem en pacientes con angina y disfunción del ventrículo izquierdo, ya que pueden agravar la disfunción ventricular y la insuficiencia cardiaca55.
NitratosA través de su componente activo, el óxido nítrico, los nitratos, a las dosis habituales, son fundamentalmente vasodilatadores venosos (reducen la precarga) y coronarios, mientras que a dosis más altas reducen las resistencias vasculares periféricas y son vasodilatadores arteriales. De esta forma, los nitratos producen un alivio de la angina. Junto con los antagonistas de los canales del calcio, están especialmente indicados en la angina vasoespástica1. Durante el tratamiento crónico con nitratos de acción prolongada se genera tolerancia y pérdida de eficacia, por lo que deben dejarse intervalos de 10-14 h al día sin tratamiento con nitratos. Por otra parte, los nitratos pueden administrarse vía oral o transdérmica mediante parches de liberación retardada. La dosis se debe ajustar hasta conseguir el alivio de la angina con la dosis máxima tolerada. Se debería evitar la suspensión abrupta para disminuir el efecto rebote. Los efectos secundarios más frecuentes incluyen la hipotensión, la cefalea y el rubor. La taquicardia refleja asociada con el tratamiento con nitratos se puede disminuir con el tratamiento combinado con los antianginosos frenadores de la frecuencia cardiaca (tabla 3) y 4, figura 3). Se ha asociado con un alivio de la angina, pero no de la calidad de vida ni con una disminución de los eventos cardiovasculares1–4·38·39·56·57. En casos de disfunción eréctil que precise tratamiento con inhibidores de la fosfodiesterasa-5, se debería intentar sustituirlos por otros antianginosos1.
Por otra parte, la nitroglicerina (sublingual o en aerosol) es especialmente eficaz en el alivio rápido de la angina de pecho. También se pueden emplear como profilaxis antes de comenzar actividades que se sabe van a causar angina1.
IvabradinaLa ivabradina reduce la frecuencia cardiaca (efecto cronotrópico negativo) al inhibir selectivamente la corriente de marcapasos (If) del nódulo sinusal, incrementar el tiempo de diástole y disminuir la demanda miocárdica de oxígeno. Es un mecanismo de acción complementario al de los bloqueadores beta y, dado que actúa principalmente en los canales If que se encuentran en estado abierto-activo, la ivabradina tiene un mayor efecto cuanto mayor sea la frecuencia cardiaca y menor cuando se reduce. Asimismo, podría aumentar la perfusión coronaria colateral y la reserva coronaria de flujo. En cambio, la ivabradina no tiene efecto inotrópico o lusitrópico negativo (tabla 3 y tabla 4, figura 3). Diferentes estudios han mostrado que la ivabradina es tan eficaz como el atenolol o el amlodipino para controlar la angina de los pacientes con cardiopatía isquémica crónica, y que la combinación con bloqueadores beta produce un mayor control de la frecuencia cardiaca y los síntomas de angina1-4,40-43,57. De hecho, la combinación de bloqueadores beta e ivabradina podría asociarse con una mejoría clínica más pronunciada, junto con una mayor tolerabilidad, en comparación con ajustar la dosis de blo- queadores beta44. En el estudio BEAUTIFUL, que incluyó a pacientes con cardiopatía isquémica crónica y fracción de eyección < 40%, la adición de ivabradina no redujo la variable primaria de muerte cardiovascular, hospitalización por infarto de miocardio o insuficiencia cardiaca, si bien en los pacientes con una frecuencia cardiaca ≥ 70 lpm hubo una reducción significativa de la hospitalización por infarto de miocardio mortal y no mortal, así como de la revascularización coronaria45. En el estudio SIGNIFY, la adición de ivabradina no se tradujo en una reducción de los eventos cardiovasculares en pacientes con cardiopatía isquémica crónica, sin insuficiencia cardiaca clínica y una frecuencia cardiaca ≥ 70 lpm63. Aunque es poco frecuente, la ivabradina puede aumentar el intervalo QT, por lo que habría que tener especial precaución cuando se administra junto con otros fármacos que prolongan el intervalo QT1-4,40.
RanolazinaLa ranolazina es un inhibidor selectivo de la corriente tardía de sodio, lo que disminuye en último término la sobrecarga de calcio en las células del miocardio. Esto es relevante, ya que la sobrecarga de calcio en los cardiomiocitos se asocia con disfunción eléctrica (aumento del riesgo de arritmias), disfunción mecánica (incremento de la tensión diastólica y disminución de la contractilidad) y un desequilibrio entre el aporte y la demanda de oxígeno (aumento del consumo de ATP y disminución de la síntesis de ATP). Asimismo, la ranolazina tiene un efecto positivo en el metabolismo del corazón, al disminuir la betaoxidación de los ácidos grasos e incrementar la eficiencia del oxígeno miocárdico. En consecuencia, la ranolazina tiene un impacto positivo en la disminución de la isquemia miocárdica. Numerosos ensayos clínicos han demostrado que la ranolazina, sola o en combinación con otros fármacos antianginosos, mejora significativamente los síntomas y la capacidad de ejercicio. Además, que no tenga efecto significativo en la frecuencia cardiaca o la presión arterial facilita su uso en la práctica clínica, pues se puede prescribir a un amplio espectro de pacientes con cardiopatía isquémica crónica (tabla 3, figura 3)1,3,57-59. Aunque en el estudio MERLIN, realizado en pacientes con síndrome coronario sin elevación del segmento ST, la ranolazina no redujo la variable primaria compuesta de muerte cardiovascular, infarto de miocardio o isquemia recurrente, en el subgrupo de pacientes con angina crónica, la ranolazina sí redujo significativamente la isquemia recurrente, el empeoramiento de la angina y la necesidad de intensificar el tratamiento antianginoso. Además, en ese estudio se observó que la ranolazina es capaz de reducir significativamente la glucohemoglobina (HbA1c), lo que indica que este fármaco podría ser especialmente útil en la población diabética con cardiopatía isquémica crónica64,65. Así, en el estudio TERISA, en pacientes con diabetes y angina crónica a pesar del tratamiento con un máximo de 2 antianginosos, la ranolazina redujo la angina y las tomas de nitroglicerina sublingual con buena tolera- bilidad. Además, los beneficios terapéuticos de la ranolazina fueron mayores en los pacientes con valores de HbA1c más elevados66,67. Los efectos secundarios más relevantes incluyen mareo, náuseas y estreñimiento. En general estos efectos secundarios son poco frecuentes, leves en intensidad, dependientes de la dosis y reversibles al suspender el fármaco. Aunque es poco frecuente, la ranolazina puede aumentar el intervalo QT, por lo que hay que tener precaución con el tratamiento concomitante con fármacos que prolonguen el intervalo QT (tabla 4)1,3,46-48.
Trimetazidina y nicorandilAunque su empleo en el tratamiento de la angina en la práctica clínica es menor, también se ha demostrado su utilidad en el control de síntomas del paciente con síndrome coronario crónico. Aunque no se conoce exactamente el mecanismo de la trimetazidina, parece que el mecanismo antianginoso principal sería la inhibición de la 3-cetoacil coenzima A tiolasa, que reduce la betaoxidación de los ácidos grasos en el miocardio isquémico. De esta forma la trimetazidina reduce la oxidación de los ácidos grasos libres y produce un aumento de la utilización de glucosa por el miocardio isquémico. Diversos estudios han mostrado que la trimetazidina tiene un efecto neutro en los parámetros hemodinámicos. Varios estudios, generalmente de pequeño tamaño, han mostrado que la trimetazidina mejoraría ligeramente los síntomas de angina, así como la capacidad de ejercicio, tanto en monoterapia como combinada con otros fármacos como los bloqueadores beta o los antagonistas de los canales del calcio. La tole- rabilidad es en general buena y los efectos secundarios suelen ser gastrointestinales (tabla 3 y 4figura 3).1,3,32,49,50.
El nicorandil es un agente vasodilatador utilizado para tratar la angina de pecho que tiene un mecanismo doble de acción. Por un lado, el nicorandil activa los canales del potasio rectificadores de entrada sensibles al ATP, lo que provoca una vasodilatación arterial que reduce la poscarga, y por otro, aumenta la producción de óxido nítrico (similar a la nitroglicerina), lo que favorece la relajación venosa y disminuye la precarga. Además, el nicorandil tiene un efecto directo en las arterias coronarias mejorando el flujo sanguíneo de las regiones posestenóticas y el equilibrio de oxígeno en el miocardio. El nico- randil no tiene efecto en la contractilidad ni en la conducción cardiaca. Diversos estudios clínicos han mostrado que el nicorandil mejoraría el tiempo hasta la aparición de la isquemia de esfuerzo y la duración total del esfuerzo. Además, en el estudio IONA se objetivó que podría ser beneficioso en la reducción de algunos eventos coronarios mayores. Sin embargo, un importante porcentaje de pacientes interrumpen el tratamiento por cefalea. Por otra parte, el tratamiento concomitante de nicorandil con ácido acetilsalicílico podría aumentar el riesgo de úlceras gastrointestinales, perforaciones y hemorragias (tabla 3 y 4, figura 3)1,3,32,51,52.
Indicaciones de revascularizaciónLos 2 objetivos principales de la revascularización coronaria, per- cutánea o quirúrgica, son el alivio de los síntomas y mejorar el pronóstico en determinados grupos de pacientes. Sin embargo, excluyendo a los pacientes con enfermedad del tronco significativa o enfermedad proximal de 3 vasos grave, los ensayos clínicos no han mostrado superioridad de la revascularización frente al tratamiento médico óptimo1,3,68. Así, en el estudio ISCHEMIA, que incluyó a 5.179 pacientes con isquemia moderada-grave (se practicó al 73% tomogra- fía computarizada de coronarias para descartar afección del tronco o enfermedad coronaria no obstructiva), tras una mediana de seguimiento de 3 años, la estrategia invasiva inicial no mostró superioridad frente al tratamiento médico óptimo en la variable primaria de muerte cardiovascular, infarto de miocardio u hospitalización por angina inestable, insuficiencia cardiaca o parada cardiaca recuperada ni en la variable secundaria de muerte cardiovascular o infarto de miocardio17.
Por lo tanto, la clave para reducir los síntomas de angina de los pacientes con síndrome coronario crónico es el tratamiento médico óptimo junto con cambios en el estilo de vida (dieta, ejercicio físico y rehabilitación cardiaca en su caso), y se debería reservar la revascularización coronaria para los pacientes que sigan sintomáticos a pesar del tratamiento antianginoso óptimo o presenten grandes áreas de isquemia1.
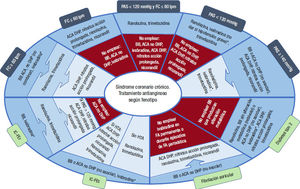
Estrategia terapéutica con los fármacos antianginosos en función del perfil clínico de los pacientesLos cambios en el estilo de vida (pérdida de peso en pacientes con sobrepeso/obesidad, aumento de la actividad física, dieta saludable) y el control de los factores de riesgo son básicos para reducir la carga de angina. Así, el ejercicio físico es fundamental, dado que es capaz de promover la creación de circulación colateral incluso ante obstrucciones coronarias completas. En pacientes muy sintomáticos o no revascularizables, los programas de rehabilitación cardiaca con entrenamiento en isquemia pueden conseguir resultados muy significativos en la mejora pronóstica y de calidad de vida69. Con respecto al tratamiento anginoso, exceptuando en el caso de los pacientes con insuficiencia cardiaca y fracción de eyección reducida o tras un infarto agudo de miocardio reciente, en los que se ha observado un beneficio pronóstico con los bloqueadores beta; en el resto de los casos, el tratamiento antianginoso ha mostrado beneficio sintomático pero no pronóstico1–3. Asimismo, el análisis de los diferentes estudios en los que se comparaba la eficacia antianginosa (mejoría en la duración de la prueba de esfuerzo, frecuencia de los episodios de angina, necesidad de nitroglicerina sublingual), tampoco mostró diferencias entre los diferentes grupos farmacológicos2,70. En consecuencia, salvo en el caso de insuficiencia cardiaca con fracción de eyección reducida o tras un infarto agudo de miocardio reciente, la elección del tratamiento antianginoso, en monoterapia o en combinación, debería individualizarse en función de las características clínicas del paciente, de acuerdo con el efecto de estos fármacos en diferentes variables como la frecuencia cardiaca, la presión arterial y la presencia de insuficiencia cardiaca o fibrilación auricular1,3,7,32,54,71. En la figura 4 se resumen las pautas de tratamiento con fármacos antianginosos para pacientes con las distintas comorbilidades que se presentan con frecuencia en la angina crónica estable. En función de cada comorbilidad, se recomiendan los fármacos que podrían ser más útiles en cada situación clínica. Cuando existen varios fármacos antianginosos en el mismo nivel de recomendación, se puede emplear cualquiera de ellos, solos o en combinación, para controlar la angina. Si con los de un nivel no es suficiente para el control de los síntomas, se podrían añadir los del siguiente nivel. También se indican los fármacos que no deberían emplearse en determinados contextos clínicos.
Pautas de tratamiento de los fármacos antianginosos en función de las características clínicas del paciente. Cuando existen varios fármacos antianginosos en el mismo nivel de recomendación, se puede emplear cualquiera de ellos, solos o en combinación, para controlar la angina. Figura elaborada con datos de Knuuti1, Balla3, Joshi7, Ferrari32, Bertero54 y Manolis71. ACA: antagonistas de los canales del calcio; BB: bloqueadores beta; DHP: dihidropiridínicos; FC: frecuencia cardiaca; HTA: hipertensión arterial; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada.
*Ivabradina: junto con los BB o en su lugar si la FC es > 70 lpm (no combinar con ACA no DHP).
La angina de pecho es la manifestación clínica más frecuente de la cardiopatía isquémica. No solo es que empeore la calidad de vida de los pacientes, sino que a mayor gravedad de la angina el riesgo de complicaciones cardiovasculares aumenta. Por lo tanto, es fundamental controlarla. Existen diferentes grupos farmacológicos para el control de la angina. Salvo en alguna situación concreta, el principal beneficio de estos fármacos es sintomático, sin que se haya demostrado la superioridad de unos sobre otros. Por lo tanto, el tratamiento farmacológico antianginoso, en monoterapia o en combinación, se debería ajustar en función de las características clínicas de cada paciente y reservar la revascularización para cuando el control sintomático no sea suficiente. Y siempre en el contexto de un enfoque integral que incluya hábitos de vida cardiosaludables y ejercicio físico, además de optimizar el control de los diferentes factores de riesgo y el tratamiento antitrombótico más adecuado para cada paciente.
Contribución de los autoresLos autores han participado en la redacción y revisión del manuscrito de forma proporcional y aceptan su publicación.
Conflicto de interesesC. Escobar declara haber recibido honorarios en los últimos 5 años por charlas educativas, asesorías científicas y proyectos de investigación de Amgen, AstraZeneca, Bayer, Boehringer-Ingelheim, Daiichi-Sankyo, Esteve, Ferrer, Lilly, Menarini, Mundipharma, Novartis, Novo Nordisk, Organon, Pfizer, Sanofi, Servier y Viatris. A. Ariza no tiene conflictos de interés. V. Barrios declara haber recibido en los últimos 5 años compensación económica por charlas educativas, asesorías científicas y proyectos de investigación de Amgen, AstraZeneca, Bayer, BMS, Boehringer-Ingelheim, Daiichi- Sankyo, Esteve, Ferrer, Lilly, Menarini, Mundipharma, Novartis, Novo Nordisk, Organon, Pfizer, Sanofi, Servier y Viatris. R. Campuzano declara haber recibido honorarios en los últimos 5 años por charlas educativas, asesorías científicas y proyectos de investigación de AstraZeneca, Boehringuer-Ingelheim, Lilly, Sanofi, Novartis, Novo Nordisk, Amgen, Daichii-Sankyo, Servier, Menarini, Organon, Ferrer, Bayer, Mylan y Mundifarma. R. Freixa-Pamias declara haber recibido en los últimos 5 años compensación económica por charlas educativas, asesorías científicas y proyectos de investigación de Amgen, AstraZeneca, Bayer, Boehringer-Ingelheim, Daiichi-Sankyo, Ferrer, Lilly, Menarini, Novartis, Novo Nordisk, Pfizer, Sanofi y Viatris. J.M. Gámez delcara haber recibido compensación económica en los últimos 5 años por charlas educativas, asesorías científicas y proyectos de investigación de Almirall, Amgen, Boehringer-Ingelheim, Daiichi-Sankyo, Menarini, Novartis, Organon, Pfizer-BMS, Rovi, Sanofi y Viatris. M.R. Fernández Olmo declara haber recibido honorarios en los últimos 5 años por charlas educativas, asesorías científicas y proyectos de investigación de Amgen, AstraZeneca, Daiichi-Sankyo, Ferrer, Lilly, Novartis, Novo Nordisk, Pfizer y Sanofi. P. Jorge-Pérez declara haber recibido en los últimos 5 años compensación económica por charlas educativas, asesorías científicas y proyectos deinvestigación de AstraZeneca, Boehringer-Ingelheim, Ferrer, Lilly, Novartis, Novo Nordisk y Sanofi. J. Tamargo no tiene conflictos de interés.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Actualización del uso de los fármacos antianginosos en el tratamiento del síndrome coronario crónico: enfoque práctico», que ha sido patrocinado por Menarini.