Los pacientes con diabetes mellitus tipo 2 (DM2) tienen un elevado riesgo de complicaciones cardiovasculares y renales. Además, los pacientes con DM2 tienen numerosas comorbilidades, entre las que destacan la obesidad y otros factores de riesgo. En consecuencia, es necesaria una aproximación global a estos pacientes. A pesar de los beneficios mostrados por los agonistas del receptor del GLP-1, su empleo en la práctica clínica sigue siendo bajo. La semaglutida es un agonista del receptor del GLP-1 que disminuye de manera marcada la HbA1c (1,0-1,8%) y el peso corporal (3,5-6,5 kg) de los pacientes con DM2 y tiene un efecto positivo en la presión arterial y el perfil lipídico. La semaglutida se presenta en 2 formulaciones, una oral (1 vez al día) y otra subcutánea (1 vez a la semana), lo que permite individualizar el tratamiento según las necesidades de cada paciente. El análisis conjunto de los estudios SUSTAIN 6 y PIONEER 6 mostró reducciones significativas del 24% en el riesgo de MACE en comparación con el placebo, ambos añadidos al tratamiento estándar, en pacientes con DM2 y alto riesgo cardiovascular. Dicha reducción se debió principalmente a un menor riesgo de ictus no mortal en el estudio SUSTAIN 6 y a un menor riesgo de muerte cardiovascular en el PIONEER 6. En consecuencia, la introducción de la semaglutida oral debería traducirse en un mayor empleo de los agonistas del receptor del GLP-1 en la práctica clínica. En esta actualización se revisan los beneficios de la semaglutida dentro de la estrategia global del paciente con DM2.
Palabras clave
La diabetes mellitus tipo 2 (DM2) supone una auténtica epidemia en todo el mundo1. En España, la prevalencia de diabetes se sitúa en torno al 14%, lo que implica que más de 4,5 millones de españoles padecen DM22. Asimismo, se estima que la incidencia de DM en la población española es de 11,6 casos cada 1.000 personas y año3. Sin embargo, teniendo en cuenta que el sobrepeso/obesidad y el seden- tarismo están incrementándose en nuestra sociedad, estas cifras van a ir en aumento en los próximos años4,5. Los pacientes con DM2 tienen múltiples comorbilidades que dificultan el abordaje de estos pacientes y es imprescindible tenerlas en cuenta. Así, en un estudio realizado en España, el 72% de los pacientes con DM tenían hipertensión arterial; el 61%, dislipemia; el 45%, obesidad; el 28%, enfermedad renal crónica; el 23%, enfermedad cardiovascular ateroescle-rótica, y el 7%, insuficiencia cardiaca6. En consecuencia, para mejorar de verdad el pronóstico del paciente con DM, es necesaria una aproximación global. De hecho, el tratamiento multifactorial en la DM2 se asocia con una mayor supervivencia y un menor riesgo de com- plicaciones7.
La DM2 aumenta el riesgo de complicaciones microvasculares (p. ej., la retinopatía diabética es la principal causa de ceguera en la población adulta y la nefropatía diabética es la principal causa de enfermedad renal crónica)8,9. Pero más relevantes resultan las complicaciones vasculares asociadas con la DM2. Así, aproximadamente un 50-80% de las personas con DM mueren de causa cardiovascular8,9. Y es que la DM2 aumenta el riesgo de infarto de miocardio no mortal y de insuficiencia cardiaca aproximadamente en un 55%, y el de ictus isquémico en un 70%10. En el reciente estudio CAPTURE, realizado en 13 países de todo el mundo, aproximadamente 1 de cada 3 pacientes con DM2 tenía enfermedad cardiovascular diagnosticada11. Esto no es de extrañar, ya que el paciente con DM2 tiene una mayor predisposición a rotura, trombosis y cicatrización, lo que produce más crecimiento y vulnerabilidad de la placa de ateroma. Además, la dislipemia aterogénica, tan característica en esta población, es especialmente deletérea, ya que sus efectos perjudiciales persisten aunque se hayan logrado los objetivos de colesterol unido a lipoproteínas de baja densidad (cLDL)12.
En definitiva, la prevención y el tratamiento de la enfermedad cardiovascular ateroesclerótica debe ser un objetivo primordial en los pacientes con DM2. Además, el tratamiento precoz tras el diagnóstico permite retrasar la aparición de las complicaciones microvasculares y macrovasculares, así como reducir la mortalidad13. Sin embargo, no con todos los tratamientos para la DM2 se ha demostrado reducción del riesgo de enfermedad cardiovascular, incluso alguno de ellos podría resultar deletéreo14.
Se ha demostrado que los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) no solo mejoran el control glucémico, sino que también favorecen la pérdida de peso15. Sin embargo, solo algunos de ellos reducen el riesgo de eventos cardiovasculares16–19. A pesar de estas evidencias positivas, el empleo de los agonistas del receptor del GLP-1 continúa siendo inaceptablemente bajo en todos los niveles asistenciales (atención primaria, cardiología, etc.)20,21.
La semaglutida es un agonista del GLP-1 con 2 formulaciones, oral 1 vez al día y subcutánea (sc) 1 vez a la semana, y demostrada eficacia en la protección cardiometabólica22–25. En esta actualización se revisan de una manera sencilla y práctica el tratamiento con semaglutida y su papel en la estrategia global para el paciente con DM2.
Semaglutida y protección cardiometabólica para el paciente con DM2La semaglutida es un análogo del GLP-1, con un 94% de homología de secuencia con el GLP-1 humano, que actúa como un agonista del receptor del GLP-1 estimulando la secreción pancreática de insulina dependiente de la glucosa e inhibiendo el glucagón. Además, causa sensación de saciedad y enlentece el vaciamiento gástrico. Debido a su similitud estructural con el GLP-1 nativo, su inmunogenicidad es baja26,27.
La semaglutida reduce eficazmente la glucohemoglobina (HbA1c). Así, a lo largo del programa SUSTAIN, la semaglutida 1 mg sc administrada 1 vez a la semana redujo la HbA1c un 1,5-1,8% tras 30-56 semanas de tratamiento en un amplio grupo de pacientes con DM2 tratados con diferentes regímenes terapéuticos, cifras basales de HbA1c y grados de gravedad y duración de la DM. El descenso de la HbA1c fue mayor con la semaglutida sc que con la sitagliptina, la liraglutida, la exenatida de liberación retardada, la dulaglutida, la canagliflozina o la insulina glargina. Asimismo en el programa PIONEER (Peptide Innovation for Early Diabetes Treatment), la semaglutida 14 mg oral administrada 1 vez al día redujo la HbA1c un 1,0-1,4%, en mayor medida que la sitagliptina o la empagliflozina y de modo similar que la liraglutida tras 26 semanas de tratamiento (tabla 1, figura 1). De esta forma, el 66-80% y el 55-77% de los pacientes con DM2 tratados con semaglutida sc u oral respectivamente alcanzaran el objetivo de HbA1c < 7%. Además, con semaglutida, un número mayor de pacientes lograron el objetivo compuesto de HbA1c < 7,0% sin hipoglucemia grave o confirmada por determinación de la glucemia y sin aumento de peso frente a placebo y los comparadores activos28–43.
Efectos de la semaglutida en los factores de riesgo cardiovascular de los pacientes con diabetes mellitus 2.
| HbA1c | sc: ↓1,5-1,8% |
| Oral: ↓1,0-1,4% | |
| Peso | sc: ↓4,5-6,5 kg |
| Oral: ↓3,4 4,4 kg | |
| Presión arterial sistólica | sc: ↓3,5-7,3 mmHg |
| Oral: ↓2-7 mmHg | |
| Triglicéridos | Ayunas |
| sc: ↓12% | |
| Oral: ↓19% | |
| Posprandial | sc: ↓> 40% |
| Oral: ↓24% |
Asimismo, el tratamiento con semaglutida sc redujo el peso corporal en 4,5-6,5 kg, y en mayor medida que con sitagliptina, exenatida de liberación prolongada, dulaglutida, liraglutida, canagliflozina o insulina glargina, mientras que la semaglutida oral lo hizo en 3,4-4,4 kg, y de una manera más pronunciada que con sitagliptina, empagli-flozina y liraglutida (tabla 1, figura 1).28,29,31–43. En general, esta pérdida de peso es mayor cuanto más elevado sea el peso basal del paciente. Este efecto de la semaglutida en el peso corporal se explica por varios mecanismos, complementarios entre sí. Así, fisiológicamente, la secreción del GLP-1 por las células L del intestino delgado tiene efecto regulador de la saciedad. Además, se han descrito mecanismos mediados tanto a nivel central como periférico, entre los que destacan la inhibición de la grelina o el enlentecimiento del vaciamiento gástrico, entre otros45,51.
Estos resultados se han confirmado en estudios de vida real. Así, en un estudio realizado en España se objetivó que, tanto en pacientes que iniciaban tratamiento con semaglutida como los que cambiaban desde otros arGLP-1, la semaglutida sc redujo significativamente la HbA1c (el 1,8 y el 0,6% respectivamente) y el peso (5,1 y 2,1 kg respectivamente) tras 24 semanas de tratamiento. Asimismo, combinando la consecución de ambos objetivos (control glucémico y reducción del peso), un mayor porcentaje de pacientes lograron una reducción > 1% de la HbA1c combinada con una pérdida de peso > 5% frente placebo y los comparadores activos. El porcentaje de pacientes que no respondieron a la semaglutida, lo que se definió como ausencia de pérdida de peso y mejora en la HbA1c, fue menor que con otros agonistas del receptor del GLP-1 (tabla 1). figura 1).44.
En cuanto a la presión arterial, la semaglutida sc redujo significativamente la presión arterial sistólica, 3,5-5,1 mmHg (0,5 mg) y 5,4-7,3 mmHg (1 mg), mientras que la semaglutida oral redujo la presión arterial sistólica 2-7 mmHg (tabla 1). En definitiva, la semaglutida produce en general reducciones de la presión arterial sistólica de entre 2 y 8 mmHg, si bien la disminución es mayor cuanto mayores sean los valores basales de presión arterial. Se han implicado diversos mecanismos, entre ellos la reducción de peso, el efecto vasodilatador y el aumento de la natriuresis a través de la estimulación de la secreción de péptido natriurético auricular26,27,45,46,47. Asimismo, en comparación con el placebo, la semaglutida sc redujo los triglicéridos en ayunas y las lipoproteínas de muy baja densidad (VLDL) en un 12 y 21% respectivamente, y la respuesta posprandial de ambos a la comida rica en grasas en más de un 40%. Con la semaglutida oral estas cifras fueron el 19, el 20, el 24 y el 21% respectivamente. En resumen, la semaglutida reduce la concentración plasmática de triglicéridos, ácidos grasos y cLDL y tiene un efecto atenuador de la hiperlipemia pos- prandial (tabla 1, figura 1)26,27,45,46,47.
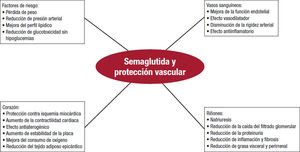
Además, la semaglutida produce beneficios cardiacos (protección contra la isquemia miocárdica, reducción del tejido adiposo epicár- dico y mejora de la contractilidad cardiaca mediante la mejora de la recaptación miocárdica de glucosa, el consumo de oxígeno y el rendimiento miocárdico), vasculares (efectos vasodilatador y antiinflamatorio y mejoría de la disfunción endotelial) y renales (reducción de la caída del filtrado glomerular y la proteinuria, inhibición de la reabsorción tubular de sodio, reducción de la concentración plasmática de angiotensina II y efecto antiinflamatorio) (figura 1).26,27,44–50.
Semaglutida y reducción de eventos cardiovasculares en el paciente con DM2Dos grandes ensayos clínicos, SUSTAIN 6 y PIONEER 6 han evaluado el efecto de la semaglutida (sc y oral respectivamente) en los eventos cardiovasculares adversos mayores (MACE por sus siglas en inglés) en pacientes con DM219,52.
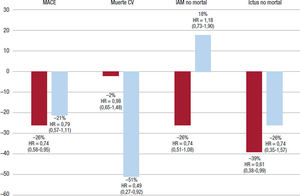
El estudio SUSTAIN 6 incluyó a 3.297 pacientes con DM2 y alto riesgo cardiovascular (edad ≥ 50 años con enfermedad cardiovascular establecida o enfermedad renal crónica o ≥ 60 años con al menos un factor de riesgo cardiovascular), que recibieron semaglutida sc 1 vez a la semana (0,5 o 1,0 mg) o placebo, ambos añadidos al tratamiento estándar para la diabetes y los factores de riesgo/enfermedad cardiovascular, durante 104 semanas. Al inicio del estudio, el 83% de los pacientes seguidos tenían enfermedad cardiovascular previa, insuficiencia cardiaca o enfermedad renal crónica. El objetivo principal del estudio fue la variable combinada tiempo hasta el primer evento cardiovascular grave definido como muerte cardiovascular, infarto de miocardio no mortal o ictus no mortal. El tratamiento con semaglu- tida mostró un riesgo del objetivo compuesto primario un 26% menor (estadísticamente significativo), a expensas de un 39% de descenso de los accidentes cerebrovasculares (con significación estadística) y un 26% de infarto de miocardio (que no alcanzó significación estadística), pero sin diferencias en mortalidad cardiovascular. Unos datos que se mantuvieron con ambas dosis de semaglutida. En riesgos absolutos, el número de pacientes que tratar para prevenir un MACE en los 24 meses del estudio fue de 45. Además, el beneficio fue precoz y fue aumentando a lo largo del tiempo con el tratamiento. El estudio mostró también que la progresión de enfermedad renal (medida como un objetivo compuesto renal) fue menor en el grupo de pacientes tratados con semaglutida (tabla 2, figura 2).). Si bien en general hubo menos efectos adversos en el grupo de semaglutida, incluidas las enfermedades cardiacas graves, se produjeron más interrupciones por efectos secundarios con la semaglutida, principalmente gastrointestinales. La mayoría de los eventos gastrointestinales fueron de intensidad leve a moderada y ocurrieron en las primeras 30 semanas. No se describió ningún caso de carcinoma medular de tiroides. Es importante destacar que no se reportaron más casos de hipoglucemia grave con sema- glutida19.
Resultados principales de los estudios SUSTAIN-6 y PIONEER 6.
| Variable | Semaglutida (eventos/100 personas-año) | Placebo (eventos/100 personas-año) | HR (IC95%) | P |
|---|---|---|---|---|
| SUSTAIN-6 | ||||
| Variable primariaa | 3,24 | 4,44 | 0,74 (0,58-0,95) | < 0,001 (no inferioridad) 0,02 (superioridad) |
| Variable primaria extendidab | 6,17 | 8,36 | 0,74 (0,62-0,89) | 0,002 |
| Infarto de miocardio no mortal | 1,40 | 1,92 | 0,74 (0,51-1,08) | 0,12 |
| Ictus no mortal | 0,80 | 1,31 | 0,61 (0,38-0,99) | 0,04 |
| Revascularización | 2,50 | 3,85 | 0,65 (0,50-0,86) | 0,003 |
| Nefropatía (nueva o empeoramiento)c | 1,86 | 3,06 | 0,64 (0,46-0,88) | 0,005 |
| Muerte cardiovascular | 1,29 | 1,35 | 0,98 (0,65-1,48) | 0,92 |
| PIONEER-6 | ||||
| Variable primariaa | 2,9 | 3,7 | 0,79 (0,57-1,11) | < 0,001 (no inferioridad) 0,17 (superioridad) |
| Variable primaria extendidad | 4,0 | 4,9 | 0,82 (0,61-1,10) | - |
| Infarto de miocardio no mortal | 1,8 | 1,5 | 1,18 (0,73-1,90) | - |
| Ictus no mortal | 0,6 | 0,8 | 0,74 (0,35-1,57) | - |
| Muerte cardiovascular | 0,7 | 1,4 | 0,49 (0,27-0,92) | - |
| Muerte por cualquier causa | 1,1 | 2,2 | 0,51 (0,31-0,84) | - |
Figura elaborada con datos de Marso19 y Husain52. HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal, revascularización (coronaria o periférica) y hospitalización por angina inestable o insuficiencia cardiaca.
Nefropatía (nueva o empeoramiento) que incluye macroalbuminuria persistente, duplicación persistente de los valores de creatinina sérica y un aclaramiento de creatinina < 45 ml/min/1,73 m2 fórmula MDRD (Modification of Diet in Renal Disease). o necesidad de tratamiento de sustitución renal continua.
El estudio PIONEER 6 incluyó a 3.183 pacientes con DM2 y alto riesgo cardiovascular (edad ≥ 50 años con enfermedad cardiovascular establecida o enfermedad renal crónica o ≥ 60 años con al menos un factor de riesgo cardiovascular). El objetivo principal del estudio fue la variable combinada tiempo hasta el primer evento cardiovascular grave definido como muerte cardiovascular, infarto de miocardio no mortal o ictus no mortal. Fue un estudio de no inferioridad (margen de 1,8 en la parte superior del intervalo de confianza del 95% [IC95%]) dirigido a eventos. Tras una mediana de seguimiento de 15,9 meses al alcanzar los 122 eventos, hubo una tendencia a menos riesgo de la variable primaria en los pacientes tratados con semaglutida oral (dosis objetivo, 14 mg) frente a placebo (el 3,8 frente al 4,8%; hazard ratio [HR] 0,79; IC95% 0,57-1,11; p < 0,001 para no inferioridad). La mortalidad cardiovascular (0,7 frente a 1,4/100 personas-año; HR = 0,49; IC95%, 0,27-0,92) y la mortalidad por cualquier causa (1,1 frente a 2,2/100 personas-año; HR = 0,51 ; IC 95% 0,31-0,84) fueron menores con la semaglutida oral (tabla 2,figura 2). Los eventos adversos gastrointestinales que llevaron a suspenderla fueron más frecuentes con la semaglutida oral (el 6,8 frente al 1,6%), la mayoría de intensidad leve a moderada. Sin embargo, la interrupción permanente por efectos adversos graves fue menor con la semaglutida oral (el 2,6 frente al 3,0%). Los porcentajes de hipoglucemia grave fueron del 1,4 y el 0,8% respectivamente. Todos los casos de hipoglucemia grave ocurrieron en pacientes que tomaban de manera concomitante insulina o sulfonilureas. No hubo más casos de cáncer medular de tiroides. Hubo un aumento de 4 lpm en el grupo de semaglutida oral. Sin embargo, no se observaron cambios relevantes en los parámetros bioquímicos ni en los hematológicos con semaglutida52.
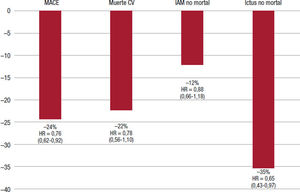
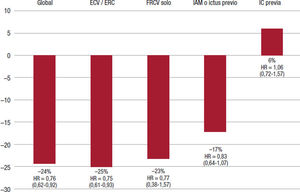
Se ha realizado un análisis conjunto de ambos estudios (los criterios de inclusión y exclusión fueron los mismos). Aunque hay que interpretar con cautela los resultados de un análisis combinado, en comparación con placebo la semaglutida redujo significativamente en un 24% el riesgo de MACE (HR = 0,76; IC95%, 0,62-0,92), principalmente por un menor riesgo de ictus no mortal (HR = 0,65; IC95%, 0,43-0,97). Estos resultados fueron concordantes entre los distintos subgrupos de riesgo analizados (enfermedad cardiovascular o enfermedad renal crónica, factores de riesgo cardiovascular, infarto o ictus previo). Sin embargo, no hubo un efecto significativo en las hospitalizaciones por insuficiencia cardiaca (figura 3 y figura 4).)53. Recientes subestudios del análisis combinado de ambos ensayos clínicos también han aportado información relevante. Así, el beneficio de la semaglutida en eventos cardiovasculares y reducción de la HbA1c y el peso corporal fue independiente de la toma previa de metformina54. Estos resultados están en línea con los de un metanálisis en el que se ha objetivado que la protección cardiovascular de los agonistas del receptor del GLP-1 no depende de la toma de metformina55. Igualmente, la reducción de la HbA1c y el peso corporal obtenida con semaglutida fue independiente de la función renal, también en los pacientes con enfermedad renal crónica al inicio del estudio56. En definitiva, la adición de semaglutida al tratamiento de los pacientes con DM2 se asocia con una ganancia significativa de años de vida libres de enfermedad cardiovascular57.
Análisis combinado de MACE de los estudios SUSTAIN 6 y PIONEER 6 de acuerdo con el riesgo cardiovascular. Figura elaborada con datos de Marso19, Husain52,53. ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FRCV: factores de riesgo cardiovascular; HR: hazard ratio; IAM: infarto de miocardio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores (muerte cardiovascular, infarto de miocardio no mortal, ictus no mortal).
Aunque no se han publicado ensayos clínicos que informen sobre resultados renales como objetivo primario del tratamiento con agonistas del receptor del GLP-1, existen evidencias sobre el beneficio renal, especialmente en la reducción de la proteinuria. En un reciente metanálisis que examinaba los resultados renales de los agonistas del receptor del GLP-1, los autores encontraron que reducían claramente el riesgo de empeoramiento de la función renal cuando se evaluaban utilizando un resultado renal compuesto amplio58. El ensayo FLOW (NCT03819153) será el primer estudio diseñado para examinar específicamente los efectos de un agonista de los receptores del GLP-1 (semaglutida) en los resultados renales primarios. El ensayo ha finalizado su aleatorización y sus resultados se esperan entre 2024 y 2025.
Pacientes con DM2 que más se pueden beneficiar del tratamiento con semaglutidaEn resumen, la semaglutida es un fármaco en el arsenal terapéutico de la DM2 que ofrece una reducción de HbA1c y una pérdida de peso mayores que otros fármacos antidiabéticos, y añade beneficios cardiovasculares en términos de reducción de la morbimortalidad cardiovascular y un beneficio en la progresión del daño renal. Puede prescribirse a un espectro amplio de pacientes con DM2 en prevención primaria y secundaria. A continuación, se resumen las recomendaciones de las diferentes guías de práctica clínica sobre el empleo de la semaglutida.
La guía ESC 2019 sobre diabetes, prediabetes y enfermedad cardiovascular, en colaboración con la European Association for the Study of Diabetes59 recomienda la semaglutida para pacientes con DM2 y enfermedad cardiovascular o con un riesgo alto/muy alto (lesión de órgano dianaproteinuria, disfunción renal, hipertrofia del ventrículo izquierdo o retinopatía—, otros factores de riesgo o diabetes de larga duración)60 para reducir los episodios cardiovasculares. Para pacientes con riesgo moderado, se recomienda la semaglutida para lograr los objetivos de HbA1c, en monoterapia cuando no se pueda emplear metformina por intolerancia o contraindicación o en combinación con otros fármacos antidiabéticos (excepto inhibidores de la dipeptidil peptidasa 4 [iDPP4])59.
La guía de la American Diabetes Association de 202114 señala que, para los pacientes con enfermedad cardiovascular ateroesclerótica o alto riesgo (edad ≥ 55 años con estenosis coronaria, carotídea o de las arterias de extremidades inferiores > 50% o hipertrofia ventricular izquierda), se recomiendan los arGLP-1 con probado beneficio cardiovascular, como la semaglutida o los inhibidores del cotransportador 2 de sodio-glucosa (iSGLT2), independientemente de los valores basales de HbA1c, el objetivo de HbA1c o la toma de metformina. Si el paciente tiene enfermedad renal crónica, las guías recomiendan los iSLGT2 con beneficio demostrado en la progresión de la enfermedad renal o arGLP-1 con beneficio demostrado en caso de que no se pueda emplear los primeros. Si el paciente no tiene un elevado riesgo de enfermedad cardiovascular ateroesclerótica, se recomienda de inicio metformina y añadir un fármaco antidiabético en caso de falta de control. En este caso, los arGLP-1 estarían especialmente indicados si además se persigue la pérdida de peso como parte del abordaje integral del paciente con DM214.
En el algoritmo propuesto por la Sociedad Española de Cardiología sobre el tratamiento del paciente con DM2 y enfermedad cardiovascular o renal o riesgo alto/muy alto de contraerla, en caso de enfermedad cardiovascular ateroesclerótica se recomiendan los arGLP-1, y en caso de insuficiencia cardiaca o enfermedad renal, los iSGLT262. Tanto en este consenso como en las guías internacionales se recomienda la combinación de arGLP-1 e iSGLT2 con beneficio cardiovascular demostrado para la población de alto riesgo o con enfermedad cardiovascular o renal en caso de que no se controle adecuadamente la HbA1c con alguno de ellos14,59,61.
Los resultados de los ensayos clínicos fundamentales, así como del análisis combinado de ambos, indican que estas recomendaciones podrían ser aplicables a la semaglutida, tanto en su formulación oral como en la subcutánea. Considerando los datos provenientes de los ensayos clínicos, así como de las recomendaciones de las diferentes guías de práctica clínica, en la tabla 3 se resume qué pacientes con DM2 más podrían beneficiarse del tratamiento con semaglutida25–27,59–61. De manera resumida, la semaglutida es especialmente beneficiosa para los pacientes con DM2 en los que el control de peso sea importante, así como para pacientes con enfermedad cardiovascular ateroesclerótica o alto/muy alto riesgo de sufrirla o con mal control de HbA1c a pesar del tratamiento antidiabético previo. Además, la semaglutida dispone de 2 formulaciones, una oral (1 vez al día) y otra subcutánea (1 vez a la semana). Esto facilita su empleo en la práctica clínica (p. ej., pacientes con DM2 y síndrome coronario agudo antes del alta, unidades de rehabilitación cardiaca, seguimiento ambulatorio) según las necesidades del paciente. En consecuencia, es esperable una mayor prescripción de los agonistas del receptor del GLP-1, no solo por la evidencia disponible, sino también por la introducción en la práctica clínica de la formulación oral de la semaglutida. Asimismo, la semaglutida también puede considerarse como una primera opción inyectable en el tratamiento de la DM2, puesto que la disminución de la HbA1c es superior al control de la glucemia logrado con la insulina y se asocia con una reducción de peso con menor riesgo de hipoglucemias.
Pacientes con diabetes mellitus tipo 2 que más van a beneficiarse del tratamiento con semaglutida.
| Pacientes en los que el control de peso es importante |
|---|
| ECVA (cardiopatía isquémica, enfermedad cerebrovascular, arteriopatía periférica) |
| Alto/muy alto riesgo de ECVA: |
| • TFGe < 45 ml/min/1,73 m2 independientemente de albuminuria |
| • TFGe 45-59 ml/min/1,73 m2 y microalbuminuria (CAC 30-300 mg/g) |
| • Proteinuria (CAC > 300 mg/g) |
| • Presencia de enfermedad microvascular |
| • Presencia de otros factores de riesgo cardiovascular |
| • Duración de la DM ≥ 10 años |
| • Mal control de la HbA1c a pesar del tratamiento antidiabético previo |
Tabla elaborada con datos de Seidu24, las fichas técnicas de la semaglutida oral26 y subcutánea27, y de Cosentino60, Visseren61 y el algoritmo del abordaje integral en paciente con DM262 CAC: cociente albúmina/creatinina; DM2: diabetes mellitus tipo 2; ECVA: enfermedad cardiovascular ateroesclerótica; TFGe: tasa de filtrado glomerular estimada.
La semaglutida está disponible tanto en formulación subcutánea (inyección 1 vez a la semana) como oral (administración 1 vez al día). La elección entre una y otra depende principalmente de las características clínicas y las preferencias del paciente. La inyección subcutánea es sencilla de aplicar (pluma precargada) y se debe conservar en frío. En cuanto a la semaglutida oral, debe tomarse en ayunas con un sorbo de agua (máximo, 120 ml) y esperar 30 min antes de volver a ingerir (líquidos, alimentos, fármacos) (tableau 4).)22,24,26,27.
Aspectos prácticos del tratamiento con semaglutida.
| Semaglutida subcutánea | Semaglutida oral | |
|---|---|---|
| Recomendaciones generales | Más conveniente en pacientes polimedicados, viajes frecuentes Puede aumentar la adherencia (inyección semanal frente a tomas más frecuentes) Fácil de administrar por pluma precargada Requiere conservar en frío | Se toma con el estómago vacío (generalmente por la mañana en ayunas) Se ingiere entero con un sorbo de agua (máximo, 120 ml) Se debe esperar al menos 30 min antes de comer, beber o tomar otros medicamentos orales No es necesario almacenar en frío Más conveniente en pacientes que rechacen medicación inyectable |
| Posología | Dosis de inicio, 0,25 mg 1 vez a la semana Aumentar la dosis a las 4 semanas a 0,5 mg 1 vez a la semana A las 4 semanas, la dosis se puede aumentar a 1 mg 1 vez a la semana para mejorar el control glucémico | Iniciar 3 mg 1 vez al día durante 1 mes Aumentar a 7 mg 1 vez al día durante al menos 1 mes Aumentar a 14 mg para mejorar el control glucémico No es necesario el ajuste de dosis de acuerdo con la función renal (TFGe > 15 ml/min) |
| Fármacos concomitantes | Insulina basal: reducir dosis un 20% SU: reducir dosis SU Metformina, iSGLT2, tiazolidinedionas: mantener la dosis iDPP4: retirar iDPP4 Levotiroxina: tomar al menos 3 h después de la última comida del día o 1 h antes de la comida o la cena | |
| Tratamiento de los efectos secundarios gastrointestinales | Se debe explicar que las náuseas y otros síntomas generalmente son leves y transitorios Se debe tomar medidas que disminuyan el riesgo de efectos secundarios: comidas poco copiosas, evitar comidas picantes, con grasa o con olores fuertes, evitar consumo de alcohol, etc. Ajustar dosis si persisten los síntomas |
Independientemente de la formulación, es importante ajustar a la dosis máxima tolerada para conseguir el mayor beneficio clínico posible (metabólico y de reducción de eventos cardiovasculares). Por otra parte, para evitar el riesgo de hipoglucemias, hay que reducir la dosis de insulina o de sulfonilureas en caso de que el paciente las estuviese tomando. No es necesario ajustar la dosis con otros antidiabéticos (no se puede emplear de manera concomitante con los iDPP4). La sema- glutida se puede dar a pacientes ancianos (edad ≥ 65 años), ya que no se encontraron diferencias en la seguridad y la eficacia generales ni hubo necesidad de ajuste de dosis en comparación con los pacientes más jóvenes. Tampoco es necesario ajustar la dosis de pacientes con insuficiencia renal. Sin embargo, aunque la semaglutida puede emplearse hasta con filtrados de 15 ml/min, hay escasa experiencia en pacientes con insuficiencia renal grave. Asimismo, la semaglutida se debe utilizar con precaución en pacientes con insuficiencia hepática, nuevamente por la poca experiencia en este contexto clínico. Los principales efectos secundarios son de origen gastrointestinal. En general, son leves y transitorios. Al igual que con otros agonistas del GLP-1, el inicio gradual de la posología puede ayudar a reducir el riesgo de efectos adversos gastrointestinales. La ocurrencia de náuseas, vómitos y diarrea es más común al comienzo del tratamiento, pero generalmente disminuye con el tiempo. Además, se pueden tomar diferentes medidas para disminuir el riesgo de que aparezcan, como tomar comidas poco copiosas, evitar comidas picantes, con grasa o con olores fuertes, así como el alcohol, etc. (tabla 4).22,24,26,27. La semaglutida oral no debe prescribirse a pacientes con antecedentes personales o familiares de carcinoma medular de tiroides o síndrome de neoplasia endocrina múltiple tipo 2. No está indicada para pacientes con diabetes tipo 1 y en general no es recomendable para pacientes con gastroparesia26,62.
Por último, considerando los efectos en el control glucémico y la pérdida de peso (mayor que con la mayoría de los fármacos antidiabéticos), así como su beneficio en los eventos cardiovasculares, la sema- glutida representa una alternativa coste-efectiva63,64.
ConclusionesLos pacientes con DM2 tienen un elevado riesgo de complicaciones cardiovasculares. La evidencia proveniente de los estudios con los agonistas del receptor del GLP-1 muestran importantes beneficios metabólicos y algunos de ellos también protección cardiovascular. De hecho, están muy recomendados por las guías de práctica clínica, sobre todo para los pacientes con un mayor riesgo cardiovascular. Desafortunadamente, su empleo en la práctica clínica es claramente insuficiente en todos los niveles asistenciales (atención primaria, cardiología, etc.). La semaglutida es un agonista de los receptores del GLP-1 que disminuye la HbA1c y el peso corporal en los pacientes con DM2. Además tiene un efecto positivo en la presión arterial y el perfil lipídico. Pero lo más importante es que también se han demostrado en ensayos clínicos reducciones del riesgo de enfermedad cardiovascular ateroesclerótica y enfermedad renal independientemente del peso y de la HbA1c, debido a su efecto antiinflamatorio y antiate- roesclerótico, entre otros. En consecuencia, los agonistas del GLP-1 y concretamente la semaglutida deben considerarse como una de las opciones preferentes en el tratamiento de la DM2, especialmente de los pacientes con enfermedad cardiovascular o enfermedad renal crónica y pacientes para quienes la necesidad de perder peso sea una prioridad. La semaglutida tiene 2 formulaciones, subcutánea (1 vez a la semana) y oral (1 vez al día), lo que permite individualizar el tratamiento según las necesidades de cada paciente y facilita su uso. De hecho, la introducción de la semaglutida oral debería traducirse en un mayor empleo de los agonistas del receptor del GLP-1 en la práctica clínica.
FinanciaciónEste artículo ha sido financiado por una beca no condicionada de Novo Nordisk.
Contribuciones de los autoresLos autores han participado en la redacción y revisión del manuscrito de forma proporcional y aceptan su publicación.
Conflictos de interesesC. Escobar declara haber recibido honorarios por actividades de asesoría/conferencias de AstraZeneca, Mundipharma Pharmaceuticals, Novo Nordisk. A. Castro declara haber recibido honorarios por asesoría/conferencias/investigación de Novo Nordisk. J. Francisco Gómez Cerezo: no tiene conflictos de intereses. J.L. Górriz: ha recibido honorarios por asesoría/conferencias de AstraZeneca, Bayer, Boehringuer Ingelheim, Eli Lilly and Co, Merck Sharp & Dohme, Menarini, Mundipharma Pharmaceuticals, Novartis, Novo Nordisk, Sanofi y Janssen. J.C. Obaya Rebollar: ha recibido honorarios como ponente por cursos de los laboratorios Novartis, Lilly, Sanofi, Boehringer, Novo Nordisk, MSD, Mylan, Janssen, Esteve, Astra-Zeneca. R. Villar-Taibo: ha recibido honorarios por actividades de asesoría/ conferencias de AstraZeneca, Boehringuer Ingelheim, Eli Lilly and Co, Merck Sharp & Dohme, Mundipharma Pharmaceuticals, Novo Nordisk, Sanofi y Janssen.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Abordaje práctico de la semaglutida en el paciente con diabetes tipo 2», que ha sido patrocinado por Novo Nordisk.